9 січня, 2020
Застосування внутрішньовенної та внутрішньом’язової форм парекоксибу для усунення гострого післяопераційного болю в дорослих
Гострий біль виникає внаслідок ушкодження тканин, зазвичай випадкового (внаслідок травми) або після хірургічного втручання. Гострий післяопераційний біль – це ознака запалення, що супроводжує травму тканини. Першочерговим завданням у лікуванні пацієнтів, яким виконано оперативне втручання, є ліквідація болю та запалення.
Автори спробували довести відносну ефективність анальгетичних препаратів, використавши для цього непряме порівняння з плацебо. Розглянуті дослідження є дуже подібними. У них схожий дизайн, зіставні результати і приблизно однакова тривалість. Доведена відносна ефективність будь-якого анальгетика не означає, що він є препаратом вибору у певній ситуації або для конкретного пацієнта, але її можна використати для розробки місцевих клінічних настанов.
Серед усіх знеболювальних препаратів лікарі різних країн віддають перевагу нестероїдним протизапальним препаратам (НПЗП). Отримано багато доказів їхньої ефективності при лікуванні гострого болю (Moore, 2003). НПЗП зворотно інгібують циклооксигеназу (ЦОГ; простагландин-ендопероксид-синтазу), фермент, що бере участь у синтезі простагландинів та тромбоксану A2 (FitzGerald, 2001). Простагландини чинять різну фізіологічну дію, зокрема забезпечують бар’єрну функцію слизової оболонки шлунка, регулюють нирковий кровообіг і тонус судин, впливаючи на їхній ендотелій. До того ж вони є важливими посередниками у розвитку запалення і виникненні болю. Проте достеменно дія цих сполук досі не досліджена. Встановлено лише здатність простагландинів інгібувати ЦОГ-залежний механізм утворення простаноїдів (Hawkey, 1999). На відміну від опіоїдів, НПЗП не пригнічують дихання і не впливають на моторику шлунково-кишкового тракту (BNF, 2002), тому є ефективними медикаментами для лікування болю, що виникає після незначних операцій та втручань у денному стаціонарі. Крім того, вони мають опіатозберігаючий ефект, що важливо в умовах серйозного хірургічного втручання (Grahame-Smith, 2002).
Встановлено, що у ЦОГ є щонайменше два окремих ізоферменти: ЦОГ‑1 і ЦОГ‑2. Науковці припускають, що ЦОГ‑1 бере участь у формуванні захисної функції шлунка та в гемостазі. Вважається, що ЦОГ‑2 опосередковує різні патофізіологічні процеси, зокрема запалення, біль і лихоманку. На підставі цих гіпотез були розроблені селективні інгібітори ЦОГ‑2: целекоксиб, рофекоксиб та еторикоксиб. Ці препарати мають сильнішу знеболювальну дію, ніж стандартні НПЗП. Крім того, при застосуванні у терапевтичних дозах вони не пригнічують агрегацію тромбоцитів, а тому, ймовірно, викликають менше побічних ефектів з боку шлунково-кишкового тракту, ніж звичайні НПЗП (наприклад, ібупрофен).
Парекоксиб
Парекоксиб – перший інгібітор ЦОГ‑2 для парентерального застосування. Це проліки (первинно неактивний препарат), які in vivo швидко гідролізуються, утворюючи активну форму – вальдекоксиб. За даними клінічних випробувань, парекоксиб є ефективним препаратом для лікування болю, що виникає після стоматологічних і ортопедичних хірургічних втручань та деяких операцій на черевній порожнині (гістеректомії). За результатами інших досліджень, не виявлено значного впливу вальдекоксибу на функцію тромбоцитів і слизову оболонку верхнього відділу шлунково-кишкового тракту (Graff, 2007; Harris, 2004; Noveck, 2001; Stoltz, 2002). Завдяки цьому парекоксиб натрію схвалено до застосування у країнах Європи для лікування післяопераційного болю. У Великій Британії, наприклад, зареєстровано препарат парекоксибу у формі порошку (із розчинником і/або розчином для ін’єкцій) дозуванням 20 та 40 мг, який використовують для швидкого усунення післяопераційного болю.
У 2002 р. лікарі висловили занепокоєння можливими побічними ефектами парекоксибу через тяжкі реакції, що виникали у деяких пацієнтів під дією вальдекоксибу, активного метаболіту парекоксибу натрію. Такими ефектами були: анафілаксія, ангіоневротичний набряк та виражені ураження шкіри, зокрема токсичний епідермальний некроліз (EMEA, 2002). Через це у 2005 р. відповідні органи призупинили ліцензування вальдекоксибу. Наразі парекоксиб протипоказаний пацієнтам, в анамнезі яких є підвищена чутливість до сульфонамідів (групи протибактеріальних препаратів, що призначають для лікування інфекцій), через ризик серйозних побічних ефектів. За даними нещодавнього огляду постмаркетингових досліджень, присвячених безпеці медичних препаратів, після призначення будь-якого препарату з класу коксибів дуже рідко реєстрували тяжкі шкірні реакції (загальний коефіцієнт – 0,008%; Layton, 2006).
Автори попереднього систематичного огляду (Barden, 2003) оцінили застосування парекоксибу в осіб із післяопераційним болем, використавши дані чотирьох рандомізованих контрольованих досліджень, до яких було залучено 620 осіб. Учені дійшли висновку, що парекоксиб є ефективним препаратом для післяопераційної аналгезії. Відтоді були опубліковані дані нових досліджень. Ймовірно, вони допоможуть точніше встановити позитивні та негативні ефекти парекоксибу.
Мета дослідження – оцінити ефективність і побічні ефекти парекоксибу при його одноразовому застосуванні за допомогою відповідних методів (шляхом порівняння даного препарату з іншими анальгетиками у стандартизованих дослідженнях із практично однаковою методологією та результатами).
Матеріали та методи
Критерії включення досліджень до цього огляду
До огляду були включені подвійні сліпі дослідження, де порівнювали одноразове застосування парекоксибу та плацебо для усунення післяопераційного болю (помірного і сильного) у дорослих. У кожному дослідженні взяли участь мінімум 10 пацієнтів, яких було рандомізовано розподілено у терапевтичні групи. Дослідження багаторазового застосування включали до огляду, якщо в них були зазначені відповідні дані про ефект однієї дози препарату. Використали також перехресні дослідження, що містили ізольовані результати першої (досліджуваної) групи учасників.
Було виключено такі дослідження:
- оглядові статті, окремі клінічні випадки та клінічні спостереження;
- дослідження експериментально викликаного болю;
- дослідження, в яких вираженість болю оцінювали виключно лікарі, медсестри або особи, які доглядали за пацієнтами (а не учасники дослідження);
- дослідження тривалістю <4 год або дослідження, у яких відсутні дані через 4-6 год після прийому препарату.
Дослідження післяпологового болю включали до огляду, якщо він був викликаний епізіотомією або кесаревим розтином, незалежно від наявності у пацієнтки маткових спазмів; при цьому не розглядали біль, що виникав виключно через спазми матки.
Учасники дослідження
У дослідженні взяли участь дорослі пацієнти (≥15 років) із діагностованим помірним та сильним післяопераційним болем, що виник після хірургічного втручання в умовах денного стаціонару чи лікарні. У дослідженнях, де використали візуально-аналогову шкалу (VAS, visual analogue scale) болю, біль середньої інтенсивності відповідав відрізку довжиною 30 мм (Collins, 1997).
Види клінічних втручань
Парекоксиб або відповідний препарат плацебо вводили парентерально й одноразово для усунення післяопераційного болю.
Збір даних для оцінювання результатів
Для оцінювання результатів були отримані такі дані:
- характеристики учасників;
- вихідна вираженість болю зі слів пацієнта (до аналізу не включали оцінку болю лікарями, медсестрами або особами, що доглядали за пацієнтом);
- зменшення болю, яке реєстрували щонайменше щогодини протягом 4-6 год після застосування препарату, з використанням відповідних затверджених шкал (інтенсивності та зменшення болю, VAS чи категорійних, або обох видів одночасно);
- загальна оцінка лікування зі слів пацієнта;
- час, що минув від початку дослідження до застосування препаратів для невідкладного знеболення;
- кількість учасників, які приймали препарати для невідкладного знеболення;
- кількість учасників, у яких зареєстровано один або кілька побічних ефектів;
- кількість учасників, у яких виникли тяжкі побічні ефекти;
- кількість пацієнтів, що припинили участь у дослідженні (всі виключені особи, учасники, виключені через побічні ефекти).
Методи пошуку досліджень
Для пошуку досліджень, які включили у цей огляд, використали такі електронні бази даних:
- Cochrane CENTRAL;
- MEDLINE, через платформу Ovid;
- EMBASE, через Ovid;
- Oxford Pain Relief Database (Jadad, 1996a).
Деякі дослідження були знайдені за посиланнями наприкінці розглянутих статей, у підручниках та оглядах літератури. Збір та аналіз даних проводили відповідно до настанов QUOROM (Moher, 1999).
Оцінювання якості досліджень
Два незалежних рецензенти оцінили якість досліджень за п’ятибальною шкалою (Jadad, 1996b), враховуючи правильність рандомізації та шифрування даних, кількість виключених учасників та пацієнтів, дані яких були втрачені.
Обробка даних
Дані були вилучені двома рецензентами та внесені у стандартну форму вилучення даних.
Аналіз даних
Для аналізу ефективності вивчали дані тих учасників із кожної терапевтичної групи, які були рандомізовані, отримували препарат та пройшли принаймні одне обстеження після вихідного. Для аналізу безпеки використали дані учасників із кожної терапевтичної групи, які приймали досліджуваний препарат. Автори вирішили проаналізувати дані, отримані при застосуванні різних доз препарату. Дослідники також запланували аналіз чутливості, щоб оцінити вплив на первинний результат типу болю (порівняти біль після стоматологічних втручань та інші види післяопераційного болю) та якості дослідження (порівняти дослідження, що отримали 2 бали, і дослідження, яким присвоєно ≥3 бали). Автори розрахували, що для будь-якого аналізу їм потрібні дані хоча б двох досліджень та мінімум 200 учасників (Moore, 1998). При порівнянні однієї терапевтичної групи до аналізу залучали всіх осіб, які приймали плацебо. Якщо порівнювали кілька активних терапевтичних груп, групу плацебо розділяли на однакові підгрупи, які потім аналізували окремо.
Первинні результати: кількість учасників, у яких зареєстровано зменшення болю принаймні на 50%
У кожному дослідженні оцінювали специфічні показники. TOTPAR (total pain relief – загальне зменшення болю) розраховували як суму балів, присвоєних препарату за зменшення болю протягом певного періоду часу. Якщо біль зменшувався відразу після прийому знеболювального препарату і такий стан зберігався 6 год, то визначений через зазначений проміжок часу показник отримав назву TOTPAR6 (максимальний період часу, протягом якого визначали TOTPAR, становив 24 год). SPID (summed pain intensity difference, загальна різниця інтенсивності болю) – сума різниць між показниками болю за певний проміжок часу. VAS TOTPAR та VAS SPID – це відповідні індекси, визначені за VAS болю. Дана шкала являє собою відрізок, початок якого означає «відсутність болю», а кінець – «найсильніший можливий біль». Пацієнти відзначають місце на шкалі, що відповідає інтенсивності їхнього болю. Оцінювання здійснюють, визначивши відстань між початком шкали та позначкою пацієнта, зазвичай у міліметрах.
Для кожного дослідження середні значення TOTPAR, SPID, VAS TOTPAR і VAS SPID, отримані в активних групах і групах плацебо, поділили на їхні розраховані максимальні показники й вивели індекси % maxTOTPAR та % maxSPID (Cooper, 1991). За методом верифікованих рівнянь у кожній терапевтичній групі було визначено частку учасників, у яких отримано показник ≥50% maxTOTPAR (у яких біль зменшився принаймні на 50%) (Moore, 1996; Moore, 1997а; Moore, 1997b). Потім за цими частками розрахували кількість осіб, що досягли показника ≥50% maxTOTPAR, помноживши їх на загальну кількість учасників у терапевтичній групі. Учасників із досліджуваних груп і груп плацебо, які отримали ≥50% maxTOTPAR, відібрали для розрахунку співвідношення відносної користі/відносного ризику (RR) та NNT (number needed to treat to benefit – кількість осіб, яких потрібно пролікувати, щоб досягти зменшення болю в одного пацієнта).
Для оцінювання болю і подальшого розрахунку показників TOTPAR і SPID використали такі інструменти: п’ятибальні категорійні шкали зменшення болю з відповідними позначеннями: зменшення болю «відсутнє», «незначне», «помірне», «достатнє» або «повне»;
- чотирибальні категорійні шкали інтенсивності болю з відповідними позначеннями: біль «відсутній», «незначний», «помірний» або «сильний»;
- VAS зменшення болю;
- VAS інтенсивності болю.
Якщо в дослідженні не застосовано жодного із цих засобів, учасниками, у яких біль зменшився принаймні на 50%, вважали пацієнтів, що оцінили знеболювальну дію препарату як «високу» і «відмінну» (за загальною п’ятибальною категорійною шкалою знеболювальної дії з варіантами відповіді: «низька», «помірна», «достатня», «висока» і «відмінна») (Collins, 2001).
Вторинні результати
Застосування препаратів для невідкладного знеболення. Серед пацієнтів із терапевтичних груп та груп плацебо розрахували такі показники: RR і NNTp (number needed to treat to prevent – кількість осіб, яких потрібно пролікувати, щоб запобігти одному випадку застосування препаратів для невідкладного знеболення). З показників медіани (або середнього значення) часу, який минув від початку дослідження до застосування препарату для невідкладного знеболення, розрахували відповідні зважені показники медіани (або середнього значення) часу, за допомогою яких оцінили первинні результати. Зважені величини обчислювали за кількістю учасників.
Побічні ефекти. Серед учасників кожної терапевтичної групи, у яких виникли побічні ефекти, розрахували RR та NNH (number needed to harm – кількість осіб, яких потрібно пролікувати, щоб виник один випадок побічної дії). Розрахунок проводили серед осіб:
- у яких виник будь-який побічний ефект;
- у яких виявлено будь-який тяжкий побічний ефект (що зафіксовано у протоколі дослідження);
- яких виключено з дослідження у зв’язку з появою в них побічного ефекту.
Виключені учасники. Зареєстровано всіх пацієнтів, виключених із дослідження з інших причин, ніж неефективність лікування. Для показників відносної користі і відносного ризику розрахували 95% довірчий інтервал (ДI) за допомогою моделі з фіксованими ефектами (Morris, 1995). Для показників NNT, NNTp і NNH розрахували 95% ДІ, підсумувавши кількість випадків за методом Кука і Сакета (Cook, 1995). Вважалося, що між результатами досліджуваної та контрольної груп досягнуто статистично значущої різниці, якщо 95% ДІ, визначений для показника відносної користі, не містив одиниці.
Результати
Критеріям включення відповідали сім досліджень, у яких взяли участь 1446 осіб (Barton, 2002; Bikhazi, 2004; Daniels, 2001; Malan, 2005; Mehlisch, 2003; Mehlisch, 2004; Rasmussen, 2002).
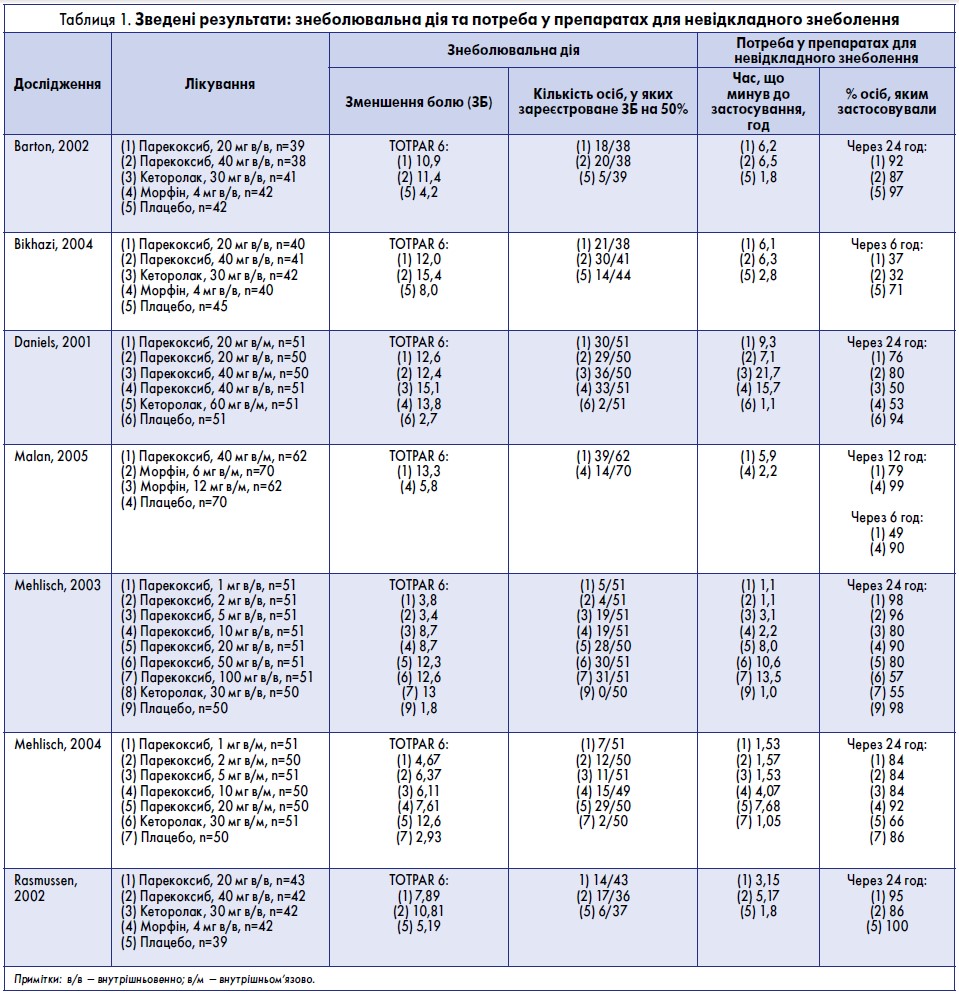
Детальні результати досліджень ефективності препаратів (знеболювальна дія та потреба у препаратах для невідкладного знеболення) наведені в табл. 1.
Порівняння парекоксибу в дозі 20 мг та плацебо
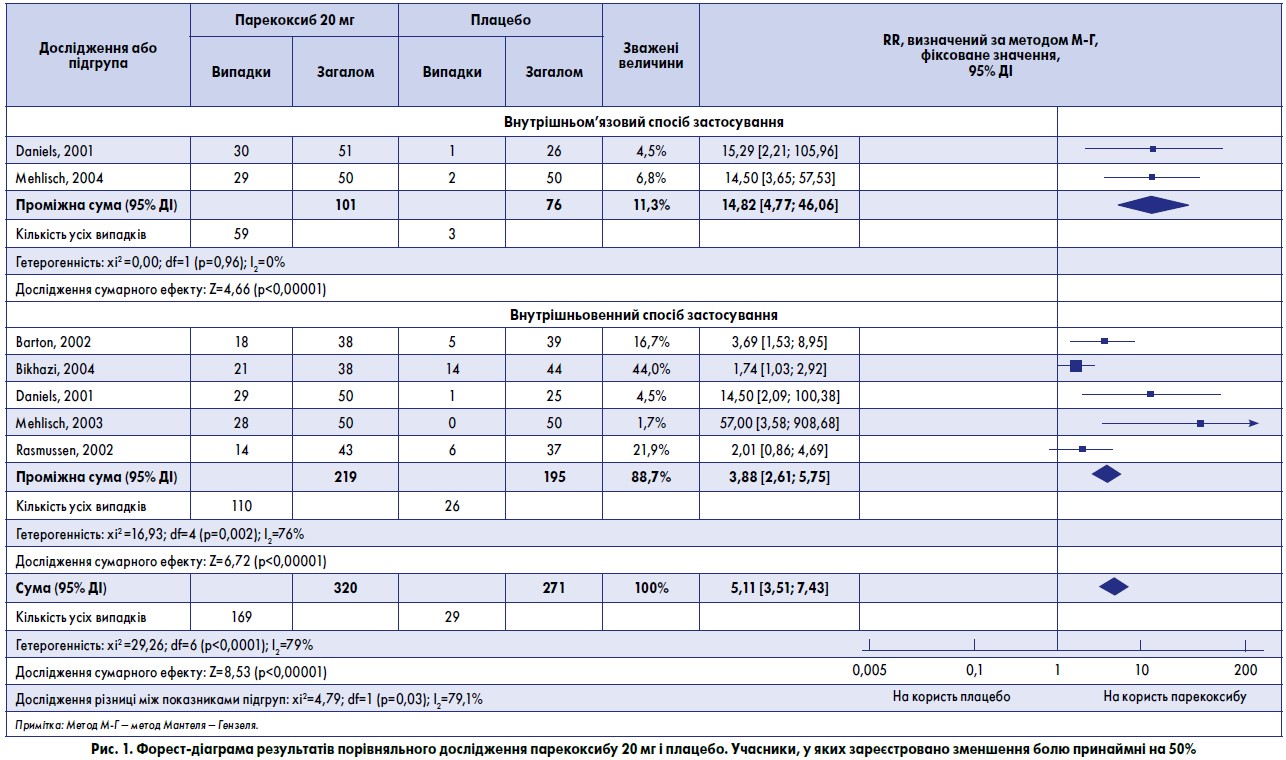
- Використані дані шести досліджень (Barton, 2002; Bikhazi, 2004; Daniels, 2001; Mehlisch, 2003; Mehlisch, 2004; Rasmussen, 2002) за участю 320 пацієнтів, яким призначили парекоксиб у дозі 20 мг, та 271 пацієнт, що отримував плацебо (табл. 1, 2, рис. 1).
- Частка учасників, у яких після застосування 20 мг парекоксибу зареєстровано зменшення болю принаймні на 50% і збереження цього стану впродовж 6 год, становила 53% (169/320).
- Частка учасників, у яких після застосування плацебо зареєстровано зменшення болю принаймні на 50% і збереження цього стану впродовж 6 год, становила 11% (29/271).
- Показник відносної користі від застосування парекоксибу в дозі 20 мг порівняно з плацебо становив 5,1 (3,5-7,4).
- Показник NNT із зареєстрованим зменшенням болю принаймні на 50% протягом 6 год становив 2,4 (2,1-2,8). На кожних 2 учасників, які отримали 20 мг парекоксибу, припадав 1, у якого виявлено зменшення болю хоча б на 50%, на відміну від групи плацебо, де таких результатів не зареєстровано.
Порівняння парекоксибу в дозі 40 мг та плацебо
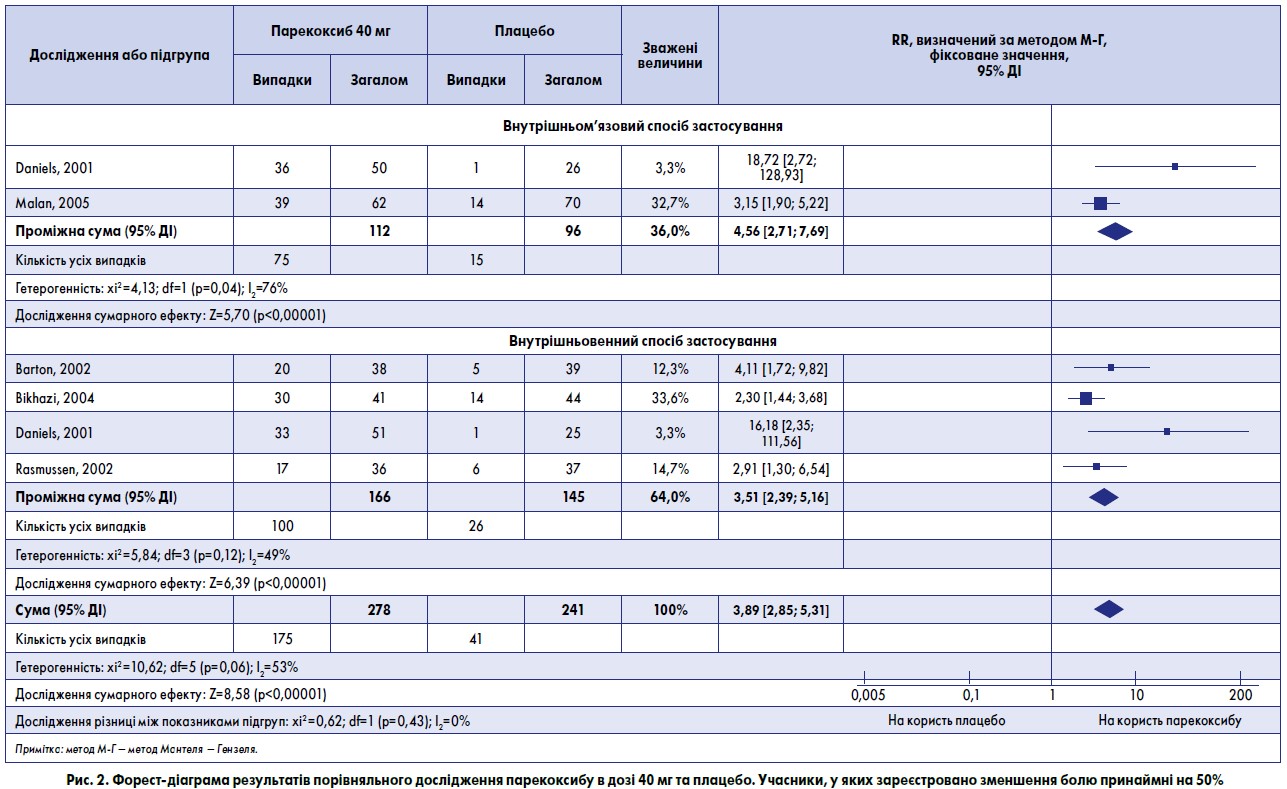
- Використані дані п’яти досліджень (Barton, 2002; Bikhazi, 2004; Daniels, 2001; Malan, 2005; Rasmussen, 2002), до яких залучено 278 пацієнтів, що отримували парекоксиб у дозі 40 мг, та 241 пацієнта, якому призначено плацебо (табл. 1, 2, рис. 2).
- Частка учасників, у яких після застосування парекоксибу 40 мг зареєстровано зменшення болю принаймні на 50% і збереження цього стану впродовж 6 год, становила 63% (175/278).
- Частка учасників, які отримали плацебо й у яких зареєстровано зменшення болю принаймні на 50% і збереження цього стану впродовж 6 год, становила 17% (41/278).
- Показник відносної користі від застосування парекоксибу в дозі 40 мг порівняно з плацебо становив 3,9 (2,9-5,3).
- Показник NNT із зареєстрованим зменшенням болю принаймні на 50% впродовж 6 год становив 2,2 (1,9-2,6). На кожних 2 учасників, які отримали парекоксиб 40 мг, припадав 1, у якого виявлено зменшення болю хоча б на 50%, на відміну від групи плацебо, де таких результатів не отримано.
У дослідженні парекоксибу виявлено деякі дозозалежні ефекти. Проте, оцінюючи зменшення болю принаймні на 50% впродовж 6 год, автори не встановили значущої різниці між ефективністю доз 20 і 40 мг.
Спосіб застосування
Автори порівняли ефективність внутрішньовенної і внутрішньом’язової форм парекоксибу в дозі 20 і 40 мг.
- Вивчено дані п’яти досліджень із 414 учасниками, яким вводили парекоксиб 20 мг внутрішньовенно (Barton, 2002; Bikhazi, 2004; Daniels, 2001; Mehlisch, 2003; Rasmussen, 2002). Показник відносної користі із зареєстрованим зменшенням болю принаймні на 50% протягом 6 год становив 2,9 (2,6-5,8), а показник NNT – 2,7 (2,2-3,5). У двох дослідженнях, до яких було залучено 177 учасників, які отримували парекоксиб 20 мг внутрішньом’язово (Daniels, 2001; Mehlisch, 2004), встановлено, що показник RR становив 15 (4,8-46), а NNT – 1,8 (1,5-2,3).
- Крім того, розглянуто дані чотирьох досліджень, до яких залучено 311 пацієнтів, що отримували парекоксиб 40 мг внутрішньовенно (Barton, 2002; Bikhazi, 2004; Daniels, 2001; Rasmussen, 2002). Показник відносної користі із зареєстрованим зменшенням болю принаймні на 50% протягом 6 год становив 3,5 (2,4-5,2), а показник NNT – 2,4 (1,9-3,1). У двох дослідженнях, до яких залучено 208 учасників, які отримували парекоксиб 40 мг внутрішньом’язово (Daniels, 2001; Malan, 2005), встановлено, що показник RR становив 4,6 (2,7-7,7), а NNT – 2,0 (1,6-2,5).
У дослідженні, де застосовували внутрішньом’язову форму парекоксибу, отримано нижчі (кращі) показники NNT, ніж у випробуваннях внутрішньовенної форми. Утім довірчі інтервали цих показників перекриваються, що свідчить про відсутність статистично значущої різниці між даними способами застосування препарату.
Застосування препаратів для невідкладного знеболення
У п’яти із семи досліджень зазначено кількість учасників, які застосовували препарати для невідкладного знеболення протягом 24 год (Barton, 2002; Daniels, 2001; Mehlisch, 2003; Mehlisch, 2004; Rasmussen, 2002) (табл. 1).
- У групах, де вводили парекоксиб 20 мг, частка пацієнтів, які приймали препарат для невідкладного знеболення протягом 24 год, становила 81% порівняно з 94% у групах плацебо. Розраховане значення NNTp – 7,5 (5,3-12,8).
- Серед учасників, які приймали парекоксиб 40 мг, частка тих, кому застосували препарат для невідкладного знеболення протягом 24 год, становила 66% порівняно з 96% у групах плацебо, NNTp – 3,3 (2,6-4,5).
У групах, де призначали парекоксиб 40 мг, значно менше осіб приймали препарати для невідкладного знеболення, ніж у групах, де застосовували дозу 20 мг (z=3,38, р<0,0007) (рис. 3).
Час від початку дослідження до застосування препаратів для невідкладного знеболення
- Серед учасників, які отримували парекоксиб 20 мг (Barton, 2002; Bikhazi, 2004; Daniels, 2001; Mehlisch, 2003, Mehlisch, 2004; Rasmussen, 2002), середньозважене значення медіани часу, що минув до застосування препаратів для невідкладного знеболення, становило 6,9 год у групі парекоксибу і 1,6 год – у групі плацебо.
- Серед пацієнтів, яким призначено парекоксиб 40 мг (Barton, 2002; Daniels, 2001; Malan, 2005; Rasmussen, 2002), середньозважене значення медіани часу, що минув до застосування препаратів для невідкладного знеболення, становило 10,6 год у групі парекоксибу і 2,0 год – у групі плацебо.
Побічні ефекти
В усіх семи дослідженнях, включених до огляду, зазначено кількість учасників, у яких виникли будь-які побічні ефекти. Між частотою побічних явищ у групах, що приймали парекоксиб і плацебо, не виявлено значущої різниці. Вона становила близько 54% у кожній групі, тому дослідники не розрахували показник NNH. Найчастіше реєстрували легкі або середньої тяжкості побічні ефекти. Не встановлено залежності між побічними явищами та дозою призначеного препарату.
Виключені учасники
Пацієнти, які приймали препарати для невідкладного знеболення, були виключені з дослідження через неефективність лікування і згадані вище як «учасники, що застосовували препарати для невідкладного знеболення».
Даних про інші виключення досить мало. У дослідженнях, де вивчають одноразове застосування препарату, учасників рідко виключають з інших причин, ніж неефективність. Кілька осіб було виключено через дуже сильний вихідний біль, помилки у протоколі або використання препаратів для невідкладного знеболення протягом 1-ї години дослідження. Досі не з’ясовано, чи можна вважати таких учасників цільовою досліджуваною популяцією. Малоймовірно, що похибки, зумовлені неправильними даними, вплинуть на результати досліджень.
Загалом через побічні ефекти виключено 13 учасників: 5 із них отримували парекоксиб 20 мг, 4 – парекоксиб 40 мг і 2 – плацебо, і були виключені здебільшого через головний біль (Barton, 2002). Серед осіб, яким вводили парекоксиб 40 мг, 1 учасник припинив дослідження через незазначений побічний ефект (Malan, 2005), і ще 1 – через тривожний стан (Rasmussen, 2002).
Обговорення
У цьому огляді використано дані 1446 учасників. З них 320 особам призначено однократне введення парекоксибу в дозі 20 мг, а 278 пацієнтам – у дозі 40 мг. Кількість учасників приблизно вдвічі перевищує число пацієнтів, розглянутих у попередньому систематичному огляді (Barden, 2003), тому результати цих досліджень більш точні (Moore, 1998) і практично зіставні з даними минулого огляду, отриманими для аналогічних доз. Крім того, нові дослідження містять деякі результати застосування парекоксибу в низьких дозах.
Серед пацієнтів, які приймали парекоксиб, невідкладного знеболення потребувала значно менша частка, ніж у групі плацебо. Між групами, що отримували парекоксиб 20 і 40 мг відповідно, не встановлено значущої різниці у досягненні первинного результату. Однак серед учасників, яким вводили дозу 40 мг, значно менше осіб потребували невідкладного знеболення порівняно з пацієнтами, яким призначили парекоксиб 20 мг. Щоб запобігти одному випадку застосування препаратів для невідкладного знеболення протягом 24 год, у групах, де приймали парекоксиб 20 мг, потрібно було пролікувати 7-8 осіб, а у групах, де вводили парекоксиб 40 мг – 3. За умови застосування плацебо ці показники були б вищими.
Медіана часу, що минув до застосування препарату для невідкладного знеболення, у різних дослідженнях була неоднаковою, особливо в різних активних терапевтичних групах, але загалом була довшою в осіб, які приймали парекоксиб, ніж у пацієнтів, які отримували плацебо. Крім того, даний показник був вищим у групах, де призначали парекоксиб 40 мг, порівняно з групами, де застосовували 20 мг цього препарату. Середньозважене значення медіани часу, що минув до застосування препаратів для невідкладного знеболення, становило 1,5 год у групах плацебо, 6,9 год – у групах, що отримували парекоксиб 20 мг, і 10,6 год – в осіб, які приймали парекоксиб 40 мг.
Досліджуючи одноразове застосування препарату, складно оцінити вираженість побічних ефектів. Враховуючи розмір вибірок та тривалість цих випробувань, можливий лише найпростіший аналіз отриманих даних, як уже було зазначено в даному огляді (Edwards, 1999). У розглянутих дослідженнях недостатньо даних для того, щоб порівняти побічні явища, що виникли в різних учасників. Між частотою побічних ефектів у групах, що приймали парекоксиб та плацебо, не виявлено значущої різниці. Вона становила близько 54% у кожній групі. Узагальнити отримані результати доволі складно, бо деякі з них були отримані у різні періоди часу. Зареєстровані побічні ефекти переважно були легкими або середньої тяжкості й, швидше за все, зумовлені анестезією або самим хірургічним втручанням (наприклад, нудота, блювання та сонливість).
Важливо, що у жодному дослідженні не зареєстровано клінічно значущих змін результатів лабораторних досліджень, даних фізикального обстеження або життєво важливих показників пацієнтів протягом усього періоду вивчення.
За даними аналізу чутливості не встановлено, що спосіб введення парекоксибу значно впливає на показники відносної користі від застосування препарату або NNT.
Висновки
Парекоксиб є ефективним анальгетиком у пацієнтів із післяопераційним болем. При одноразовому застосуванні цього препарату виявляють низьку частоту побічних явищ. Введення парекоксибу у дозі 20 або 40 мг забезпечувало достатнє знеболення у 50-60% пацієнтів із помірним та сильним болем, що виник після різних хірургічних втручань. На двох учасників, які отримували парекоксиб 20 або 40 мг, припадав один із зменшенням болю принаймні на 50%. За умови застосування плацебо ці показники були б вищими.
Підготувала Анна Сакалош
За матеріалами R. Lloyd et al. Intravenous or intramuscular parecoxib for acute postoperative pain in adults.
Cochrane Database of Systematic Reviews 2009, Issue 2. Art. No.: CD004771.
Надруковано за підтримки представництва «Пфайзер Експорт Бі Ві».
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 3 (37), вересень 2019 р.