13 січня, 2020
Тактика назначения лекарственных средств в периоперационный период у больных ревматоидным артритом
Несмотря на стремительное развитие биологической, базисной терапии и активное внедрение препаратов в менеджмент лиц с ревматическими заболеваниями, больные ревматоидным артритом (РА) часто подвергаются ортопедическим хирургическим вмешательствам [1]. Эндопротезирование суставов, артропластика, артроскопический дебридмент, реконструкция сухожилий, удаление ревматоидных узелков, декомпрессия туннельного и запястного каналов – неполный перечень ортопедических вмешательств при РА. Кроме того, у пациентов с РА проводят оперативное лечение и по соматическим показаниям, причем чаще, чем в популяции в целом [1].
Периоперационный период ассоциирован с высоким риском развития инфекционных процессов, таких как хирургическая раневая инфекция и пневмонии. Важным вопросом, который стоит перед клиницистами, является определение объема исследований, частоты мониторинга и необходимости коррекции терапии у пациентов с РА, готовящихся к оперативным вмешательствам и перенесших таковые. Одна из наиболее обсуждаемых проблем, связанных с курацией больных РА, вращается вокруг периоперационного протокола применения различных лекарственных средств, используемых для лечения этого заболевания.
Для ведения пациентов с РА используют широкий спектр препаратов, которые могут оказать негативное влияние как во время операции, так и в послеоперационный период. Наиболее распространенными являются нестероидные противовоспалительные препараты (НПВП), глюкокортикоиды (ГК), синтетические болезнь-модифицирующие антиревматические препараты (БМАРП) и биологические агенты. Многие из них используют в комбинированной терапии [2].
По оценкам некоторых авторов, количество лиц с РА, подвергающихся артропластике во время приема традиционных или биологических БМАРП, составляет от 75 до 84%. Применение ГК в той же группе больных оценивают в 80% [3].
Стоит отметить, что рекомендации относительно начала и прекращения приема лекарственных средств во время операции постоянно меняются. Например, ранее шла речь о необходимости отмены метотрексата за две недели до операции и возобновления его приема через две недели после во избежание развития инфекционного процесса [4‑6]. Это же касалось и лефлуномида [7]. В последних рекомендациях данное положение больше не поддерживается, однако остается дискуссионной темой [8, 9].
Важно понимать, что подход к ведению пациентов должен быть индивидуализированным. Критично важно, чтобы ревматолог, хирург/ортопед и, возможно, инфекционист совместно оценивали необходимость периоперационного назначения медикаментозной терапии каждому больному РА. Изменение режима лечения в периоперационный период у лиц с РА может привести к ухудшению состояния и возникновению обострения, поэтому следует рассмотреть вопрос о приемлемых альтернативных препаратах для замены прекращенных в течение данного временного отрезка. Это потенциально уменьшит негативный эффект прерывания приема требуемых лекарственных средств и будет способствовать быстрому восстановлению в периоперационный период.
Рекомендации по применению НПВП и ацетилсалициловой кислоты
Использование НПВП в лечении симптомов РА является традиционным подходом. В связи с их неселективным ингибирующим действием на тромбоксан А2 при агрегации тромбоцитов существует повышенный риск хирургического кровотечения. Следовательно, прием НПВП должен быть прекращен в периоперационный период, что особенно касается селективных ингибиторов циклооксигеназы‑2 (ЦОГ‑2) – коксибов. При использовании НПВП функция тромбоцитов обратимо ингибируется и возвращается к нормальной к периоду полувыведения препарата. Для различных НПВП он колеблется в значительных пределах: от 2‑6 ч (ибупрофен, кетопрофен, индометацин) до 7‑15 ч (целекоксиб, напроксен) и до >20 ч (мелоксикам, набуметон, пироксикам) [10]. Желательно отменить НПВП до операции на время, равное пяти периодам полувыведения лекарственного средства, для обеспечения возврата к самостоятельному гемостазу и возобновить прием через 2‑3 дня после процедуры [11]. Так, если вопрос касается мелоксикама, то 20 ч × 5 = 100 ч, то есть препарат следует отменить приблизительно за четыре дня до планируемого хирургического вмешательства.
Селективные ингибиторы ЦОГ‑2, также известные как коксибы, были разработаны для сведения к минимуму количества побочных эффектов, связанных с желудочно-кишечным трактом. Кроме того, они, по-видимому, значительно не повышают риск периоперационного кровотечения [10]. Однако коксибы и высокоселективные ингибиторы ЦОГ‑2 в большей степени увеличивают вероятность кардиоваскулярных событий / катастроф [12]. Поэтому использование коксибов не рекомендовано пациентам с высоким кардиоваскулярным риском или имеющим тромбофилии [12]. В недавнем исследовании было установлено, что один из коксибов – целекоксиб – не уступает ибупрофену или напроксену в отношении безопасности при сердечно-сосудистых заболеваниях (ССЗ), если его назначать в умеренных/низких дозах [13].
Данные исследований на животных показывают, что ингибиторы ЦОГ‑2 могут также оказывать негативное влияние на процесс заживления ран и сращения сухожилий [14]. Вероятно, это связано с ингибированием синтеза простагландинов, ответственных за образование кости, увеличение пролиферации и дифференцировку остеобластов [15].
На основании этих результатов следует отметить, что периоперационное использование НПВП должно быть тщательно оценено и ограничено у лиц с РА из-за повышенного риска кардиоваскулярных событий, а также возможного вмешательства НПВП в процесс заживления ран, которое у таких пациентов также может нарушаться вследствие применения БМАРП и ГК. Сочетанное применение парацетамола с опиоидами в послеоперационный период может быть безопасной и эффективной альтернативой НПВП [16].
Ацетилсалициловая кислота (АСК) необратимо связывается с ЦОГ тромбоцитов и «ломает» ее; таким образом, возврат функции агрегации тромбоцитов не зависит от периода полураспада препарата. Восстановление функции мегакариоцитов достигается за счет аутопроизводства через тотипотентные стволовые клетки, регулируемые тромбопоэтином, который вырабатывается в печени и почках. Исходя из этого, некоторые исследователи из-за опасений по поводу развития периоперационного кровотечения предлагают отменить АСК за 10 дней до операции, чтобы обеспечить адекватное формирование новых тромбоцитов. Однако в большом ретроспективном исследовании N.R. Smilowitz et al. (2016) обнаружили, что применение АСК в периоперационный период не было связано с повышением риска кровотечений [17].
Американская коллегия специалистов в области торакальной медицины (ACCP) и Американская коллегия кардиологов (ACC/AHA) рекомендуют продолжать прием аспирина пациентам со средним и высоким риском сердечно-сосудистых событий, получающих терапию препаратом в качестве вторичной профилактики до предполагаемой операции [18, 19]. Такие пациенты со средним и высоким риском включают лиц с ишемической болезнью сердца, застойной сердечной, почечной недостаточностью, сахарным диабетом или цереброваскулярной патологией [18]. Тем не менее РА сам по себе является фактором риска ССЗ. Поэтому, учитывая низкий риск угрожающего жизни кровотечения при приеме АСК и в случае отсутствия серьезных противопоказаний, продолжение его использования возможно и рекомендуется для всех пациентов с РА, которые уже получают лечение [18, 19].
Прием β-адреноблокаторов следует продолжать у пациентов, которые применяют их на постоянной основе [19]. Назначение β-адреноблокаторов для контроля сердечного ритма и антиишемического действия, а статинов – для снижения риска повреждения эндотелия может обеспечить дополнительную защиту для лиц с РА и ССЗ [19].
Синтетические стандартные БМАРП
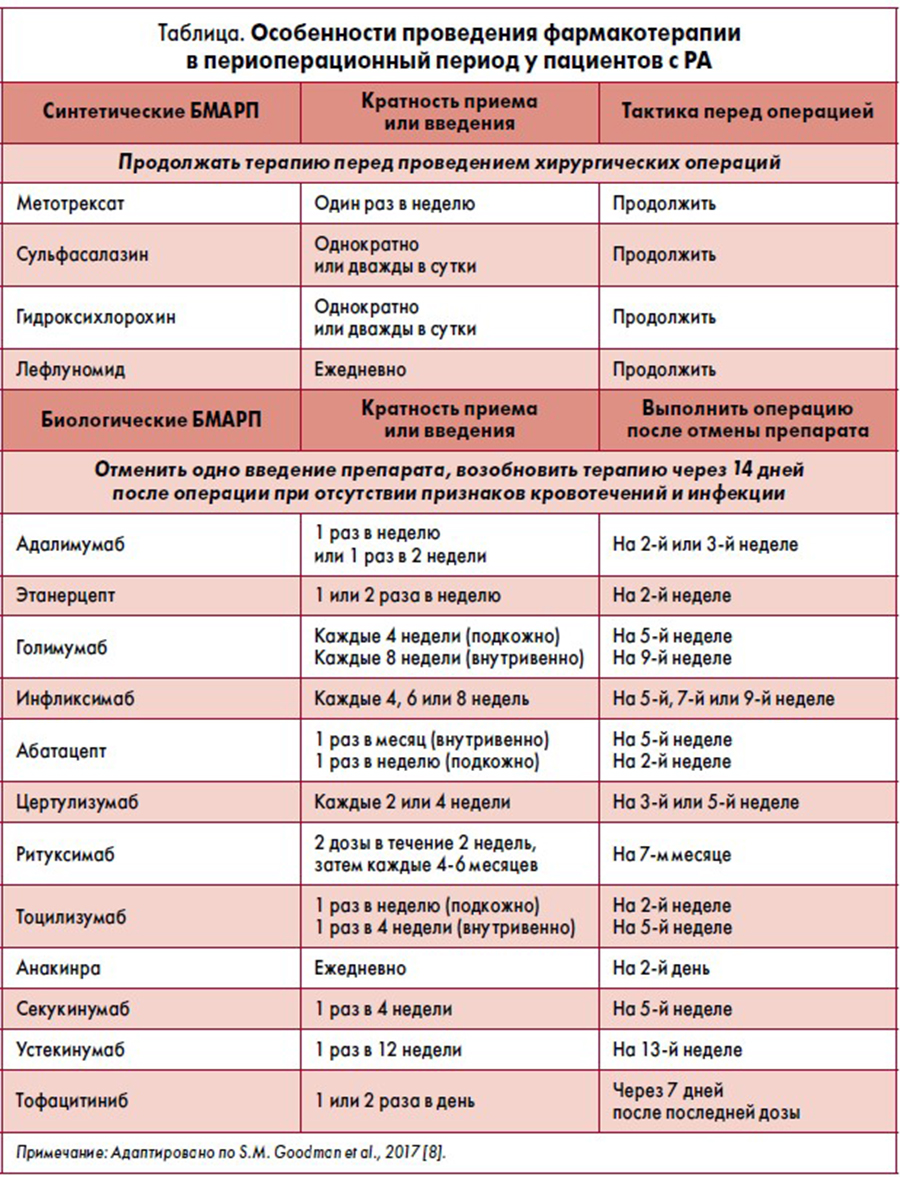
За последние годы принципы лечения пациентов с РА значительно изменились в связи с прорывом в понимании патогенеза болезни. Синтетические БМАРП (сБМАРП) – одни из наиболее распространенных лекарственных средств, назначаемых лицам с РА. К сБМАРП относятся метотрексат, сульфасалазин, лефлуномид и гидроксихлорохин [3].
Механизмы действия сБМАРП различны. Хирург-ортопед должен иметь представление о том, как эти препараты, в зависимости от фармакокинетики, могут повлиять на состояние пациента во время операции. Метотрексат обладает механизмом ингибирования дигидрофолатредуктазы (ДГФР), которая, вызывая снижение концентрации тетрагидрофолата, в конечном итоге приводит к угнетению синтеза пуринов и пиримидина. Препарат имеет ряд побочных эффектов, включающих ингибирование гемопоэза, гепатотоксичность и повышенный риск развития инфекционных процессов. Поэтому прием метотрексата должен быть дополнен фолиевой кислотой в связи с его ингибирующим влиянием на ДГФР [20]. Согласно данным последних исследований, метотрексат не ассоциируется с побочными явлениями в периоперационный период, и его применение не следует прекращать до и во время хирургического вмешательства [3, 8, 9].
Это положение подтверждено в последних рекомендациях, опубликованных Американской коллегией ревматологов (ACR) совместно с Американской ассоциацией хирургов бедра и коленного сустава (AAHK) и Британским обществом ревматологов (BSR) [8]. Исключением являются пациенты с замедлением консолидации в послеоперационный период или полным несрастанием. В научной литературе присутствуют противоречивые мнения относительно того, влияет ли метотрексат на остеобластическую активность и замедляет ли процесс сращения кости. В связи с этим в некоторых источниках по-прежнему рекомендованы прекращение использования метотрексата за одну неделю до операции и возобновление приема через 1‑2 недели после нее [4, 5].
Сульфасалазин является ингибитором синтеза пиримидина de novo посредством селективного ингибирования дигидрооротат-дегидрогеназы; он представляет собой комбинацию 5-аминосалициловой кислоты и сульфапиридина. Первоначально сульфасалазин использовали для лечения РА благодаря противовоспалительной активности и антимикробным свойствам, в настоящее время его продолжают активно применять, но в большей степени в комбинации с другими БМАРП [21]. ACR и AAHK рекомендуют продолжать прием сульфасалазина на протяжении всего периоперационного периода без прерывов в лечении [8].
Хотя гидроксихлорохин (ГХХ) наиболее известен как антималярийный препарат, его также широко назначают при РА. Механизм действия ГХХ – ингибирование лизосомальной активности, презентации антигена и передачи сигналов Toll-подобного рецептора [22]. Проведенные исследования продемонстрировали множественные положительные эффекты для пациентов с РA в результате терапии ГХХ, среди которых нормализация уровня липидного профиля, снижение риска развития ССЗ, частоты возникновения сахарного диабета и сердечно-сосудистых событий в целом [22]. ACR и AAHK рекомендуют продолжать прием ГХХ в течение всего периоперационного периода без перерывов на хирургическое вмешательство [8].
Противоречивые результаты опубликованы в отношении лефлуномида [23‑25]. Значительное увеличение инфекционных осложнений послеоперационной раны, замедление заживления было зарегистрировано у пациентов, получавших лефлуномид по сравнению с таковыми на метотрексате [26]. Тем не менее не обнаружено различий в риске развития инфекционных осложнений между больными, продолжавшими прием лефлуномида, и теми, у кого лефлуномид отменили за один месяц до операции [27]. Поэтому неудивительно, что рекомендации относительно периоперационного использования лефлуномида значимо отличаются [7]. M. Müller и W. Pippi-Ludwig (2014) предложили и дальше принимать лефлуномид у пациентов, подвергающихся процедурам низкого риска, а при таковых высокого использовать совместно с холестирамином [28]. Это нашло отражение и в современных рекомендациях ACR и AAHK, в которых указано на целесообразность продолжения приема лефлуномида в периоперационный период у лиц с РА [8].
Глюкокортикоиды
В настоящих исследованиях уделялось довольно мало внимания тактике применения ГК по сравнению с терапией БМАРП в периоперационный период. Известно, что наиболее серьезными потенциальными дозозависимыми осложнениями в результате приема ГК являются хирургические инфекции, замедление заживления ран, снижение плотности костной ткани и гемодинамическая нестабильность, вторичная по отношению к надпочечниковой недостаточности [29, 30].
Минимальная доза ГК, способствующая иммуносупрессии и супрессии гипоталамус-гипофиз-надпочечниковой системы, давно обсуждается и окончательно не установлена [31]. Существуют доказательства, что доза преднизолона 20 мг в течение пяти дней является достаточной для ингибирования эндогенного синтеза кортизола [31]. Установлено также, что риск послеоперационной инфекции был примерно вдвое выше у больных, получавших преднизолон по >10 мг/сут в течение трех месяцев до операции [32]. Пациенты, которые применяли >15 мг/сут преднизолона в течение одного года, подвергались послеоперационному риску инфекционных осложнений в 20 раз чаще, чем таковые общей популяции после артропластики; частота инфекции суставов после протезирования в 2,5‑3 раза выше, чем среди населения в целом [31]. Следовательно, доза преднизолона <10 мг/сут более безопасна в периоперационный период, чем >10 мг/сут.
Пациентам, находящимся на хроническом лечении ГК, перед большим ортопедическим хирургическим вмешательством часто назначают высокие периоперационные дозы ГК, называемые «стресс-дозой», из-за риска развития острой надпочечниковой недостаточности во время процедуры [33]. Польза и необходимость высокой предоперационной дозы ГК обсуждается давно. На сегодняшний день доказательства повышенного риска развития побочных эффектов у больных, принимающих периоперационную стрессовую дозу ГК по сравнению с обычной, отсутствуют [34]. Кроме того, нет подтверждения концепции, что введение высокой дозы ГК может уменьшить вероятность гемодинамической нестабильности у лиц с РА, которые перенесли серьезную ортопедическую операцию по сравнению с получавшими обычную дозу преднизолона ≤15 мг/сут [35].
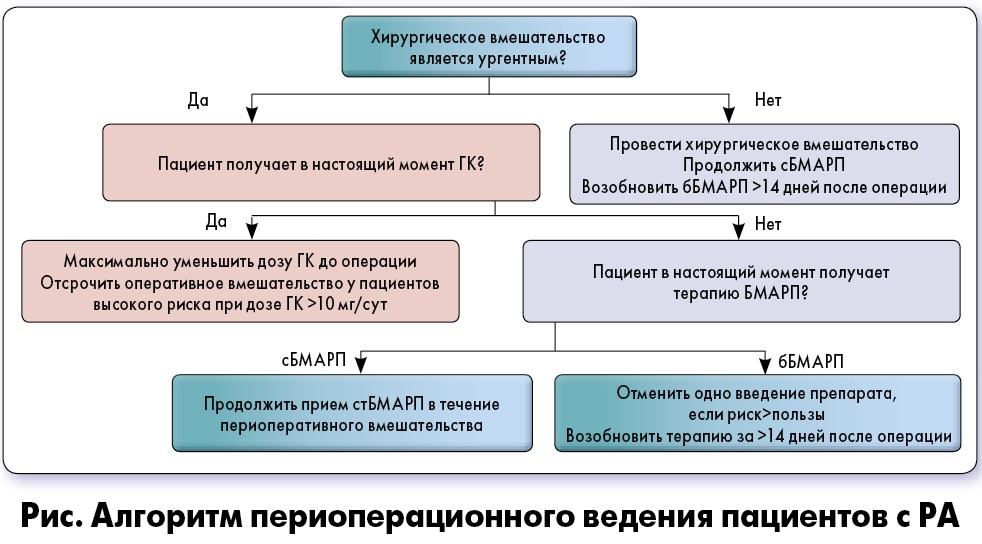
Основываясь на этих данных, ACR/AAKH рекомендуют не назначать пациентам предоперационную стрессовую дозу ГК, если они продолжают принимать обычную суточную, которую по возможности следует снизить до уровня <20 мг/сут преднизолона до хирургического вмешательства [8]. Тем не менее лица с РА при постоянном длительном лечении ГК должны тщательно контролироваться и получать дополнительные дозы стероидов, если у них развиваются признаки гемодинамической нестабильности, такие как гипотензия или тахикардия [35]. Рекомендации не относятся к пациентам с первичной недостаточностью надпочечников или первичным заболеванием гипоталамуса [35].
У больных, которые принимают преднизолон по >10 мг/сут, а возможности уменьшить дозировку нет из-за риска обострения заболевания, особенно важно обеспечить тщательные стерильные условия, осторожное интраоперационное обращение с кожей, плотное закрытие раны и надлежащую антибиотикопрофилактику [36]. Рекомендуется использовать другие стратегии, такие как костный цемент, импрегнированный антибиотиками, что было предложено почти 10 лет назад в качестве подходящего метода для пациентов с высоким риском предрасположенности к периоперационным инфекциям и в настоящее время широко применяется [37].
Пациентам, которые принимают ГК в высоких дозах и нуждаются в плановом хирургическом вмешательстве, рекомендуется, по возможности, подождать, пока не будет достигнут лучший контроль активности заболевания и появится возможность снизить дозу ГК <20 мг/сут в преднизолоновом эквиваленте [8].
Чрезвычайно важно, чтобы хирург обсудил вопрос приема ГК в периоперационный период с больным, ревматологом и анестезиологом на предмет возможного введения дополнительных периоперационных ГК. Это необходимо для противодействия вероятному развитию гипотонии, связанной с подавленной эндогенной функцией надпочечников, у лиц, которые получали ежедневную терапию стероидами.
Биологические БМАРП
Биологические болезнь-модифицирующие антиревматические препараты (бБМАРП) представляют собой большую группу современных лекарственных средств и включают пять ингибиторов фактора некроза опухоли (ФНО) альфа (инфликсимаб, адалимумаб, этанерцепт, цертолизумаба пэгол, голимумаб), ингибитор Т-клеточной костимуляции (абатацепт), препарат анти-В-клеточной терапии (ритуксимаб), моноклональное антитело, блокирующее рецептор интерлейкина (ИЛ)-6 (тоцилизумаб), а также ингибитор ИЛ‑1 (анакинра) [8]. Использование бБМАРП обусловило прорыв в лечении РА и способствовало значительному улучшению результатов терапии, однако существенно повлияло на периоперационное ведение пациентов с РА, что привело к возникновению новых задач и проблем.
Известно, что использование бБМАРП ассоциируется с риском инфицирования в нехирургических условиях, инфекциями кожи, мягких тканей и колонизацией стафилококка [38, 39]. Вероятность инфицирования особенно велика в первые месяцы после начала биологической терапии, что может быть связано с большей активностью заболевания и более высокой дозировкой ГК (как «мост-терапия») в начале лечения [40].
бБМАРП имеют разные механизмы действия и определенные различия в степени инфекционных рисков. Однако в настоящее время недостаточно доказательств, чтобы убедительно продемострировать клинически значимые отличия рисков инфицирования между биопрепаратами во время терапии [41]. Предварительные данные свидетельствуют о том, что вероятность послеоперационной инфекции одинакова у пациентов, получающих различные биологические агенты [42]. Поскольку ингибиторы ФНО остаются самыми «старыми», наиболее изученными и часто назначаемыми биологическими средствами, текущие данные о периоперационном риске при использовании бБМАРП в основном получены из исследований препаратов этой группы.
В нескольких обсервационных исследованиях сравнивали риск послеоперационной инфекции у пациентов с РА, получавших ингибиторы ФНО, и лиц, которые не находились на биологической терапии. S.M. Goodman et al. (2016) провели метаанализ этих работ при участии в общей сложности 7991 больного РА, которые перенесли большую ортопедическую операцию [43]. Пациенты, которые использовали ингибитор ФНО, имели более высокую частоту возникновения поверхностной и глубокой раневой инфекции по сравнению с лицами, не получавшими биологическое лечение (относительный риск [ОР] 2,47; 95% доверительный интервал [ДИ] 1,66‑3,68). Последующий метаанализ, проведенный C. Mabille et al. (2017), продемонстрировал схожие результаты [44]. Недавно R.L. Cordtz et al. (2018) оценивали риск инфицирования протезированного сустава (ИПС) у больных РА, получавших и не получавших биологическую терапию, в течение 90 дней после эндопротезирования тазобедренного или коленного сустава [1]. Авторы изучили несколько датских реестров. Было обнаружено, что ИПС отмечалось намного чаще у пациентов, которые находились на биологическом лечении по сравнению с теми, кто не получал его (2,8 и 1,9 на 100 человеко-лет соответственно), хотя различия не были статистически значимыми (скорректированный ОР 1,61; 95% ДИ 0,70‑3,69).
Тем не менее важно отметить, что пациенты на бБМАРП имели более высокую активность заболевания и с большей вероятностью получали лечение ГК и иммуносупрессантами до операции. Примечательно, что показатели инфицирования были выше у лиц при использовании ГК (скорректированный ОР 2,12; 95% ДИ 0,90‑4,98) и таковых с более высокой активностью болезни, оцененной по DAS28 (скорректированный ОР 2,00; 95% ДИ 1,28‑3,13). ГК и активность РА (но не биологические агенты) также были связаны со значительным риском смерти в течение первого года после операции.
Ведение пациентов на биологической терапии в периоперационный период
Ранее исследователи проявляли некоторую обеспокоенность в отношении риска послеоперационной инфекции у пациентов на биологической терапии. Однако более важный вопрос, стоящий перед клиницистами, заключается не в том, повышен ли риск у больных, применяющих такие препараты, а в том, снизится ли он в случае прекращения/приостановления биологического лечения до операции. В большинстве исследований изучали пациентов, получавших и не получавших биологические средства, но эти группы довольно сильно отличались друг от друга с точки зрения активности заболевания, сопутствующих патологий и проведенной терапии (в том числе ГК). В результате с помощью даже самых сложных статистических методов вряд ли получится создать полностью сопоставимые группы.
Поскольку случаи развития серьезных инфекций после операции относительно редки (приблизительно 1% риск инфекции протезированного сустава после его замены), в настоящее время не представляется возможным провести рандомизацию пациентов с целью принятия однозначного решения: прекратить или продолжать биологическую терапию. Обнаружение умеренной разницы в случаях серьезных инфекций (например, 5 против 7%) или ИПС (например, 1 против 2%) потребовало бы выборки с участием более 4 тыс. пациентов.
Однако в нескольких недавних обсервационных исследованиях начали анализировать сроки биологического лечения, что позвоило получить некоторое представление о роли его прерывания перед хирургическим вмешательством. А. Zahr et al. (2015) [45] оценили 6024 пациента с РА, получавших БМАРП, в том числе 896 – биологические препараты и перенесших операцию. Прерывание приема традиционных (синтетических) или биологических БМАРП не было связано с уменьшением риска послеоперационной инфекции.
Для решения проблем, связанных с точным измерением времени действия биологического агента и определения момента его отмены до операции группа исследователей во главе с M.D. George (2017) отобрала 4288 пациентов, перенесших эндопротезирование тазобедренного или коленного сустава, которым была проведена инфузия инфликсимаба за шесть месяцев до хирургического вмешательства [32]. Установлено, что у больных, получавших инфликсимаб за четыре недели до процедуры, не было различий в риске развития 30-дневной или 1-летней послеоперационной инфекции протезированного сустава по сравнению с теми, кому инфликсимаб в последний раз назначали хотя бы за один интервал дозирования (8‑12 недель) до хирургической интервенции (ОР 0,90; 95% ДИ 0,60‑1,34 и ОР 0,98; 95% ДИ 0,52‑1,87 соответственно для двух исходов). В исследовании контролировали также ряд других потенциальных факторов, в том числе коморбидные заболевания, медицинские манипуляции и сопутствующие препараты, которые принимали пациенты.
В исследовании с участием 311 лиц с воспалительным заболеванием кишечника, перенесших операцию на брюшной полости, оценивали связь между дозой инфликсимаба и риском послеоперационной инфекции [46]. Высокие уровни инфликсимаба, по крайней мере 3 мг/мл, были связаны с большой вероятностью инфекции, но только у лиц с болезнью Крона, а не язвенным колитом. В небольших исследованиях с участием пациентов, получавших тоцилизумаб и ритуксимаб, было недостаточно результатов для адекватной оценки факторов риска инфекции [47, 48]. Авторы отмечали, что вероятность инфицирования не связана со временем между последней инфузией ритуксимаба и тоцилизумаба перед операцией.
Аналогичные результаты наблюдались при оценке французского реестра 263 больных, использовавших внутривенный абатацепт и подвергшихся хирургическому вмешательству. Обнаружено, что время приема абатацепта перед операцией не ассоциировалось с изменением риска осложнений, хотя размер выборки был небольшим, а способность обнаруживать различия – ограниченной [49].
Предварительные данные испытания при участии 1537 пациентов, которые получали внутривенный абатацепт и подверглись эндопротезированию тазобедренного или коленного сустава, были схожими. Больные при применении абатацепта в течение четырех недель до операции имели подобные показатели послеоперационной инфекции и регоспитализаций по сравнению с теми, кто последний раз получал абатацепт более чем за четыре недели (один интервал дозирования) до операции [50].
Таким образом, результаты этих исследований свидетельствуют о том, что длительное прерывание биологического лечения не может в значительной мере положительно повлиять на исход операции.
Существующие испытания и метаанализы крупных обсервационных исследований не могут однозначно доказать, что продолжающееся лечение биологическими агентами хорошо переносится и не повлияет на риск возникновения серьезных инфекций. Однако в целом данные указывают на то, что польза от прерывания биологической терапии, скорее всего, будет небольшой [51].
В связи с известным риском инфицирования, ассоциированного с бБМАРП, группа ACR/AAHKS рекомендовала отменить все бБМАРП до планового оперативного вмешательства и выполнять его, пропустив одно введение препарата [8]. Для определения этой рекомендации использовали интервал дозирования, а не период полураспада лекарственных средств, поскольку он не коррелирует с продолжительностью действия препаратов.
В соответствии с данным положением пациент, получающий инфликсимаб каждые восемь недель, должен последний раз получать его за девять недель до операции. В свою очередь больному, который использует адалимумаб каждые две недели, необходимо применять его последний раз за три недели до хирургического вмешательства. Возобновление лечения биологическими агентами следует проводить через 14 дней после процедуры, если послеоперационная рана хорошо заживает и нет признаков местной или системной инфекции.
В обновленных руководствах по биологической безопасности бБМАРП BSR принят аналогичный подход, согласно которому рекомендуется прерывание бБМАРП на один интервал введения для большинства биологических препаратов (за исключением двух недель для тоцилизумаба для подкожного введения и четырех – для внутривенного, 36 месяцев – для инфликсимаба). В случае оперативных вмешательств у пациентов высокого риска следует рассмотреть прекращение приема препарата за 3‑5 периодов полураспада (если данный промежуток времени длиннее одного интервала дозирования) [9].
В таблице представлены сроки отмены и возобновления лечения пациентов с РА бБМАРП в периоперационный период.
Обсуждение
Тщательный периоперационный анализ пациента с РА чрезвычайно важен для достижения благоприятных результатов лечения в послеоперационный период и для последующего менеджмента. Детально собранный анамнез, физикальное обследование с соответствующей лабораторной оценкой функции органов и систем, дифференциальный диагноз коморбидных состояний составляют основу такого подхода. Следует информировать больных о потенциальных рисках хирургического вмешательства, в том числе повышенной вероятности инфицирования, замедления заживления ран и развития ВТЭ-событий, а также об основных возможных сердечно-сосудистых, легочных и неврологических нарушениях, которые могут быть обусловлены хирургическим вмешательством.
Клинические исследования, проведенные за последние несколько лет, улучшили понимание надлежащего периоперационного менеджмента пациентов с РА, хотя в отношении биологической терапии остается еще много неопределенностей. Недавние данные подтвердили, что лица с РА подвергаются большему риску инфекции после операции, но прием лекарственных средств, вероятно, объясняет только часть этого риска. Терапию БМАРП в предоперационный период следует осуществлять в соответствии с рекомендациями основных ведущих ревматологических сообществ, но подход должен быть индивидуализирован с привлечением мультидисциплинарной команды. В руководящих принципах предоставлена отправная точка для рассмотрения вопроса о минимизации риска в периоперационный период, однако важно интерпретировать фактические данные в контексте каждого отдельного пациента. В настоящее время авторы поддерживают продолжение приема синтетических традиционных БМАРП в течение всего периоперационного периода и рекомендуют кратковременные прерывания биологической терапии за один интервал дозирования перед операцией с возобновлением через 14 дней.
Может показаться, что основной подход заключается в том, чтобы остановить биологическую терапию перед операцией несмотря на многочисленные современные исследования, не продемонстрировавшие явной пользы от прерывания лечения. Этот подход является разумным для многих пациентов, но в некоторых случаях остановка применения бБМАП – не лучший подход для минимизации риска. Например, больные, которые часто имеют обострения заболевания, требующие лечения более высокими дозами ГК, могут иметь лучшие результаты, если в периоперационный период продолжать, а не прерывать использование биологических методов терапии.
Для некоторых пациентов опасения по поводу обострения болезни, которые часто встречаются в послеоперационный период, могут перевешивать проблему возможного развития инфекционного осложнения, особенно при процедурах с низким риском без протезного материала. Напротив, лица с длительной ремиссией заболевания, но с множественными инфекционными осложнениями в прошлом могут с большей вероятностью получить пользу от прерывания терапии. К счастью, прекращение терапии за один интервал дозирования до операции и возобновление через 14 дней после (как предполагают современные рекомендации) приводят к кратковременному прерыванию лечения для большинства пациентов. Данные же наблюдений, безусловно, подтверждают гипотезу о том, что более длительные перерывы нецелесообразны.
Несмотря на то что проблема необходимости прекращения приема биологических средств в периоперационный период все еще обсуждается, существует консенсусное мнение, что при приеме высоких доз ГК риск инфицирования более значительный. Это позволяет предположить, что длительное прерывание лечения биопрепаратами может быть контрпродуктивным, поскольку, вероятно, вызовет обострение заболевания у пациентов, требующих назначения ГК. Данные также подтверждают цель сокращения использования глюкокортикоидов до хирургического вмешательства, когда это возможно.
Следует подчеркнуть, что более высокие дозы ГК, по-видимому, вносят значительно больший негативный вклад в риск послеоперационной инфекции, чем биологическая терапия. Хотя в рекомендациях ACR указывается необходимость избегать плановой операции у пациентов, которым требуется назначение преднизолона по >20 мг/сут, риск осложнений возрастает даже при более низких дозах.
Необходимо приложить все усилия, чтобы уменьшить дозу ГК до минимально возможной перед процедурой. Более поздние данные наблюдений подтверждают, что длительное прекращение биологической терапии не улучшает результаты, а ограничение воздействия ГК за счет снижения дозы <20 мг преднизолона перед хирургической интервенцией имеет первостепенное значение. У больных, получающих более высокие дозы, следует рассмотреть возможность отсрочки плановых операций до тех пор, пока заболевание станет менее активным. Предлагаемый подход к пациенту с РА, который перенес оперативное вмешательство, основанный на существующих данных и рекомендациях, представлен на рисунке.
Выводы
Таким образом, современные рекомендации могут помочь в ведении пациентов с РА при предстоящем хирургическом вмешательстве. Одновременно продолжается ряд исследований, которые, мы надеемся, внесут в будущем большую ясность в менеджмент таких больных.
Список литературы находится в редакции
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 6 (67), 2019 р.