17 січня, 2020
Гастробезпека терапії нестероїдними протизапальними препаратами у пацієнтів із ревматичними захворюваннями
 У вересні 2019 року в Одесі відбулася науково-практична конференція «Ревматологія ХХІ сторіччя». До вашої уваги представлено огляд озвученої в межах заходу доповіді начальника кафедри військової терапії Української військово-медичної академії, д. мед. н., професора Галини Василівни Осьодло. Виступ був присвячений актуальному питанню безпеки застосування нестероїдних протизапальних препаратів (НПЗП) у пацієнтів ревматологічного профілю в аспекті впливу на шлунково-кишковий тракт (ШКТ).
У вересні 2019 року в Одесі відбулася науково-практична конференція «Ревматологія ХХІ сторіччя». До вашої уваги представлено огляд озвученої в межах заходу доповіді начальника кафедри військової терапії Української військово-медичної академії, д. мед. н., професора Галини Василівни Осьодло. Виступ був присвячений актуальному питанню безпеки застосування нестероїдних протизапальних препаратів (НПЗП) у пацієнтів ревматологічного профілю в аспекті впливу на шлунково-кишковий тракт (ШКТ).
Найважливішими симптоматичними препаратами, які призначають пацієнтам ревматологічного профілю, є НПЗП. Спектр показань для застосування визначається здатністю впливати на характерні симптоми ревматологічних захворювань, як-то гострий/хронічний біль, температурна реакція тощо, та охоплює запальні процеси будь-якого ґенезу й локалізації (Zeidler et al., 2002). Приймання НПЗП супроводжується низкою побічних ефектів, провідне місце серед яких посідають дистрофічні та запальні зміни слизової оболонки травного каналу, що проявляються ерозіями та виразками шлунка й дванадцятипалої кишки (Свінцицький, 2008).
Гастроінтестинальні ураження
Сьогодні гастроінтестинальна (ГІ) безпека терапії НПЗП являє собою серйозну медичну проблему, адже вони є однією з найбільш затребуваних груп препаратів. Щоденно НПЗП отримують близько 30 млн осіб, при цьому частота ушкоджень верхніх відділів ШКТ (ерозивно-виразкові ураження, перфорації, кровотечі) при регулярному використанні може сягати 30‑40%. Загострення виразкової хвороби, гастродуоденіту або гастроезофагеальної рефлюксної хвороби, вказівки на них в анамнезі є обмеженнями для призначення НПЗП (Наумова, 2017).
Відносний ризик (ВР) ушкоджень при використанні НПЗП із тривалим періодом напіввиведення та неселективних інгібіторів циклооксигенази‑2 (ЦОГ‑2) становить 7,2 (<30 днів) та 3,9 (>30 діб), супутньому прийманні антикоагулянтів – 6,4, глюкокортикостероїдів – 2,2. В осіб віком понад 70 років ризик зростає у 5,6 раза, а при застосуванні НПЗП у перші три місяці після призначення (при плануванні тривалої терапії) – удвічі. Надалі відбувається так звана вторинна адаптація гастродуоденальної зони до НПЗП – феномен простагландинової гастропротекції: за 3‑4 місяці регулярного приймання вірогідність НПЗП-гастропатій знижується (Свінцицький, 2008).
Також спікер актуалізувала проблему ступенів ризику ГІ-уражень. За рекомендаціями Американської колегії гастроентерологів (ACG), про високий ГІ-ризик свідчать наявність в анамнезі ускладненої виразки гастродуоденальної зони та множинні фактори ризику (>2), про помірний – 1‑2 фактори (вік >65 років, приймання НПЗП у високих дозах, неускладнена виразка в анамнезі, одночасне використання АСК, глюкокортикостероїдів, антикоагулянтів). Низьким є ризик за відсутності таких чинників (Lanza et al., 2009).
НПЗП-гастропатії
Серед НПЗП-гастропатій доцільно розрізняти ранні та пізні. Протягом декількох перших днів терапії НПЗП значну роль відіграють місцеві пошкоджувальні ефекти, зумовлені цитопатичною дією самої молекули НПЗП. Як наслідок, з’являються ерозії та неглибокі виразки переважно верхніх відділів шлунка. Здебільшого вони минають самостійно, оскільки слизова оболонка здатна адаптуватися. Безумовно, більшу небезпеку становлять пізні ушкодження. Відстрочені НПЗП-гастропатії найбільш виражені в антральному відділі шлунка (місце колонізації H. pylori) та пов’язані з системними проявами терапії – пригніченням синтезу простагландинів (Свінцицький, 1991).
Механізм протизапальної дії НПЗП пов’язаний із пригніченням активності ЦОГ – ключового ферменту метаболізму арахідонової кислоти та зниженням синтезу простагландинів. З її метаболітами асоційовані запалення та утворення виразок ШКТ, а 5-ліпооксигеназа спрямовує синтез арахідонової кислоти шляхом лейкотрієнів та відіграє значну роль у ґенезі побічних симптомів при інгібуванні ЦОГ.
Останнім часом через появу нових фактів щодо значення ЦОГ-залежного синтезу простагландинів у нормі та при патології думку про те, що ЦОГ‑1 є «фізіологічним», а ЦОГ‑2 – «патологічним» ферментами переглянуто. Виразну експресію ЦОГ‑1 відзначено при патологічних станах, як-то ревматоїдний артрит, остеоартроз, бурсит. Натомість в експериментальних дослідженнях на тваринах показано, що за відсутності в організмі ЦОГ‑2 виразність запального процесу ідентична в особин контрольної групи. Отже, доведено фізіологічну роль ЦОГ‑2-залежного синтезу простагландинів у процесах: загоєння дефектів слизової оболонки ШКТ; «адаптивної цитопротекції» клітин ШКТ до токсичних речовин; розвитку стресу; регуляції овуляції, судинного тонусу, функції підшлункової залози та нирок; ремоделювання та регенерації кісткової тканини тощо (Van et al., 2000).
Тому поява коксибів не забезпечила повної ГІ-безпеки. Також вони не виправдали сподівань щодо впливу на серцево-судинну систему. Селективні інгібітори ЦОГ‑2 підвищують ризик інфарктів, інсультів і протипоказані при ішемічній хворобі серця, цереброваскулярних та інших судинних порушеннях (EMEA, 2005).
НПЗП зі сприятливим профілем ГІ-безпеки
Якщо розглядати так звані неселективні препарати, то серед них найсприятливіший профіль ГІ-безпеки має диклофенак. Диклофенак є діючою речовиною препарату Диклоберл, який характеризується не тільки широким спектром терапевтичних ефектів, але й наявністю різних лікарських форм. Якщо порівнювати диклофенак із селективними НПЗП, то його ГІ-профіль також виглядає цілком гідно.
У межах дискусії відносно ризиків та переваг було визначено вірогідність ГІ-кровотечі, пов’язаної з використанням коксибів, неселективних НПЗП та АСК або їхніх комбінацій у клінічній практиці. Так, коксиб має менший коефіцієнт ризику ГІ-кровотечі, ніж неселективні НПЗП. Однак при поєднанні з АСК у низькій дозі відмінності між неселективними НПЗП та коксибами зазвичай зникають. Лікування антиагрегантом без АСК чи кардіопротекторним аспірином також пов’язане з вірогідним розвитком кровотеч (Lanas et al., 2006). Тож можна стверджувати, що диклофенак (Диклоберл) є препаратом вибору в пацієнтів, які приймають АСК.
Кровотечі у ШКТ, індуковані НПЗП, антикоагулянтами та антиагрегантами
У багатоцентровому (18 лікарень в Іспанії та Італії) контрольованому дослідженні оцінювали ризик виникнення кровотеч у верхніх відділах ШКТ, пов’язаних із НПЗП та анальгетиками, з акцентом на тих, що були введені останніми роками (ацеклофенак, целекоксиб, декскетопрофен, мелоксикам, німесулід, рофекоксиб). До аналізу «випадок/контроль» було включено 2813 епізодів ГІ-кровотеч у пацієнтів >18 років та 7193 – контролю. Індивідуальні ризики для кожного НПЗП залежали від дози. Ризик підвищувався в осіб із виразковою хворобою та/або кровотечами у ШКТ в анамнезі, а також тих, хто приймав антитромбоцитарні препарати (АТП).
Дослідники дійшли висновку, що індуковані НПЗП кровотечі з верхніх відділів ШКТ є частою причиною госпіталізацій. Окрім виразкової хвороби в анамнезі, ризик кровотечі залежить від конкретного препарату, дози та супутнього лікування. При цьому не підтверджено, що більша селективність для ЦОГ‑2 асоційована з меншим ризиком кровотеч із верхніх відділів ШКТ (Laporte et al., 2004).
Дослідження ризику виникнення ГІ-кровотеч при використанні НПЗП, антикоагулянтів та антиагрегантів показали, що антикоагулянти, АСК у низьких дозах та інші препарати (не-АСК – АТП, 82,3% тієнопіридинів) асоціювалися з нижньою та верхньою ГІ-кровотечею. Ризик був удвічі вищим для антикоагулянтів (ВР 4,2), ніж АСК у низькій дозі (ВР 2,1) чи інших препаратів без АСК-AТП (ВР 2,0). НПЗП також асоціювалися з підвищеною вірогідністю ГІ-кровотеч, особливо з верхніх (ВР 2,6) відділів ШКТ.
Таким чином, антикоагулянти, низькодозована АСК, НПЗП та інші препарати без АСК-АТП асоційовані з підвищеною ймовірністю кровотечі з верхніх та нижніх відділів ШКТ, при цьому найістотніший фактор ризику – приймання антикоагулянтів. Тому слід звернути увагу, що використання інгібіторів протонної помпи (ІПП) на тлі НПЗП, антиагрегантів чи антикоагулянтів пов’язане з меншим ризиком верхніх ГІ-кровотеч (Lanas et al., 2015).
H. pylori як фактор ризику виразкової кровотечі
Доповідачка нагадала, що виразкова хвороба є основною причиною кровотеч у верхні відділи ШКТ, тоді як інфекція H. pylori – головним етіологічним фактором виразкової хвороби. За даними метааналізу, в якому порівнювали ефективність ерадикаційного лікування H. pylori та тривалої антисекреторної терапії без ерадикації для запобігання повторним кровотечам, успішна ерадикація Н. pylori знижувала вірогідність рецидиву кровотечі протягом року порівняно з використанням лише ІПП (Gisbert et al., 2004).
Також показано, що НПЗП, АСК у низькій дозі та інфекція H. pylori є трьома незалежними чинниками ризику розвитку виразкової кровотечі. При цьому ВР ГІ-кровотеч за супутнього використання НПЗП та інфекції H. рylori передбачав адитивний ефект (ВР 8), тоді як взаємодії з АСК не виявлено (ВР 3,5) (Sostres et al., 2015).
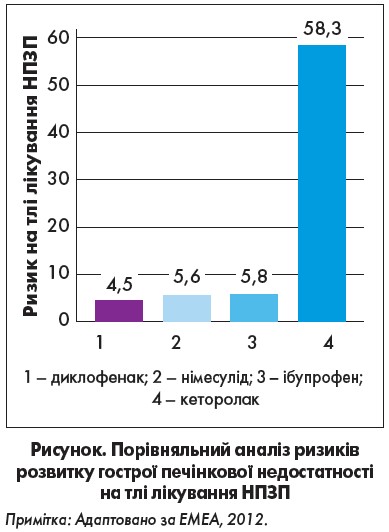
Як відомо, НПЗП притаманна певна гепатотоксичність. Частота епізодів тяжкого ураження печінки при використанні німесуліду становить близько 1 випадку на 100 тис. пацієнтів, тобто є зіставною з такою побічних явищ, що виникають на тлі приймання НПЗП (або нижчою). Користь від зниження ризику тяжких гастродуоденальних ускладнень за використання німесуліду значно перевищує ймовірну небезпеку, пов’язану з рідкісними гепатотоксичними реакціями на препарат (Каратеєв, Насонова, 2004).
Порівняльний аналіз ризиків розвитку гострої печінкової недостатності на тлі лікування НПЗП представлений на рисунку. Було продемонстровано найбільш сприятливий гепатологічний профіль диклофенаку та найгірший – кеторолаку (EMEA, 2012).
Профілактика НПЗП-асоційованих гастропатій
За даними метааналізу, в якому порівнювали ефективність ІПП та трьох препаратів (плацебо, герфарнату та фамотидину), у плані профілактики НПЗП-асоційованих гастропатій (виразок та кровотеч із верхніх відділів ШКТ, викликаних АСК) явні переваги показали ІПП (Scheiman, 2013). При лікуванні коморбідних пацієнтів за низького ГІ-ризику можна використовувати неселективні НПЗП, проте необхідно проводити моніторинг на предмет диспепсії, болю, прихованої крові у калі.
За наявності високої ймовірності серцево-судинних подій варто призначати інші препарати разом з ІПП. При середньому ГІ-ризику перевагу слід віддавати селективним за ЦОГ‑2 НПЗП (німесулід без «прикриття» ІПП або диклофенак разом із ІПП). Для осіб із високим ГІ-ризиком можна використовувати як селективні, так і неселективні НПЗП (ібупрофен, диклофенак чи целекоксиб) виключно «під прикриттям» ІПП. Отже, диклофенак (Диклоберл) можна призначати усім категоріям пацієнтів у монотерапії або в комбінації з ІПП (при середньому і високому ГІ-ризику).
Ентеро- та колопатії
Доповідачка зауважила, що НПЗП-ентеропатії є частим ускладненням лікування. Вони становлять до 2/3 випадків ушкоджень ШКТ та до 40% усіх тяжких ГІ-ускладнень. Ретроспективне спостереження за участю 4524 пацієнтів показало, що використання АСК у високій дозі (1000 мг) щодня протягом 4 років підвищує ризик неспецифічного виразкового ураження ШКТ у 10,7 раза, (Ткач, 2014). Тож наявність у хворого симптомів кишкової диспепсії, зниженого вмісту гемоглобіну та симптомів залізодефіцитної анемії може вказувати на ураження слизової оболонки кишечника.
Ефективність у профілактиці медикаментозних ентеропатій демонструють селективні інгібітори ЦОГ‑2 (целекоксиб), деривати простагландинів (мізопростол), цитопротектори (ребаміпід), НПЗП-фосфатидилхолін та пробіотики. Доцільною є гастроінтестинопротекція (ребаміпід, еупатилін), кислотосупресія (ІПП), деконтамінація кишківника при розвитку синдрому надмірного бактеріального росту (СНБР) (рифаксимін, пре- та пробіотики), а ефективність кислотосупресії (ІПП) переглядається (Ткач, 2014). Тривале застосування ІПП може зумовити появу СНБР. Отже, якщо хворий схильний до ентеро- та колопатій на тлі терапії НПЗП, слід обирати нові медикаментозні стратегії.
Висновки
Таким чином, у запальному процесі беруть участь ЦОГ‑1 і ЦОГ‑2, при цьому ризики ГІ-ускладнень мінімальні при застосуванні німесуліду (Німесил) та диклофенаку (Диклоберл). За підвищення ризику ГІ-подій та одночасного приймання АСК рекомендовані НПЗП (Диклоберл) та ІПП у стандартній дозі. Перед початком тривалої терапії НПЗП доцільним є тестування на хелікобактерну інфекцію та її лікування за наявності. Профілактика ентеропатій необхідна пацієнтам, які мали клінічно значимі НПЗП-індуковані ушкодження тонкої кишки в анамнезі.
Підготувала Олександра Демецька
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 4 (51) грудень 2019 р.