23 січня, 2020
Неочевидні питання імунобіологічної терапії при ревматичних хворобах
Значимою подією для лікарів-ревматологів та фахівців суміжних галузей стала науково-практична конференція «Ревматологічні хвороби – сучасні проблеми лікування та забезпечення моніторингу», що відбулася 31 жовтня – 1 листопада 2019 року в Києві. Серед нагальних питань були, зокрема, розглянуті актуальні аспекти імунобіологічної терапії (ІБТ).
.jpg) Академік НАМН України, д. мед. н., професор Володимир Миколайович Коваленко представив резолюцію щодо ведення пацієнтів, які потребують ІБТ, зокрема лікування інгібіторами фактора некрозу пухлин α (іФНП-α). ФНП-α – 26-кілодальтоновий гомотримерний трансмембранний білок, що експресується на поверхні макрофагів,
Академік НАМН України, д. мед. н., професор Володимир Миколайович Коваленко представив резолюцію щодо ведення пацієнтів, які потребують ІБТ, зокрема лікування інгібіторами фактора некрозу пухлин α (іФНП-α). ФНП-α – 26-кілодальтоновий гомотримерний трансмембранний білок, що експресується на поверхні макрофагів,
Ведення пацієнта із ХЗЗ, що підлягає лікуванню іФНП, є складним і тривалим комплексним процесом, який передбачає співпрацю ревматологів з лікарями суміжних спеціальностей, а саме інфекціоністами, зокрема, гепатологами, гастроентерологами, фтизіатрами, імунологами, дерматологами. Метою такої взаємодії є якісний контроль побічних ефектів лікування, оскільки хворі потребують регулярного скринінгу патологічних станів, як-от туберкульоз, гепатит В, інфекційні ускладнення.
Голімумаб: показання та профіль безпеки
Одним із часто застосовуваних препаратів ІБТ, що являють собою людські моноклональні антитіла до ФНП, є голімумаб. Цей лікарський засіб схвалений для терапії помірно тяжких / тяжких форм РА у комбінації з метотрексатом, активного ПсА у вигляді монотерапії або при спільному застосуванні з метотрексатом, активного АС та помірно тяжких / тяжких форм виразкового коліту в пацієнтів із неадекватною відповіддю на попереднє лікування, непереносимістю останнього чи потребою у тривалій кортикостероїдній терапії (Kay et al., 2016).
У дослідженнях фази 3 за участю хворих на РА, ПсА та АС безпека голімумабу впродовж трьох років лікування відповідала показникам інших іФНП (Kay et al., 2015). У 2016 р. автори провели узагальнений аналіз п’ятьох великих мультицентрових досліджень (GO-BEFORE, GO-FORWARD, GO-AFTER, GO-REVEAL, GO-RAISE), до яких були залучені дорослі пацієнти з активними формами РА, ПсА та АС.
Після стандартизації за часом спостереження відмінностей у частоті розвитку тяжких інфекцій, активного туберкульозу (АТБ), опортуністичних інфекцій, смерті, демієлінізації чи злоякісних пухлин у групах голімумабу та плацебо не виявлено. Найбільш поширені побічні ефекти включали інфекційні процеси, артеріальну гіпертензію, еритему в місці введення препарату, підвищення рівня аланінамінотрансферази (АЛТ). У 18 із 2228 пацієнтів виникли опортуністичні інфекції, зокрема шість випадків стравохідного/шлунково-кишкового кандидозу, три – гістоплазмозу, два – легіонельозної пневмонії, по одному – аспергіломи, стравохідного кандидозу/аспергильозу, пневмоцистної пневмонії, герпесу й оксоплазмозу ока, кокцидіомікозу, криптоспоридіозу.
Загальна частота розвитку злоякісних пухлин, стандартизована за часом, не зростала за умов лікування голімумабом порівняно із плацебо (1,07 та 2,59 випадку на 100 пацієнто-років відповідно) та очікуваним рівнем захворюваності у загальній популяції. Однак слід зауважити, що через п’ять років використання голімумабу в дозі 100 мг на місяць поширеність лімфом у групі лікування перевищувала аналогічний показник у загальній популяції США. Автори метааналізу пояснюють цей факт значною тривалістю та високою активністю фонового запального захворювання (переважно РА).
Туберкульоз
У пацієнтів із хронічними запальними захворюваннями, що отримують будь-яке імуносупресивне лікування, зокрема іФНП, зростає вірогідність розвитку туберкульозу. На тлі терапії іФНП відносний ризик туберкульозу збільшується у 1,6‑25 разів залежно від клінічного контексту, застосовуваного препарату, національної приналежності пацієнта (Solovic et al., 2010). У зв’язку з цим для таких хворих обов’язковими є скринінг на наявність латентного інфікування Mycobacterium tuberculosis та профілактичне лікування з метою зниження ризику прогресування латентної туберкульозної інфекції (ЛТІ) з розвитком захворювання на туберкульоз (Mir Viladrich et al., 2016). Слід пам’ятати, що >50% відомих випадків туберкульозу, асоційованих із терапією іФНП, позалегеневі (British Thoracic Society, 2005).
Діагностика ЛТІ у пацієнтів, що підлягають імуносупресивному лікуванню, особливо важлива у групах високого ризику, які включають такі підгрупи:
- особи, які нещодавно контактували із хворим на туберкульоз;
- особи, що народилися, проживають або часто подорожують до країн із високою поширеністю туберкульозу (до таких, серед інших, належать Росія та країни Східної Європи);
- мешканці та працівники закритих установ (в’язниці, притулки для бездомних осіб, соціальні медичні центри);
- особи з ЛТІ, які знаходяться на лікуванні препаратами з імуносупресією;
- особи, що зловживають алкоголем чи іншими токсичними речовинами, зокрема курці;
- працівники галузі охорони здоров’я, передусім ті, хто лікують пацієнтів з АТБ;
- пацієнти з рентгенографічними ознаками перенесеного туберкульозу, особливо якщо вони ніколи не отримували специфічного лікування;
- імуноскомпрометовані особи;
- пацієнти із патологіями, які підвищують ризик розвитку туберкульозу (ВІЛ-інфекція, автоімунні хвороби, стан після трансплантації органів і гастректомії, силікоз, хронічна ниркова недостатність, цукровий діабет, пухлини).
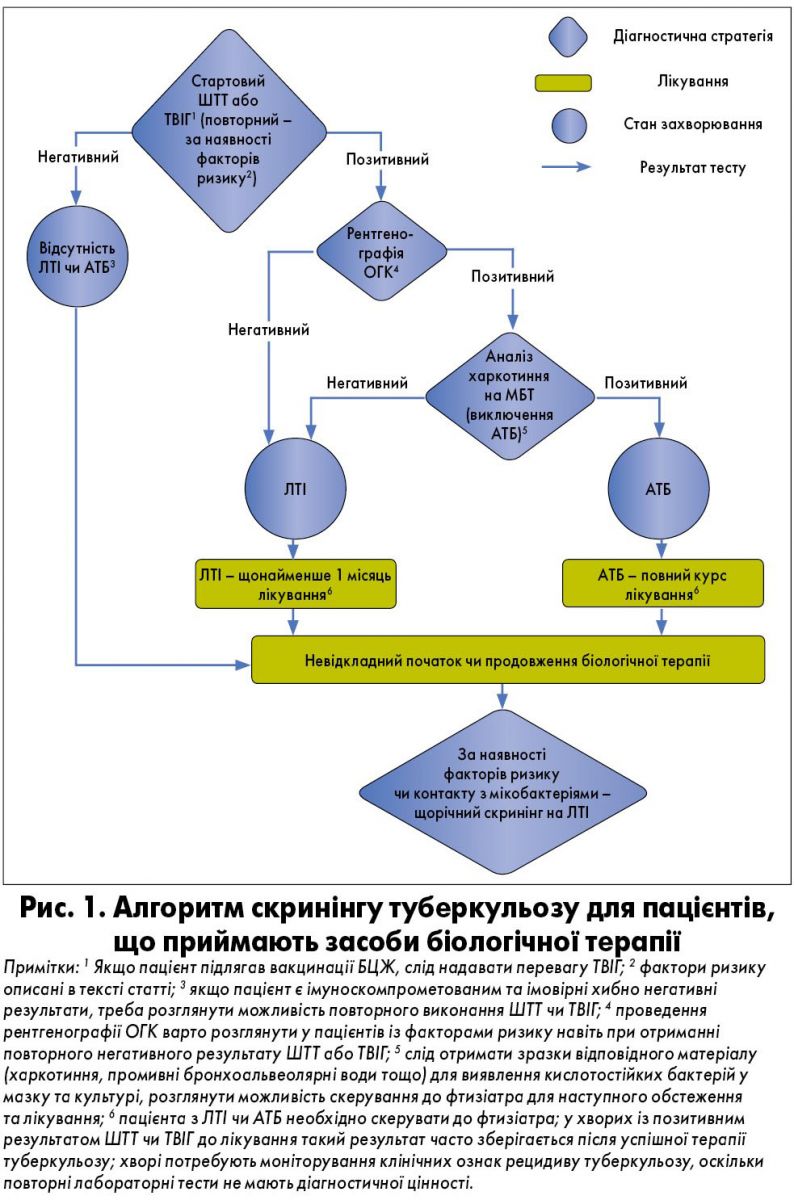
Перед призначенням іФНП слід ретельно вивчити історію хвороби (із метою виявлення туберкульозу або ЛТІ в анамнезі та встановлення факту попереднього лікування), провести рентгенографію органів грудної клітки (ОГК) та шкірний туберкуліновий тест (ШТТ). Варто зазначити, що у пацієнтів, які отримують імуносупресивні препарати, спостерігається висока частка (до 40%) хибнонегативних результатів ШТТ (Garcia-Gasalla et al., 2013; Ponce de Leon et al., 2005, 2008).
Виявлення та лікування ЛТІ зменшують імовірність розвитку активного туберкульозу в таких пацієнтів. Терапію ЛТІ слід проводити лише після виключення АТБ. Режим лікування ЛТІ передбачає застосування ізоніазиду впродовж щонайменше шести місяців або ізоніазиду з рифампіцином – трьох. Звична доза ізоніазиду становить 5 мг/кг маси тіла на добу, максимальна – 300 мг/добу. Оптимальна тривалість лікування ЛТІ ізоніазидом – шість місяців. Стандартна доза рифампіцину складає 10 мг/кг маси тіла на добу, максимальна – 600 мг/добу.
Профілактика прогресування ЛТІ до активної форми захворювання проводиться паралельно з терапією іФНП, бажано ініціювати її щонайменше за місяць до початку іФНП. У разі непереносимості ізоніазиду або нечутливості до нього призначають рифампіцин.
Алгоритм скринінгу туберкульозу в пацієнтів, що підлягають застосуванню біологічної терапії, представлено на рисунку 1.
Гепатит B
Ризик реактивації вірусу гепатиту В (ВГВ) у ревматологічних пацієнтів із хронічною ВГВ-інфекцією, що підлягають лікуванню високими дозами кортикостероїдів, іФНП та ритуксимабом без антивірусної профілактики, є надзвичайно високим, а для осіб із ВГВ-інфекцією в анамнезі – мінімальним (Koutsianas et al., 2017). Так, частка реактивації у дослідженні R. Perez-Alvarez et al. (2011) за участю хворих на хронічний гепатит В становила 64%. Більшість реактивацій відбулася через кілька місяців після початку іФНП (в середньому через 9,8 місяця).
На даний час узагальненого консенсусу щодо визначення реактивації ВГВ після імуносупресії не існує. На думку більшості експертів, реактивація ВГВ передбачає зростання сироваткових рівнів ДНК ВГВ більш ніж на 1‑2 log10 МО/мл (якщо ДНК ВГВ визначали при вихідному обстеженні) чи виявлення ДНК ВГВ (>100 МО/мл, якщо ДНК ВГВ при вихідному обстеженні не визначали). У деяких пацієнтів це супроводжується повторною появою HBs-антигену (зворотна сероконверсія). Реактивація ВГВ може відбуватися разом зі спалахами гепатиту, які визначаються як підвищення АЛТ у три та більше разів порівняно з верхньою межею норми або абсолютне значення АЛТ на рівні ≥100 МО/мл (Koutsianas et al., 2017).
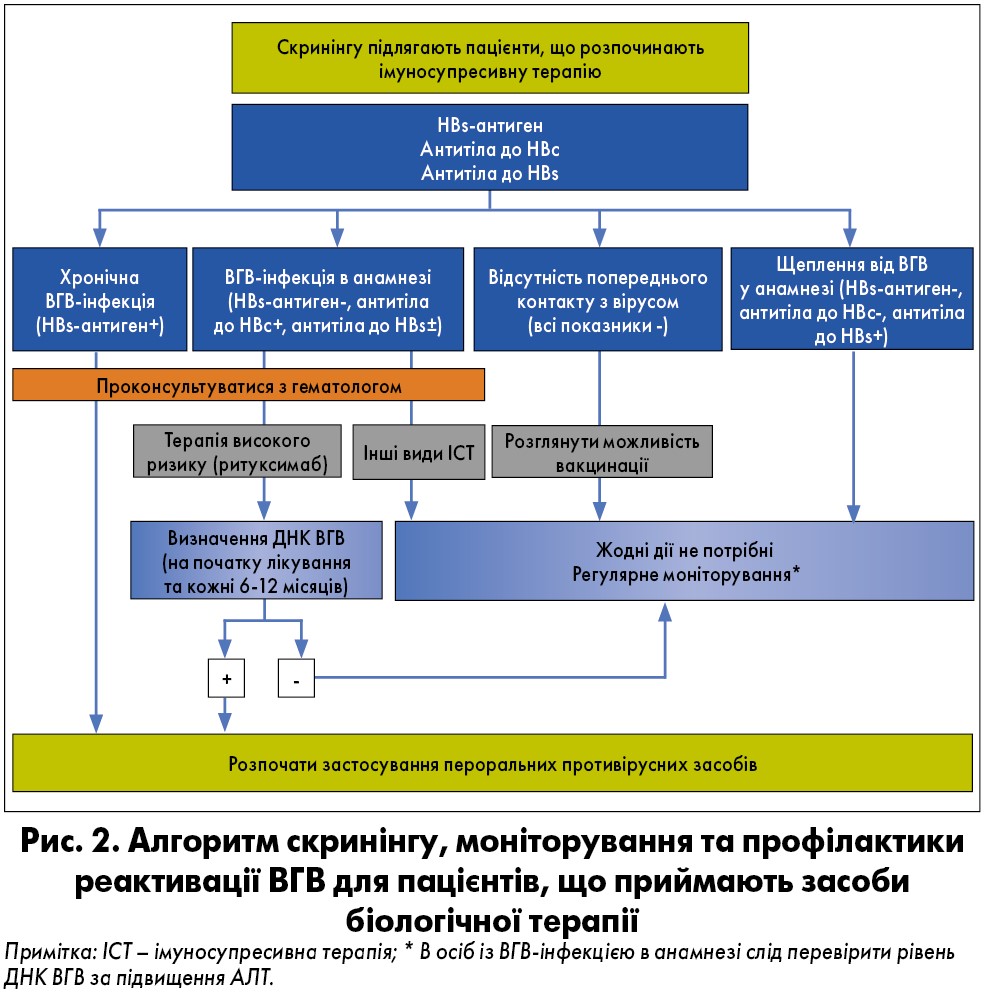
Високий ризик реактивації ВГВ та можливість запобігти цьому процесу обґрунтовують доцільність виявлення хворих групи ризику до початку імуносупресивного лікування. Згідно з рекомендаціями Американської гастроентерологічної асоціації (AGA, 2015), імуносупресивну біологічну терапію можна безпечно застосовувати одночасно із профілактичним призначенням антивірусних засобів (Singh et al., 2015). Для пацієнтів із природним імунітетом до гепатиту В (позитивний ядерний антиген ВГВ [HBc], негативний поверхневий антиген ВГВ [HBs] та позитивні антитіла до HBs, нормальні показники функції печінки) лікування РА має бути таким самим, як і для тих, хто ніколи не мав гепатиту В або не був носієм цього вірусу.
Однак кожні 6‑12 місяців слід контролювати вірусне навантаження (Yeo, Johnson, 2006; Lok et al., 1991). Нелікованих хворих на хронічний гепатит B необхідно скерувати для проходження антивірусної терапії до початку застосування імуносупресивних засобів.
Серологічний скринінг на ВГВ-інфекцію слід проводити у всіх пацієнтів, що підлягають імуносупресивному лікуванню, та хворих з ознаками ураження печінки (підвищений рівень АЛТ, асцит, варикозне розширення вен передньої черевної стінки тощо). На думку експертів Управління з санітарного нагляду за якістю харчових продуктів та медикаментів США (FDA) й AGA, базисними скринінговими методами є визначення HBs-антигену та антитіл до HBc, тоді як включення до скринінгової програми антитіл до HBs є суперечливим. Хворим, що є негативними за усіма трьома переліченими вище аналізами, слід провести щеплення від ВГВ до початку імуносупресивної терапії.
У хворих, що раніше підлягали вакцинації (HBs-антиген негативний, антитіла до HBc негативні, антитіла до HBs позитивні) та мають титр антитіл до HBs >10 МО/мл, жодні наступні дії не потрібні. У пацієнтів із меншим титром слід розглянути можливість ревакцинації. Особи із позитивним тестом на HBs-антиген характеризуються найвищим ризиком реактивації ВГВ під час імуносупресивної терапії, тому при їхньому веденні обов’язково варто консультуватися з гепатологом. Хворі на активний хронічний гепатит B (підвищений рівень АЛТ, високий рівень ДНК ВГВ, помірна/висока некротично-запальна активність при біопсії печінки) або цирозом печінки повинні розпочинати пероральну противірусну терапію відповідно до сучасних рекомендацій, незалежно від запланованої ІБТ.
Усі інші пацієнти повинні отримувати антивірусну терапію паралельно з лікуванням іФНП, хоча в рекомендаціях AGA (2015) не вказано доцільність рутинного застосування противірусних засобів у цій популяції, яку вважають групою низького ризику. На думку авторів настанови, антивірусну профілактику слід залишити винятково для пацієнтів із нетяжким фіброзом печінки та за доступності ретельного моніторування рівня ДНК ВГВ й АЛТ.
Профілактичне антивірусне лікування варто розпочинати за 1‑2 тижні до антиревматичного, особливо у пацієнтів із високим вихідним рівнем ДНК ВГВ. У випадках, коли це неможливо (ревматичне захворювання загрожує життю або збереженню органів), антивірусну терапію можна розпочинати одночасно з імуносупресивною. Антивірусні препарати слід продовжувати приймати щонайменше протягом шести місяців після завершення антиревматичного лікування (AGA, 2015).
Алгоритм скринінгу гепатиту В для пацієнтів, що підлягають лікуванню засобами біологічної терапії, представлено на рисунку 2.
Гепатит C
Особи з РА, інфіковані вірусом гепатиту С (ВГС), повинні підлягати такому самому лікуванню, як і пацієнти без цієї інфекції. Для моніторингу стану хворих, що отримують противірусні препарати, ревматологи мають співпрацювати з гастроентерологами та/або гематологами (Singh et al., 2015).
Опортуністичні інфекції
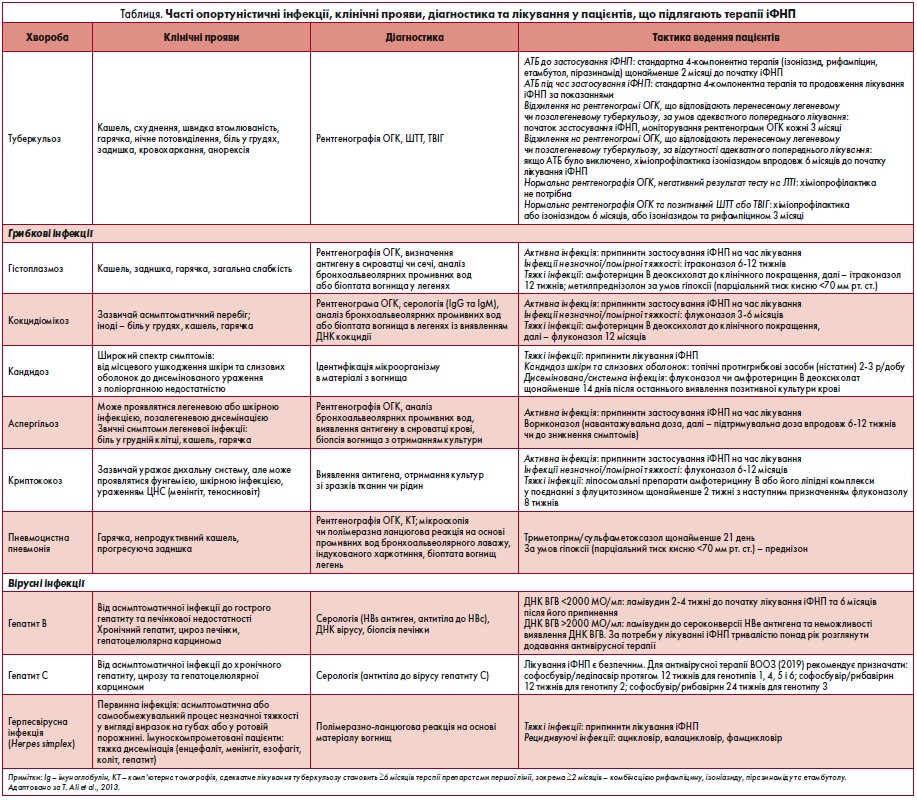
Лікування іФНП супроводжується малим, але значущим ризиком тяжких опортуністичних інфекцій (Maini et al., 2002; Koo et al., 2010; Roach et al., 2002). Останні являють собою тяжкі прогресувальні інфекції, спричинені організмами, які за звичайних умов є низькопатогенними або непатогенні взагалі (Symmers, 1965). Найрозповсюдженіші опортуністичні інфекції, тактика ведення пацієнтів із цими станами, а також стратегія ведення хворих на туберкульоз та вірусні гепатити представлені у таблиці.
Вакцинація
У настанові Американського коледжу ревматології (ACR, 2015) вказано, що пацієнтам з РА, які розпочинають лікування засобами біологічної терапії, слід за показаннями провести вакцинації вбитими (пневмококова, протигрипозна, проти гепатиту В), рекомбінантними (проти людського вірусу папіломи), живими ослабленими вакцинами (проти оперізуючого лишаю). Відповідно до рекомендацій Центра контролю та профілактики хвороб США, особи з РА після 50 років повинні підлягати вакцинації проти Herpes zoster до ініціації ІБТ, хоча у загальній популяції критичний вік початку таких процедур становить 60 років. Після вакцинації від оперізуючого лишаю біологічну терапію потрібно розпочинати після 2-тижневої перерви. Пацієнтам із раннім РА або встановленим діагнозом РА, які на даний час отримують ІБТ, слід уникати живих ослаблених вакцин, зокрема вакцин проти оперізуючого лишаю.
Усі ці рекомендації є умовними, оскільки доказових даних із цього питання на сьогодні недостатньо.
Онкологія
У разі раку шкіри в пацієнтів ревматологічного профілю імунобіологічні препарати (ІБП) не є засобами першого вибору. Однак деякі учасники робочої групи вказують, що при помірно високій/високій активності хвороби суглобів у осіб, що раніше підлягали лікуванню із приводу меланоми невисокого ступеня тяжкості чи немеланомного раку шкіри, біологічні засоби можна використовувати за умов регулярного спостереження за станом шкіри (необхідна консультація дерматолога) (Singh et al., 2015).
Коментарі спеціалістів
На зазначеній науково-практичній конференції з коментарями до викладеного виступили спеціалісти суміжних галузей.
.jpg) Наталія Анатоліївна Гріцова, к. мед. н., доцент кафедри фтизіатрії та пульмонології Національної медичної академії післядипломної освіти імені П.Л. Шупика (м. Київ), у доповіді «Фтизіатричний супровід пацієнтів, які отримують лікування імунобіологічними препаратами», наголосила, що хворі, які отримують ІБТ, зокрема інгібітори фактора некрозу пухлини (іФНП), входять до групи високого ризику щодо захворюваності на туберкульоз. Чому і за яких умов у них може розвинутися активна форма хвороби? По-перше, це наявність латентної туберкульозної інфекції (ЛТБІ) у пацієнтів, які ніколи не мали туберкульозу. Тим паче ризики зростають в осіб, що хворіли та вилікувалися від ТБ. Другою передумовою може стати зниження імунологічної реактивності на тлі лікування ІБП.
Наталія Анатоліївна Гріцова, к. мед. н., доцент кафедри фтизіатрії та пульмонології Національної медичної академії післядипломної освіти імені П.Л. Шупика (м. Київ), у доповіді «Фтизіатричний супровід пацієнтів, які отримують лікування імунобіологічними препаратами», наголосила, що хворі, які отримують ІБТ, зокрема інгібітори фактора некрозу пухлини (іФНП), входять до групи високого ризику щодо захворюваності на туберкульоз. Чому і за яких умов у них може розвинутися активна форма хвороби? По-перше, це наявність латентної туберкульозної інфекції (ЛТБІ) у пацієнтів, які ніколи не мали туберкульозу. Тим паче ризики зростають в осіб, що хворіли та вилікувалися від ТБ. Другою передумовою може стати зниження імунологічної реактивності на тлі лікування ІБП.
Сьогодні ВООЗ представляє велику кількість настанов із програмного ведення випадків ЛТБІ. Проте, як зазначила спікер, жодні з цих рекомендацій не є досконалими та не дають однозначних відповідей на ключові запитання щодо виявлення та менеджменту осіб із ЛТБІ. За визначенням ВООЗ (2018), латентна туберкульозна інфекція – це стан стійкої імунної відповіді на антигени мікобактерій туберкульозу (Mycobacterium tuberculosis) непоствакцинального характеру за відсутності клінічних проявів активної форми туберкульозу.
Відповідно до настанови ВООЗ із ведення пацієнтів з ЛТБІ 2018 р. (наполеглива рекомендація, низька або дуже низька якість фактичних даних), когорти пацієнтів, в яких слід систематично проводити тестування та лікування ЛТБІ:
- ВІЛ-інфіковані особи, дорослі й діти, що контактували із хворими на легеневу форму ТБ;
- пацієнти, які починають лікування із приводу ФНП;
- хворі на діалізі, або ті, які готуються до трансплантації органів чи переливання крові;
- особи з силікозом.
Для тестування на ЛТБІ застосовують внутрішньошкірну туберкулінову пробу Манту з 2 ТО ППД-Л та/або тест вивільнення гамма-інтерферону (квантинтерфероновий тест) (ТВГІ). Діаскінтест не рекомендований ВООЗ. Доповідачка зауважила, що не існує «золотого стандарту» діагностики ЛТБІ, і всі методи мають певні недоліки. Крім того, проба Манту не прийнятна у хворих, які приймають ІБП чи за гострих або хронічних запальних захворювань (ХЗЗ) у період загострення через можливий хибно негативний/некоректний результат.
Тож варто детальніше розглянути ТВГІ. Це тест, який дозволяє визначити рівень специфічного гамма-інтерферону у крові пацієнта, що вивільняється сенсибілізованими Т-клітинами, стимульованими in vitro специфічними протеїнами мікобактерій туберкульозу, які входять до комплексу з кількох близькоспоріднених видів мікобактерій, здатних спричинити туберкульоз у людини і тварин (Micobacterium tuberculosis complex). Ці протеїни відсутні у вакцинних штамах Mycobacterium bovis BCG (бацила Кальмета – Герена) і в більшості нетуберкульозних мікобактеріях. Тому якщо квантинтерефероновий тест виявився позитивним – це 100% свідчить про інфікування пацієнта та не потребує повторного обстеження.
Крім того, Н.А. Гріцова акцентувала, що в кожного хворого, якому заплановано призначити ІБТ, слід провести обстеження на ЛТБІ до початку лікування. Адже одним із основних факторів імунної відповіді у боротьбі з туберкульозною інфекцією є значення активованих Т-лімфоцитами макрофагів ФНП, що відіграють провідну роль в елімінації збудника (Heumann, 1996). При застосуванні іФНП може порушуватися співвідношення між вірулентністю і масивністю мікобактерії туберкульозу та реактивністю макроорганізму на користь збудника.
Що ж робити, коли пацієнт, який отримує ІБП, захворів на туберкульоз? За словами лекторки, потрібно лікувати туберкульоз відповідно до сучасних стандартів. Питання щодо припинення ІБТ (чи зміни режиму застосування) слід вирішувати диференційовано для кожного хворого через міждисциплінарну лікарську консультативну комісію.
 Лариса Василівна Мороз, д. мед. н., професор Вінницького національного медичного університету імені М.І. Пирогова, висвітлила важливу тему «Тактика ведення вірусно-бактерійних ускладнень на тлі імунобіологічної терапії ревматичних захворювань». За даними статистики, розповсюдженість ревматоїдного артриту (РА) становить 0,5‑1% популяції (The Lancet, 2018). Впровадження у медичну практику хворобомодифікувальних препаратів, особливо біологічних, дозволило покращити якість життя пацієнтів, зменшило кількість ускладнень при ревматичних захворюваннях.
Лариса Василівна Мороз, д. мед. н., професор Вінницького національного медичного університету імені М.І. Пирогова, висвітлила важливу тему «Тактика ведення вірусно-бактерійних ускладнень на тлі імунобіологічної терапії ревматичних захворювань». За даними статистики, розповсюдженість ревматоїдного артриту (РА) становить 0,5‑1% популяції (The Lancet, 2018). Впровадження у медичну практику хворобомодифікувальних препаратів, особливо біологічних, дозволило покращити якість життя пацієнтів, зменшило кількість ускладнень при ревматичних захворюваннях.
При РА застосовують наступні групи ІБП:
1. Інгібітори цитокінів:
- ФНП-α (адалімумаб, голімумаб та ін.);
- інтерлейкін (ІЛ)-1 (анакінра);
- ІЛ‑6 (тоцилізумаб).
2. Блокатор костимуляції Т-лімфоцитів (абатацепт).
3. Анти-В-клітинний препарат (ритуксимаб).
Професор детальніше зупинилася на імуносупресії на тлі застосування ІБП, внаслідок якої можуть розвиватися інфекційні ускладнення. Стосовно гепатиту, розповсюдженість HBsAg I anti-HCV серед хворих на РА та АС більшою мірою припадає на когорти осіб працездатного (>30 років) та старшого віку. Це пов’язано з тим, що на час народження цих пацієнтів ще не було запроваджено обов’язкової вакцинації від гепатиту В (Yılmaz et al., 2014).
Таким чином, актуальними є питання скринінгу та вакцинації цих хворих, яким заплановано чи вже проводять ІБТ (Karadag et al., 2016):
- НВV-скринінг слід виконувати перед призначенням ІБП.
- Першу дозу вакцини від НВV-інфекції потрібно ввести до лікування за умови виключення усіх ризиків зараження.
- При Аnti-HBs >100 МО/мл вакцинацію не проводять, ініціація ІБТ можлива; у разі Аnti-HBs <100 МО/мл ініціація ІБТ можлива після 2-кратної вакцинації.
- За наявності хронічної НВV-інфекції необхідні додаткові обстеження на HBеAg, anti-HBе, НВV DNA, Anti-Delta tot, амінотрансферазу, УЗД печінки. Показана противірусна профілактика. При будь-яких титрах НВV DNA доцільно застосовувати 0,5 мг ентекавіру і 245 мг/добу тенфовіру за два тижні до початку ІБТ.
- При HBsAg (–), Аnti-HBs (–), але Аnti-HBс total (+) рекомендоване обстеження на НВV DNA: якщо НВV DNA (+), варто провести противірусне лікування, НВV DNA (–) – вакцинацію.
- Якщо HBsAg (–), Аnti-HBs (+), Аnti-HBс total (+), слід здійснити обстеження на НВV DNA: за наявності НВV DNA (+) необхідна противірусна терапія, НВV DNA (–) і Аnti-HBs <100 МО/мл – дві дози вакцинації.
На додачу, спікер звернула увагу авдиторії на групи пацієнтів, які обов’язково потребують скринінгу на НСV. Це хворі із підтвердженим ризиком зараження, що вживають наркотичні засоби ін’єкційним чи назальним шляхом; особи з підвищеним ризиком зараження, що перебувають на гемодіалізі, мають татуювання, працюють у лабораторіях зі зразками крові або ті, у кого в анамнезі є переливання крові до 1994 р. Інші групи: ВІЛ-позитивні хворі, пацієнти з високим рівнем аланінамінотрансферази або іншими патологіями печінки (Karadag et al., 2016).
Крім того, слід пам’ятати, що частими ускладненням на тлі ІБТ є опортуністичні інфекції, як-то Herpes Zoster, пневмоцистна пневмонія, генералізований кандидоз, гістоплазмоз, аспергильоз, цитомегаловірус та ін. Як наголосила професор, на час лікування даних ускладнень ІБТ призупиняють (Bernatsky et al., 2007).
Окрім того, Лариса Василівна зупинилася ще на одному важливому аспекті ведення хворих на РА, а саме принципах вакцинації пацієнтів, що отримують імуносупресивну терапію.
Відповідно до рекомендацій Американського товариства інфекційних хвороб (IDSA), неживі вакцини (включно з інактивованою вакциною проти грипу) та пневмококову вакцину (PCV13) доцільно призначати пацієнтам із ХЗЗ, яким планують чи проводять імуносупресивне лікування (Lorry et al., 2013). Полісахаридну пневмококову вакцину (PPSV23) потрібно призначати особам віком ≥2 років із ХЗЗ, що отримують низькодозову чи високодозову імуносупресивну терапію. Схема застосування: PPSV23 ≥8 тижнів після PCV13, другу дозу PPSV23 вводять через п’ять років.
Інші рекомендовані вакцини, зокрема проти гепатиту В, не повинні бути відтерміновані через ризик загострень ХЗЗ чи імуносупресивних захворювань. Вакцинацію від вітряної віспи слід призначати пацієнтам із ХЗЗ без імунітету до вітряної віспи (≥4 тижні до початку імуносупресивної терапії, якщо лікування може бути безпечно відстрочене). Вакцинацію від вітряної віспи варто розглядати в осіб із ХЗЗ без імунітету до вітряної віспи, які отримують низькодозову імуносупресивну терапію. Інші живі вакцини не повинні призначатися пацієнтам із ХЗЗ, що використовують імуносупресивні засоби.
.jpg) Андрій Едуардович Дорофеєв, д. мед. н., професор Національної медичної академії післядипломної освіти імені П.Л. Шупика (м. Київ), у доповіді «Сучасні підходи ведення пацієнтів на імунобіологічній терапії» зробив акцент на важливості злагодженого міждисциплінарного ведення пацієнтів із автоімунною патологією.
Андрій Едуардович Дорофеєв, д. мед. н., професор Національної медичної академії післядипломної освіти імені П.Л. Шупика (м. Київ), у доповіді «Сучасні підходи ведення пацієнтів на імунобіологічній терапії» зробив акцент на важливості злагодженого міждисциплінарного ведення пацієнтів із автоімунною патологією.
Насамперед лектор наголосив на актуальності проблеми, адже поширеність автоімунних захворювань як у світі, так і в Україні зокрема зростає. Це стосується здебільшого пацієнтів молодого віку, що означає тривалу терапію, яка може призводити до низки небезпечних і важких ускладнень. Якщо до того ж враховувати високу коморбідність при зазначених патологічних станах, такі хворі потребують ретельного спостереження групою спеціалістів.
Надважливою задачею клініциста є вибір стратегії ІБТ. Цей процес слід розділити на кілька етапів:
- відбір пацієнтів на ІБТ – верифікація діагнозу, клінічна активність хвороби, вік, куріння тощо; перш ніж призначити ІБП, необхідне комплексне обстеження, зокрема консультації фтизіатра, невролога, офтальмолога, пульмонолога, кардіологічні дослідження; важливу роль відіграє супутня патологія, яку також мають оцінювати спеціалісти різного профілю;
- вибір оптимального препарату, оскільки на сьогодні на вітчизняному фармринку представлено широкий асортимент ІБП, що направлені на різні ланки імунобіологічного компонента;
- наступний моніторинг пацієнта, підтримання досягнутого терапевтичного ефекту і профілактика ускладнень.
На тлі ІБТ, зокрема іФНП, занепокоєння викликають інфекційні ускладнення. Саме тому доцільно робити вибір на користь тих препаратів, які чинять мінімальну кількість побічних ефектів. У даному контексті добре зарекомендував себе іФНП з високим профілем безпеки голімумаб (Ahadiech et al., 2019). Закономірно, що, залежно від побічних ефектів, можна оцінити прихильність до терапії з боку пацієнтів. У дослідженні P. Bhoi et al. (2016) найвищий комплаєнс було відмічено у хворих, що застосовували голімумаб порівняно з іншими іФНП (етанерцепт, адалімумаб).
Ще одним аспектом, який слід оцінювати при виборі ІБП, окрім тривалості досягнутої ремісії та клінічного ефекту, є імуногенність. Вона залежить від часового проміжку застосування препарату, дози, нозології. Висока імуногенність є причиною додаткового призначення імуносупресора. У дослідженні B. Gorovits et al. (2018) голімумаб показав достовірні переваги щодо імуногенності порівняно з адалімумабом при різних нозологіях.
Насамкінець професор зазначив, що в жодних авторитетних настановах, наприклад Американського коледжу ревматології (ACR) з лікування ювенільного РА (2019), РА (2015), АС (2019) тощо, немає чітких рекомендацій щодо мультидисциплінарного супроводу пацієнтів. Андрій Едуардович слушно запропонував розробити подібний документ зі спільного менеджменту хворих, які отримують ІБТ.
Фіналом конференції стало прийняття Резолюції на нараді Асоціації ревматологів України, головних спеціалістів НАМН і експертів МОЗ України, головних обласних ревматологів та терапевтів, а також провідних фахівців під головуванням професора Володимира Миколайовича Коваленка. Було укладено перелік міждисциплінарних робочих груп, зокрема з імунобіологічної терапії, куди, крім ревматологів, увійшли такі спеціалісти, як інфекціоністи, дерматологи, гастроентерологи.
Підготувала Наталія Нечипорук
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 6 (67), 2019 р.