14 лютого, 2020
Лікування артеріальної гіпертензії у хворих на бронхіальну астму
У світі понад 300 млн людей хворіють на бронхіальну астму (БА), близько 250 тис. щороку вмирають, а витрати, пов’язані з астмою, становлять 80 млрд доларів на рік. Артеріальна гіпертензія (АГ) – найпоширеніший у світі модифікований фактор ризику серцево-судинних захворювань (ССЗ) і смерті. Показники систолічного артеріального тиску (САТ) перевищують 140 мм рт. ст. у 874 млн дорослих жителів планети (Whelton P. et al., 2018), а його контроль є основним способом запобігання смерті (GBD 2015 Risk Factors Collaborators).
Незалежно від традиційних факторів ризику, хворі на БА більше схильні до розвитку АГ, ніж інші люди (Dogra S. et al., 2007). Гіпертензія асоціюється з тяжчим перебігом астми (Christiansen S. et al., 2016), а знижена функція легень корелює з вищою смертністю від ССЗ (Sin D. et al., 2005). Зважаючи на тісний взаємозв’язок між дисфункцією дихальної та серцево-судинної систем, адекватне лікування й контроль АГ у хворих на БА є особливо важливими. Хоча вплив контролю тиску на перебіг астми недостатньо досліджений, ризик смерті від ССЗ знижується за умови зниження САТ <130 мм рт. ст. (Williamson J. et al., 2016; Ettehad D. et al., 2016; Berlowitz D. et al., 2017).
Зв’язок між гіпертензією й астмою
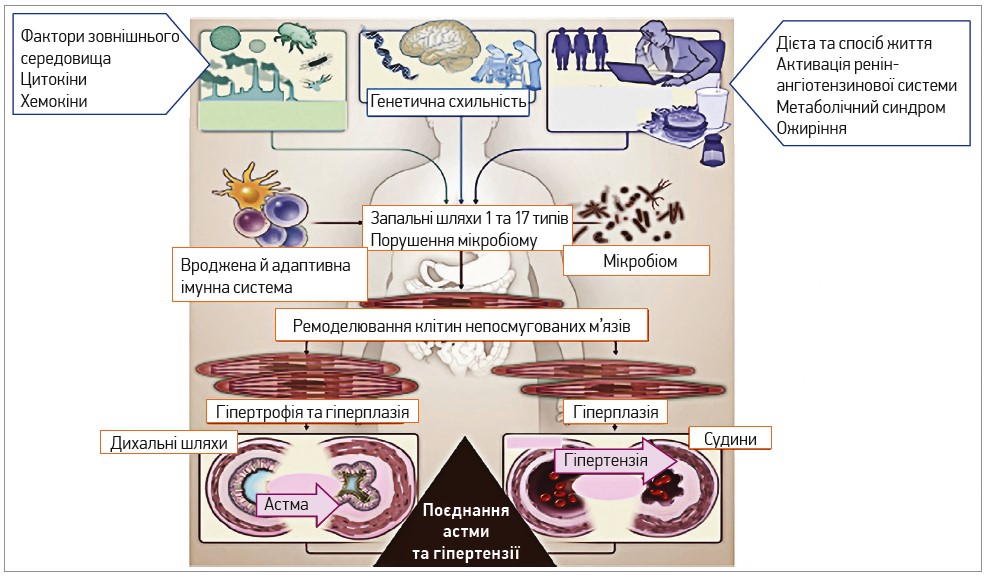
До формування гіпертензивного астматичного фенотипу призводять генетичні фактори, стрес, вік, дієта, спосіб життя та запальні механізми (рис. 1). Спільним для обох станів є системне запалення, що є головним патогенетичним механізмом астми, спричиняє виникнення АГ та її ускладнень (Hotamisligil G., 2017; Gauthier M. et al., 2015; Wenzel U. et al., 2016). Велике крос-секційне дослідження за участю хворих на БА середнього віку показало, що поширеність АГ вища серед осіб із нижчими показниками об’єму форсованого видиху за 1 с (ОФВ1), при цьому ризик гіпертензії обернено пропорційний до ОФВ1 (Ferguson S. et al., 2014). Крім того, швидкість зменшення ОФВ1 корелює з рівнем C‑реактивного протеїну (СРП) – маркером системного запалення, пов’язаним з інтерлейкіном (ІЛ) 6 і ССЗ (Rasmussen F. et al., 2009).
Рис. 1. Патофізіологія й експресія хвороби в пацієнтів із поєднанням астми та гіпертензії
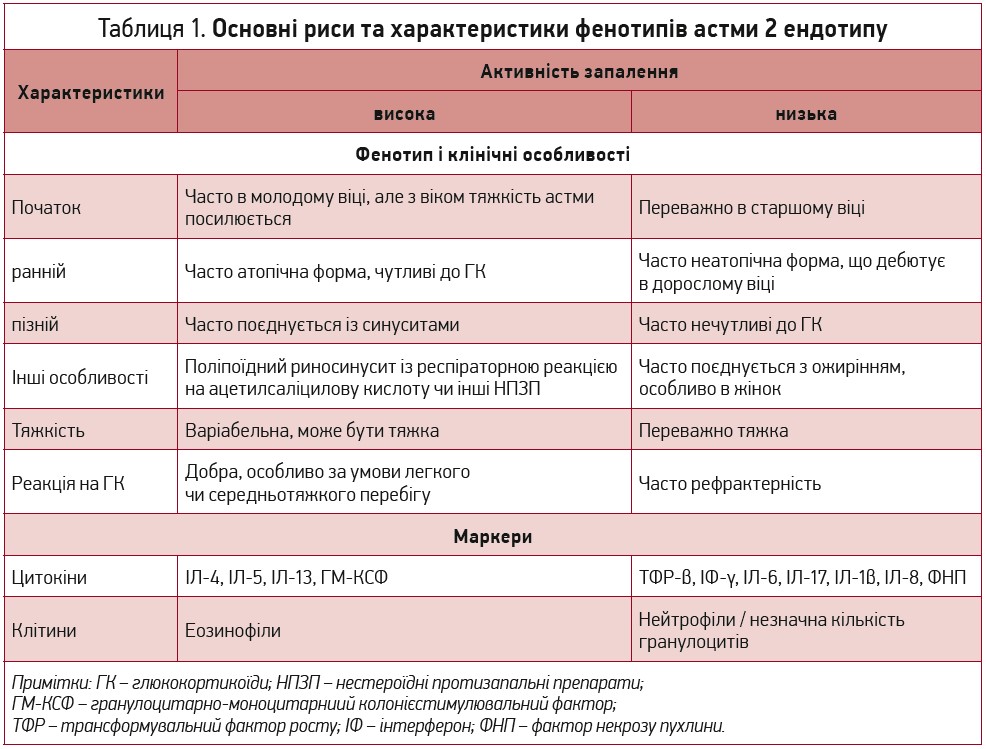
За сучасними уявленнями, в патогенезі БА домінує 2 ендотип із високою чи низькою активністю запалення. Ці підтипи мають різні механізми, котрі значною мірою залежать від того, які клітини в них задіяні – Т‑клітини чи вроджені лімфоцити та цитокіни (Israel E., Reddel H., 2017). Кожен з ендотипів, своєю чергою, поділяється на декілька фенотипів із різними клінічними особливостями, патологічними ознаками та біомаркерами (табл. 1). Через відсутність єдиних критеріїв класифікації ендотипів БА їх поширеність чітко не визначена, хоча є думка про рівномірний розподіл (Gauthier M. et al., 2015).
У рамках Програми вивчення тяжкої астми проведено багато досліджень, у яких пацієнтів групували на кластери на підставі аналізу клінічних характеристик, біомаркерів, клітинних профілів, функції легень, атопічного статусу, відповіді на лікування, експресії генів і супутніх станів (Moore W. et al., 2010, 2014; Modena B. et al., 2014). Два дослідження продемонстрували, що АГ переважно поєднується з астматичним профілем, характерним для 2 ендотипу з низькою активністю запалення (Moore W. et al., 2010, 2014). В одному з досліджень більше шансів на АГ мали пацієнти старшого віку, з вищими показниками індексу маси тіла, пізнішім виникненням астми, але тяжчим її перебігом, низьким рівнем атопії (n=48; 27%), порівняно з пацієнтами з 2 ендотипом і високою активністю запалення (n=50; 9%) (Moore W. et al., 2010). Схожі результати продемонструвало й інше дослідження: 31 проти 11% (Moore W. et al., 2014).
Ступінь запалення в пацієнтів з АГ та БА відображає суміжні впливи обох станів. Гіпертензія спрямовує Т‑хелпери 1 типу (Th1) на прозапальний фенотип, який характеризується підвищеною відповіддю ІФ‑γ та зниженням реакцій Тh2 (Shao J. et al., 2003). Значна гіперреактивність дихальних шляхів і тяжкий перебіг астми асоціюються з підвищеним рівнем ІФ‑γ (Raundhal M. et al., 2015). Своєю чергою, ІФ‑γ та Th1 зумовлюють підвищення АТ і пов’язані з ним ускладнення (Wenzel U. et al., 2016).
Як у дослідженнях на тваринах, так і в моделях in vitro показано, що ІЛ‑17 відіграє важливу роль у виникненні АГ та гіпертензивному ураженні органів-мішеней. Саме ІЛ‑17 індукує прозапальний фенотип у клітинах непосмугованих м’язів судин, посилюючи вивільнення таких медіаторів, як СРП, ІЛ‑6 і хемокінів CXCL8 та CXCL10 (Chen S., Agrawal D., 2015). У дослідженнях на тваринах застосування антитіл до ІЛ‑17 або генетична делеція зменшували гіпертензію (Chen S., Agrawal D., 2015; Wenzel U. et al., 2016). Роль ІЛ‑17 також очевидна в деяких пацієнтів із тяжкою БА, оскільки його рівень корелює з нейтрофільною інфільтрацією, гіперреактивністю дихальних шляхів і відсутністю чутливості до ГК. У цих пацієнтів ІЛ‑17 здатний індукувати секрецію прозапальних цитокінів зі структурних клітин легень і непосмугованих м’язів дихальних шляхів, включаючи ФНП, ІЛ‑1β, ГКСФ та ІЛ‑6, а також хемокіни CCL11 (еотаксин) і CXCL8 (ІЛ‑8), які відіграють важливу роль у процесах запалення дихальних шляхів і ремоделювання (Wang Y., Wills-Karp M., 2011; Chesné J. et al., 2014).
Утім, як свідчать результати одного дослідження, спрямована на ІЛ‑17 терапія не покращила симптомів у пацієнтів із тяжкою астмою (Busse W. et al., 2013). Докладний аналіз виявив підгрупу з істотним збільшенням зниженого ОФВ1 та певне покращення симптомів за Анкетою контролю астми. Сприятливий ефект у цій підгрупі, очевидно, зумовлений впливом ІЛ‑17 на скорочення гладком’язових клітин (Kudo M. et al., 2012).
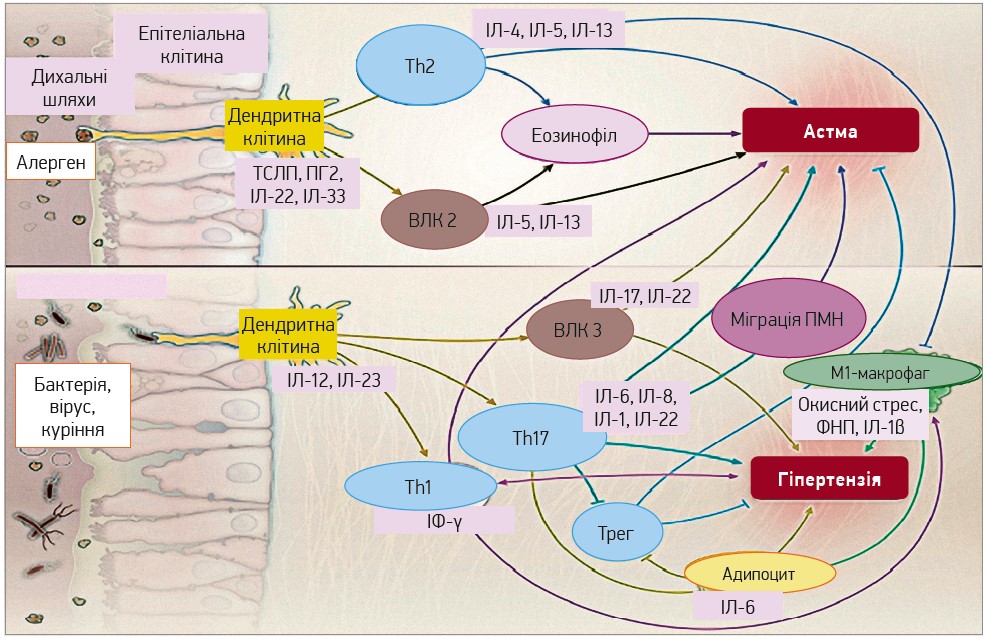
Експериментальні дані вказують на те, що підвищений рівень ІЛ‑6 сприяє диференціації Т‑клітин CD4+ через взаємодію з ТФР‑β, що забезпечує перехід у бік Тh17. Як наслідок, зменшується кількість регуляторних Т‑клітин (Трег), які відіграють захисну роль при АГ. Ці процеси частково пов’язані з утворенням ІЛ‑10 (Kudo M. et al., 2012) і відіграють вирішальну роль у виникненні астми (Lloyd C., Hawrylowicz C., 2009). Взаємодія між ІФ‑γ, ІЛ‑17 та ІЛ‑6 може впливати на прояви як астми, так і гіпертензії (рис. 2), оскільки вказані цитокіни стимулюють запалення, активують непосмуговані м’язи й утворення фібрину, котрі відіграють важливу роль у патогенезі обох станів.
Рис. 2. Запальні шляхи в пацієнтів з астмою та гіпертензією
Примітки: ТСЛП – тимічний стромальний лімфопоетин; ПМН – поліморфно-ядерний нейтрофіл; ВЛК – вроджена лімфоцитарна клітина.
Отже, особи з поєднанням астми та гіпертензії становлять особливу підгрупу пацієнтів із високим ризиком ураження органів-мішеней і поганою відповіддю на терапію.
Ожиріння та метаболічні розлади
Підвищений рівень ІЛ‑6 і системне запалення порушують обмін речовин, що збільшує захворюваність як на астму, так і на гіпертензію. Секреція прозапальних цитокінів, зокрема ІЛ‑6, адипоцитами та запальними макрофагами в білій жировій тканині має патогенне значення при БА; цей цитокін є біомаркером метаболічної дисфункції та тяжкості астми (Weisberg S. et al., 2003; Peters M. et al., 2016). У дослідженнях за участю пацієнтів і на тваринних моделях підвищення рівнів ІЛ‑6 асоціюється з виникненням АГ (Lee D. et al., 2004; Gibas-Dorna M. et al., 2015).
Ремоделювання непосмугованих м’язів і біологія судин
Ремоделювання непосмугованих м’язів значною мірою зумовлене запальними цитокінами та є важливою складовою як БА, так і АГ (Simcock D. et al., 2008; Rzucidlo E. et al., 2007; Wettschureck N., Offermanns S., 2002). Гіперплазія й аномальне скорочення міоцитів дихальних шляхів відіграють важливу роль в обструкції бронхів. З іншого боку, аномальне скорочення та проліферація міоцитів є чітко визначеними особливостями гіпертензивного ремоделювання судин і дисфункції ендотелію.
Генетичні фактори мають визначений вплив на експресію обох захворювань; однак відповідні взаємозв’язки доволі складні, їх важко виокремити. Є повідомлення про поліморфізм β-адренергічних рецепторів на клітинах непосмугованих м’язів у пацієнтів з АГ та БА, що визначає реакцію на антагоністи й агоністи, а отже, і на результати лікування (Leineweber K., Heusch G., 2009). Модифікація фенотипу міоцитів судин під впливом зовнішніх факторів відіграє важливу роль у патогенезі АГ, БА й атеросклерозу (Rzucidlo E., 2009).
Дієтичне споживання кухонної солі
Відомий патогенетичний чинник АГ, адже є субпопуляції гіпертоніків, чутливих і нечутливих до солі (Chrysant G. et al., 1999). За умови чутливої до солі гіпертензії спостерігається чутливість нирок, симпатичної нервової системи та судин (Coffman T., 2011).
Важливе значення у відповіді на сіль може мати імунна система. Цей зв’язок, очевидно, реалізується через Тh17 (Wenzel U. et al., 2016; Chen S., Agrawal D., 2015). У тваринній моделі дієта з високим умістом солі сприяла утворенню цих клітин через вплив на мікробіом кишечнику та виснаження Lactobacillus murinus. І навпаки, через модулювальний вплив на Тh17 застосування L. murinus запобігає виникненню чутливої до солі АГ. З’ясувалося, що це зумовлено метаболітами триптофану, котрі виробляють указані мікроорганізми (Wilck N. et al., 2017). У здорових людей, які вживають багато солі, також спостерігається зниження кількості лактобактерій, підвищення рівнів Тh17 і АТ (Afsar B. et al., 2018; Rucker A. et al., 2018). Хоча такі впливи поки що не досліджувались у хворих на астму, зазначені факти підтримують гіпотезу, що високий уміст солі в харчовому раціоні спричиняє виникнення запалення в людини.
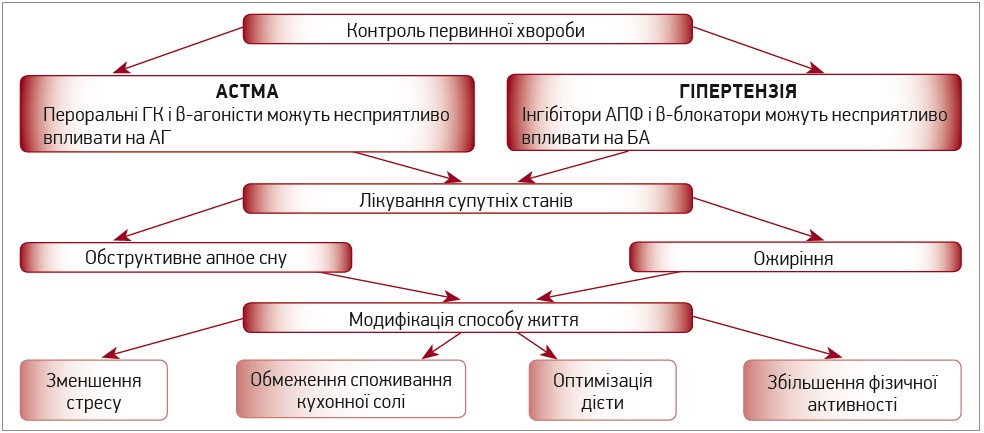
Ведення пацієнтів з астмою та гіпертензією має бути багатофакторним і включати контроль обох захворювань, лікування супутніх станів і модифікацію способу життя (рис. 3).
Рис. 3. Підходи до лікування хворих на БА й АГ
Фармакотерапія АГ у хворих на БА
Оскільки 2017 року в США зменшено рівень тиску, що визначає АГ, частка дорослих із гіпертензією збільшилася з 32 до 46%. За американськими стандартами, АГ класифікується на дві стадії: 130-139/80-89 мм рт. ст. – I стадія, >140/90 мм рт. ст. – II стадія. Фармакотерапія рекомендована пацієнтам із I стадією за наявності ССЗ або високого ризику й усім пацієнтам із II стадією (Whelton P. et al., 2018).
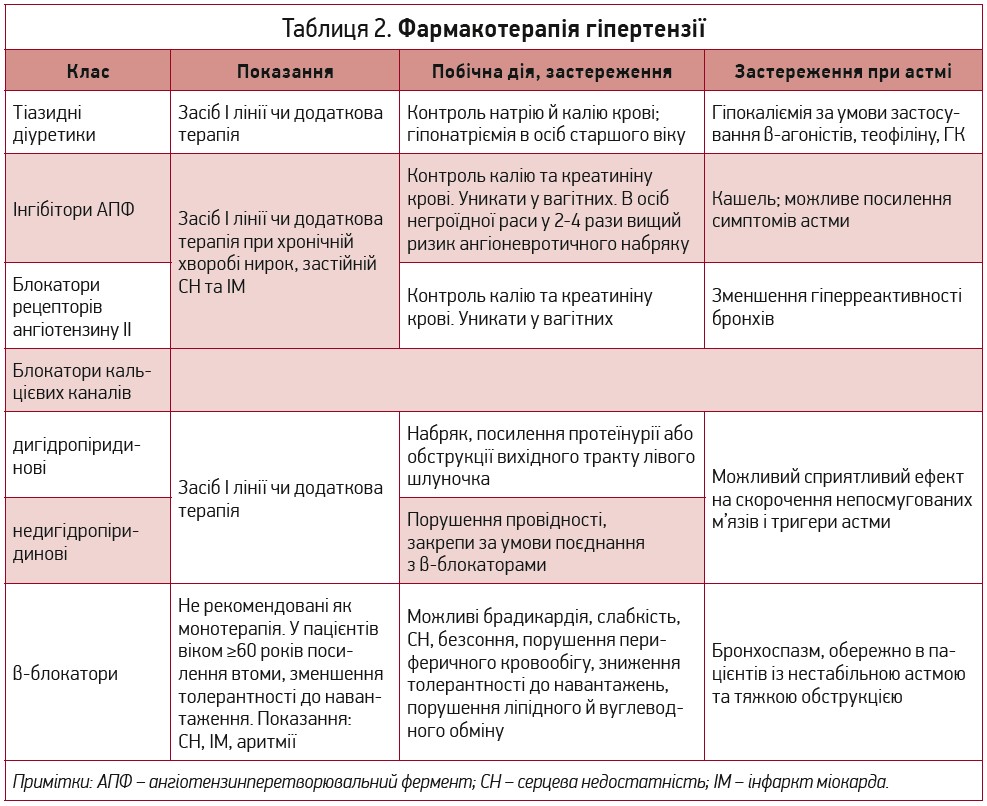
Що має на меті лікування АГ і як це може вплинути на пацієнтів із БА? На сьогодні загальна смертність хворих на АГ, котрі отримували будь-який із чотирьох основних класів антигіпертензивних препаратів (АГП) І ряду суттєво не відрізнялася. Результат насамперед залежить від ступеня зниження АТ, а не від АГП (Law M. et al., 2009). Однак у пацієнтів з астмою слід ураховувати додаткові проблеми, пов’язані з АГП (табл. 2).
Бета-адреноблокатори (ББ) виправдано призначати в разі специфічних показань (табл. 2), а не як монотерапію. Що стосується хворих на астму, то ББ треба призначати з обережністю через можливість звуження бронхів і зменшення терапевтичної відповіді на β2-агоністи. Крім того, є неселективні (вплив на β1-
Метааналіз рандомізованих сліпих плацебо-контрольованих досліджень вказує на порівняно невелике, але значуще зниження ОФВ1 (≥20%) у пацієнтів, які отримували короткочасне лікування будь-якими ББ, і значне посилення симптомів астми в пацієнтів, які отримували неселективні ББ. Відзначено також зменшення відповіді на β2-агоністи короткої дії (SABA), причому селективні ББ її притуплюють, а неселективні – цілком усувають. Тривале застосування ББ асоціюється з меншим ризиком бронхоспазму, ніж короткочасне (Morales D. et al., 2014).
У клінічній практиці ББ застосовують у пацієнтів зі стабільним перебігом астми без зниження ОФВ1, за відсутності потреби в частому застосуванні SАBА чи в разі посилення симптомів на тлі терапії ББ (Salpeter S. et al., 2002). Однак їх застосування хворими з нестабільною астмою чи тяжкою обструкцією дихальних шляхів потребує особливої обережності.
Інгібітори ангіотензинперетворювального ферменту (ІАПФ) чинять багато позитивних впливів не лише в загальній популяції хворих на АГ, а й у хворих на БА, котрим вони не протипоказані. Проте через можливість виникнення кашлю у 2,8-40% пацієнтів застосування ІАПФ може спричинити проблеми з диференціацією клінічних симптомів (Mukae S. et al., 2002; Omboni S., Borghi C., 2011; Vukadinović D. et al., 2019).
Є також повідомлення, що ІАПФ можуть посилити тяжкість проявів астми в деяких пацієнтів (Lunde H. et al., 1994). У дослідженні випадок-контроль ІАПФ посилювали тяжкість астми, збільшували потребу в SАBА чи системних ГК, а також частоту звернення до відділення невідкладної допомоги чи госпіталізації (Christiansen S. et al., 2016). З огляду на те що ІАПФ вважаються основним класом АГП, лікарі повинні пам’ятати про можливість появи несприятливих ефектів у певної частки хворих на БА.
Блокатори рецепторів ангіотензину ІІ (БРА) є кращою альтернативою блокади ренін-ангіотензинової системи в пацієнтів з астмою. Відомо, що при тяжкому загостренні БА циркулюючі рівні реніну й ангіотензину II підвищуються. Експериментальна інфузія ангіотензину II призводить до зниження ОФВ1 і посилює симптоми стискання в грудях і кашлю навіть у пацієнтів із легким перебігом (Millar E. et al., 1994). Пригнічення рецепторів ангіотензину II 1 типу значно зменшує гіперреактивність бронхів (Myou S. et al., 2000). Отже, БРА впливають на шляхи, задіяні в патогенезі обох станів. Окрім того, БРА не спричиняють кашлю та не посилюють чутливість дихальних шляхів навіть у пацієнтів, які не толерують до ІАПФ (Tanaka H. et al., 2001; Caldeira D. et al., 2012).
Блокатори кальцієвих каналів (БКК) зменшують скорочення непосмугованих м’язів, запобігаючи звуженню бронхів у відповідь на різні подразники, зокрема гістамін, антигени, холодне повітря та фізичне навантаження, а також чинять м’яку бронхолітичну дію (Patakas D. et al., 1983), що теоретично робить їх потенційно корисними у хворих на БА з АГ. Однак у клінічній практиці їх сприятливий вплив на наслідки астми не доведено (Chiu K. et al., 2017). Утім, зважаючи на фізіологічний профіль та ефективність, БКК можна вважати сприятливими для лікуванням цієї категорії пацієнтів (Flack J. et al., 2010; Qi H. et al., 2018).
Тіазиди часто призначають для лікування АГ у вигляді монотерапії або в комбінації з ІАПФ, БРА чи БКК (Harman J. et al., 2013). Проте застосування високих доз β2-агоністів збільшує ймовірність гіпокаліємії. Ризик стає ще вищим за умови супутнього застосування тіазидів, що може мати аритмогенний ефект (Lipworth B. et al., 1989), особливо якщо на додачу пацієнт приймає ГК або теофілін.
Фармакотерапія БА в пацієнтів з АГ
Гіпертензія є одним із головних серцево-судинних ускладнень у пацієнтів, які лікуються системними ГК (Sholter D., Armstrong P., 2000). В осіб із поєднанням астми та гіпертензії контроль АТ особливо проблематичний, оскільки саме ці особи мають тяжкий фенотип астми, що потребує тривалої терапії системними ГК у високих дозах. Часте використання SABA для зняття нападів астми також посилює серцево-судинний ризик (Salpeter S. et al., 2004). Отже, важливо мінімізувати дози системних ГК та SABA. Нещодавно переглянуто терапевтичні підходи в разі тяжкої та резистентної до лікування БА (Israel E., Reddel H., 2017). Сучасні варіанти біологічної терапії переважно спрямовані на 2 ендотип із високим рівнем запалення. Проте вивчаються також препарати для лікування 2 ендотипу з низьким рівнем запалення (Manka L., Wechsler M., 2018).
Обструктивне апное сну асоціюється з АГ та зумовлює активізацію запальних шляхів, які мають значення як при ССЗ, так і при БА. Періодична гіпоксія, типова для обструктивного апное, активізує шляхи, опосередковані ядерним фактором каппа B (NF‑κB), підсилювачем легкого ланцюга активованих В‑клітин. Це призводить до вивільнення медіаторів, які відіграють важливу роль у патогенезі системного запалення та судинній патології. Хоча вплив лікування обструктивного апное на контроль АТ потребує подальшого вивчення, воно впливає на зменшення маркерів запалення, котрі можуть спричиняти виникнення АГ (Ryan S. et al., 2002).
Ожиріння на сьогодні сягає масштабів епідемії (Ng M. et al., 2014). Дві треті населення США мають надмірну масу тіла або ожиріння (Health, United States, 2015). Збільшення маси тіла на кожні 5% підвищує ризик АГ на 20-30% (Drøyvold W. et al., 2005). Кожен втрачений кілограм маси тіла знижує тиск приблизно на 1 мм рт. ст., а також зменшує ризик серцево-судинної смерті. Ожиріння також безпосередньо пов’язане з тяжкістю астми (Quinto K. et al., 2011; DeMarco V. et al., 2014), а зменшення маси тіла покращує клінічний перебіг БА в осіб з ожирінням (Peters U. et al., 2018). Відтак, у пацієнтів із поєднанням астми та гіпертензії дуже важливо контролювати масу тіла, хоча лікування ожиріння є надзвичайно складним і потребує мультидисциплінарного підходу (Heymsfield S., Wadden T., 2017).
Спосіб життя. Загальній популяції притаманні тенденції до надмірного споживання кухонної солі, калорій з інших джерел, окрім овочів і фруктів, низької фізичної активності й ожиріння. Це зумовлює збільшення поширеності АГ та, можливо, БА (Ng M. et al., 2014). Тому пацієнтам із поєднанням астми та гіпертензії показана модифікація способу життя, що включає зміни в харчуванні, обмеження споживання солі, підвищення споживання калію та збільшення фізичних навантажень (Sacks F. et al., 2001; Ma J., et al., 2016). Кожне з цих нефармакологічних втручань знижує САТ на 3-8 мм рт. ст., а діастолічний тиск – на 1-4 мм рт. ст. (Neter J. et al., 2003; Whelton P. et al., 2018).
Здорове харчування та фізичні вправи також позитивно впливають на наслідки астми, навіть у пацієнтів без ожиріння (Toennesen L. et al., 2018). Стрес підвищує сприйнятливість до різних захворювань, включаючи АГ та БА (Chen E., Miller G., 2007; Spruill T., 2010; Rosenberg S. et al., 2014). Хоча результати контрольованих досліджень щодо впливу стресу на пацієнтів з АГ та БА відсутні, було б цікаво дослідити нефармакологічні підходи, зокрема вплив трансцендентальної медитації на зменшення стресу.
Отже, особи з поєднанням АГ та БА становлять особливу підгрупу пацієнтів, кількість яких прогресивно збільшується в цілому світі. Експериментальні докази досліджень на тваринах і клінічні спостереження за пацієнтами вказують на те, що основними характеристиками цієї підгрупи є активація непосмугованих м’язів, дисфункція судин і системне запалення. Вплив запальних шляхів 1 та 17 типів посилює тяжкість астми й гіпертензії, збільшує ризик ожиріння та метаболічної дисфункції. Лікування таких пацієнтів має бути комплексним і включати фармакотерапію та зміни способу життя. Найбезпечнішими АГП у цієї категорії хворих є БРА та БКК.
Christiansen S. C., Zuraw B. L. Treatment of hypertension in patients with asthma. N. Engl. J. Med. 2019; 381: 1046-1057. DOI: 10.1056/NEJMra1800345.
Переклала з англ. Ольга Королюк
Медична газета «Здоров’я України 21 сторіччя» № 2 (471), січень 2020 р.