3 березня, 2020
Эффективность ингибиторов протеаз при остром панкреатите
 Острый панкреатит – это острый воспалительный процесс в поджелудочной железе (ПЖ), захватывающий окружающие ткани, сопровождающийся синдромом системного воспалительного ответа с риском перехода его в полиорганную недостаточность и смерти больного [1]. Он является одним из самых распространенных неотложных гастроэнтерологических заболеваний во всем мире. Частота развития острого панкреатита в мировой популяции составляет в среднем 34 случая на 100 тыс. населения в год.
Острый панкреатит – это острый воспалительный процесс в поджелудочной железе (ПЖ), захватывающий окружающие ткани, сопровождающийся синдромом системного воспалительного ответа с риском перехода его в полиорганную недостаточность и смерти больного [1]. Он является одним из самых распространенных неотложных гастроэнтерологических заболеваний во всем мире. Частота развития острого панкреатита в мировой популяции составляет в среднем 34 случая на 100 тыс. населения в год.
Среди экономически развитых стран заболеваемость острым панкреатитом превышает среднее значение в США (58 случаев на 100 тыс.) и Тайване (44 на 100 тыс.) [2]. В Европе этот показатель варьируется от 11,8 (Нидерланды) до 72,5 (Испания) случая [3]. В Украине заболеваемость острым панкреатитом составляет 77 случаев на 100 тыс. населения в год [4].
Как правило, течение заболевания нетяжелое, с самоограничивающимся локальным воспалением ПЖ, а длительность госпитализации не превышает 48 часов. Однако у 15-25% пациентов к воспалению ПЖ присоединяются поражение других органов и систем, некроз тканей и инфекция [5, 6]. Летальность при остром панкреатите колеблется от нуля в легких случаях до 80% при тяжелом панкреонекрозе [7].
В основе патогенеза острого панкреатита лежит «панкреатическое самопереваривание» [8]. В норме защита ПЖ от самопереваривания заключается в том, что ферменты выделяются в неактивной форме и активируются в двенадцатиперстной кишке. Энтерокиназа, располагающаяся на щеточной кайме энтероцитов тонкой кишки, активирует профермент трипсиноген, превращая его в трипсин. Трипсин, в свою очередь, катализирует активацию других проферментов. В норме ПЖ вырабатывает ингибиторы трипсина, которые препятствуют его спонтанной активации в ацинарных клетках. Под влиянием различных агрессивных факторов (токсико-метаболических, механических, генетических и т.д.) защитные механизмы ослабевают, и спонтанная активация трипсина вызывает активацию других ферментов, а также системы комплемента, каскада коагуляции и фибринолиза, что способствует распространению процесса за пределы ПЖ [9]. Таким образом, именно активация трипсина является важнейшим триггером острого панкреатита.
Ферментативный аутолиз ПЖ запускает реакцию системного воспалительного ответа с участием клеток иммунной системы. Это приводит к тромбозу сосудов микроциркуляции, ишемии и некрозу ПЖ [9].
На данный момент не существует специфической терапии острого панкреатита, которая была бы направлена на уменьшение каскада воспаления или препятствовала нарушениям коагуляции. Лечение заболевания на данный момент включает только симптоматическую терапию (жидкостная ресусцитация, обезболивание и спазмолитики, нутритивная поддержка, посиндромное лечение). В качестве терапии, которая могла бы остановить продолжающееся самопереваривание ПЖ, уменьшить каскад воспаления и нарушений коагуляции, рассматривают применение ингибиторов протеаз. К этой группе препаратов относится улинастатин (ингибитор трипсина, выделенный из мочи человека) [10].
Улинастатин – это термо- и кислотостабильный гликопротеин, являющийся ингибитором сывороточных протеаз, который содержится в крови и моче человека. Он состоит из 143 аминокислотных остатков и содержит два домена Кунитца. Предшественник улинастатина, высокомолекулярный интер-α-ингибитор трипсина, в норме синтезируется в гепатоцитах [11,12]. Воспаление стимулирует выброс сывороточных протеаз из нейтрофилов, макрофагов, тучных клеток, лимфоцитов, а также эпителиальных и эндотелиальных клеток. Активированная нейтрофильная эластаза расщепляет интер-α-ингибитор трипсина, превращая его в улинастатин [13, 14]. Таким образом, улинастатин относится к позитивным белкам острой фазы воспаления [15]. При воспалении уровень эндогенного улинастатина в плазме крови и выраженность экспрессии его гена возрастают [16].
Улинастатин ингибирует различные сывороточные протеазы, такие как трипсин, тромбин, химотрипсин, калликреин, плазмин, эластаза, катепсин G, а также IXa, Xa, XIa и XIIa факторы свертывания крови [16-18]. Помимо этого он подавляет инфильтрацию нейтрофилов и выброс из них эластазы и медиаторов воспаления, угнетает продукцию фактора некроза опухоли α (TNF-α), интерлейкинов[IL]-1, IL‑6 и IL‑8, одновременно увеличивая количество регуляторных Т-клеток и продукцию IL‑10 [18, 19]. Также он улучшает капиллярный кровоток, повышает уровень фибриногена и продуктов его распада в сыворотке крови, тем самым уменьшая проявления коагулопатии и ДВС-синдрома [20]. Ингибируя сывороточные протеазы и оказывая иммуномодулирующий эффект, улинастатин предотвращает органное повреждение и полиорганную дисфункцию.
Противовоспалительное действие улинастатина активно изучалось в эксперименте. H.Shigetomi et al. (2010) отметили, что у мышей, искусственно лишенных гена для синтеза эндогенного улинастатина, повышалась смертность при экспериментальном сепсисе [21]. В экспериментах Y.Z. Cao et al. (2012) и Y.Liu et al. (2017) у крыс, которые получали улинастатин, при сепсисе снижались уровни TNF-α, IL‑6, P-селектина и комплекса тромбин-антитромбин, повышались концентрации IL‑10 и IL‑13, уменьшалась выраженность органной дисфункции [22, 23]. Z.Q. Dan et al. (2019) обнаружили у крыс с сепсисом достоверное повышение уровня трипсина в сыворотке крови, в сердце, легких и кишечнике по сравнению со здоровыми крысами. У здоровых крыс уровни трипсина в сыворотке крови не превышали 12,1 нг/мл, в сердце и легких – 6,4 нг/мл, кишечнике – 0,4 нг/мл. Применение улинастатина у крыс с сепсисом позволяло снизить уровень трипсина в сыворотке крови с 73,7±9,1 до 65,8±4,9 нг/ мл; в сердце – с 51,6±15,1 до 26,3±12,0 нг/ мл; легких – с 54,7±5,6 до 28,7±4,5 нг/мл; кишечнике – с 1,2±0,4 до 0,8±0,2 нг/мл [24].Исследование эндогенного предшественника улинастатина, интер-α-ингибитора трипсина, у больных с сепсисом (Y.P. Lim et al., 2003) показало, что при сепсисе его уровень в сыворотке снизился с 872±234 до 688±295 мг/л. При развитии септического шока уровень интер-α-ингибитора трипсина снижался до 540±246 мг/л, а у пациентов с тяжелым сепсисом, которые впоследствии умерли, – до 486±193 мг/л [25].
Клинические исследования подтверждают целесообразность введения экзогенного улинастатина при сепсисе. Так, Q.Xu et al. (2018) ретроспективно изучили 263 истории болезни пациентов с сепсисом. В исследуемой группе 179 больных получали внутривенную инфузию 200 000 МЕ улинастатина 3 раза в сутки до улучшения состояния. Группу контроля составили 84 пациента. В группе улинастатина на 3-и сутки достоверно снижался уровень С-реактивного белка (83,8 [21,35; 125,5] против 124 [61,9; 217,0] мг/л в группе контроля; p=0,061). Летальность при применении улинастатина снижалась с 55 до 31% (p<0,001) [26].
D.R. Karnad et al. (2014) обследовали 114 пациентов с тяжелым сепсисом. Из них 55 лиц получали 200 000 МЕ улинастатина каждые 12 ч в течение 5 сут; 59 пациентов – плацебо. На фоне применения улинастатина частота развития синдрома полиорганной недостаточности (СПОН) снизилась с 44,1 до 18,2% (p=0,003), длительность госпитализации сократилась на 51,2% (p<0,001); 28-дневная летальность уменьшилась с 20,3 до 7,3% (p=0,045) [27].
Ученые также оценивали влияние улинастатина на воспаление у больных с тяжелой черепно-мозговой травмой(ЧМТ). В исследовании Y.Tu et al. (2012) участвовали 60 лиц с политравмой и преобладающей ЧМТ. Из них 32 больных получали улинастатин в дозе 200 000 МЕ каждые 8 ч; 28 лиц составили группу контроля. В группе улинастатина достоверно снижались уровни всех маркеров воспаления: лейкоцитоз составлял 12,3±4,5×109/л против 15,9±6,3×109/л; уровень C-реактивного белка – 46,12±11,47 против 64,24±18,31 мг/л; прокальцитонина – 4,51±1,27 против 10,51±4,27 мкг/л; АлТ – 47,26±8,23 против 60,94±8,39 Ед/л; АсТ – 42,67±7,63 против 68,51±10,17 Ед/л; креатинина – 79,62±15,36 против 102,36±16,82 мкмоль/л; азота мочевины – 6,35±2,36 против 8,39±1,67 ммоль/л; TNF-α – 93,6±31,5 мкг/л против 195,8±23,9 мкг/л; IL‑2-12,3±4,5 против 15,9±6,3 мкг/л; IL‑6-52,36±12,46 против 69,34±26,13 мкг/л (p<0,05). Также при применении улинастатина снижались частота синдрома системного воспалительного ответа (21,9% против 46,4%) и СПОН (9,4% против 28,6%) [28].
L.Hui et al. (2014) обследовали 92 больных с тяжелой ЧМТ, часть которых получали улинастатин в дозе 200 000 МЕ внутривенно 2 раза в сутки в течение 7 дней. На фоне применения улинастатина наблюдалось достоверное снижение уровня лактата крови по сравнению с исходным и плацебо начиная с 3-х суток, а также улучшение показателей церебральной оксиметрии. Уровень C-реактивного белка в группе улинастатина также снижался по сравнению с контролем и составлял на 5-е сутки 35,27±15,18 против 56,19±13,24 мг/л; на 7-е сутки – 22,65±10,48 против 47,36±15,73 мг/л (p<0,05) [29].
C.Liang et al. (2014) исследовали неврологический статус 90 больных с тяжелой ЧМТ. Из них 45 лиц получали улинастатин в дозе 200 000 МЕ внутривенно дважды в день в течение 12 сут; другие 45 – пирацетам в дозе 4 г/20 мл дважды в сутки в течение 12 сут. На фоне терапии улинастатином отмечалось более быстрое восстановление сознания на 12-е сутки. Через 6 мес при применении улинастатина по сравнению с пирацетамом наблюдались достоверно лучшие показатели по шкале исходов Глазго: хорошее восстановление – у 62,3% против 40% пациентов; глубокая инвалидизация – 4,4% против 17,8%; смерть – 2,2% против 6,7% [30].
Y.Leng et al. (2014) провели метаанализ эффективности улинастатина при остром повреждении легких и остром респираторном дистресс-синдроме (ОРДС) в 29 рандомизированных исследованиях (n=1726). Индекс оксигенации изучался в 26 исследованиях (n=1552).Дозировка улинастатина составляла 50 000 МЕ 1 раз в сутки – в 2 исследованиях; 100 000 МЕ 2-3 раза в сутки – в 3 исследованиях; 200 000 МЕ от 1 до 3 раз в сутки – в 16 исследованиях; 300 000 МЕ 2-3 раза в сутки – в 6 исследованиях и в двух исследованиях – 500 000 МЕ 2 раза в сутки и 600 000 МЕ 4 раза в сутки соответственно. Длительность лечения улинастатином варьировалась от 2 до 10 (в среднем 6,4) дней.
Во всех исследованиях индекс оксигенации после лечения был выше в группе улинастатина по сравнению с контролем. В группе улинастатина он составлял от 206,78±17,68 до 389,59±5,77 мм рт. ст.; в контрольной – от 161,06±18,2 до 327,08±9,57 мм рт. ст. (стандартизированная средняя разница [ССР]=1,85; 95% доверительный интервал [ДИ] 1,42-2,29; р<0,00001). Летальность в отделениях интенсивной терапии (ОИТ) колебалась в группе улинастатина от 4,3 до 36,7%; в контрольной – от 13,6 до 71,4% (I2=0%; отношение рисков [ОР]=0,48; 95% ДИ 0,38-0,59; р<0,00001). Общая летальность составила 18,0% в группе улинастатина против 37,8% в группе контроля, т. е. улинастатин достоверно снижал летальность в ОИТ при ОРДС. В то же время 28-дневная летальность достоверно не отличалась между группами (ОР=0,78; 95% ДИ 0,51-1,19; I2=0%). Длительность лечения в ОИТ в группе улинастатина также сокращалась и колебалась от 6,7±1,6 до 15,3±6,0 сут против 9,2±1,2-23,5±8,1 сут в группе контроля (ССР =–0,97; 95% ДИ 1,20-–0,75; р<0,00001; I2=86%). Таким образом, улинастатин способствовал выраженному улучшению оксигенации, сокращению сроков пребывания и снижению летальности в ОИТ без достоверной разницы в показателях 28-дневной летальности [31].
Противовоспалительный эффект улинастатина изучался также при хирургической травме. В исследовании J.H. Park et al. (2010) принимали участие 30 больных, подлежащих плановой резекции желудка. Из них 15 лиц получали улинастатин в дозе 100 000 МЕ внутривенно в течение 2 ч перед операцией; еще 15 – составили группу контроля. В группе улинастатина повышение уровня IL‑6 на конец операции и спустя 1 ч после ее завершения было менее выраженным: 10,3±4,2 против 20,0±9,4 пг/мл на конец операции; 20,7±10,5 против 45,7±26,8 пг/мл через 1 ч после ее завершения [32].
K.Uemura et al. (2008) провели обследование 40 пациентов, подлежащих панкреатодуоденэктомии. Из них 20 лиц получали улинастатин внутривенно капельно в периоперационном периоде; другие 20 – вошли в группу контроля. На фоне терапии улинастатином достоверно реже повышался уровень α-амилазы в сыворотке крови и отделяемом из дренажей (10% против 45%; p=0,013) и достоверно реже возникал послеоперационный острый панкреатит (0% против 25%; p=0,016) [33].
В исследовании T.Tsujino et al. (2005) участвовали 406 пациентов, которым проводилась эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ). Из них 204 больных за 10 мин до процедуры получали внутривенно инфузию 150 000 МЕ улинастатина; 202 – плацебо. Установлено, что в группе улинастатина достоверно снижалась частота нарастания уровня α-амилазы (14,7% против 24,8%; p=0,011) и липазы крови (25,5% против 37,6%; p=0,008), при этом частота развития связанного с ЭРХПГ панкреатита снижалась с 7,4% до 2,9% (p=0,041) [34].
R.Vedamanickam et al. (2017) обследовали 46 пациентов, подлежащих ЭРХПГ, из которых 23 получали улинастатин внутривенно капельно в дозе 100 000 МЕ в течение 10 мин за 1 ч до ЭРХПГ, остальные 23 – плацебо. Согласно полученным результатам, в группе улинастатина достоверно реже возникала гиперферментемия (повышение амилазы и липазы менее чем в 3 раза от нормы) – в 13,0% против 30,4% случаев, а также достоверно реже развивался острый панкреатит (4,3% против 17,3%; p<0,05) [35].
Эффективность улинастатина исследовалась не только при профилактике, но и при лечении острого панкреатита. J.Y. Lagoo et al. (2018) ретроспективно изучили 48 историй болезни пациентов с острым панкреатитом и органной дисфункцией. Из них 25 пациентов получали улинастатин внутривенно в дозе 200 000 МЕ каждые 12 ч в течение 5 сут; еще 23 – составили группу контроля. Авторы определили, что в группе улинастатина достоверно снижалась госпитальная летальность – 16,0% против 69,6% (p=0,0003) и частота возникновения СПОН – 24,0% против 73,9% (p=0,0005). На фоне лечения улинастатином до 5 сут достоверно чаще восстанавливались функции дыхательной (48% против 11%; p=0,02) и свертывающей (83% против 10%; p=0,001) систем [11].
G.Wang et al. (2016) разделили 492 пациентов с острым панкреатитом на 4 группы в зависимости от варианта проводимой терапии: соматостатин; соматостатин + улинастатин; соматостатин + габексат; соматостатин + улинастатин + габексат. Было установлено, что во всех группах, кроме группы монотерапии соматостатином, снижалась тяжесть состояния по шкале APACHE-II (шкала оценки острых физиологических расстройств и хронических нарушений состояния), а также достоверно сокращались сроки нормализации частоты сердечных сокращений, частоты дыхания, уровней сывороточной амилазы и глюкозы крови. В группах «соматостатин + улинастатин» и «соматостатин + улинастатин + габексат» по сравнению с группами «соматостатин» и «соматостатин + габексат» достоверно снижалась частота СПОН, осложнений и летальности. На 4-е сутки лечения в группах комбинированной терапии по сравнению с монотерапией соматостатином уровни TNF-α, IL‑6, IL‑8 были достоверно ниже, а IL‑10 – достоверно выше. Таким образом, улинастатин позволяет не только достичь улучшения состояния больных, но и снизить частоту СПОН, осложнений и летальности [36].
S.I. Hassan et al. (2016) обследовали 60 пациентов с острым панкреатитом. Из них 30 больных получали улинастатин внутривенно капельно в дозе 100 000 МЕ дважды в день в течение 5 сут, а 30 – составили группу контроля. В результате было выявлено, что в группе улинастатина уровень α-амилазы был ниже, чем таковой в контрольной; на 2-е сутки – на 54,7%; на 3-и сутки – на 74,1%; на 5-е сутки – на 77,3%. Уровень α-амилазы в группе улинастатина нормализовался на 5-е сутки, в то время как в группе контроля на 5-е сутки он превышал норму в 3 раза. Частота осложнений в группе улинастатина снизилась до 6,7% против 40,0% [37].
G.D. Zhen et al. (2017) вводили улинастатин 141 пациенту с острым панкреатитом в дозе 200 000 МЕ дважды в день в течение 7 сут. При этом 135 лиц составили группу контроля. На 7-е сутки в группе улинастатина количество лейкоцитов составило 5,70±0,54 против 9,58±0,67×109/л (p<0,05); уровень альбумина крови – 38,3±6,5 против 25,5±7,9 г/л (p<0,05); амилазы мочи – 1348,72±88,18 против 2419,26±167,41 МЕ/л (p<0,05); амилазы сыворотки крови – 509,75±41,23 против 624,38±88,54 МЕ/л (p<0,05) [38].
Ряд авторов отмечают достоверное снижение частоты развития СПОН и летальности при применении улинастатина у больных с тяжелым острым панкреатитом. В проспективном рандомизированном плацебо-контролируемом исследовании U.D. Manoranjan et al. (2018) с участием 50 пациентов с острым панкреатитом показали, что применение 200 000 ЕД улинастина дважды в день в течение 5 сут достоверно снижало частоту развития СПОН с 44,4 до 20,0% (p=0,047), летальность – с 32,0 до 8,0% (p=0,025) [39]. L.Meng et al. (2019) обследовали 108 пациентов с острым панкреатитом. В группе контроля 54 больных получали октреотид в дозе 0,6 мг внутривенно капельно 1 раз в сутки в течение 7 дней. Еще 54 пациента (основная группа) дополнительно получали 100 000 МЕ улинастатина внутривенно капельно дважды в сутки в течение 7 дней. Через 7 сут от начала лечения в группе улинастатина уровень эндотелина был на 24,3% ниже, чем в группе контроля (p<0,001); уровень эндотоксина – на 52,9% (p<0,001). Показатель иммуноглобулина [Ig] A в группе улинастатина по сравнению с контрольной был выше на 14,5% (p=0,031); IgM – на 18,2% (p=0,007); IgG – на 11,0% (p=0,001). Под влиянием улинастатина достоверно повысилась частота клинического улучшения (96,3% против 85,2%; p=0,046) [40].
Цель исследования заключалась в изучении влияния улинастатина на тяжесть течения острого панкреатита.
Материалы и методы
Нами обследовано 50 больных острым панкреатитом, которые проходили лечение в КУ «Днепропетровская шестая городская клиническая больница» ДОС с 01.11.2018 г. по 01.05.2019 г. В зависимости от выбранной схемы лечения они были случайным образом разделены на 2 группы. Больные 1-й контрольной группы (n=25) получали стандартную интенсивную терапию согласно протоколу [41]. Пациентам 2-й основной группы (n=25) дополнительно назначался улинастатин (ю-трип, «Бхарат Сирамс энд Вакцинс Лимитед», Индия) в дозе 100 000 МЕ внутривенно капельно 1 раз в сутки в течение 3 дней.
Критериями включения были [42]:
- начальный период острого панкреатита алиментарного, алкогольного или билиарного генеза;
- отечная или некротическая неинфицированная (с наличием ферментативного асцита и острых жидкостных образований в проекции ПЖ) форма заболевания;
- наличие полиорганной дисфункции.
Критериями исключения были:
- панкреонекроз в анамнезе;
- острый травматический или послеоперационный панкреатит;
- некротическая инфицированная форма панкреатита;
- прогрессирующая полиорганная недостаточность.
Мы исследовали объем жидкости в брюшной полости по данным УЗИ, а также показатели воспаления (лейкоцитоз, лейкоцитарный индекс интоксикации [ЛИИ]), уровни α-амилазы крови и диастазы мочи, которые определялись аппаратным методом по унифицированным методикам [43]. Точки контроля: при поступлении, через 24 ч, на 3-и и 5-е сутки заболевания. Тяжесть заболевания определялась через 48 ч по классификации Атланта‑2012 [44]. Критериями эффективности лечения были частота оперативных вмешательств и летальность, а также длительность пребывания в ОИТ и стационаре.
Анализ полученных результатов проводился с помощью параметрических (ANOVA) и непараметрических методов статистики с определением достоверности различий по критериям Стьюдента и χ2. Расчеты выполняли с помощью программы Microsoft Excel 2016.
Результаты и их обсуждение
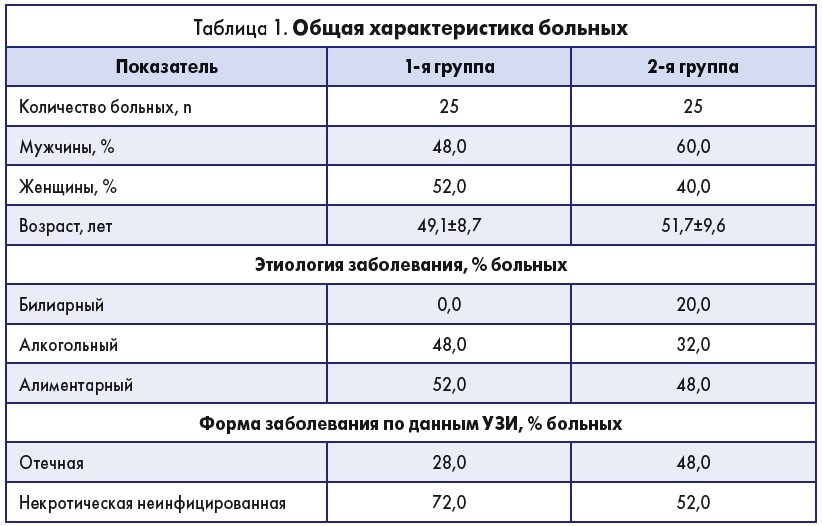
Пациенты в изучаемых группах достоверно не отличались по возрасту, полу, этиологии заболевания и тяжести состояния (табл. 1). У 10,0% всех больных был диагностирован острый панкреатит билиарной этиологии, у 40,0% – алкогольной, у 50,0% – алиментарной. Отечная форма панкреатита отмечалась в 40,0% случаев, некротическая неинфицированная – в 60,0%.
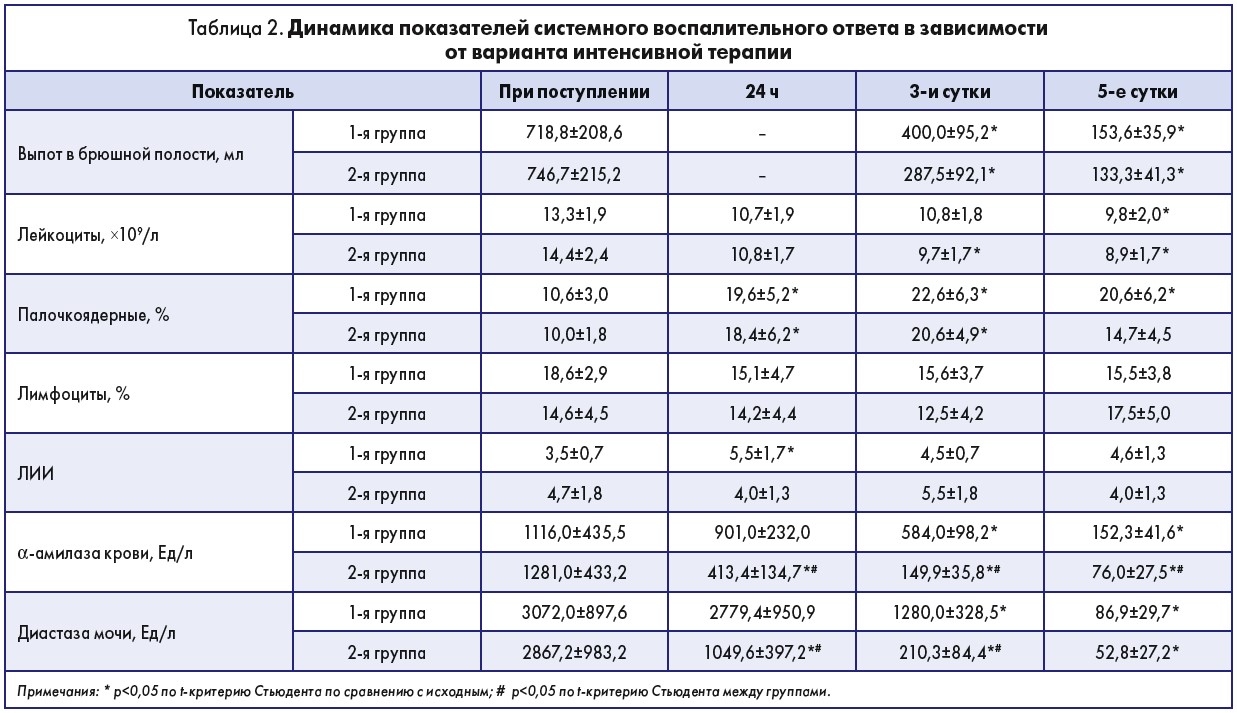
При поступлении больных в стационар объем жидкости в брюшной полости составлял 718,8±208,6 и 746,7±215,2 мл в контрольной и основной группе соответственно (табл. 2). При этом резко повышался уровень α-амилазы в крови (до 1116,0±435,5 и 1281,0±433,2 Ед/л соответственно) и диастазы в моче (3072,0±897,6 и 2867,2±983,2 Ед/л). Параллельно отмечался нейтрофильный лейкоцитоз (количество лейкоцитов – 13,3±1,9 и 14,4±2,4×109/л) с палочкоядерным сдвигом (10,6±3,0 и 10,0±1,8%), относительная лимфопения (18,6±2,9 и 14,6±4,5%), что свидетельствовало об активном воспалении ПЖ. Показатели ЛИИ составляли 3,5±0,7 и 4,7±1,9 в контрольной и основной группах, что соответствовало средней степени эндогенной интоксикации [45].
На 3-и сутки наблюдения в обеих группах отмечалось уменьшение объема жидкости в брюшной полости. При этом в контрольной группе объем уменьшился на 44,3% от исходного (p=0,013), а в группе улинастатина – на 61,5% (p<0,001). Дренирование брюшной полости потребовалось у 68,0% больных контрольной группы и только у 40,0% – группы улинастатина (p=0,047 между группами). Дренирование проводилось на 3-4-е сутки.В результате на 5-е сутки наблюдения объем жидкости в брюшной полости достоверно не отличался между группами и был на 78,6% ниже от исходного (p<0,001) в контрольной группе; на 82,1% (p<0,001) – в группе улинастатина. Таким образом, лечение улинастатином способствовало ускоренному разрешению ферментативного асцита, что снижало частоту дренирования брюшной полости.
Анализ активности воспаления показал, что через 24 ч выраженность лейкоцитоза уменьшилась в обеих группах независимо от особенностей проводимой терапии. Однако в группе улинастатина уменьшение общего количества лейкоцитов было более выраженным (на 25,4%; p=0,03), чем в контрольной группе (на 19,8%). На 3-и сутки наблюдения общее количество лейкоцитов в группе улинастатина продолжало уменьшаться и было на 32,7% ниже исходного (p=0,008), тогда как в контрольной группе сохранялось на прежнем уровне. На 5-е сутки наблюдения указанная динамика сохранялась. В группе улинастатина общее количество лейкоцитов уменьшилось на 38,1% (p=0,003) от исходного, а в контрольной группе – всего на 26,0% (p=0,023) от исходного.
При этом через 24 ч от начала лечения количество палочкоядерных нейтрофилов нарастало у всех больных и превышало исходный уровень в 1,9 раза (p=0,004) в контрольной группе и в 1,8 раза (p=0,039) – в группе улинастатина. На 3-и сутки наблюдения палочкоядерный сдвиг в обеих группах достигал пиковых значений, в 2,1 раза превышая исходный уровень (p<0,05), что на 14,6-16,6% превышало норму. На 5-е сутки наблюдения характер изменений палочкоядерного сдвига зависел от схемы проводимого лечения. На фоне применения улинастатина отмечалось уменьшение количества палочкоядерных нейтрофилов до 14,7±4,5%, тогда как в контрольной группе сохранялся выраженный палочкоядерный сдвиг (20,6±6,2%). Относительная лимфопения сохранялась в обеих группах на протяжении всего периода исследования. Однако у больных, получавших улинастатин, на 5-е сутки наблюдения отмечалась тенденция к восстановлению количества лимфоцитов, что сопровождалось снижением ЛИИ на 12,7% против контрольной группы. Указанная динамика маркеров воспаления подтверждала противовоспалительное действие улинастатина и соответствовала данным J.Wang et al. [46].
Анализ показал, что через 24 ч от начала лечения уровень α-амилазы крови снижался в обеих группах. Однако в группе улинастатина мы отмечали снижение α-амилазы крови на 67,7% (p=0,001) от исходного, что превышало норму в 4,1 раза. В то же время в контрольной группе уровень α-амилазы крови снижался всего на 19,3%, что превышало норму в 9 раз. На 3-и сутки наблюдения в группе улинастатина уровень α-амилазы крови продолжал снижаться и превышал норму всего в 1,5 раза, тогда как в контрольной группе – в 5,8 раза. На 5-е сутки лечения уровень α-амилазы крови в группе улинастатина соответствовал норме, тогда как в контрольной группе он превышал ее в 1,5 раза.
Подобная динамика наблюдалась и при исследовании уровня диастазы мочи. Через 24 ч от начала лечения в группе улинастатина концентрация диастазы мочи снизилась на 63,4% (p=0,006) от исходного значения, что превышало норму в 16,4 раза. Вместе с тем при традиционном лечении уровень диастазы мочи достоверно не отличался от исходного и превышал норму в 43,4 раза. На 3-и сутки наблюдения наметилась тенденция к снижению уровня диастазы мочи в обеих группах с достоверной разницей по группам. В группе улинастатина уровень диастазы мочи снизился на 92,7% от исходного (p<0,001), что превышало норму всего в 3,3 раза. При этом в контрольной группе он снизился всего на 58,3% (p=0,01) от исходного уровня, что превышало норму в 20 раз. На 5-е сутки наблюдения на фоне применения улинастатина отмечалась нормализация уровня диастазы мочи, тогда как в контрольной группе он превышал норму на 35,8%.
Таким образом, улинастатин эффективно ингибировал активность протеолитических ферментов уже с первых суток лечения, что позволило достичь верхней границы их нормы к 5-м суткам. Эти данные соответствуют результатам, полученным в ходе исследований S.I. Hassan et al. (2016), G.D. Zhen et al. (2017) [38, 39].
В соответствии с вышеизложенным, диагноз острого панкреатита тяжелой степени к 3-м суткам от начала заболевания был подтвержден у 80,0% больных контрольной группы. Наряду с этим на фоне применения улинастатина степень тяжести заболевания уменьшалась, и диагноз острого панкреатита тяжелой степени был подтвержден только у 48,0% больных (p=0,018). Летальность в контрольной группе составила 20,0%, тогда как в группе улинастатина летальных случаев не зафиксировано (p=0,018). Длительность лечения в ОИТ в группе улинастатина сократилась с 3,6±1,0 до 2,3±0,9 сут. Длительность пребывания в стационаре не отличалась между группами и составляла 13,7±3,4 и 14,9±4,3 сут в контрольной и основной группе соответственно.
Выводы
У больных острым панкреатитом улинастатин оказывает выраженный противовоспалительный эффект. Это проявляется быстрым и достоверным снижением гиперферментемии и регрессом ферментативного асцита. Улинастатин уменьшает степень тяжести панкреатита, ускоряет разрешение синдрома системного воспалительного ответа, предупреждая тем самым развитие панкреонекроза.
Литература
1. Beger H.G. Diseases of the Pancreas / H.G.Beger, S.Matsuno, J.L. Cameron. – Springer Berlin Heidelberg, 2008. – 949 p.
2. Global incidence and mortality of pancreatic diseases: a systematic review, meta-analysis, and meta-regression of population-based cohort studies / Xiao A.Y., Tan M.L., Wu L.M. [et al.] // Lancet Gastroenterol Hepatol. –2016. – Vol. 1(1). – P. 45-55.
3. The incidence and aetiology of acute pancreatitis across Europe / S.E.Roberts, S. Morrison-Rees, A.John [et al.]// Pancreatology. –2017. – Vol. 17, № 2. – P. 155-165.
4. Болезни поджелудочной железы как одна из ведущих проблем гастроэнтерологии и абдоминальной хирургии (современная эпидемиология) / Ю.М. Степанов, Н.Г. Гравировская, И.Ю. Скирда, О.П. Петишко // Гастроентерологія. – 2014. – № 3. – С. 7-14.
5. Advances in management of acute pancreatitis / N.H. Janisch, T.B. Gardner // Gastroenterol Clin North Am. – 2016. – Vol. 45(1). – P. 1-8.
6. Incidence of individual organdysfunction in fatal acute pancreatitis: analysis of 1024 death records / Mole D.J., Olabi B., Robinson V. [et al.] // HPB. – 2009. – Vol. 11(2). – P. 166-170.
7. Antibiosis of necrotizing pancreatitis / Arlt A., Erhart W., Schafmayer C. [et al.] // Visceral Medicine. – 2014. – Vol. 30(5). – P. 318-324.
8. Update on pathogenesis and clinical management of acute pancreatitis / D.M. Cruz-Santamaría, C. Taxonera, M. Giner // World J Gastrointest Pathophysiol. – 2012. – Vol. 3(3). – P. 60-70.
9. Современные подходы к лечению острого панкреатита (обзор международных рекомендаций) / С.И. Ситкин, В.Н. Силаев, Е.Ю. Бозова, С.И. Токарева // Верхневолжский медицинский журнал. – 2015. – Т. 13, № 1. – С. 17-21.
10. Role of Ulinastatin, a trypsin inhibitor, in severe acute pancreatitis in critical care setting: A retrospective analysis. / Lagoo J.Y., D’Souza M.C., Kartha A., Kutappa A.M. // J Crit Care. – 2018. – № 45. – P. 27-32.
11. The inter-alpha-inhibitor family: from structure to regulation / Salier J.P., Rouet P., Raguenez G., Daveau M. // Biochem J. – 1996. – Vol. 315 (Pt 1). – P. 1-9.
12. Biosynthesis of bikunin (urinary trypsin inhibitor) in rat hepatocytes / E.M. Sjöberg, E.Fries // Arch Biochem Biophys. – 1992. – Vol. 295(2). – P. 217-222.
13. Han J.I. Urinary trypsin inhibitor: miraculous medicine in many surgical situations? /J.I.Han // Korean J Anesthesiol. – 2010. – № 58. – P. 325-327.
14. Pugia M.J. Bikunin (Urinary Trypsin Inhibitor): Structure, Biological Relevance, And Measurement / M.J.Pugia, R. Valdes, S.A.Jortani // Advances in Clinical Chemistry. – 2007. – Vol. 44. – P. 223-245.
15. Fries E. Bikunin-not just a plasma proteinase inhibitor / Fries E., Blom A.M. // Int J Biochem CellBiol. – 2000. – Vol. 32(2). – P. 125-137.
16. Inflammation-induced systemic proteolysis of inter-alpha-inhibitor in plasma from patients with sepsis / Balduyck M., Albani D., Jourdain M. [et al.] // J Lab Clin Med. – 2000. – Vol. 135. – P. 188-198.
17. An exciting candidate therapy for sepsis: ulinastatin, a urinaryprotease inhibitor / Linder A., Russell J.A. // Intensive Care Med. – 2014. – Vol. 40(8). – P. 1164-1167.
18. Umeadi C. Ulinastatin is a novel protease inhibitor andneutral protease activator / Umeadi C., Kandeel F., Al-Abdullah I.H. // Transplantation Proceedings. –2008. – Vol. 40. – № 2. – P. 387-389.
19. Ulinastatin ameliorates tissue damage of severe acute pancreatitis through modulating regulatory T cells / Pan Y., Fang H., Lu F. [et al.] // J Inflamm (Lond). – 2017. – Vol. 14. – P. 7.
20. Treatment effects of Ulinastatin on Disseminated Intravascular Coagulation / Shen L., Cai L., Qin B. [et al.] // Chinese Journal of General Practice. – 2011. – Vol. 8. – P. 11-17.
21. Anti-inflammatory actions of serine protease inhibitors containing the Kunitz domain / Shigetomi H., Onogi A., Kajiwara H. [et al.] // Inflamm Res. – 2010. – Vol. 59. – P. 679-687.
22. Protective effect of Ulinastatin against murine models of sepsis: inhibition of TNF-α and IL‑6 and augmentation of IL‑10 and IL‑13 / Cao Y.Z., Tu Y.Y., Chen X. [et al.] // Exp Toxicol Pathol. – 2012. – Vol. 64(6). – P. 543-547.
23. Effect of ulinastatin on serum levels of tumor necrosis factor-α, P-selectin, and thrombin-antithrombin complex in young rats with sepsis / Liu Y., Wu X.H. // Zhongguo Dang Dai Er Ke Za Zhi. – 2017. – Vol. 19(2). – P. 237-241.
24. The expression of trypsin in serum and vital organs of septic rats / Dan Z.Q., Liao X.L., Hou C.S. [et al.] // Zhonghua Nei Ke Za Zhi. – 2018. – Vol. 57(7). – P. 505-510.
25. Correlation between mortality and the levels of inter-alpha inhibitors in the plasma of patients with severe sepsis / Lim Y.P., Bendelja K., Opal S.M. [et al.] // J Infect Dis. –2003. – Vol. 188. – P. 919-926.
26. Xu Q. Ulinastatin is effective in reducing mortality for critically ill patients with sepsis: a causal mediation analysis / Q. Xu, Q. Yan, S. Chen // ScientificReports. – 2018. – Vol. 8. – P. 14360.
27. Intravenous administration of ulinastatin (human urinary trypsin inhibitor) in severe sepsis: a multicenter randomized controlled study / D. R. Karnad, R. Bhadade, P.K. Verma [et al.] // Intensive Care Med. – 2014. – Vol. 40(6). – P. 830-838.
28. Effect of ulinastatin in traumatic brain injury with multiple injuries / Tu Y., Diao Y.F., Yang X.P. [et al.] // Zhongguo Wei Zhong Bing Ji Jiu Yi Xue. –2012. – Vol. 24(11). – P. 677-679. [Chinese]
29. Effects of ulinastatin on cerebral oxygen metabolism and CRP levels in patients with severe traumatic brain injury / L. Hui, F. Shen, H. Chang [et al.] // Exp Ther Med. –2014. – Vol. 7(6). – P. 1683-1686.
30. Comparative study of neuroprotective effects of ulinastatin versus piracetam treating on acute traumatic craniocerebral injury / C. Liang, J. Xia, Y. Dia [et al.] // Journal of Chemical and Pharmaceutical Research. – 2014. – Vol. 6(6). – P. 1124-1128.
31. Ulinastatin for acute lung injury and acute respiratory distress syndrome: A systematic review and meta-analysis / Leng Y.X., Yang S.G., Song Y.H. [et al.] // World J Crit Care Med. – 2014. – Vol. 3(1). – P. 34-41.
32. Effect of ulinastatin on cytokine reaction during gastrectomy / Park J.H., Kwak S.H., Jeong C.W. [et al.] // Korean J Anesthesiol. – 2010. – Vol. 58(4). – P. 334-337.
33. Randomized clinical trial to assess the efficacy of ulinastatin for postoperativepancreatitis following pancreaticoduodenectomy / Uemura K., Murakami Y., Hayashidani Y. [et al.] // J Surg Oncol. – 2008. – № 98. – P. 309-313.
34. Ulinastatin for pancreatitis after endoscopic retrograde cholangiopancreatography: a randomized, controlled trial / Tsujino T., Komatsu Y., Isayama H. [et al.] // Clin Gastroenterol Hepatol. – 2005. – № 3(4). – P. 376-383.
35. Vedamanickam R. A study on ulinastatin in preventing post ERCP pancreatitis / Vedamanickam R., Kumar V., Hariprasad B. // International Journal of Advances in Medicine. – 2017. – Vol. 4(6). – P. 1528-1531.
36. Effect of Somatostatin, Ulinastatin and Gabexate on the Treatment of Severe Acute Pancreatitis / Wang G., Liu Y., Zhou S.F. [et al.] // Am J Med Sci. – 2016. – № 351(5). – P. 506-512.
37. Hassan S.I. Evaluation of therapeutic effectiveness of ulinastatinin acute pancreatitis / Hassan S.I., Hassan S.M.A. // Asian Pac. J. Health Sci. – 2016. – Vol. 3(4S). – P. 27-33.
38. Associations of MMP‑2 and MMP‑9 gene polymorphism with ulinastatin efficacy in patients with severe acute pancreatitis / Zhen G.D., Zhao L.B., Wu S.S. [et al.] // Bioscience Reports. – 2017. – Vol. 37 (4): BSR20160612.
39. Manoranjan U.D. A prospective study of the efficacy of intravenous ulinastatin in the treatment of acute pancreatitis / Manoranjan U.D., Nikhil S., Abhiram S.V. // International Journal Of Scientific Research. – 2018. – Vol.7. – № 7. – P. 70-71.
40. Meng L. Effect of Ulinastatin Combined with Octreotide on Serum Endothelin, Endotoxin Levels and Immune Function in Acute Pancreatitis / Meng L., Wu Z., Zhang H. // J Coll Physicians Surg Pak. – 2019. – № 29(1). – P. 90-92.
41. Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги: гострий панкреатит / МОЗ України. – К., 2016. – 53 с.
42. Невідкладна хірургія органів черевної порожнини (стандарти організації та професійно-орієнтовані алгоритми надання медичної допомоги) / За ред. П.Д. Фоміна, О.Ю. Усенко, Я.С. Березницького. – К.: «Бібліотека «Здоров’я України», 2018. – 354 с.
43.Про затвердження методик виконання вимірювань медико-біологічних показників: Наказ МОЗ № 417 від 15.11.2002 [Електронний ресурс]. – Режим доступу: http://mozdocs.kiev.ua/view.php?id=1960.
44. Banks P.A. Classification of acute pancreatitis 2012: revision of Atlanta classification and definitions by international consensus / Banks P.A., Bollen T.L., Dervenis C. [et al.] // Gut. – 2013. – № 62. – Р. 102- 111.
45. Островский В. К. Лейкоцитарный индекс интоксикации при острых гнойных и воспалительных заболеваниях легких // Вестник хирургии им. И.И. Грекова. – 1983. – Т. 131. – № 11. – С. 21-24.
46. Clinical value of the early use of ulinastatin in patients with moderately severe or severe acute pancreatitis / Wang J., Jin J., Huang J. [et al.] // Zhonghua Yi Xue Za Zhi. – 2017. – Vol. 97(16). – P. 1252-1255. [Chinese]