3 березня, 2020
Особливості ведення хворих із полірезистентними інфекціями в акушерській та загальній клінічній практиці
Однією з актуальних тем Конгресу анестезіологів України, який відбувся 19-21 вересня у Києві, були питання раціонального використання антибіотиків, зокрема в акушерській службі, та принципи раціональної антибіотикотерапії полірезистентних інфекцій.

У контексті цієї проблеми була представлена доповідь професора кафедри акушерства, гінекології та репродуктології НМАПО ім. П.Л. Шупика, головного спеціаліста з питань акушерської реанімації департаменту охорони здоров’я, доктора медичних наук Руслана Опанасовича Ткаченка.
Передусім автор доповіді зазначив, що, згідно з даними ВООЗ за 2015 рік, у структурі материнської смертності інфекції займають третє місце й поступаються лише кровотечам та тяжким супутнім захворюванням. Кожного року у світі реєструється 6,9 млн випадків сепсису в акушерстві, летальність при цьому становить 7-17% у разі тяжкого сепсису та 28-33% при септичному шоці. У США у період 1998-2000 років частота акушерського сепсису склала 6,5 випадку на 100 тис. пологів. За останні 10 років цей показник зріс у 2,2 раза, а у 2008 році складав уже 13,8 випадку на 100 тис. пологів. Негативна динаміка статистичних даних вказує на те, що проблема інфекцій в акушерстві не втрачає своєї актуальності й стосується не лише країн, що розвиваються, а й країн із розвинутою економікою.
До факторів ризику тяжкого сепсису відносять:
- застійну серцеву недостатність (відносний ризик – ВР=135);
- хронічне захворювання нирок (ВР=55,96);
- хронічне захворювання печінки (ВР=33,7);
- системний червоний вовчак (ВР=3,4).
Найчастіше акушерський сепсис має полімікробну етіологію (Dale W., 2013) і викликається наступними видами мікроорганізмів:
- грампозитивні – Streptococcus, Enterococcus, Staphylococcus;
- грампозитивні анаероби – Peptococcus species, Peptostreptococcus species;
- грамнегативні аероби – Escherichia coli;
- грамнегативні анаероби – Bacteroides bivius.
Доповідач зауважив, що в останні роки стало приділятися більше уваги антибіотикорезистентності та раціональному використанню антибіотиків. І не дарма, адже у клініках, у тому числі акушерських, дедалі частіше виникають інфекції, спричинені штамами бактерій, що є резистентними до більшості антибактеріальних препаратів.
Згідно з результатами дослідження Study for Monitoring Antimicrobial Resistanse Trends prоgram (SMART, 2002-2010), протягом останніх 9 років достовірно знизилась (p<0,05) чутливість штамів E. coli, що продукують β-лактамази розширеного спектра (БЛРС), до цефалоспоринів і фторхінолонів. А чутливість до цефтриаксону, який широко використовують у відділеннях різного профілю, практично відсутня (S. Hawsera et al., 2013).
Резистентність до гентаміцину становить до 80%, до амікацину – 45%, до тетрацикліну – 76%, однак чутливість до карбапенемів, лінкозамідів, гліцилциклінів та оксазолідинонів все ще зберігається у зв’язку з нешироким їх застосуванням (Lambiase G. еt al., 2012). За даними 2013 року, у вагітних резистентність стрептококів та E. coli до кліндаміцину та еритроміцину сягає 49,5% (Li Y.P. et al., 2016).
На сьогодні, зазначив Р.О. Ткаченко, основним підходом у лікуванні інфекцій залишається емпірична антибіотикотерапія, а саме деескалаційний метод її застосування. Такий підхід показав високу ефективність при введенні антибіотика в першу годину після надходження пацієнта до стаціонару.
Принцип деескалаційної терапії передбачає два етапи: 1) емпірична антибіотикотерапія препаратами широкого спектра, що охоплює всі ймовірні збудники конкретної інфекції; 2) призначення антибіотиків вузького спектра після отримання даних про виділений збудник та його чутливість до антибіотиків. Така терапія дозволяє уникнути необґрунтовано тривалої антибіотикотерапії, розвитку антибіотикорезистентності, високої летальності, що пов’язані з неадекватною антибактеріальною терапією (Bassetti M. et al., 2014).
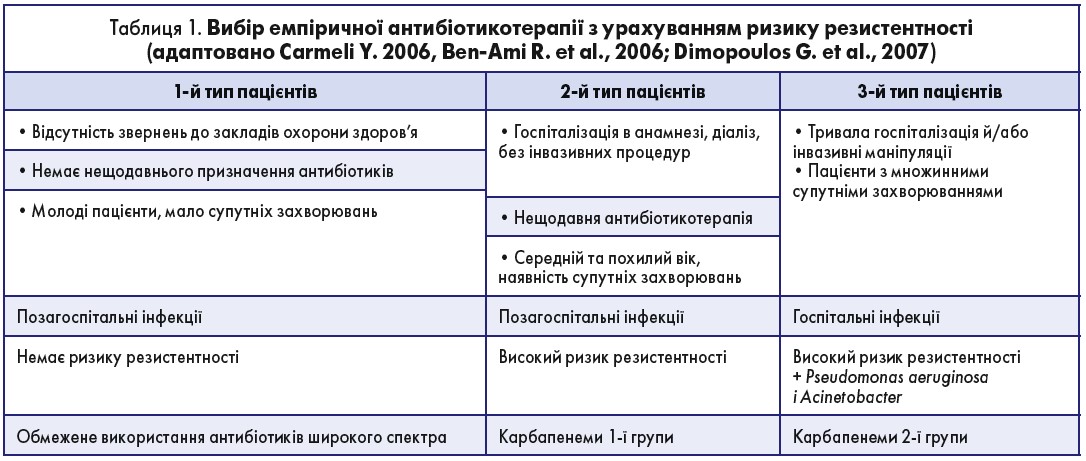
Для оптимального вибору антибіотика в якості емпіричної терапії зручно користуватися методом розподілу пацієнтів на три типи, що враховує вік хворого, інформацію про нещодавнє використання антибіотиків та наявність госпіталізацій в анамнезі (табл. 1).
Автор доповіді зауважив, що найкращим вибором для стартової емпіричної терапії є призначення карбапенемів: іміпенему, меропенему, ертапенему. Однак не всі представники даного класу антибіотиків однакові за своїми властивостями, а саме:
- Іміпенем проявляє більш високу активність щодо грампозитивних мікроорганізмів, але менш ефективний по відношенню до грамнегативних порівняно з меропенемом. Також препарат здатен провокувати клонічні судоми й має властивість інактивуватися нирковими дегідропептидазами при одночасному прийомі циластатину;
- Меропенем більш активний щодо грамнегативної флори, а його ефективність проти грампозитивних збудників зіставна з іміпенемом;
- Ертапенем має низьку ефективність проти неферментуючих грамнегативних бактерій, а саме P. aeruginosa; його застосування обмежене при лікуванні госпітальних інфекцій.
Меропенем (оригінальний препарат – Меронем, компанія «Пфайзер») виявляє більш високу клінічну та бактеріологічну ефективність, а також меншу частоту значущих побічних ефектів порівняно з іміпенемом та ертапенемом (Edwards J., 2005). На відміну від решти карбапенемів, меропенем не руйнується дегідропептидазою й не має нефротоксичних властивостей, а отже, не потребує додаткового застосування циластатину. За даними дослідження E.J. Giamarellos-Bourboulis (2006), застосування Меронему не призводить до розвитку системного ендотоксикозу. Активність Меронему in vitro проти виділених штамів E. coli, Enterobacter spp. та P. aeruginosa була достовірно вищою порівняно з іншими представниками групи карбапенемів. Препарат при деяких показаннях застосовується в дозі до 2 г тричі на добу (кожні 8 год) у дорослих та дітей із масою тіла >50 кг, а в дітей від 3 міс до 11 років із масою <50 кг – у дозі до 40 мг/кг тричі на добу.
Професор Р.О. Ткаченко рекомендував застосовати Меронем в якості першого етапу деескалаційної терапії. Однак при цьому враховувати той факт, що серед вагітних жінок поширеним є носійство резистентних штамів стафілококів. Так, у цервікальних мазках, узятих на 35-37-му тижні гестації, у 24,3% випадків було виявлено метицилін-резистентний Staphylococcus aureus (MRSA). Це свідчить про те, що терапії лише карбапенемами може бути недостатньо, а для повноцінної ерадикації збудника необхідно застосовувати комбіновану антибіотикотерапію.
Доповідач наголосив, що у таких випадках, а також у разі тяжких інфекцій в акушерстві оптимальним є застосування комбінації (грунтуючись на даних чутливості): карбапенем (Меронем) + кліндаміцин (Далацин) + флуконазол (Дифлюкан). Така комбінація здатна охопити весь спектр патогенів і має високу клінічну ефективність. Застосування даної схеми лікування дозволяє досягнути ерадикації збудників у пацієнтів із MRSA-асоційованою бактеріємією (Gomez J. et al., 2007).
Далацин – препарат групи лінкозамідів, діючою речовиною якого є кліндаміцин. Демонструє високу активність проти грампозитивних аеробних та анаеробних патогенів, має високу біодоступність та проявляє бактерицидну або бактеріостатичну дію залежно від концентрації, виду мікроорганізмів та локалізації інфекції. Приймати препарат слід дорослим та дітям від 14 років у дозі 0,6-1,8 г кліндаміцину на добу (4-12 капсул), запиваючи великою кількістю води. Добову дозу слід розділити на 4 прийоми.
Ще один клас препаратів, що показали високу інтенсивність у лікуванні MRSA-інфекції, – це оксазолідинони. Представником цього класу є лінезолід (Зивокс). Згідно з даними дослідження, у якому порівнювалась ефективність ванкоміцину та лінезоліду, застосування останнього дозволило покращити результати ерадикації MRSA-інфекції на 30%. Призначення лінезоліду в якості антибіотикотерапії асоціюється з низькими показниками летальності від сепсису та більш успішною мікробіологічною ерадикацією порівняно з ванкоміцином у хворих із бактеріємією, зумовленою MRSA (Weigelt J. et al., 2004). Препарат не чинить нефротоксичної дії на відміну від інших препаратів цього класу. Застосовують його в дорослих та дітей від 12 років по 600 мг 2 рази на добу (кожні 12 год) у вигляді таблеток або внутрішньовенних інфузій. При неускладнених інфекціях шкіри та її структур у дорослих застосовується Зивокс у дозі 400 мг кожні 12 год перорально.
Доповідач зазначив, що в разі інфікування полірезистентними збудниками, які продукують БЛРС і мають резистентність до карбапенемів, слід розглянути використання високоефективного препарату із групи гліцилциклінів – тайгецикліну (Тигацил). Практичною цінністю препарату є те, що він зберігає свою активність проти багатьох карбапенем-, ванкоміцин-резистентних збудників та бактерій, які продукують БЛРС, а також проти полірезистентних патогенів. У разі тяжких внутрішньолікарняних інфекцій тайгециклін є одним із небагатьох варіантів для успішної терапії.
Тигацил доступний лише для внутрішньовенного застосування. Стандартним режимом для дорослих є навантажувальна доза 100 мг, потім – по 50 мг кожні 12 год. Тигацил може використовуватись у вигляді як комплексної, так і монотерапії.
Висновки
- На сьогодні основним підходом у лікуванні інфекцій є деескалаційний метод антибіотикотерапії. Він дозволяє уникнути необґрунтовано тривалої антибіотикотерапії, розвитку антибіотикорезистентності та високої летальності.
- Найкращим вибором для стартової емпіричної терапії є призначення карбапенемів. Меронем виявляє більш високу клінічну та бактеріологічну ефективність, а також меншу частоту значущих побічних ефектів порівняно з іміпенемом та ертапенемом.
- У разі тяжких інфекцій в акушерстві оптимальним буде застосування комбінації (грунтуючись на даних чутливості) карбапенем (Меронем) + кліндаміцин (Далацин) + флуконазол (Дифлюкан).
- У разі інфікування полірезистентними збудниками, що продукують БЛРС та мають резистентність до карбапенемів, високу ефективність показав препарат тайгециклін (Тигацил).
 Актуальну тему «Принципи раціональної антибіотикотерапії полірезистентних інфекцій» висвітлив у своїй доповіді директор Українського медичного центру інтенсивної терапії сепсису, кандидат медичних наук Леонід Аполлонович Харченко.
Актуальну тему «Принципи раціональної антибіотикотерапії полірезистентних інфекцій» висвітлив у своїй доповіді директор Українського медичного центру інтенсивної терапії сепсису, кандидат медичних наук Леонід Аполлонович Харченко.
Доповідач зазначив, що з моменту початку ери антибіотиків лікарі дедалі менше стали стикатись із сепсисом. Однак ті нечасті випадки сепсису є доволі складними в лікуванні, адже разом із доступністю антибіотиків гостро встала проблема антибіотикорезистентності.
Сепсис – це документально підтверджена або передбачувана інфекція із системними клінічними проявами, до яких відносяться:
- гіпертермія (температура >38 °C або <36 °C);
- лейкоцитоз (рівень лейкоцитів у крові >12×109 або <4×109);
- тахікардія (частота пульсу >90/хв);
- тахіпноє (частота дихання >20/хв або PаCO2 <32 мм рт. ст.)
У 2016 році були запропоновані нові критерії сепсису, що відображені у шкалах SOFA та Quick SOFA. Використання даних шкал включає в себе оцінку ефективності зовнішнього дихання, гемокоагуляції, функціонування системи кровообігу, рівня білірубіну, креатиніну та добового діурезу, а також оцінку свідомості за шкалою коми Глазго. Ці шкали дають можливість лікарю оцінити вірогідність розвитку у хворого дисфункції внутрішніх органів й оперативно вирішити питання про ургентне переведення його у відділення інтенсивної терапії. Так, показник ≥2 балів за шкалою SOFA асоціюється з вираженими несприятливими наслідками – підвищенням летальності >10%.
Л.А. Харченко акцентував увагу колег на тому, що тяжкий сепсис призводить до поліорганної недостатності й супроводжується гострою дихальною, нирковою, наднирниковою недостатністю, коагуляційними порушеннями та мозковою комою. За наявності тяжких гемодинамічних порушень та при падінні систолічного артеріального тиску (САТ <90 мм рт. ст.) слід говорити про септичний шок.
Для покращення прогнозу при лікуванні сепсису найважливішу роль відіграють наступні заходи:
- рання діагностика інфекції;
- хірургічне дренування;
- раціональна антибіотикотерапія.
При надходженні пацієнта із сепсисом або підозрою на сепсис у стаціонар упродовж першої години має бути проведений певний комплекс заходів відповідно до принципів Surviving Sepsis Campaign, що передбачає:
- визначення концентрації лактату в крові;
- проведення забору крові для мікробіологічного дослідження (перед призначенням антибіотикотерапії);
- застосування антибіотиків широкого спектра дії;
- початок швидкої інфузії розчину кристалоїдів – 30 мл/кг;
- при гіпотонії та відсутності реакції на інтенсивну початкову інфузійну терапію – призначення судинозвужуючих лікарських засобів для підтримання середнього артеріального тиску на рівні ≥65 мм рт. ст. (Levy M.M., Evans L.E. et al., 2018).
Доповідач зауважив, що, призначаючи емпіричну антибіотикотерапію, слід пам’ятати про чотири основні групи мікроорганізмів:
- грампозитивні;
- грамнегативні;
- анаероби;
- метицилін-резистентна флора (особливо MRSA).
Крім того, при виборі антибіотика потрібно враховувати чутливість збудників у кожному конкретному регіоні та клінічному відділенні. Із цією метою рекомендовано впроваджувати мікробіологічний паспорт відділення. Перспективним напрямком може бути створення регіональних рекомендацій емпіричної антибіотикотерапії на підставі мікробіологічного паспорта відділення або лікарні. Антибактеріальний режим слід переоцінити через 48-72 год від початку емпіричної терапії.
Окремо автор доповіді зупинився на питанні: чи має діагностичну цінність при виявленні сепсису рівень прокальцитоніну крові?
Прокальцитонін – це попередник кальцитоніну, що продукується у С-клітинах щитоподібної залози. Підвищення цього показника відбувається при невірусних інфекціях. При діагностичному рівні прокальцитоніну 1,1 нт/мл (cut-off) чутливість даного показника складає 97%, а специфічність – 78% (Harbarth S. et al., 2001).
Клінічна інтерпретація результатів рівня прокальцитоніну представлена у табл. 2.
 Доповідач зауважив, що після проведення гемокультивування бувають випадки отримання негативних результатів посіву у пацієнтів із сепсисом. Причини цього можуть бути наступні:
Доповідач зауважив, що після проведення гемокультивування бувають випадки отримання негативних результатів посіву у пацієнтів із сепсисом. Причини цього можуть бути наступні:
- локальна інфекція (захисні сили організму утримують інфекцію в одному місці);
- неправильний час взяття матеріалу (значно посилює вірогідність пропустити інтермітуючу бактеріємію);
- значно малий об’єм отриманого матеріалу (часта помилка);
- взяття матеріалу на фоні самостійного прийому хворим антибіотиків (досить поширена причина).
Наступним етапом після отримання позитивної гемокультури є визначення мікробіологічної чутливості до антибіотиків. Зробити це можна декількома методами – антибіотикограма за «методом дисків», Etest або за допомогою мікробіологічного автомату. Після отримання результатів антибіотикограми слід дотримуватися деескалаційного методу використання антибіотиків.
Стартова емпірична антибіотикотерапія сепсису має розпочинатись не пізніше першої години від моменту надходження пацієнта до стаціонару, і перевагу слід віддавати препаратам широкого спектра дії на всі ймовірні збудники інфекції. У всіх пацієнтів перша доза кожного антибіотика має відповідати повній терапевтичній дозі. Через 48-72 год проводиться коригування антибіотикотерапії з урахуванням результатів антибіотикограми.
Л.А.Харченко зауважив, що у світі зберігається глобальне зростання інфекцій, спричинених MRSA. Так, частота останніх у різних країнах складає (Diekema D.J. et al., 2001): Італія – 50%, Греція – 34%, Велика Британія – 27%, Франція – 21%, Іспанія – 19%, США – 34%
До антибіотиків, що застосовуються для лікування сепсису у відділенні інтенсивної терапії та діють на MRSA-збудники, відносяться: ванкоміцин, тейкопланін, лінезолід. Препарати, що діють на грампозитивну анаеробну інфекцію: лінезолід, дорипенем, кліндаміцин, орнідазол.
Препарат лінезолід (Зивокс) активний щодо MRSA-інфекції, грампозитивних аеробних та анаеробних мікроорганізмів, але при цьому він не чинить нефротоксичну дію, на відміну від ванкоміцину та тейкопланіну. Фармакокінетика лінезоліду не змінюється в пацієнтів із будь-яким ступенем ниркової недостатності й не потребує коригування дози, однак кожен окремий випадок слід оцінювати індивідуально.
Механізм дії Зивоксу відрізняється від такого антибіотиків інших класів. Дослідження клінічних штамів (метицилін-резистентних стафілококів, ванкоміцин-резистентних ентерококів, а також пеніцилін- і еритроміцин-резистентних стрептококів) іn vitro показують, що лінезолід зазвичай активний відносно мікроорганізмів, стійких до одного або декількох інших класів антимікробних агентів. Стійкість до лінезоліду пов’язана з точковими мутаціями у 23S рРНК.
Застосовувати Зивокс слід у дорослих та дітей від 12 років по 600 мг 2 рази на добу (кожні 12 год) у вигляді таблеток або внутрішньовенних інфузій. При неускладнених інфекціях шкіри та її структур у дорослих Зивокс застосовується в дозі 400 мг кожні 12 год перорально. Тривалість лікування залежить від клінічного стану пацієнта, але не має перевищувати 28 діб.
У випадках анаеробних інфекцій препаратом першого вибору вважається кліндаміцин (Далацин Ц). При аеробних інфекціях за наявності чутливості кліндаміцин є альтернативою, якщо інші антимікробні препарати не діють або протипоказані. Далацин Ц у вигляді інфузій слід використовувати для лікування тяжких бактеріальних інфекцій, у тому числі септичних станів, спричинених чутливими до кліндаміцину збудниками.
Добова доза Далацину Ц при пероральному застосуванні в дорослих та дітей від 14 років становить 600-1800 мг кліндаміцину, розподілених на 3-4 прийоми. Капсули запивають достатньою кількістю води.
Пацієнти з порушеннями функції нирок та печінки не потребують коригування дози, оскільки виведення кліндаміцину становить близько 2/3 із фекаліями та 1/3 із сечею. Решта виводиться у вигляді біологічно неактивних метаболітів, що не впливають на функціональний стан організму.
Висновки
- У першу годину після надходження пацієнта із сепсисом до стаціонару необхідно виконати забір крові для посіву й розпочати інфузійну та емпіричну антибіотикотерапію.
- Після отримання гемокультури слід перейти до наступного етапу деескалаційної терапії – призначення антибіотика згідно з отриманою антибіотикограмою.
- Зивокс активний щодо MRSA-інфекції, грампозитивних аеробних та анаеробних мікроорганізмів за наявних даних чутливості, але при цьому він не чинить нефротоксичної дії.
- У випадку анаеробних інфекцій за наявної чутливості препаратом першого вибору вважається Далацин Ц.
Підготувала Іванна Садівська
Публікується за підтримки представництва
«Пфайзер Експорт Бі Ві».
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 4 (38), грудень 2019 р.