18 березня, 2020
IMpower110: монотерапія атезолізумабом покращує загальну виживаність хворих на недрібноклітинний рак легені IV стадії з високою експресією PD-L1
З 27 вересня по 1 жовтня 2019 року у м. Барселона (Іспанія) проходив Конгрес Європейського товариства медичної онкології (ESMO). Це масштабний щорічний форум, під час якого клініцисти, дослідники, представники фармацевтичної індустрії та організацій пацієнтів з усього світу традиційно обговорюють останні наукові досягнення у галузі діагностики та лікування злоякісних новоутворень та можливості їх якнайшвидшого впровадження в клінічну практику. Цього року істотна кількість виступів і поданих резюме наукових робіт була присвячена різноманітним аспектам лікування такого поширеного онкологічного захворювання, як рак легені. Зокрема, увагу вчених і клініцистів привернули результати проміжного аналізу показників загальної виживаності (ЗВ) пацієнтів з недрібноклітинним раком легені (НДРЛ), які були отримані у дослідженні IMpower110 та вперше представлені під час цього конгресу міжнародною групою дослідників (D. Spigel et al. IMpower110: Interim OS Analysis of a Phase III Study of Atezolizumab (atezo) vs Platinum-Based Chemotherapy (chemo) as 1L Treatment (tx) in PD‑L1-selected NSCLC ESMO 2019. Abstract and oral #LBA78).
Сьогодні інгібітори ліганду білка запрограмованої клітинної смерті‑1 (PD-L1) у режимі монотерапії або в комбінації з двокомпонентною хіміотерапією на основі препаратів платини (± бевацизумаб) застосовуються у першій лінії лікування при НДРЛ. При цьому одним із факторів вибору препаратів є визначення експресії PD-L1. Для пацієнтів, яким з певних причин не може бути проведена комбінована терапія, монотерапія інгібіторами PD-L1 залишається одним із варіантів лікування. У дослідженні IMpower110 оцінено застосування атезолізумабу у першій лінії терапії при позитвному статусі експресії PD-L1 незалежно від гістологічного типу пухлини.
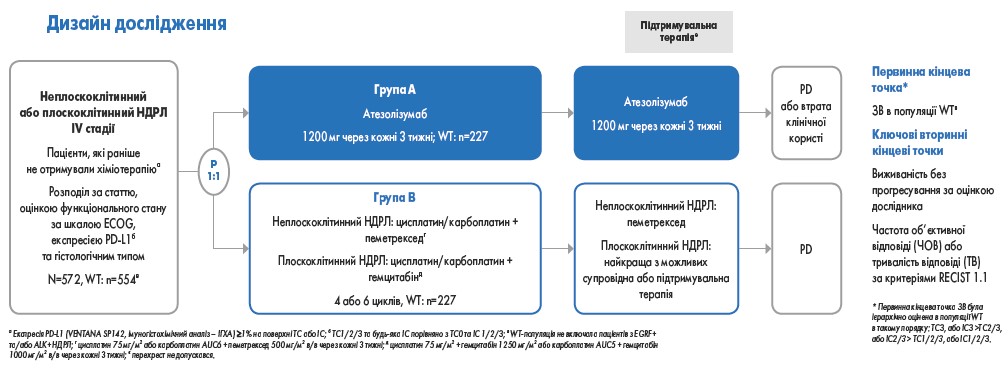
У дослідження IMpower110 було включено 572 пацієнти, які раніше не отримували хіміотерапію та мали IV стадію неплоскоклітинного або плоскоклітинного НДРЛ з експресією PD-L1 на клітинах пухлини (tumor cell, ТС) або на імунних клітинах, що інфільтрують пухлину (immune cell, ІС), вимірювані прояви захворювання згідно з Критеріями оцінки відповіді при солідних пухлинах (RECIST 1.1) та з оцінкою 0-1 загального функціонального стану онкологічного хворого за шкалою ECOG.
Пацієнти були рандомізовані у співвідношенні 1:1 для отримання атезолізумабу в дозі 1200 мг внутрішньовенно (в/в) через кожні 3 тижні (група A) або проведення хіміотерапії на основі препарату платини (група B; 4 або 6 циклів тривалістю 21 день кожен). У групі B пацієнти з неплоскоклітинним НДРЛ отримували цисплатин у дозі 75 мг/м2 площі поверхні тіла або карбоплатин AUC6 + пеметрексед 500 мг/м2 в/в через кожні 3 тижні. Пацієнтам з плоскоклітинним НДРЛ у групі B вводили цисплатин у дозі 75 мг/м2 + гемцитабін у дозі 1250 мг/м2 або карбоплатин AUC5 + гемцитабін 1000 мг/м2 в/в через кожні 3 тижні. Факторами стратифікації були стать, загальний функціональний статус за шкалою ECOG, гістологічна картина та PD-L1-статус. Первинна кінцева точка – ЗВ – представлена 3 показниками: медіаною ЗВ, 6- та 12-місячною ЗВ. Вона оцінювалася у пацієнтів з відсутністю мутацій у генах EGFR/ALK («дикий» тип, WT), розділених на такі підгрупи залежно від рівня експресії PD‑L1 на поверхні ТС або ІС: TC3 або IC3 (високий рівень експресії), потім – TC2/3 або IC2/3 (середній і високий рівень експресії), потім – TC1/2/3 або IC1/2/3 (будь-який рівень експресії).
Відповідно, три популяції первинної оцінки ефективності лікування включали:
- 554 пацієнти з TC1/2/3 або IC1/2/3 WT;
- 328 пацієнтів з TC2/3 або IC2/3 W;
- 205 пацієнтів з TC3 або IC3 WT.
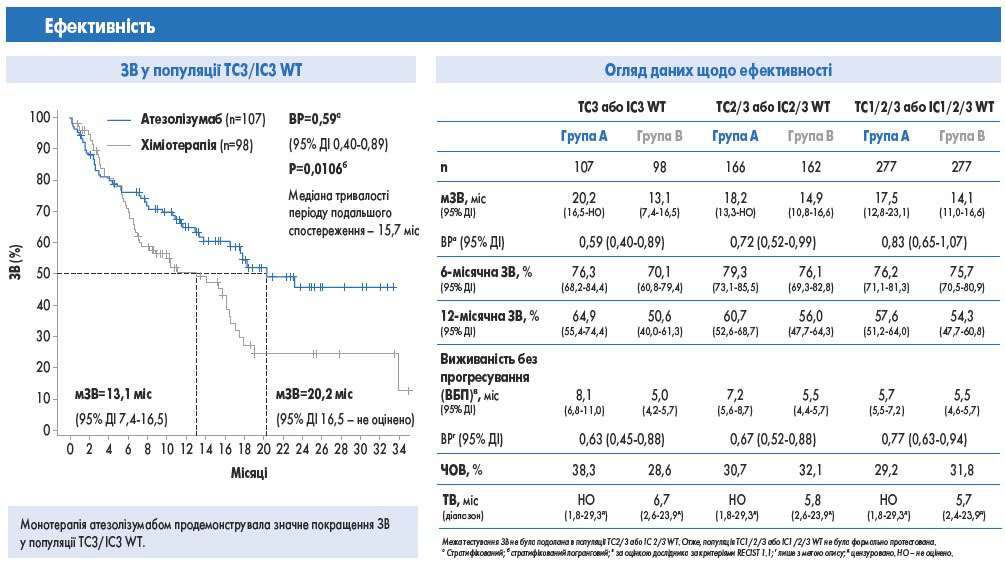
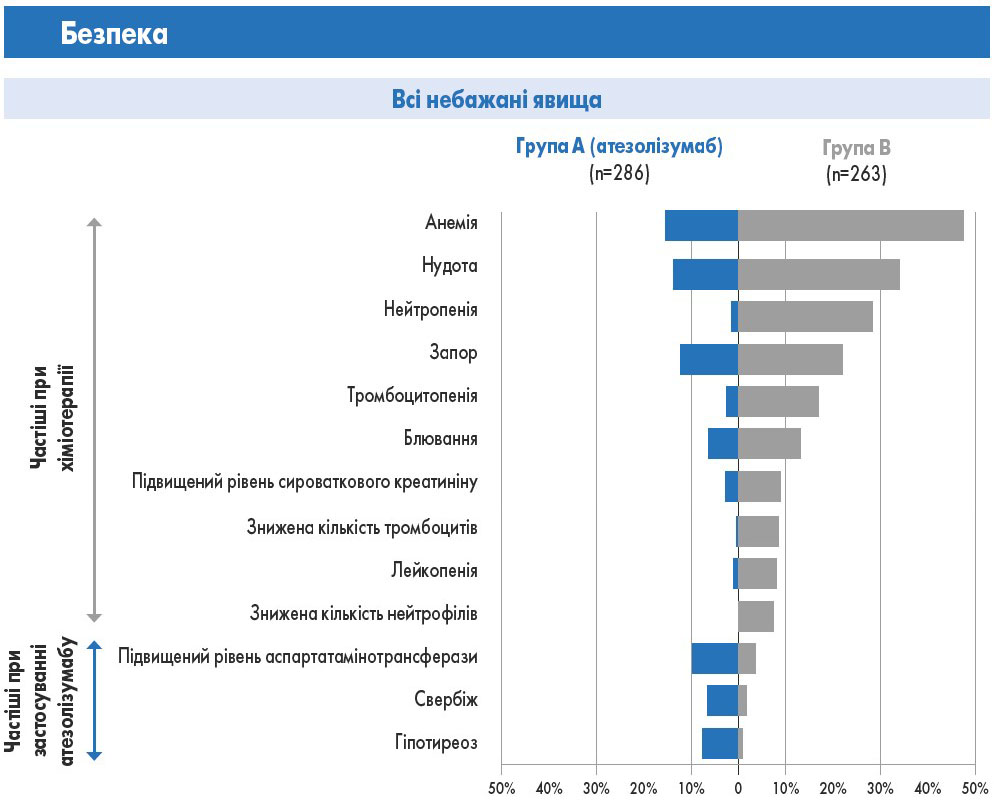
У популяції TC3 або IC3 WT монотерапія атезолізумабом сприяла достовірному збільшенню медіани ЗВ на 7,1 міс (відносний ризик – ВР – 0,595; P=0,0106) порівняно з хіміотерапією; медіана періоду спостереження складала 15,7 міс. Пов’язані з лікуванням небажані явища оцінювали та порівнювали у 286 пацієнтів групи A та 263 пацієнтів групи B. Пов’язані з лікуванням небажані явища (ПЛНЯ), зокрема ПЛНЯ 3-4 ступеня, були зареєстровані у 60,5 (група A), 85,2 (група B), 12,9 (група A) та 44,1% (група B) пацієнтів відповідно.
! Таким чином, при проведенні цього проміжного аналізу результатів дослідження Impower110 було констатовано досягнення первинної кінцевої точки ЗВ зі статистично достовірним і клінічно значущим її покращенням у популяції з високим рівнем експресії PD-L1 (TC3 або IC3 WT).
Spigel D et al. IMpower110: Interim overall survival (OS) analysis of a phase III study of Atezolizumab (Atezo) vs platinum-based chemotherapy (Chemo) as first-line (1L) treatment (TX) in PD-L1-selected NSCLC. ESMO.2019 (Abstract LBA78).
Підготувала Олена Зотова
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 5 (61), 2019 р.