25 березня, 2020
Новітні підходи в лікуванні остеоартриту: сучасний стан проблеми
 Наприкінці 2019 р. у Києві відбулася масштабна подія у сфері ревматології – науково-практична конференція «Ревматологічні хвороби – сучасні проблеми лікування та забезпечення моніторингу». В межах заходу були розглянуті питання коморбідності у ревматології, методологічні аспекти встановлення діагнозу та формування прогнозу, концепції лікування запальних захворювань суглобів, біологічної та імуномодулюючої терапії. Тему сучасного підходу в терапії остеоартриту (ОА) висвітлив завідувач кафедри внутрішньої медицини № 3 Національного медичного університету імені О.О. Богомольця (м. Київ), д. мед. н., професор Олег Борисович Яременко.
Наприкінці 2019 р. у Києві відбулася масштабна подія у сфері ревматології – науково-практична конференція «Ревматологічні хвороби – сучасні проблеми лікування та забезпечення моніторингу». В межах заходу були розглянуті питання коморбідності у ревматології, методологічні аспекти встановлення діагнозу та формування прогнозу, концепції лікування запальних захворювань суглобів, біологічної та імуномодулюючої терапії. Тему сучасного підходу в терапії остеоартриту (ОА) висвітлив завідувач кафедри внутрішньої медицини № 3 Національного медичного університету імені О.О. Богомольця (м. Київ), д. мед. н., професор Олег Борисович Яременко.
На початку лекції професор наголосив, що, згідно з даними Всесвітньої організації охорони здоров’я, понад 50% усіх лікарських засобів призначають та відпускають неналежним чином. Зокрема, має місце надмірне використання ін’єкцій, коли більш доречно приймати ліки перорально. Це свідчить про те, що міф, ніби ін’єкційне введення ліків є дієвішим за таблетки, поширений не лише в Україні.
Внаслідок укорінення даної інформації у свідомості пацієнтів, останні змушені перебувати у стаціонарах лікарень тоді, коли цього можна уникнути. Своєю чергою це не лише створює певні економічні та соціальні незручності для хворого, але й суттєво збільшує фінансове навантаження на державу.
Яскравим прикладом недоцільного призначення ін’єкційних форм препаратів є використання внутрішньом'язового введення диклофенаку. Відомо, що диклофенак спричиняє пошкодження органів опосередковано за рахунок пригнічення циклооксигенази або активації метаболітів, що викликають клітинний стрес, специфічні імунні реакції та погіршують мітохондріальні функції. Це призводить до формування шлунково-кишкових ерозій та кровотеч, ураження ниркових канальців.
Однак безпосередня травматизація тканин після внутрішньом’язової ін’єкції диклофенаку зумовлена його прямою цитотоксичністю на м’язову тканину. Це пов’язано з активацією каспаз (ферментів, що розщеплюють білок при апоптозі, некрозі тощо), що призводить до руйнації ДНК та деградації клітин.
Локальна токсичність диклофенаку може бути опосередкована рН залежною розчинністю препарату. Частинки диклофенаку осідають у місці ін’єкції навіть після незначного зниження рН, викликаного місцевим ущільненням тканин, нерівновагою іонів або запальними змінами, що призводить до тривалішого впливу на уражену ділянку та подовження місцевої токсичності. Як було продемонстровано в нещодавньо опублікованому дослідженні, після внутрішньом’язового введення диклофенаку рівень креатинкінази (маркер пошкодження м’язової тканини) у крові підвищувався у 8 разів вже через вісім годин після введення препарату та повернувся до норми лише через шість тижнів. Незважаючи на пошкодження тканин, підтверджене на магнітно-резонансній томографії, не було скарг на біль у місці ін’єкції, що пов’язано з місцевоанестезуючою дією диклофенаку (Probst et al., 2017).
Чи існує гідна за ефективністю та безпечніша альтернатива у сфері знеболення? Відповідно до даних кокранівського огляду, в якому було проаналізовано 350 досліджень за участю 45 тис. пацієнтів, 46 знеболювальних препаратів та їхніх комбінацій, за силою аналгетичної активності першу позицію посів еторикоксиб, що конкурував лише з наркотичними анальгетиками. Це зумовлено тим, що терапевтично значуща концентрація препарату в крові підвищується вже через 24 хвилини (встановлено для дози 120 мг) після приймання та досить швидко досягає пікових концентрацій як у тканинному ексудаті, так і в цереброспінальній рідині.
Згідно з результатами дослідження, у пацієнтів з ОА колінних суглобів еторикоксиб значно зменшував периферичну та центральну сенситизацію, а також зводив до мінімуму ефект часової сумації болю. Застосування препарату супроводжувалося поліпшенням клінічних показників, причому виразніший позитивний вплив спостерігався у хворих із високими ознаками центральної сенситизації (Arendt-Nieisen et al., 2016).
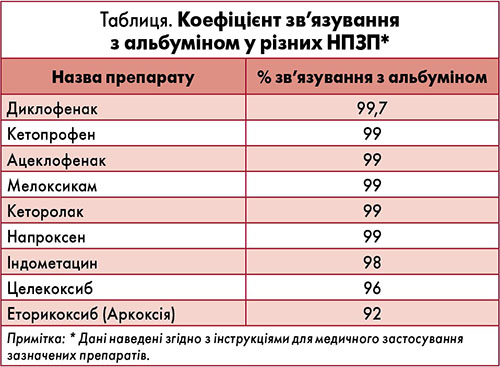
Порівняно з іншими нестероїдними протизапальними препаратами (НПЗП), еторикоксиб володіє найбільшим відсотком проходження через гематоенцефалічний бар’єр, адже має найменший коефіцієнт зв’язування з альбуміном (таблиця).
Тому ще один механізм дії еторикоксибу полягає у його здатності селективно інгібувати експресію та накопичення циклооксигенази‑2 (ЦОГ‑2) в іпсілатеральних нейронах спинного мозку. Це сприяє зменшенню запалення та пригніченню виразного больового синдрому, одним із компонентів якого є периферична сенситизація (Samad at al., 2001).
На українському фармацевтичному ринку молекула еторикоксибу представлена у вигляді препарату Аркоксія®. Препарат є представником селективних інгібіторів ізоформ ЦОГ‑2, яка утворюється виключно у вогнищі запалення. Аркоксія® виявляє найбільшу селективність щодо ЦОГ‑2 серед НПЗП, що зумовлює не лише виразну знеболювальну, протизапальну та жарознижувальну дію, але й значно знижує ризик виникнення побічних ефектів із боку травної системи за рахунок відсутності інгібувального впливу на синтез захисних простагландинів шлунка.
Висновки
1. Актуальною на сьогодні проблемою є надмірне використання ін’єкцій, коли існує нагода приймати ліки перорально. Приклад нераціонального способу введення ліків – внутрішньом’язові ін’єкції диклофенаку.
2. Існують дані, які свідчать про пряму цитотоксичну дію ін’єкцій диклофенаку на м’язові клітини, що може маскуватися його місцевоанестезуючою дією.
3. Альтернативою ін’єкціям є НПЗП із виразною аналгезивною дією. Одним із таких кандидатів можна вважати еторикоксиб.
4. До переваг еторикоксибу відносять:
- швидкий початок дії (через 24 хв, для дози 120 мг);
- тривалий ефект (24 години);
- проникнення через гематоенцефалічний бар’єр за рахунок найменшого відсотка зв’язування з альбуміном;
- доведений вплив на центральний та периферичний механізм суглобового болю;
- високий профіль безпеки стосовно шлунково-кишкового тракту.
5. Еторикоксиб доступний у зручних дозуваннях (60, 90 та 120 мг), що дає можливість підібрати дозу індивідуально для кожного пацієнта з огляду на інтенсивність больового синдрому та типу патології. Препарат застосовується один раз на добу й не потребує корекції дозування для літніх хворих та осіб зі ШКФ >30 мл/хв.
Довідка «ЗУ»
Серед випробувань останнього часу із НПЗП цікавими є дані про можливості їхнього впливу на метаболізм хряща при ОА. Так, у дослідженні, проведеному Wen еt al. та опублікованому в Eur J Pain (2020; 24: 209-222; https://doi.org/10.1002/ejp.1478), вивчали вплив еторикоксибу на розвиток ОА та супутні зміни в ноцицептивній поведінці (у лабораторних тварин). Для підтвердження даної інформації було проведено експеримент на щурах, в яких ОА моделювався шляхом резекції передньої хрестоподібної зв’язки (ACLT) правого колінного суглоба.
Тварин було випадковим чином розподілено на шість груп:
- 1-ша група: не піддавалися операції чи лікуванню;
- 2-га група: проведено артротомію без ACLT із застосуванням 0,1 мл фізіологічного розчину перорально;
- 3-тя група: виконано ACLT із використанням 0,1 мл фізіологічного розчину перорально;
- 4-та група: проведено ACLT, застосування 6,7 мг/кг еторикоксибу шляхом перорального прийому тричі на тиждень протягом 12 тижнів поспіль, починаючи з 8-го тижня після операції;
- 5-та група: терапія аналогічна 4-й групі за винятком того, що доза еторикоксибу становила 33,3 мг/кг;
- 6-та група: застосування еторикоксибу по 33,3 мг/кг для перевірки переносимості.
У процесі дослідження оцінювали якість больових поведінкових тестів до операції та через кожні три тижні до 21-го тижня після неї. Вимірювали вторинну механічну алодинію, рівень розподілу ваги між задніми лапами та зміну ширини колінного суглоба. Також був використаний імуногістохімічний аналіз з метою вивчення впливу еторикоксибу на експресію TGF-β1 та фактор росту нейронів (NGF) у хондроцитах суглобового хряща. TGF-β1 – трансформуючий фактор росту, що індукує вироблення тканинного інгібітора матричної металопротеїнази (MMPs). Він знижує експресію та секрецію колагеназ, які здатні руйнувати хрящову тканину.
NGF – це білок, який сприяє росту аксона, активації периферичних нейронів та пов’язаний із виникненням сенситизації. У пацієнтів із запальними або дегенеративними ревматичними захворюваннями, зокрема ОА, ревматоїдним артритом та спондилоартритом, у синовіальній рідині уражених суглобів виявляють підвищений рівень NGF. NGF надмірно виражений на остеохондральному стику в пацієнтів з ОА, що призводить до неорганізованої іннервації раніше аневрального хряща та периферичної сенситизації.
За результатами описаного вище дослідження було показано, що на тлі лікування етирококсибом значно знижувався рівень NGF та підвищувався – TGF-β1-позитивних клітин у колінному хрящі в групах з експериментальним остеоартритом (АСLT). При оцінюванні вторинної механічної алодинії зусилля, необхідне для відсмикування задньої лапи у групі АСLT із застосуванням еторикоксибу, було значно вищим порівняно з групою АСLT без лікування через 12, 15, 18 та 21 тиждень після операції. Розподіл ваги опору правої лапи у всіх досліджуваних тварин протягом спостереження значно не відрізнявся, однак кращі результати спостерігались у групах, де використовували еторикоксиб.
При оцінці зміни ширини колінного суглоба у тварин зі змодельованим ОА було відмічено, що у групах із застосуванням еторикоксибу в дозах 6,7 та 33,3 мг/кг ширина суглоба була вдвічі меншою порівняно із групою ACLT без еторикоксибу, причому ця різниця збільшувалася з часом (від 12-го до 21-го тижнів). Відповідно до гістопатологічного аналізу хряща колінного суглоба щурів, зразки груп із використанням еторикоксибу по 6,7 мг/кг показали легкі нерівності поверхневого шару, фібриляцію, тріщини в поверхневому шарі хряща та незначну дифузну гіперклітинність у передній та радіальній зонах. Натомість, у тварин, яким не давали препарат (ACLT без еторикоксибу), виявляли значне пошкодження хрящової поверхні (зменшення товщини хряща, зникнення клітин поверхневого шару, тріщини, що поширюються на перехідну та променеву зони, і гіпоцелюлярність хондроцитів у перехідній та променевій зонах).
Таким чином, у результаті проведеного дослідження було встановлено, що:
- у групах з експериментальним ОА, в яких застосовували еторикоксиб, спостерігався значно нижчий ступінь дегенерації хряща, ніж при отриманні плацебо;
- дослідження ноцицептивної поведінки показало значне покращення у групах з ACLT + еторикоксиб порівняно з лише ACLT;
- еторикоксиб послаблював експресію NGF та збільшував експресію TGF-β1 у хрящі, ураженому ОА.
Дослідники дійшли висновків, що пероральний прийом еторикоксибу на моделі ACLT:
- послаблював розвиток ОА;
- знижував ноцицепцію;
- модулював метаболізм хондроцитів, пригнічуючи експресію NGF та збільшуючи експресію TGF-β1.
З огляду на отримані дані можна говорити про новий механізм знеболювальної дії еторикоксибу та його хондропротекторні властивості.
Підготувала Іванна Лемкалович
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 1 (68), 2020 р.