29 вересня, 2016
Неотложные сердечно-сосудистые состояния: мультидисциплинарный подход

16-17 июня в г. Киеве состоялась научно-практическая конференция Ассоциации по неотложной кардиологии «Неотложные сердечно-сосудистые состояния: мультидисциплинарный подход» с участием ведущих специалистов из разных областей Украины.
В ходе мероприятия были рассмотрены важные практические вопросы ведения пациентов с острыми состояниями в кардиологии, при этом в обсуждение были максимально вовлечены участники конференции. Организаторы отвели большую часть времени разборам клинических случаев и мастер-классам по отдельным проблемам неотложной кардиологии – острому коронарному синдрому (ОКС), аритмиям с остановкой кровообращения, дифференциальной диагностике боли в груди.
 Член-корреспондент НАМН Украины, руководитель отдела реанимации и интенсивной терапии ГУ ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины, доктор медицинских наук, профессор Александр Николаевич Пархоменко в программной лекции «Новости неотложной кардиологии» прокомментировал последние тенденции в направлении оптимизации ведения пациентов с ОКС.
Член-корреспондент НАМН Украины, руководитель отдела реанимации и интенсивной терапии ГУ ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины, доктор медицинских наук, профессор Александр Николаевич Пархоменко в программной лекции «Новости неотложной кардиологии» прокомментировал последние тенденции в направлении оптимизации ведения пациентов с ОКС.
– За последние два десятилетия мы пережили настоящий бум исследований, которые касались антитромботической терапии при ОКС и реперфузионных стратегий у пациентов с острым инфарктом миокарда (ОИМ). На основании массива доказательной базы сформированы европейские и национальные стандарты ведения больных с ОКС, которыми мы сегодня руководствуемся. Сопоставляя результаты исследований с сегодняшней клинической практикой, мы можем выделить ряд дополнительных возможностей борьбы за улучшение исходов у пациентов с неотложными состояниями.
Одной из таких возможностей является оптимизация гиполипидемической терапии после ОКС с применением как статинов, так и новых липидснижающих препаратов. Так, результаты исследования IMPROVE-IT, доложенные на конгрессе Европейского общества кардиологов в 2015 г., подтверждают преимущества стратегии длительной комбинированной гиполипидемической терапии симвастатином и эзетимибом. Показано, в частности, что у пациентов с сахарным диабетом использование такого подхода позволяет снизить относительный риск развития ИМ на 24%, а ишемического инсульта – на 39%, что нельзя объяснить только липидснижающими эффектами препаратов.
В исследовании ODYSSEY было достигнуто выраженное (до 70 мг/дл) и стойкое снижение уровня холестерина липопротеинов низкой плотности (ХС ЛПНП) у больных, которые получали еженедельные подкожные инъекции алирокумаба – ингибитора белка PCSK9, участвующего в инактивации рецепторов к ЛПНП на поверхности клеток печени. Это важно для пациентов с ОКС, у которых в исследованиях с применением статинов доказан положительный эффект от дальнейшего снижения уровня ХС ЛПНП, даже при исходном нормальном уровне.
Терапия ингибиторами PCSK9 – дорогостоящая, но высокоэффективная и удобная – открывает новые перспективы в плане повышения эффективности гиполипидемической терапии и улучшения комплайенса. Кроме того, в США проводится первое исследование с препаратом некодирующих микро-РНК, который блокирует ген PCSK9 и вводится 1 раз в 6 мес.
Профессор А.Н. Пархоменко отметил, что одной из недооцененных проблем в лечении пациентов с ОКС является острая контраст-индуцированная нефропатия при выполнении катетерных вмешательств. По данным регистра (3093 пациента с разными формами ОКС), почечная дисфункция ухудшает прогноз в течение первого года после реваскуляризации, даже если процедура была успешной (Lin et al., 2014). Поэтому осуществляется поиск возможностей эффективной защиты почек перед ангиографией, и в этом отношении большой интерес представляют результаты исследования PRATO-ACS, в котором розувастатин в нагрузочной дозе 40 мг назначали до выполнения коронарографии и чрескожного коронарного вмешательства (ЧКВ) с переходом на дозу 20 мг/сут.
Это способствовало значимому снижению частоты случаев острого повреждения почек в последующие 3 суток после процедуры с 15,1 до 6,7%.
Исследования в области нефропротекции при выполнении ЧКВ проводятся не только со статинами. Так, достоверное уменьшение частоты нефропатии, определяемой по увеличению уровня креатинина после ЧКВ, отмечено также в исследовании с триметазидином (M. Shehata et al., 2015).
Механизм влияния транзиторной дисфункции почек на отдаленный прогноз пациентов с ОКС недостаточно изучен, но очевидно, что важную роль играют параллельные процессы, которые протекают и в почках, и в сердце. Например, система IL‑1 рецептор-ассоциированной киназы (IRACS-M) участвует в трансформации моноцитов и макрофагов из провоспалительных в репаративные, обеспечивая активацию восстановительных процессов и предотвращение фиброза, апоптоза и атрофии канальцев почек после их ишемии/реперфузии (M. Lech et al., 2014).
Похожий механизм действует и при заживлении зоны ИМ. Выдвинута гипотеза о том, что трансформация макрофагов из провоспалительных в репаративные лежит в основе эффектов терапии стволовыми клетками (T. Ben-Mordechai et al., 2013).
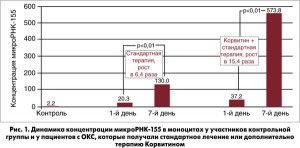
В исследовании, проведенном нами совместно со специалистами Института физиологии им. А.А. Богомольца НАМН Украины (А.Н. Пархоменко, В.Е. Досенко, А.А. Сопко и др., 2015), изучалось содержание некодирующих микроРНК в плазме крови, тромбоцитах и моноцитах у пациентов с ОИМ. Установлено, что к 7-м суткам после развития события, т.е. к моменту активации репаративных процессов, повышается концентрация микроРНК‑155 в плазме, тромбоцитах и моноцитах, но в большей степени – в моноцитах. МикроРНК участвует в управлении воспалительным ответом, процессом фиброза и в поддержании функции эндотелия. Определена обратная корреляционная связь между уровнем микроРНК‑155 в моноцитах на 7-е сутки после ОИМ и размерами полости левого желудочка (ЛЖ), а также прямая корреляционная связь между уровнем микроРНК‑155 на 7-е сутки после ОИМ и функцией почек, которую оценивали по скорости клубочковой фильтрации. Сегодня изучаются возможности фармакологической коррекции этих параллельных процессов. В уже упоминавшемся совместном исследовании показано 15-кратное увеличение концентрации микроРНК‑155 на фоне применения биофлавоноида кверцетина (украинский препарат Корвитин) дополнительно к стандартной терапии ИМ с элевацией сегмента ST, что ассоциировалось с меньшей дилатацией ЛЖ и лучшей функцией почек (А.Н. Пархоменко, В.Е. Досенко, Я.М. Лутай, А.А. Сопко и др., 2015) (рис. 1).
Следует отметить, что биофлавоноид кверцетин (Корвитин) обладает рядом уникальных свойств, которые реализуются в важные клинические эффекты у пациентов с ОИМ. В одном из исследований, проведенных в ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины показано улучшение результатов теста с эндотелийзависимой дилатацией плечевой артерии, повышение синтеза фактора роста сосудистого эндотелия (VEGF) и снижение уровня миелопероксидазы (маркер выраженной эндотелиальной дисфункции) на 7-е сутки после развития ИМ с элевацией сегмента ST на фоне терапии Корвитином по сравнению с контрольной группой (Я.М. Лутай, А.Н. Пархоменко и др., 2015) (рис. 2).

В настоящее время большое внимание уделяется развитию еще одного важного направления в лечении пациентов с ОКС – двойной антиагрегантной терапии (ДАТ). В 2014 г. было завершено международное исследование DAPT, которое проводилось с участием пациентов с ишемической болезнью сердца (ИБС), перенесших стентирование, из них 26% – с ОКС. В этом исследовании оценивали дополнительные преимущества продления ДАТ до 30 мес. Отмечалось достоверное снижение частоты тромбозов стентов и связанных с ними инфарктов, однако появилась тенденция к увеличению риска смерти. Ценой, которую пришлось заплатить за положительные эффекты продленной ДАТ, стало также увеличение частоты кровотечений. В связи с этим была разработана математическая модель для оценки риска развития ишемических и геморрагических событий на фоне ДАТ, результатом которой стало создание шкалы DAPT (табл.). Следует учитывать, что шкала DAPT используется у пациентов, которым было выполнено стентирование коронарных артерий.

Количество баллов <2 по этой шкале означает отсутствие пользы от продления ДАТ с увеличением риска кровотечений. У пациентов, набравших ≥2 баллов, отмечено отчетливое достоверное снижение частоты ИМ и тромбозов стента при меньшем риске кровотечений. Таким образом, на сегодняшний день существует возможность индивидуальной оценки соотношения риск/польза ДАТ, и мы должны использовать это в своей практике.
В области антитромбоцитарной терапии ОКС нас привлекает также возможность применения новых антиагрегантов. В исследовании PEGASUS терапия тикагрелором в дозе 90 или 60 мг дополнительно к ацетилсалициловой кислоте (АСК) у пациентов с ИМ в анамнезе по сравнению с плацебо достоверно снижала частоту наступления комбинированной конечной точки (сердечно-сосудистая смерть, ИМ или инсульт), но так же, как и в исследовании DAPT, одновременно наблюдалось увеличение риска кровотечений. Вместе с тем анализ по компонентам конечной точки продемонстрировал неожиданные результаты: доза тикагрелора 60 мг дважды в сутки оказалась не только безопаснее в отношении возникновения кровотечений, но по сравнению с дозой 90 мг в большей степени снижала смертность, хотя не влияла на риск развития ИМ (M.P. Bonaca et. al., 2016). Еще в одном из недавних субанализов исследования показано, что эффекты ДАТ с тикагрелором сохраняются у пациентов со сниженной функцией почек (G. Magnani et al., 2016). Что касается кровотечений, то риск их возникновения на фоне ДАТ с тикагрелором повышается, но при этом не увеличивается частота фатальных кровотечений и внутричерепных геморрагий. Очень важно отметить, что переход с клопидогреля на тикагрелор должен осуществляться в срок до 1 года, а идеально – до 30 дней после развития события. Как свидетельствует анализ исходов, назначение тикагрелора после годичного прерывания терапии не обеспечивает никакой пользы в профилактике повторных событий (M.P. Bonaca et al., 2015).
Что касается алгоритмов перехода с одного антитромбоцитарного препарата на другой, то в 2015 году вышла первая публикация с четкими рекомендациями по этому вопросу (F. Rollini et al., 2015). Авторы указывают, что если до госпитализации больной принимал клопидогрель, то в острой фазе ОКС его можно переводить на тикагрелор, назначая нагрузочную дозу 180 мг независимо от времени и дозы приема клопидогреля. В хронической фазе предлагается назначать тикагрелор в дозе 90 мг 2 раза в сутки через 24 ч после приема последней дозы клопидогреля.
Важно также знать, в какой момент можно отменять антиагреганты, если планируется операция, например аортокоронарное шунтирование (АКШ). По данным E.C. Hansson и соавт. (2015), у пациентов, получавших клопидогрель и тикагрелор, при отмене препаратов за 5 дней (120 ч) до вмешательства наблюдалось одинаковое количество геморрагических осложнений, а при сроках отмены за 3-5 дней до операции достоверно большая частота кровотечений отмечалась у больных, которые принимали клопидогрель, что объясняется более выраженным эффектом накопления. Если же антитромбоцитарная терапия отменялась в срок до 3 суток перед операцией, в обеих группах кровотечения возникали часто (до 30%) и никаких преимуществ одного препарата по отношению к другому не наблюдали.

Еще одно направление улучшения прогноза у пациентов с ИМ, которое обозначилось после получения убедительных результатов исследований REMINDER и EPHESUS, – это блокада эффектов альдостерона. В исследовании REMINDER ранняя (в течение 24 ч) терапия эплереноном при ОИМ с подъемом сегмента ST без СН приводила к достоверному снижению частоты достижения первичной конечной точки (время до первого события – смерть от сердечно-сосудистых причин, повторная госпитализация, устойчивая желудочковая тахикардия – ЖТ или фибрилляция, ФВ <40% или повышение уровня N-терминального фрагмента мозгового натрийуретического пептида – BNP/NT-proBNP) после месяца лечения.
Следует отметить, что в исследовании ALBATROSS 1600 пациентов с ИМ с элевацией или без элевации сегмента ST в первые 72 ч получали терапию блокаторами альдостерона: калия канреноат 200 мг внутривенно, затем спиронолактон по 25 мг/сут. В общей популяции исследования терапия не влияла на исходы, но очень интересные данные получены в субанализе у больных с ИМ с элевацией сегмента ST: выраженное и достоверное снижение смертности на 80% за 6 мес наблюдения. Эти данные открывают новые перспективы в применении блокаторов альдостерона при ОКС.
В текущем году появились новые данные относительно проблемы реперфузионного повреждения миокарда. D. Carrick и соавт. в исследовании с контрастной магнитно-резонансной томографией показали, что геморрагическая трансформация инфаркта после открытия коронарной артерии происходит в первые сутки у 20% больных, к 3-м суткам – у 43%. У пациентов с геморрагическим инфарктом наблюдалась дилатация ЛЖ с ухудшением его функции. В связи с этим один из авторов исследования, профессор Колин Берри поднимает вопрос о пересмотре агрессивной антитромботической терапии или сроков открытия коронарной артерии с ограничением до первых 4-6 ч.
Лектор сделал акцент на том, что стратегии, направленные на улучшение прогноза при развитии ОКС, особенно актуальны для пациентов с ОКС без подъема сегмента ST. Этим больным уделяется меньше внимания, однако мы должны понимать, что ОКС без элевации сегмента ST – крайне нестабильное состояние, которое ассоциируется с высокой смертностью. По данным международного регистра EPICOR, в котором изучались региональные особенности и предикторы однолетней смертности после выписки пациентов с перенесенным ОКС, смертность в странах Восточной Европы практически в 2 раза выше, чем в Северной Европе (S. Pocock et al., 2014). Это можно объяснить не только поздними госпитализациями в странах с менее развитой системой оказания помощи таким больным, но и большой долей пациентов с ОКС без элевации сегмента ST, у которых не верифицируется повреждение миокарда. Согласно данным регистра самый высокий риск смерти отмечается у пациентов с ОКС без элевации сегмента ST, которые получали только медикаментозное лечение, без выполнения коронарографии и реперфузионных вмешательств.
С целью оптимизации ведения пациентов с ОКС продолжается поиск маркеров раннего повреждения миокарда. Шведские исследователи изучают высокочувствительные тропониновые тесты, которые позволяют уже через 1 ч после появления симптомов отдифференцировать ОКС без элевации сегмента ST от ОИМ (Hamm et al., 2011). Однако внедрение такой технологии имеет смысл только при хорошо налаженной работе всей службы неотложной помощи при ОКС, и опыт Швеции в этом отношении пока что остается уникальным.
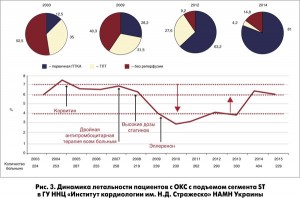
В ходе доклада были озвучены результаты анализа показателя летальности больных с ИМ с подъемом сегмента ST в ГУ ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины за последние несколько лет. Эти результаты свидетельствуют о том, что по мере внедрения новых средств фармакотерапии и увеличения частоты первичных интервенционных вмешательств показатели выживаемости пациентов улучшались (рис. 3). Однако после каждого периода снижения летальности наблюдается увеличение этого показателя, что можно объяснить поступлением более тяжелых пациентов (с кардиогенным шоком и другими осложнениями). Такая тенденция отмечается и в других странах: специализированные центры берут на себя оказание помощи тяжелым больным, и в результате летальность увеличивается, несмотря на высокое качество лечения.
В заключение профессор А.Н. Пархоменко напомнил о том, что в марте текущего года приказом Министерства здравоохранения Украины был утвержден Унифицированный клинический протокол оказания медицинской помощи пациентам с ОКС без элевации сегмента ST, а двумя годами ранее вступил в силу протокол по ведению пациентов с ОКС с элевацией сегмента ST. Таким образом, в Украине есть национальные стандарты для всех этапов оказания помощи при ОКС, которые разработаны с учетом международных рекомендаций.
 Академик НАМН Украины, ректор ГУ «Днепропетровская медицинская академия МЗ Украины» Георгий Викторович Дзяк в лекции «ХСН и внезапная смерть» напомнил причины и механизмы преждевременной смерти пациентов с ХСН, а также прокомментировал современные возможности ее профилактики в свете новых европейских рекомендаций (2016).
Академик НАМН Украины, ректор ГУ «Днепропетровская медицинская академия МЗ Украины» Георгий Викторович Дзяк в лекции «ХСН и внезапная смерть» напомнил причины и механизмы преждевременной смерти пациентов с ХСН, а также прокомментировал современные возможности ее профилактики в свете новых европейских рекомендаций (2016).
Оптимальная медикаментозная терапия (ОМТ) с применением бета-блокаторов, ингибиторов ангиотензинпревращающего фермента (ИАПФ), антагонистов минералокортикоидных рецепторов и диуретиков позволяет стабилизировать течение ХСН у многих пациентов и добиться продолжительности жизни 10 лет и более после постановки диагноза. Тем не менее даже при идеальном лечении смертность составляет около 10% в течение первого года, 22% – на протяжении второго года и 37% – в течение 5 лет.
В любой точке жизненного пути пациента с ХСН может наступить внезапная смерть. В исследовании ATLAS среди причин смерти пациентов с ХСН первую позицию заняла внезапная сердечная смерть (ВСС) – 42,5% у пациентов с ИБС и 42,8% у больных без ИБС. Собственно декомпенсация ХСН стала причиной смерти 32% пациентов, инфаркт миокарда – 8% у пациентов с ИБС и 4,2% у больных без ИБС.
По современному определению ВСС – это смерть, которая наступает в течение первых 1-6 ч после появления первых симптомов сердечного приступа. При сердечно-сосудистой патологии 50% случаев смерти приходятся на ВСС. 80% случаев ВСС связаны с ИБС, особенно в возрасте 40-50 лет. В Украине за период с 2005 по 2014 г. зарегистрировано 6602 случая остановки сердца и 5847 случаев ВСС. Успешная реанимация проведена только в 29 случаях.
ВСС можно предотвратить заранее, но шансы реанимировать человека при ее наступлении минимальны, поскольку большинство случаев ВСС происходят без свидетелей, ночью во сне или вне лечебных учреждений, где есть возможности реанимации.
В структуре причин и механизмов ВСС при ХСН первое место занимают фатальные аритмии – устойчивая ЖТ, фибрилляция желудочков (ФЖ) и полиморфная тахиаритмия по типу torsades de pointes. Среди других причин лектор назвал резкое уменьшение сердечного выброса, острую желудочковую насосную недостаточность и активацию вазопрессорных рефлексов.
Лектор перечислил группы пациентов с высоким риском ВСС:
– пациенты, которые ранее перенесли первичную ФЖ без связи с ОИМ;
– пациенты с ИБС, у которых возникают приступы ЖТ;
– пациенты в течение 6 мес после перенесенного ИМ, у которых регистрируются ранние или мультифокальные преждевременные желудочковые сокращения, особенно при тяжелой дисфункции ЛЖ;
– пациенты с увеличенным интервалом QT и частыми преждевременными сокращениями.
Учитывая, что в 1/3 случаев ВСС наступает без свидетелей и что вероятность реанимации невысока, в последние 20 лет больше внимания уделялось исследованиям по первичной профилактике ВСС.
Для профилактики аритмической ВСС решающее значение имеет своевременная диагностика аритмии, включая электрофизиологическое исследование (ЭФИ). Индукция устойчивой ЖТ достигается у 60-80% больных, успешно реанимированных после остановки сердца.
 Лектор подчеркнул, что ЭФИ при ХСН и аритмиях – это самый эффективный способ подбора антиаритмической терапии. Больным с индуцируемой ЖТ последовательно с интервалом 1-3 дня проводят повторную электростимуляцию на фоне приема антиаритмических препаратов.
Лектор подчеркнул, что ЭФИ при ХСН и аритмиях – это самый эффективный способ подбора антиаритмической терапии. Больным с индуцируемой ЖТ последовательно с интервалом 1-3 дня проводят повторную электростимуляцию на фоне приема антиаритмических препаратов.
Невозможность повторной индукции тахикардии является признаком эффективности выбранной терапии, хотя, по данным исследований, вероятность возникновения ЖТ при этом сохраняется на уровне 1,4-25% в год. Пациенты с индуцируемой ЖТ являются кандидатами на хирургическое лечение (абляцию аритмогенного субстрата) или имплантацию постоянного кардиовертера-дефибриллятора (ИКД).
По данным литературы, эффект от применения ИКД у пациентов с ФВ ЛЖ >35% сопоставим с эффективностью антиаритмической терапии, в то время как при ФВ ЛЖ ≤35% был значительно выше, чем на фоне лечения амиодароном.
В новых рекомендациях Европейского общества кардиологов по ведению пациентов с СН имплантация ИКД рекомендуется для вторичной профилактики ВСС и смерти от всех причин у пациентов, перенесших желудочковую аритмию, которая возникла вследствие гемодинамической нестабильности, чья ожидаемая продолжительность жизни составляет более 1 года (класс рекомендаций I, уровень доказательств А).
С целью первичной профилактики ИКД рекомендованы пациентам с симптомной СН (II-III функциональный класс – ФК по NYHA) и ФВ ≤35%, несмотря на оптимальную лекарственную терапию тремя и более препаратами, чья ожидаемая продолжительность жизни составляет более 1 года (класс рекомендаций IIa, уровень доказательств B).
Лектор также напомнил о противопоказаниях к установке ИКД. Согласно новым рекомендациям ЕОК (2016) ИКД не рекомендуются пациентам в течение первых 40 дней после ИМ, так как имплантация в этом случае не улучшает прогноз. Кроме того, ИКД не рекомендуются пациентам с IV ФК по NYHA и тяжелыми симптомами, рефрактерными к фармакотерапии, если они не являются кандидатами на ресинхронизирующую терапию (РСТ), установку устройства помощи желудочкам или трансплантацию сердца.
РСТ имеет самый высокий класс рекомендаций (I) и уровень доказательств (A) у пациентов с синусовым ритмом и симптомами СН, QRS ≥150 мс, блокадой левой ножки пучка Гиса и ФВ ≤35%, несмотря на оптимальную лекарственную терапию. Имплантация устройства РСТ в большей степени, чем электрокардиостимулятора, рекомендуется пациентам с СН со сниженной ФВ, независимо от ФК по NYHA, которые имеют показания к кардиостимуляции или высокую степень атриовентрикулярной блокады (класс рекомендаций I, уровень доказательств A). РСТ противопоказана пациентам с длительностью комплекса QRS <130 мс (класс рекомендаций III, уровень доказательств A).
Методом выбора для пациентов, которые не отвечают на РСТ, вне зависимости от длительности QRS, является имплантация модулятора миокардиальной сократимости (ММС).
В исследовании FIX-HF5 применение ММС по сравнению с ОМТ приводило к увеличению пикового потребления кислорода и порога анаэробного дыхания у симптомных пациентов с нормальной продолжительностью QRS, III ФК по NYHA и ФВ ЛЖ >25%.
К другим перспективным устройствам для профилактики ВСС и улучшения систолической функции при ХСН являются имплантируемые стимуляторы спинного мозга, каротидного синуса, блуждающего нерва. Принцип действия этих устройств – повышение тонуса парасимпатической системы и угнетение симпатического влияния на сердце и сосуды.
Таким образом, существующие методы профилактики ВСС у больных ХСН являются преимущественно аппаратными и дорогостоящими. Поэтому приоритетом современной кардиологии должна стать профилактика или отсрочка развития СН до ее клинических проявлений. Это достигается путем применения ОМТ у пациентов с бессимптомной дисфункцией ЛЖ (например, ИАПФ и β-адреноблокаторов – БАБ после ИМ), адекватного контроля артериальной гипертензии и других факторов риска, что отражено в европейских рекомендациях.
Воркшоп по проблеме острых коронарных синдромов провели А.М. Пархоменко, В.А. Шумаков, В.И. Целуйко, Б.И. Голобородько, В.К. Тащук. Каждый из модераторов предложил врачам в зале ответить на несколько вопросов с последующим разбором ответов.
 Cтарший научный сотрудник отдела реанимации и интенсивной терапии ННЦ «Институт кардиологии им. Н.Д. Стражеско» Ярослав Михайлович Лутай представил интересный клинический случай ОКС без поражения коронарных артерий.
Cтарший научный сотрудник отдела реанимации и интенсивной терапии ННЦ «Институт кардиологии им. Н.Д. Стражеско» Ярослав Михайлович Лутай представил интересный клинический случай ОКС без поражения коронарных артерий.
Пациентка П. 70 лет, поступила из поликлиники с жалобами на давящие боли за грудиной, сопровождающиеся выраженной одышкой, слабостью. На момент поступления артериальное давление (АД) 135/80 мм рт. ст.; частота сердечных сокращений (ЧСС) 84/мин; сатурация кислорода 93%. При аускультации не выявлено дополнительных тонов сердца, шумов и хрипов. Предыдущий диагноз (выписка за 2013 г.): ИБС: атеросклеротический кардиосклероз, атеросклероз аорты. Гипертоническая болезнь II ст., 2 ст., риск 3. Гипертрофия стенок ЛЖ. В анамнезе – перенесенная резекция желудка по поводу рака (2012 г.), частичная резекция щитовидной железы. В настоящее время принимает гормональную заместительную терапию, но доза длительное время не корректировалась.
Боли появились в течение последних 10-14 дней после стрессовой ситуации, носили прогрессирующий характер.
На ЭКГ при поступлении – отрицательные зубцы Т во всех переднегрудных отведениях без элевации сегмента ST.
В результатах лабораторных анализов обращало на себя внимание незначительное повышение МВ-фракции креатинфосфокиназы – КФК (26 Ед/л при норме до 24 Ед/л) и тропонина Т (0,19 при норме <0,1). Общий холестерин 5,7 ммоль/л.
Заключение ЭхоКГ: акинезия до дискинеза верхушки, передней стенки и межжелудочковой перегородки в апикальных отделах; ФВ 52%, митральная регургитация 2-3+; выраженная вторичная легочная гипертензия (градиент на трехстворчатом клапане 55 мм рт. ст.).
Пациентка была госпитализирована с диагнозом «ОКС без элевации сегмента ST», и в первые сутки ее вели по соответствующему алгоритму (рекомендации ЕОК 2015 г.)
Первый вопрос, который следует решить согласно этому алгоритму, – условия и сроки выполнения ангиографии и реваскуляризации. Пациентку отнесли к категории высокого риска, поскольку у нее наблюдались повышение уровня тропонина, изменения сегмента ST, и по шкале GRACE она набрала 143 балла. Пациентам высокого риска коронаровентрикулография (КВГ) должна быть выполнена в первые 24 ч, что и было сделано на следующее утро.
До процедуры были назначены АСК 160 мг однократно на догоспитальном этапе, затем постоянная доза 100 мг/сут, клопидогрель 300 мг (нагрузочная доза), затем по 75 мг/сут, фондапаринукс 2,5 мг/сут для профилактики тромбоэмболических осложнений; гиполипидемическая терапия – розувастатин 20 мг/сут; антиангинальная терапия: периндоприл 2,5 мг/сут, бисопролол 2,5 мг/сут, эплеренон 12,5 мг/сут, кверцетин, триметазидин в стандартных дозах.
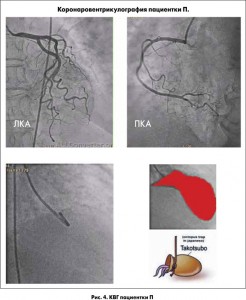
КВГ не выявила поражения коронарных артерий, но характерная конфигурация ЛЖ с акинезом и баллоноподобной дилатацией верхушечных сегментов натолкнула на мысль о кардиопатии Такоцубо (рис. 4).
Обратимая стресс-индуцированная кардиопатия или синдром Такоцубо, впервые описанный в японской популяции, чаще наблюдается у женщин в постменопаузе (80-90%), среднего возраста 65-68 лет. Клинические проявления не отличимы от ИМ. По данным литературы, кардиопатия Такоцубо выявляется в 1-2% случаев с предварительным диагнозом ИМ. Причины неизвестны, среди возможных механизмов нарушения сократимости ЛЖ рассматриваются множественный коронарный вазоспазм, микроциркуляторная дисфункция, катехоламиновое оглушение миокарда.
Для постановки диагноза ранее были предложены критерии клиники Мейо (A. Prasad et al., 2008):
– временные, обратимые нарушения регионарной сократимости ЛЖ, которые выходят за бассейн кровоснабжения одной коронарной артерии;
– отсутствие ангиографических признаков коронарной болезни сердца или острого повреждения атеросклеротической бляшки;
– новые изменения на ЭКГ (элевация сегмента ST или инверсия Т);
– отсутствие значимой травмы головы, внутричерепного кровоизлияния, феохромоцитомы, миокардита или гипертрофической кардиомиопатии.
В этом году опубликован отчет рабочей группы Ассоциации СН ЕОК, в котором изложены современные представления о синдроме Такоцубо и дополнены диагностические критерии (A.R. Lyon et al., European Journal of Heart Failure 2016; 18: 8-27). К критериям клиники Мейо добавлены следующие:
– повышение уровня натрийуретических пептидов;
– относительно небольшое повышение уровня тропонинов, которое не соотносится с величиной поражения по данным визуализирующих методов;
– восстановление функции ЛЖ в пределах 3-6 мес.
Перечислены предрасполагающие состояния: нарушения функции щитовидной железы, сепсис, заболевания печени, лекарственная зависимость, онкологическая патология, тревожные расстройства, расстройства настроения. Следует отметить, что у пациентки из клинического случая имелись два из перечисленных состояний.
Дополнительным методом подтверждения диагноза является магнитно-резонансная томография (МРТ) сердца. Отличительные признаки кардиопатии Такоцубо – регионарные нарушения сократимости и отек миокарда без рубцовых изменений, типичных для ИМ, а также отсутствие или слабая задержка гадолиниевого контраста в фазу позднего контрастирования.
Из анатомических вариантов нарушения сократимости ЛЖ при синдроме Такоцубо чаще всего встречается апикальный (75-80%), который и наблюдался у нашей пациентки по данным вентрикулографии и МРТ сердца, выполненной на 5-е сутки.
По данным литературы, при кардиопатии Такоцубо осложнения развиваются у каждого второго пациента, а внутригоспитальная летальность составляет 1-4,5%. Причинами летального исхода часто становятся острая СН, кардиогенный шок и желудочковые аритмии.
В лечении госпитализированных пациентов с кардиопатией Такоцубо пока что больше вопросов, чем ответов. Доказательная база в отношении медикаментозной терапии отсутствует. На практике применяются симптоматическая терапия, БАБ и ИАПФ. Пациенты высокого риска по критериям рабочей группы Ассоциации СН ЕОК (2016) могут нуждаться в назначении антикоагулянтной терапии для профилактики внутриполостного тромбообразования. В нашем случае в остром периоде были назначены: периндоприл 2,5 мг, бисопролол 5 мг, розувастатин 10 мг, клопидогрель 75 мг, триметазидин 35 мг 2 раза в сутки, фондапаринукс до 3-го дня пребывания в стационаре. На фоне терапии наблюдалось постепенное снижение уровней тропонина и КФК в первые 4 дня, а также улучшение регионарной сократимости ЛЖ по данным ЭхоКГ с полной нормализацией на 10-е сутки, что укрепило уверенность в диагнозе.
В отношении поддерживающей терапии доказательная база также отсутствует, но приоритетными препаратами, по мнению экспертов, являются БАБ и ИАПФ. При выписке пациентке было рекомендовано продолжать прием периндоприла, бисопролола, розувастатина и триметазидина. При повторной ЭхоКГ через 6 мес отмечалось полное восстановление кинетики ЛЖ. Однако следует помнить, что вероятность рецидивирования сохраняется, и пациентам необходимо рекомендовать наблюдение у кардиолога с повторными ЭхоКГ.
 Кандидат медицинских наук Борис Иванович Голобородько (Городская клиническая больница № 3 им. проф. Л.И. Алейниковой, г. Одесса) представил клинический случай геморрагических осложнений антитромботической терапии у пациента с ОИМ после стентирования.
Кандидат медицинских наук Борис Иванович Голобородько (Городская клиническая больница № 3 им. проф. Л.И. Алейниковой, г. Одесса) представил клинический случай геморрагических осложнений антитромботической терапии у пациента с ОИМ после стентирования.
Пациент А. в возрасте 71 год поступил в отделение интенсивной терапии кардиологического профиля (ОИТК) 17.03.2016 г. в 14.49 самостоятельно (в сопровождении родственников) с жалобами на интенсивные жгучие боли за грудиной с иррадиацией в межлопаточную область. В последние 10 дней боли участились и усилились, купировались нитроглицерином.
Накануне госпитализации боли не купировались в течение 9 ч. В анамнезе – гипертоническая болезнь с 2000 г., ИМ в 2006 г. Принимал регулярно АСК, клопидогрель, аторвастатин, карведилол, эналаприл, триметазидин, нитраты перед нагрузкой.
До госпитализации больной обращался к терапевту частной клиники. Диагноз терапевта: ИБС. Постинфарктный кардиосклероз (2006 г.). Стенокардия напряжения III ФК. Гипертоническая болезнь III ст., 2 ст., риск очень высокий. Рекомендована консультация кардиолога с решением вопроса о проведении коронарографии.
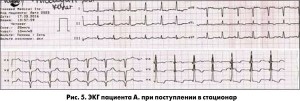
На ЭКГ, снятой в приемном отделении, – признаки ОКС без элевации сегмента ST (рис. 5). С таким предварительным диагнозом через 25 мин после ЭКГ (15.15) больной переведен в рентген-хирургический блок (РХБ), где выполнена коронароангиография. Назначены клопидогрель 300 мг, АСК 300 мг, пантопразол 40 мг, фентанил для купирования загрудинной боли. В РХБ перед процедурой пациенту ввели 7,5 тыс. МЕ нефракционированного гепарина (НФГ).
В ургентных лабораторных анализах – креатинин 0,192 ммоль/л, клиренс креатинина (КК) 35,4 мл/мин. По шкале CRUSADE у больного определен высокий геморрагический риск; по шкале GRACE – высокий тромботический риск (163 балла).
Результаты коронарографии: левый тип кровоснабжения, ствол левой коронарной артерии (ЛКА) – стеноз от устья 95-98%; ПМЖА – хроническая окклюзия в среднем сегменте; огибающая артерия – стеноз 60% в среднем сегменте и 85% в ветви тупого края; правая коронарная артерия – кальцинированная окклюзия устья.
После возвращения из РХБ в ОИТК (15.45) сохраняются интенсивные ангинозные боли, для купирования введен морфин. При наличии прямых показаний к АКШ больной категорически отказался от консультации кардиохирурга. В 17.00 боли возобновились, купированы фентанилом. ЭКГ после коронарной ангиографии (КАГ) без динамики. Инфузионно введен изосорбида динитрат. С 18.00 начаты подкожные инъекции эноксапарина по 75 мг 2 раза в сутки. В 21.40 боли возобновились, ускорение инфузии нитрата не дало эффекта, боль купирована морфином. Ночь пациент провел без боли.
18.03.2016 г. утром боли не беспокоят. На ЭКГ – инверсия зубца Т в V3. ЭхоКГ: дилатация левого предсердия (41 мм), ЛЖ (конечно-диастолический размер 58 мм, конечно-систолический размер 47 мм, конечно-диастолический объем 170 мл, конечно-систолический объем 104 мл, ФВ 39%); гипокинез перегородки, верхушки и бокового сегмента; межжелудочковая перегородка 12,5 мм; недостаточность митрального клапана II ст., недостаточность трикуспидального клапана II ст., легочная гипертензия 35 мм рт. ст.
От повторно предложенной консультации кардиохирурга и АКШ больной и родственники категорически отказались. Больной направлен на ангиопластику.
В РХБ снова ввели 10 тыс. МЕ НФГ и 150 мг клопидогреля. Докладчик особо акцентировал внимание на том, что этот пациент с высоким геморрагическим риском и нарушенной функцией почек получил в первые сутки уже 17,5 тыс. МЕ НФГ на фоне инъекций эноксапарина и двойной антитромбоцитарной терапии клопидогрель + АСК. НФГ был введен перед ангиопластикой, несмотря на то что пациент получал инъекции эноксапарина. Согласно рекомендациям, если со времени последней подкожной инъекции эноксапарина до накачивания баллона прошло менее 8 ч, дополнительное введение эноксапарина не требуется.
18.03.2016 г. с 9.55 до 11.05 больному были выполнены баллонная ангиопластика со стентированием ствола ЛКА (огибающей артерии) стентом с лекарственным покрытием 3,0×34 мм (кровоток TIMI III), а также баллонная ангиопластика среднего сегмента (Rcx), остаточный стеноз 40%, кровоток TIMI III.
После процедуры рекомендовано продолжать инъекции НМГ по схеме, принимать клопидогрель в дозе 75 мг/сут не менее 12 мес, АСК в дозе 100 мг постоянно.
В 11.20 пациент возвращен из РХБ в ОИТ со жгучими болями за грудиной. ЭКГ без динамики, аналгезия фентанилом. В последующие дни боли не возобновлялись. Продолжена антикоагулянтная терапия эноксапарином в прежней дозе на фоне двойной антитромбоцитарной терапии (согласно рекомендациям после имплантации стента с лекарственным покрытием). Кроме того, пациент получал зофеноприл, амлодипин, моксонидин, розувастатин 20 мг/сут, кверцетин, пантопразол.
На вторые сутки на фоне стабильного состояния больного возникло кровотечение из уретры. Эноксапарин отменен. Уровень креатинина повысился до 0,289 ммоль/л, КК 23,5 мл/мин. На 3-и сутки в связи с затрудненным мочеиспусканием установлен мочевой катетер. К терапии добавлены инфузии дезинтоксикационных растворов, сорбенты, обильное питье. К 20.00 по катетеру получено всего 200 мл мочи с примесью крови.
20.03.2016 г. до утра диурез 450 мл, моча без примеси крови. Гемоглобин 92 г/л, эритроциты 3,95×1012/л, цветной показатель 0,83. К 11.00 в общем анализе мочи эритроциты 1-2 в поле зрения, гематурии нет. Возобновлены инъекции эноксапарина по 75 мг 2 раза в сутки.
21.03.2016 г. Диурез 800 мл, моча без примеси крови, самочувствие удовлетворительное. Эноксапарин отменен. По настоятельному требованию больного удален мочевой катетер.
22.03.2016 г. Появились боли при попытке помочиться, выделил 150 мл кровянистой мочи. При покашливании прожилки крови в мокроте. Гемоглобин 92 г/л.
Клинический диагноз на 5-е сутки: ИБС. Острый повторный (17.03.2016 г.) переднеперегородочный и верхушечный ИМ. Постинфарктный кардиосклероз (2006 г.), стенозирующий атеросклероз коронарных артерий, многососудистое поражение (КАГ 17.03.2016 г.), ангиопластика и стентирование ствола ЛКА (огибающая артерия – стент с лекарственным покрытием; баллонная ангиопластика среднего сегмента 18.03.2016 г.). Гипертоническая болезнь III ст., 2 ст., риск IV. СН IIA. Облитерирующий атеросклероз сосудов нижних конечностей, окклюзия бедренно-подколенных сегментов с обеих сторон, бедренно-подколенное аутовенозное шунтирование (2013 г.). Гиперплазия предстательной железы, острая задержка мочеиспускания, гематурия 19.03.2016 г.
22.03.2016 г. к 14.00 отмечалось нарастание одышки и снижение диуреза. АД 85/60 мм рт. ст. Мочевина 17,8 ммоль/л, креатинин 0,544 ммоль/л, КК 12 мл/мин. До конца дня больной выделил 50 мл мочи. Нарастают признаки сердечной астмы. На коже рук появились множественные гематомы. ЭКГ без динамики. Попытка катетеризации мочевого пузыря под седацией диазепамом не удалась из-за препятствия в области шейки. Из уретры выделилась кровь со сгустками. АД 110/70 мм рт. ст. ЧСС 100/мин. Сатурация кислорода 92%. По данным ультразвукового исследования (УЗИ) – в мочевом пузыре до 550 мл мочи. С учетом стентирования продолжается двойная антитромбоцитарная терапия.
В 19.00 пациент осмотрен урологом. Установлен катетер Фолея на проводнике под седацией диазепамом.
23.03.2016 г. За сутки после катетеризации выделилось 200 мл мочи бурого цвета. По данным УЗИ, целостность мочевого пузыря сохранена. К терапии добавлены фуросемид, дофамин, теофиллин, внутривенные инфузии препарата железа (III), кверцетин, левофлоксацин.
24.03.2016 г. За сутки получено 1200 мл мочи. АД 130/80 мм рт. ст., ЧСС 96/мин, сатурация кислорода 90%. На коже рук и передней брюшной стенке – множественные гематомы. Признаков кровотечения из мочеполовой системы нет. Отмечается дальнейшее снижение уровня гемоглобина – 68 г/л. При повторном УЗИ органов брюшной полости и забрюшинного пространства признаков внутрибрюшной или забрюшинной гематомы не обнаружено.
24.03.2016 г. Гемоглобин 50 г/л, мочевина 18,9 ммоль/л, креатинин 0,595 ммоль/л, КК 11 мл/мин. После получения согласия больного за сутки введено 525 мл эритроцитарной массы и 470 мл свежезамороженной плазмы.
К 15.00 получено 1200 мл светлой мочи. На фоне симптоматической терапии продолжается прием клопидогреля и АСК.
25.03.2016 г. Гемоглобин 86 г/л, мочевина 18,7 ммоль/л, креатинин 0,548 ммоль/л, КК 12 мл/мин. Диурез 3000 мл. Терапия: клопидогрель, АСК, зофеноприл, розувастатин, пантопразол, сорбенты, препарат железа, фуразидин, пробиотик, диуретики.
В последующие три недели состояние пациента стабильное, кровотечения не повторялись, наметилась тенденция к восстановлению функции почек.
14.04.2016 г. Больной в удовлетворительном состоянии выписан с такими показателями: гемоглобин 75 г/л, эритроциты 2,7, мочевина 17,4 ммоль/л, креатинин 0,329 ммоль/л, КК 21 мл/мин. Рекомендации: бисопролол, рамиприл, розувастатин, эплеренон, торасемид, клопидогрель, АСК, тамсулозин (для лечения гиперплазии предстательной железы).
Комментируя клинический случай, Б.И. Голобородько отметил, что это пример сочетания высокого ишемического, тромботического и геморрагического риска, когда нужно творчески подходить к лечению, но не отступать от рекомендаций. На чашах весов – большое нефатальное кровотечение или жизнь пациента. Кровотечение должно быть устранено по возможности без прерывания антитромбоцитарной терапии, чтобы не подвергать больного риску повторных тромботических событий. Тщательное соблюдение рекомендаций по дозированию антикоагулянтов для особых категорий пациентов (в данном случае с нарушенной функцией почек) является обязательным условием безопасности. Назначения антитромботической терапии должны быть согласованы между интервенционными кардиологами (кардиохирургами) и лечащим врачом.
 Заведующая кафедрой кардиологии и функциональной диагностики Харьковской медицинской академии последипломного образования, доктор медицинских наук, профессор Вера Иосифовна Целуйко осветила несколько вопросов, касающихся выбора антиагрегантной и гиполипидемической терапии при ОКС.
Заведующая кафедрой кардиологии и функциональной диагностики Харьковской медицинской академии последипломного образования, доктор медицинских наук, профессор Вера Иосифовна Целуйко осветила несколько вопросов, касающихся выбора антиагрегантной и гиполипидемической терапии при ОКС.
Необходимо ли применять нагрузочную дозу тикагрелора при возможности перехода с клопидогреля на тикагрелор при ОКС?
Согласно международным рекомендациям и отечественным клиническим протоколам по ведению пациентов с ОКС всем пациентам показана двойная антитромбоцитарная терапия, то есть на фоне приема АСК должны быть назначены тикагрелор или клопидогрель. Во многих городах пациенты с ОКС получают первую дозу АСК и клопидогреля уже на догоспитальном этапе. Решение о переходе на тикагрелор чаще принимают интервенционные кардиологи перед выполнением перкутанного коронарного вмешательства (ПКВ).
Нагрузочная доза тикагрелора 180 мг (далее по 90 мг два раза в сутки) рекомендуется при отсутствии противопоказаний всем пациентам с умеренным или высоким риском ишемических явлений (например, с повышенным уровнем сердечных тропонинов), независимо от начальной стратегии лечения, включая тех больных, которые до этого принимали клопидогрель (его необходимо отменить при переходе на тикагрелор).
Комментируя этот вопрос, профессор А.Н. Пархоменко обратил внимание на то, что нагрузочная доза обязательна также в тех случаях, когда пациенту с ОКС была назначена нагрузочная доза клопидогреля (300 мг) на догоспитальном этапе. Если принято решение перевести больного на тикагрелор, например, перед выполнением ПКВ, то нагрузочная доза назначается независимо от того, когда была принята последняя доза клопидогреля.
Если тикагрелор недоступен, всем пациентам с ОКС должен быть назначен клопидогрель: нагрузочная доза 300 мг, в случае принятия решения о выполнении ПКВ общая нагрузочная доза 600 мг, затем по 75 мг/сут.
Рекомендован ли прием нагрузочной дозы тикагрелора и клопидогреля у пациентов старше 75 лет при ОКС?
При ОКС нагрузочная доза тикагрелора 180 мг (затем по 90 мг дважды в сутки) показана независимо от возраста. В инструкции по медицинскому применению тикагрелора также указано, что коррекция дозы у пациентов пожилого возраста не нужна.
Если больному с ОКС назначен тикагрелор, но развивается ИМ с элевацией сегмента ST, возможно ли проведение тромболизиса?
Вопрос сразу же требует уточнения, поскольку не указано, есть ли возможность выполнения ПКВ. При доставке в пределах 12 ч и наличии катетерной лаборатории такому пациенту показано интервенционное лечение. Тромболизис остается резервной терапией при отсутствии возможности выполнения ПКВ. После приема тикагрелора нельзя проводить тромболитическую терапию, что указано в инструкции по применению препарата. Например, в ситуации, когда ИМ с элевацией ST развивается после того, как пациенту с ОКС была назначена первая доза тикагрелора, методом выбора остается ПКВ, а тромболизис противопоказан.
В настоящее время проводится исследование TREAT, в котором изучаются безопасность и эффективность тикагрелора по сравнению с клопидогрелем у пациентов с ИМ с элевацией сегмента ST, которым выполняется медикаментозный тромболизис.
Если пациент принимал статины на момент развития ОКС, необходимо ли менять препарат на более сильный, или увеличивать дозу, или давать нагрузочную дозу перед инвазивным вмешательством?
В отечественном клиническом протоколе указано, что статины в высоких дозах, а именно розувастатин ≥20 мг или аторвастатин ≥40 мг, следует назначить или продолжить их прием сразу после госпитализации всем пациентам с ОКС без противопоказаний или непереносимости в анамнезе, независимо от исходных показателей холестерина.
Профессор обратила внимание на то, что именно эти два препарата и именно в таких дозах показаны всем пациентам перед выполнением коронарного вмешательства. Если пациент принимал какой-либо другой статин, препарат следует заменить на розувастатин или аторвастатин, а если пациент принимал меньшую дозу аторвастатина или розувастатина, то ее следует увеличить до рекомендованной в протоколе. Это важно, поскольку только для указанных режимов гиполипидемической терапии существует убедительная доказательная база в отношении улучшения клинических исходов у пациентов с ОКС. Назначение нагрузочных доз розувастатина обеспечивает достоверный превентивный эффект в отношении перипроцедурных ИМ независимо от предшествующего приема статинов.
Подготовил Дмитрий Молчанов


