14 вересня, 2016
Синдром Дресслера в практике кардиолога и пульмонолога: диагностика на стыке специальностей
Всемирная организация здравоохранения выделила 10 наиболее опасных патологических состояний, к числу которых отнесла коронарную болезнь, уносящую ежегодно более 7 млн жизней. Основная клиническая форма этой болезни, инфаркт миокарда (ИМ), является частой причиной смерти как в Украине, так и во всем мире. В структуре смертности населения нашей страны удельный вес летальных исходов вследствие ИМ составляет 22,5% [1].
Будучи важнейшей медико-социальной проблемой современности, ИМ может сопровождаться осложнениями, диагностика которых требует участия специалистов пульмонологического профиля. Примером тому является синдром Дресслера, получивший название в честь впервые описавшего его в 1955 г. американского терапевта Вильяма Дресслера. Под синдромом Дресслера (постинфарктным синдромом) понимают симптомокомплекс, развивающийся на фоне острого ИМ (чаще через 2-4 нед с момента его возникновения) и представляющий собой различные сочетания симптомов экссудативного перикардита, плеврита, пневмонита (нередко с кровохарканьем), поражений синовиальных оболочек и кожи. Клинические варианты синдрома определяются набором признаков, которые имеют место у конкретного больного. Соответственно различают типичные перикардиальный, плевральный, пневмонический варианты, их двух- и трехкомпонентные сочетания, атипичные варианты, характеризующиеся артралгиями, кожными изменениями, лихорадкой и т. п. Практически для каждого клинического варианта характерны лихорадка (может быть фебрильной, в редких случаях – отсутствовать), лейкоцитоз, увеличение СОЭ, однако полный набор перечисленных симптомов встречается нечасто [2].
Хотя все симптомы синдрома Дресслера редко возникают одновременно, основным обязательным проявлением выступает перикардит, сопровождающийся различными по характеру болями в области сердца (острыми, тупыми, приступообразными, давящими или сжимающими) с возможной иррадиацией в шею, левое плечо, лопатку, брюшную полость. Боли могут усиливаться при кашле, глубоком дыхании, глотании. Характерным аускультативным симптомом является шум трения перикарда. В большинстве случаев течение перикардита нетяжелое, боли стихают в течение нескольких дней. Однако иногда синдром Дресслера может принимать затяжной характер, длиться нескольких лет с периодами ремиссий и обострений. Так, самому В. Дресслеру удалось проследить судьбу пациента с перикардиальным выпотом, сохранявшимся в течение 15 лет, но без формирования констриктивного перикардита. Рестриктивное поражение перикарда как исход синдрома Дресслера формируется редко, но все же его развитие возможно при наличии массивного геморрагического выпота. Так, Е. И. Чазов описал историю пациента, у которого потребовалось оперативное вмешательство по поводу тяжелого геморрагического перикардита, проявившегося через 2 мес после развития острого ИМ. Проводимые больному плевро- и перикардиоцентез сопровождались временным улучшением состояния, но сформировавшаяся выраженная перикардиальная констрикция обусловила проведение перикардиотомии [3]. Плеврит при синдроме Дресслера проявляется болями в грудной клетке, усиливающимися при дыхании, и выслушиваемым при аускультации шумом трения плевры. Скопление жидкости в плевральной полости приводит к притуплению перкуторного звука. Пневмонит является более редким симптомом синдрома Дресслера, обнаруживает себя классическими признаками очаговых изменений в легких, но может сопровождаться тревожным симптомом – примесью крови в мокроте. Рентгенологическая картина может быть различной в зависимости от локализации и площади поражения легочной ткани. При синдроме Дресслера может развиваться или прогрессировать сердечная недостаточность, возможно появление системных поражений аутоиммунного характера: поражений кожи, сосудов (геморрагический васкулит), почек, а также артралгий. Симптомы, характерные для синдрома Дресслера, могут возникать не только после развития ИМ, но и после других кардиальных повреждений, прежде всего кардиохирургических, в связи с чем используется еще одно название данного состояния – синдром постповреждения сердца (postcardiac injury syndrome) [4].
За более чем полувековую историю данные об эпидемиологии синдрома претерпели значительные изменения: первоначально считалось, что синдром Дресслера развивается у 1-4% больных, перенесших ИМ. Однако с учетом атипичных и малосимптомных форм его распространенность, по данным различных авторов, могла составлять от 15 до 20%, а по некоторым источникам – достигать 30% [5, 6]. В настоящее время синдром Дресслера стал более редким диагнозом, что связывают с улучшением качества лечения острого ИМ, позволяющим минимизировать зону миокардиального некроза; возможностями ранней реперфузии миокарда с помощью тромболизиса и ангиопластики; использованием для лечения ишемической болезни сердца β-адреноблокаторов, антагонистов рецепторов альдостерона, ингибиторов ангиотензинпревращающего фермента, статинов, обладающих иммуномодулирующими и противовоспалительными эффектами. Причиной снижения распространенности синдрома Дресслера может быть и широкое использование в клинической практике нестероидных противовоспалительных препаратов (НПВП). Кроме того, возможно влияние увеличения количества случаев стертых и малосимптомных форм, когда синдром не диагностируется вовсе [7].
Имея основной причиной ИМ и чаще возникая на фоне крупноочаговых и осложненных инфарктов, синдром Дресслера также может развиваться после кровотечений в полость перикарда, ранений и контузий сердца, непроникающих ударов в область грудной клетки [6, 8-12]. Вирусная этиология данного состояния длительное время категорически отрицалась, однако отмечающееся у таких больных повышение титра противовирусных антител после кардиохирургических вмешательств позволяет допустить подобную возможность [13].
Механизмы развития синдрома Дресслера носят аутоиммунный характер. Повреждение и гибель клеток инфарктированного миокарда приводят к резорбции кардиальных антигенов и компонентов некротизированного миокарда в кровь, что способствует аутосенсибилизации, то есть развитию иммунного ответа на продукты распада собственных тканей с образованием аутоантител, направленных против молекул белка оболочек, выстилающих сердце, легкие, суставы. Развивается перекрестная аутоиммунная реакция с собственными клетками, воспринимаемыми иммунной системой как чужеродные. В перикарде, плевре, синовиальных оболочках возникает асептическое воспаление. Образующиеся иммунные комплексы оседают в тканях, поддерживая и усугубляя их повреждение. Аутоиммунный генез синдрома Дресслера подтверждается изменениями состояния клеточного и гуморального звеньев иммунной системы [14, 15].
Диагностика синдрома Дресслера основана на клинических данных, результатах электрокардиографии (типичные для перикардита диффузный подъем сегмента ST и снижение амплитуды комплекса QRS), данных эхокардиографии (характерная для перикардита сепарация листков перикарда, не достигающая, как правило, в диастолу10 мм), рентгенографии, компьютерной (КТ) и магнитнорезонансной томографии (признаки пневмонита, плеврита, перикардита), а также на характере плеврального или перикардиального пунктатов (серозный либо серозно-геморрагический с эозинофилией и высоким уровнем С-реактивного белка) [16, 17].
К медикаментозной терапии синдрома Дресслера отношение осторожное: НПВП и кортикостероиды, особенно в первые 4 нед острого ИМ, назначать нежелательно ввиду негативного влияния на процессы рубцевания миокарда и периинфарктную зону, к приему указанных средств чаще прибегают в условиях тяжелого рецидивирующего течения синдрома. Позитивный эффект от введения низких доз кортикостероидов может иметь дифференциально-диагностическое значение [18, 19]. Еще менее изучены эффекты колхицина и метотрексата, рекомендуемых при неэффективности НПВП и кортикостероидов [20].
Прогноз при синдроме Дресслера, как правило, благоприятный. Дифференциальная диагностика проводится с рецидивирующим или повторным ИМ, бактериальной пневмонией, тромбоэмболией легочной артерии (ТЭЛА), перикардитом или плевритом другой этиологии, туберкулезом, прогрессирующей сердечной недостаточностью. В клинической практике дифференциальный диагноз может вызвать серьезные затруднения, примером чего служит следующее наблюдение.
Клинический случай
Больной С., 70 лет, поступил в инфарктное отделение 26.01.2016 г. с диагнозом: острый Q-позитивный ИМ задней стенки левого желудочка (ЛЖ). При поступлении предъявлял жалобы на интенсивную боль за грудиной, одышку при ходьбе, тошноту, слабость. В анамнезе гипертоническая болезнь около 30 лет, максимальное артериальное давление (АД) 180/100 мм рт. ст. При поступлении сознание ясное, кожные покровы бледные, пульс ритмичный, тоны сердца приглушены, систолический шум на верхушке, акцент второго тона над аортой, частота сердечных сокращений (ЧСС) 78 в минуту, левая граница относительной тупости сердца расширена влево на 1,5 см. Перкуторно над легкими ясный легочной звук, аускультативно ослабленное везикулярное дыхание, частота дыхательных движений (ЧДД) 16 в минуту. Печень у края реберной дуги, периферические отеки не выявлены.
27.01.2016 г. проведено стентирование инфарктобусловившей коронарной артерии стентом без лекарственного покрытия. В этот же день на рентгенограмме органов грудной клетки, выполненной в вынужденном горизонтальном положении в условиях палаты, были выявлены изменения, вызывающие подозрение на негоспитальную (2-е сутки пребывания в стационаре) правостороннюю пневмонию (рис. 1).
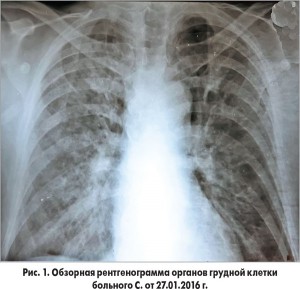
В клиническом анализе крови лейкоциты 17,7 г/л, СОЭ 10 мм/ч; прочие показатели без особенностей. Анализ мокроты: небольшое количество лейкоцитов, изредка эритроциты, КУБ и опухолевые клетки не найдены. ЭХО-кардиоскопия 27.01.2016 г.: состояние после стентирования; ЭХО-признаки атеросклероза аорты, гипертрофии миокарда ЛЖ; умеренное расширение полости левого предсердия, гипокинезия заднего сегмента ЛЖ; уплотнение створок аортального и митрального клапанов, незначительное снижение глобальной сократимости миокарда ЛЖ, трикуспидальная регургитация 0-1 ст. (среднее давление в легочной артерии 23 мм рт. ст., легочная гипертензия не выявлена), фракция выброса ЛЖ 51%.
Показатели свертывающей системы крови от 28.01.2016 г. без отклонений от нормы. На контрольной рентгенограмме органов грудной клетки от 02.02.2016 г. (8-е сутки пребывания в стационаре) – в верхней доле правого легкого неоднородная инфильтрация, такого же характера инфильтрация в прикорневой зоне левого легкого, легочный рисунок усилен, обогащен в среднебазальных отделах (рис. 2).
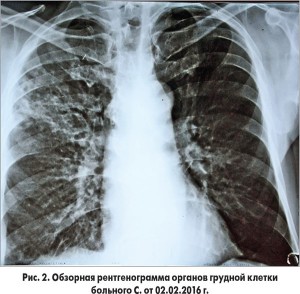
Назначена консультация пульмонолога. Заключение: негоспитальная двухсторонняя пневмония. Назначены антибактериальные препараты: цефипим внутривенно, инфузии левофлоксацина, флюконазол. Через неделю сохранялись кашель со скудной мокротой светло-серого цвета, субфебрилитет; на рентгенограмме органов грудной клетки от 09.02.2016 г. (15-е сутки пребывания в стационаре) – справа без существенной динамики, усилились изменения в левом легком (рис. 3).
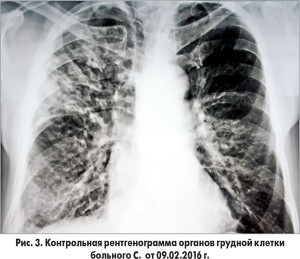
Ультразвуковое исследование (УЗИ) сердца показало уменьшение зоны гипокинезии в области задней стенки ЛЖ. На ЭКГ синусовый ритм. В клиническом анализе крови СОЭ 21 мм/ч. У пациента на фоне комбинированной антибиотикотерапии цефалоспорином IV поколения с антипсевдомонадной активностью и фторхинолоном III поколения в течение 7 дней общее состояние не улучшилось, гемодинамика оставалась стабильной, ЧДД 18 в минуту, симптомов интоксикации не было, печень у края реберной дуги, ослабленное дыхание в легких с обеих сторон, отеки не выявлялись. Трактовка изменений в легких как проявлений легочного застоя при прогрессирующей сердечной недостаточности была неубедительной ввиду стабильного клинического состояния больного, отсутствия отеков, увеличения печени и позитивной динамики УЗИ сердца. Пациент дважды был осмотрен фтизиатром, проводились исследования мокроты в лаборатории противотуберкулезного диспансера (мазок, МГ-тест, посев на жидкую среду): микобактерии туберкулеза не найдены, диагноз туберкулеза был исключен.
18.02.2016 г. (24-е сутки пребывания в стационаре) была проведена мультисрезовая КТ органов грудной клетки и средостения с контрастированием, в верхней доле правого легкого выявлена очагово-сливная инфильтрация. Идентичные, менее выраженные участки инфильтрации визуализировались в верхней доле левого легкого. В нижних отделах – пневмофиброз. В правой плевральной полости – небольшое количество свободной жидкости толщиной до 8 мм, в левой плевральной полости – свободная жидкость толщиной до 20 мм, в перикарде – небольшое количество жидкости. Сосуды проходимы, не расширены, признаков тромбоэмболии ветвей легочной артерии не выявлено (рис. 4).
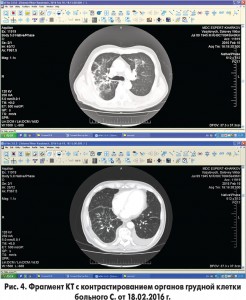
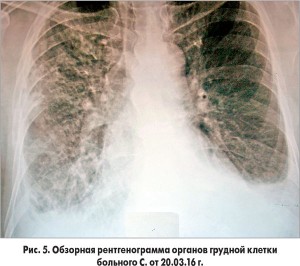
Таким образом, данные КТ органов грудной клетки и отсутствие изменений в системе гемостаза позволили исключить диагноз ТЭЛА. Пациенту была назначена комбинация петлевого диуретика с блокатором рецепторов альдостерона (торасемид с эплереноном) на фоне продолжающегося лечения ацетилсалициловой кислотой, клопидогрелем, аторвастатином, эналаприлом, бисопрололом, пантопразолом, цефипимом. Состояние больного было стабильным, сохранялся небольшой кашель, температура тела нормализовалась, антибиотики были отменены, однако на рентгенограмме органов грудной клетки от 20.03.2016 г. (55-е сутки наблюдения) оставались признаки перикардита, плеврального выпота и изменений в легких (рис. 5).
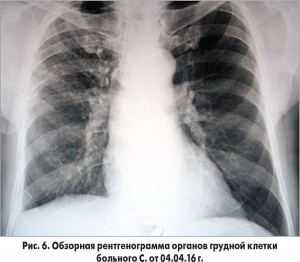
Пациент продолжал получать ацетилсалициловую кислоту, клопидогрель, аторвастатин, эналаприл, бисопролол, пантопразол, эплеренон. На рентгенограмме от 4.04.2016 г. (70-е сутки наблюдения) отмечалась выраженная положительная динамика в виде рассасывания инфильтративных изменений в легких и исчезновения плеврального выпота (рис. 6).
Таким образом, у больного через сутки от момента возникновения острого ИМ, вероятнее всего, развился синдром Дресслера, что не было типичным в отношении сроков возникновения этого осложнения. Однако в клинической картине преобладал типичный симптомокомплекс – пневмонит, плеврит, перикардит. Отсутствие динамики изменений в легких на фоне длительной антибиотикотерапии при одновременном отсутствии симптомов интоксикации ставили под сомнение диагноз пневмонии. Были исключены ТЭЛА и наличие туберкулезного процесса. Отсутствие одышки, тахикардии, ухудшения ультразвуковой симптоматики при эхокардиографии и стабильная гемодинамика не позволяли трактовать наличие выпота в полости перикарда и плевральных полостях как проявление нарастающей сердечной недостаточности. Отсутствие артралгий, скованности движений в суставах, повышения температуры тела, лабораторные данные не вызывали подозрений на развитие системного заболевания соединительной ткани. Длительность изменений в легких, перикардита и двухстороннего плеврита (более 2 мес), как и сроки возникновения, также были нетипичными для синдрома Дресслера. Однако связь заболевания с острым ИМ, исключение основных патологических состояний, с которыми проводится дифференциальная диагностика синдрома, наличие классической триады симптомов – плеврита, пневмонита, перикардита – и их исчезновение на фоне приема препаратов кардиогруппы с большой долей вероятности могли демонстрировать картину постинфарктного синдрома Дресслера.
Список литературы находится в редакции.



