18 травня, 2016
Иммобилизация как фактор риска развития венозных тромбоэмболий: практическое значение и современные рекомендации
Замедление или нарушение кровотока является одним из трех условий тромбообразования, описанных Вирховым 170 лет назад, а одной из частых причин венозного стаза у госпитализированных больных является иммобилизация или малоподвижность. Роль этого фактора и современные возможности профилактики венозных тромбоэмболий (ВТЭ) у терапевтических пациентов комментирует член-корреспондент НАМН Украины, президент Украинской ассоциации по неотложной кардиологии, руководитель отдела реанимации и интенсивной терапии Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины, доктор медицинских наук, профессор Александр Николаевич Пархоменко.
– Каким образом иммобилизация повышает риск развития тромбозов?
– Известно, что тромбы, как правило, образуются в областях с медленным или нарушенным кровотоком – чаще всего в глубоких и варикозно-расширенных поверхностных венах нижних конечностей. Застой крови препятствует работе защитных механизмов антитромбообразования. Одновременно стаз крови способствует накоплению тромботического материала на стенке сосуда. Предполагается также, что стаз приводит к гипоксии эндотелиальных клеток и их повреждению. При этом может обнажаться субэндотелиальный слой, что способствует адгезии тромбоцитов и активирует весь коагуляционный каскад.
Ограничение подвижности – хорошо известный фактор риска развития ВТЭ как в терапевтической, так и в хирургической практике. Если в хирургии обездвиженность носит облигатный и предсказуемый характер (иммобилизация как условие сращения переломов или послеоперационного заживления тканей), то в терапии это, как правило, предписанный или обусловленный характером симптомов постельный режим, но с возможностью вставать и ходить.
Избегание постельного режима, ранняя мобилизация пациентов после операций, по прошествии острого периода заболевания – современные тенденции клинической практики, и продиктовано это не только требованиями к уменьшению расходов на лечение и уход, но и в первую очередь повышенным риском развития тромбозов глубоких вен (ТГВ) и их грозного осложнения – тромбоэмболии легочной артерии (ТЭЛА).
До момента госпитализации и после стационарного этапа лечения многие пациенты неопределенно долго находятся на домашнем постельном режиме. Причины также разнообразны и не всегда объясняются тяжестью основного заболевания. В постель могут укладывать стенокардия, кахексия в терминальных стадиях хронической сердечной недостаточности (ХСН), астенический синдром после тяжелой вирусной пневмонии, поведенческие реакции, психологические проблемы (ипохондрия, депрессия). И эту домашнюю иммобилизацию также необходимо учитывать, определяя общий риск развития ВТЭ и стратегию тромбопрофилактики у конкретного пациента. Отдельную категорию составляют пациенты, длительно обездвиженные вследствие травм или заболеваний центральной нервной системы (инсульт).
– Как правильно оценивать риск развития ВТЭ у госпитализированных терапевтических больных с фактором иммобилизации?
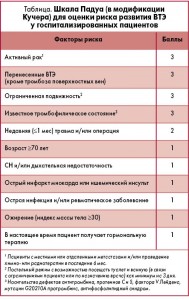
– Профилактике ВТЭ у пациентов терапевтического профиля специально посвящены практические рекомендации Американской коллегии торакальных врачей (S.R. Kahn et al. CHEST 2012; 141(2)(Suppl): e195S-e226S). Лучшим на сегодняшний день инструментом для оценки общего риска развития ВТЭ у терапевтических больных является шкала Падуа в модификации Кучера (табл.). Учитываются 11 факторов риска, каждый из них оценивается от 1 до 3 баллов. Ограничение подвижности на 3 дня и более (постельный режим с возможностью посещать туалет и ванную) отнесено к самым значимым факторам риска с оценкой в максимальные 3 балла. Сумма баллов по шкале Падуа ≥4 интерпретируется как высокий риск развития ВТЭ, <4 – как низкий. И именно по этому критерию размежевания оценивались эффективность, безопасность и экономическая целесообразность антикоагулянтной тромбопрофилактики у пациентов высокого и низкого риска развития ВТЭ.
Таким образом, если госпитализированному пациенту как минимум на три дня предписан постельный режим, или если фактор малоподвижности имел место еще до момента госпитализации, больной уже имеет 3 из 4 баллов по шкале Падуа. Достаточно еще одного из факторов риска (например, возраст старше 70 лет или наличие ожирения), чтобы констатировать высокий риск развития ВТЭ и задуматься о назначении тромбопрофилактики. Другие из факторов риска, учитываемых шкалой Падуа, часто являются одновременно и причинами госпитализации – сердечная или дыхательная недостаточность, острая инфекция или ревматическое заболевание.
За рубежом принято выделять две категории госпитализированных пациентов – с острыми заболеваниями (обычная терапевтическая палата) и в критическом состоянии (палата реанимации и интенсивной терапии). Факторы риска развития ВТЭ и их относительный вклад у этих категорий больных несколько отличаются, хотя фактор иммобилизации актуален в обоих случаях. У пациентов отделений интенсивной терапии (ОИТ) дополнительный вклад в общий риск развития ВТЭ вносят такие факторы, как катетеризация центральных сосудов, искусственная вентиляция легких, назначение вазопрессорных препаратов. Надежных моделей оценки риска развития ВТЭ для пациентов ОИТ не предложено.
В целом госпитализация по поводу острых заболеваний ассоциируется с восьмикратным повышением риска развития ВТЭ, и именно у госпитализированных терапевтических больных наблюдается каждый четвертый случай ТГВ или ТЭЛА (J.A. Нeit. Arch Intern Med. 2000; 160(6): 809-815).
– Кому и когда показана тромбопрофилактика в пределах сроков стационарного лечения?
– Госпитализированным в терапевтические стационары пациентам с повышенным риском развития ВТЭ эксперты Американской коллегии торакальных врачей (2012) рекомендуют назначать тромбопрофилактику антикоагулянтами – нефракционированным гепарином (НФГ), низкомолекулярными гепаринами (НМГ) или фондапаринуксом. Данные о пользе активной стратегии тромбопрофилактики получены в серии метаанализов контролируемых исследований, выполненных в популяциях пациентов среднего возраста 65 лет, госпитализированных по поводу ХСН, острых респираторных заболеваний или инфекций, обострений ревматических заболеваний, которые находились на постельном режиме и имели дополнительные факторы риска развития ВТЭ (R. Alikhan et al. Cochrane Database Syst Rev. 2009; (3): CD003747; F. Dentali et al. Ann Intern Med. 2007; 146(4): 278-288; N.S. Lloyd et al. J Thromb Haemost. 2008; 6(3): 405-414). Поскольку средняя длительность антикоагулянтной терапии в этих исследованиях составляла 6-21 день, американские эксперты внесли именно этот срок в свои рекомендации (или до выписки, или до восстановления подвижности, в зависимости от того, что наступит раньше).
У пациентов с низким риском развития ВТЭ (менее 4 баллов по шкале Падуа) стоимость антикоагулянтной терапии и геморрагические риски перевешивают потенциальную пользу.
У больных, госпитализированных в палаты интенсивной терапии, в целях профилактики ВТЭ также рекомендуется назначение НФГ или НМГ. Следует учитывать, что у пациентов в критическом состоянии, госпитализированных в ОИТ, стандартная доза эноксапарина 40 мг один раз в сутки может не обеспечивать достаточной антикоагуляции для предотвращения ВТЭ. S. Robinson и соавт. (2013) в небольшом двойном слепом исследовании получили предварительное подтверждение этой гипотезы. Расчет дозы эноксапарина по массе тела больных (1 мг/кг) обеспечивал лучший контроль уровня фактора свертывания Xa.
Отдельную категорию составляют пациенты с кровотечениями или высоким риском кровотечений, у которых одновременно присутствуют факторы риска развития ВТЭ. Поскольку антикоагулянты в таких случаях противопоказаны, рекомендуются только механические способы профилактики ВТЭ – компрессионные чулки или перемежающаяся пневматическая компрессия.
Что касается длительно обездвиженных больных, которые находятся в домашних условиях, приютах или других местах оказания помощи, то аспекты профилактики ВТЭ в этой многочисленной и разнородной популяции изучены намного в меньшей степени, чем у госпитального контингента. Эксперты АССР не рекомендуют рутинное назначение тромбопрофилактики этой категории пациентов.
Таким образом, достаточно четко очерчена категория больных, которым показана тромбопрофилактика в терапевтической практике. Иммобилизация является одним из наиболее значимых факторов риска развития ВТЭ, который необходимо учитывать не только по факту нахождения пациента в стационаре, но и по данным анамнеза. Продолжаются дискуссии вокруг преимуществ одних антикоагулянтов перед другими, а также сроков первичной тромбопрофилактики.
– Каким же антикоагулянтам следует отдавать предпочтение при назначении первичной профилактики ВТЭ?
– Эффективность и безопасность НФГ и НМГ сравнивались в пяти рандомизированных клинических исследованиях (РКИ). В Украине сегодня доступны такие НМГ, как эноксапарин, фондапаринукс, фраксипарин. Наиболее изученным и широко применяемым в клинической практике является эноксапарин (Клексан®) – 3 исследования (J.F. Bergmann. Thromb Haemost. 1996; 76(4): 529-534; F.X. Кleber. Am Heart J. 2003; 145(4): 614-621; E. Lechler Haemostasis. 1996; 26 (suppl 2): 49-56). Объединенный анализ результатов пяти РКИ показал сопоставимые профилактические эффекты НМГ и НФГ относительно ТГВ, ТЭЛА и общей смертности. Однако НМГ обладают важным преимуществом – реже вызывают геморрагические осложнения.
Вопреки ожиданиям новые оральные антикоагулянты (НОАК) не продемонстрировали преимуществ перед НМГ в профилактике ВТЭ у госпитализированных пациентов терапевтического профиля. В исследованиях ADOPT и MAGELLAN апиксабан и ривароксабан сравнивались с эноксапарином (S.Z. Goldhaber. N Engl J Med. 2011; 365: 2167-2177; A.T. Cohen. N Engl J Med. 2013; 368: 513-223).
Дополнительное снижение частоты ВТЭ на фоне приема НОАК достигалось слишком высокой ценой – двукратным увеличением риска больших кровотечений. В связи с этим НОАК не рекомендуются для профилактики ВТЭ у госпитализированных пациентов терапевтического профиля. Препаратами выбора остаются НМГ в связи с оптимальным соотношением эффективность/безопасность при использовании короткими курсами в пределах сроков госпитализации.
– Может ли антитромбоцитарная терапия предотвращать ВТЭ?
– Вклад активации тромбоцитов в патогенез венозного тромбоза изучен в меньшей степени, чем при артериальных тромбозах. Хотя ацетилсалициловая кислота (АСК) может применяться для профилактики ВТЭ из-за низкой стоимости, удобства перорального приема и низкого риска кровотечений, ее эффективность, как и других антиагрегантов, практически не изучена у госпитализированных терапевтических больных. Тем не менее в реальной клинической практике многие кардиологические пациенты, которые госпитализируются повторно, уже принимают назначенные ранее АСК или клопидогрель (например, после перенесенного инфаркта миокарда). Назначая тромбопрофилактику антикоагулянтами (если она показана), следует помнить об этом и учитывать возможное потенцирование риска развития геморрагических осложнений.
– В каких случаях следует продолжать тромбопрофилактику после выписки пациента из стационара?
– Факторы риска развития ВТЭ у терапевтических больных могут сохранять свою актуальность до нескольких недель или месяцев после выписки из стационара. К таким факторам относится и ограничение подвижности. Выше уже упоминалось о неучтенных днях, проведенных хроническими больными дома в постели. В плацебо-контролируемом исследовании MEDENOX, в котором пациенты с острыми терапевтическими заболеваниями получали тромбопрофилактику эноксапарином длительностью до 14 дней, 8% случаев ВТЭ, в том числе 4 фатальные ТЭЛА, наблюдались уже после курса антикоагулянтной терапии – между 15-м и 110-м днями (M.M. Samama et al. N Engl J Med.1999; 341(11): 793-800). Поэтому продолжение тромбопрофилактики представляется логичным после госпитального курса.
Как уже отмечалось, продленные курсы пероральной антикоагулянтной терапии апиксабаном и ривароксабаном не продемонстрировали преимуществ перед стандартным госпитальным курсом инъекций эноксапарина из-за повышенного риска кровотечений. В РКИ с участием пациентов хирургического профиля, перенесших ортопедические операции на нижних конечностях или удаление опухолей брюшной полости, доказаны преимущества продленной тромбопрофилактики, что отражено в соответствующих рекомендациях АССР (Y. Falck-Ytter Chest.2012; 141(2)(suppl): e278S-e325S).
EXCLAIM – единственное опубликованное РКИ, в котором изучали эффективность продленной тромбопрофилактики эноксапарином у терапевтических больных (R.D. Hull et al. Ann Intern Med. 2010; 153(1): 8-18). В исследовании участвовали более 6 тыс. пациентов старше 40 лет с острыми терапевтическими заболеваниями (СН, дыхательной недостаточностью, инфекциями) и ограниченной подвижностью. Продление терапии до 38 дней после обычного двухнедельного госпитального курса предотвращало дополнительно 6 ТГВ на 1 тыс. пациентов ценой дополнительных 5 кровотечений на 1 тыс. больных. В группе продленной тромбопрофилактики частота всех ВТЭ была на 38% меньшей. Наибольшую пользу от продленной тромбопрофилактики получили больные раком, пациенты пожилого возраста и с ограниченной подвижностью. Однако в связи с отсутствием других доказательств польза от продления антикоагулянтной терапии у больных без перенесенных ВТЭ (только с целью первичной профилактики) считается сомнительной.
– Как вести пациента, если тромбоэмболическое осложнение в стационаре все-таки произошло?
– Подходы к лечению пациентов с ВТЭ рассматриваются в недавно изданных практических рекомендациях Американской коллегии торакальных врачей (C. Kearon et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline, CHEST (2016), doi: 10.1016/j.chest.2015.11.026). Правда, пока это предварительный текст рекомендаций (вскоре ожидается рецензированная официальная публикация), и они, конечно, отличаются от принципов первичной профилактики ВТЭ. Если ТГВ нижних конечностей или ТЭЛА избежать не удалось, и пациенту была своевременно оказана неотложная помощь, дальнейшим шагом должно стать назначение тромбопрофилактики пероральными антикоагулянтами, которые рекомендуются всем больным на срок от 3 мес и дольше при отсутствии активного онкологического процесса. Дабигатрану, ривароксабану, апиксабану и эдоксабану американские эксперты присвоили одинаковый уровень доказательств В по результатам анализа проведенных исследований. Антагонисты витамина К (АВК) рекомендуются во вторую очередь (класс рекомендаций II, уровень доказательств С), если пациент по каким-либо причинам не принимает НОАК. Парентеральные антикоагулянты, а именно НМГ также имеют свои ниши применения: у больных с ВТЭ и активным раком доказаны их преимущества перед АВК (IIС). Стартовая парентеральная антикоагулянтная терапия также должна назначаться до начала приема дабигатрана, эдоксабана или АВК (при выборе ривароксабана или апиксабана она не требуется).
Что касается сроков антикоагулянтной терапии, то у пациентов с ТГВ или ТЭЛА, которые спровоцированы не хирургическими транзиторными факторами, рекомендуется продлить терапию как минимум до 3 мес или дольше (6, 12, 24 мес). Класс рекомендаций и уровень доказательств для разных сроков не отличаются (IВ). При планировании длительности антикоагулянтной терапии следует учитывать индивидуальный риск развития гипокоагуляции и геморрагических осложнений.
Пациентам с повторными ВТЭ, которые развиваются на фоне приема пероральных антикоагулянтов, рекомендуется назначение НМГ (IIС), а больным с повторными ВТЭ во время парентеральной антикоагулянтной терапии НМГ рекомендуется увеличить дозу препаратов на 1/4-1/3 от первоначальной (IIС). Вместе с тем эксперты отмечают, что повторные ВТЭ на фоне адекватной антикоагулянтной терапии в терапевтических дозах случаются редко, поэтому в таких случаях необходимо убедиться: а) действительно ли имеет место ВТЭ; б) соблюдает ли пациент режим антикоагулянтной терапии; в) заподозрить онкологический процесс.
Таким образом, рекомендации по первичной профилактике ВТЭ у госпитализированных терапевтических больных и у пациентов, у которых ВТЭ (в том числе повторные) развиваются в стационаре, имеют существенные различия как в отношении выбора антикоагулянтной терапии, так и в плане ее длительности. Иммобилизация или ограничение подвижности и в том, и в другом случае являются одними из наиболее значимых факторов риска, определяющих показания к назначению антикоагулянтной терапии.

Клинический случай
Клинический пример с назначением антикоагулянтной профилактики пациенту с длительной иммобилизацией нам предоставила доктор медицинских наук, профессор Виктория Юрьевна Жаринова (ГУ «Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины»).
В кардиологическое отделение ГУ «Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины» поступил мужчина 72 лет с жалобами на выраженное ограничение физической активности: выраженную одышку при минимальной физической нагрузке, приступы удушья по ночам, отеки на голенях и стопах, колебания артериального давления (АД) от 120/70 до 160/100 мм рт. ст.
Указанная симптоматика нарастала на протяжении последних 2-3 мес. За медицинской помощью пациент не обращался, продолжал плановый прием АСК, аторвастатина, периндоприла.
Болеет длительно артериальной гипертензией. В 2011 г. перенес острое нарушение мозгового кровообращения по ишемическому типу в бассейне правой средней мозговой артерии, в том же году больному выполнено стентирование внутренней сонной артерии справа.
По данным коронаровентрикулографии (2015 г.) – стеноз проксимальной ветви левой коронарной артерии 75%, от оперативного вмешательства пациент отказался.
Данные объективного обследования: кожные покровы бледные. Над легкими – ослабленное в нижних отделах дыхание, единичные хрипы. Границы относительной сердечной тупости расширены влево на 2 см, вправо – на 1 см. Деятельность сердца ритмичная, тоны приглушены, систолический шум на верхушке, частота сердечных сокращений (ЧСС) – 90 уд/мин, АД – 140/80 мм рт. ст. Живот вздут, печень выступает из-под края реберной дуги на 3 см, отеки стоп и голеней.
Инструментальные методы обследования
ЭКГ: ритм синусовый, тахикардия с ЧСС 90 уд/мин, электрическая ось сердца отклонена влево, признаки гипертрофии левого желудочка (ЛЖ), увеличения левого предсердия, инверсия зубца Т в передне-перегородочно-верхушечной области.
ЭхоКГ: левое предсердие – 5,34 см, правый желудочек – 4,8 см, конечный систолический размер –5,68 см, конечный диастолический размер – 6,78, фракция выброса (ФВ) ЛЖ – 20,8%, давление в легочной артерии – 70 мм рт. ст. Признаков наличия тромбов в полостях не выявлено.
Суточное мониторирование ЭКГ и АД: ритм синусовый, ЧСС – 55 уд/мин, макс. – 110 уд/мин, эпизоды депрессии ST длительностью до 5 мин – 4 эпизода, единичные суправентрикулярные экстрасистолы. Среднесуточное систолическое АД (САД) – 156 мм рт. ст, диастолическое АД (ДАД) – 96 мм рт. ст.
Оценка почечной функции: скорость клубочковой фильтрации (СКФ) – 35 мл/ мин/1,73 м2.
Тест с 6-минутной ходьбой: длительность дистанции – 125 м.
Осуществлена коррекция проводимой терапии: назначен прием бета-адреноблокаторов, антагонистов альдостерона в переносимых дозах, увеличена доза ингибитора ангиотензинпревращающего фермента, назначен петлевой диуретик торасемид и метаболическая терапия.
С целью профилактики венозных тромботических осложнений назначен НМГ в дозе 100 МЕ/кг 2 раза в сутки на протяжении 2 недель.
После курса терапии наблюдалась положительная динамика: улучшение самочувствия, отсутствие приступов кардиальной одышки, увеличение дистанции при проведении теста с 6-минутной ходьбой до 156 м, уменьшение отеков. По данным ЭхоКГ: ФВ ЛЖ – 32%. По результатам суточного мониторирования ЭКГ – 2 эпизода ишемии длительностью по 1 мин, САД – 145 мм рт. ст., ДАД – 89 мм рт. ст. СКФ – 42 мл/мин/1,73 м2.
Пациент выписан с улучшением состояния под наблюдение кардиолога по месту жительства.
Обсуждение
Назначение НМГ в данной клинической ситуации обусловлено несколькими обстоятельствами. Во-первых, предполагается, что пациент старше 70 лет с выраженной сердечной недостаточностью должен находиться на стационарном режиме в течение более 3 дней, имеет высокий риск развития венозных тромбоэмболических осложнений (5 баллов по шкале для госпитализированных пациентов терапевтического профиля Падуа). При этом риск кровотечений по шкале для терапевтических пациентов составляет 2,5 балла, что позволяет классифицировать его как низкий. Дополнительным аргументом для назначения антикоагулянтной терапии может быть клиническое состояние – наличие выраженной систолической дисфункции миокарда на фоне тяжелой ишемической болезни сердца; как правило, такое состояние сопровождается значительным ухудшением гемореологических показателей, что приводит к выраженной гипоксии тканей. В этой ситуации антикоагулянтная терапия способствует увеличению скорости кровотока, в первую очередь в микрососудах, и улучшению доставки тканям кислорода.
О современных стандартах тромбопрофилактики в ортопедической практике рассказывает главный научный сотрудник отдела заболеваний суставов у взрослых ГУ «Институт травматологии и ортопедии НАМН Украины», доктор медицинских наук, профессор Михаил Васильевич Полулях:
– Какое место занимает тромбопрофилактика в ведении пациентов, подвергающихся ортопедическим вмешательствам?
– Ортопедические операции на нижних конечностях, такие как эндопротезирование коленных и тазобедренных суставов, связаны с высоким риском тромбоэмболических осложнений, что обусловлено как непосредственно вмешательством (обширным травмированием тканей и активацией гемостаза), так и иммобилизацией в послеоперационном периоде. Поэтому тромбопрофилактика давно стала неотъемлемой частью мероприятий по контролю периоперационных рисков в ортопедической хирургии и травматологии. Согласно современным европейским и американским рекомендациям пациентам после эндопротезирования коленных или тазобедренных суставов с первых суток назначается тромбопрофилактика антикоагулянтами сроком до 35 дней (минимум 10-14 дней). Начинать антикоагулянтную терапию можно даже раньше – за 6-12 ч до операции. Пациенты, которые оперируются по поводу переломов бедренной кости, шейки бедра , также относятся к группе высокого риска тромбоэмболических осложнений и требуют назначения антикоагулянтов. Кроме того, антикоагулянты используются при артроскопии и других вмешательствах, которые могут увеличивать риск развития тромбозов, но на меньший срок и только пациентам с дополнительными факторами риска, например, с варикозным расширением поверхностных вен, сердечно-сосудистыми заболеваниями, избыточной массой тела или ожирением, женщинам, принимающим гормональные контрацептивы.
– Есть ли в руководствах и протоколах указания на конкретные сроки проведения антикоагулянтной терапии в зависимости от вида вмешательства?
– Проблема в том, что в существующих на сегодняшний день протоколах таких указаний нет. Сроки продления терапии в каждой конкретной ситуации определяет врач, исходя из степени риска развития ВТЭ у пациента, которая оценивается в хирургической практике по шкале Caprini, и степени риска кровотечения.
– Какие антикоагулянты применяются при проведении тромбопрофилактики в ортопедической практике?
– Чаще всего используют НМГ, которые рекомендуются всеми профильными ассоциациями Европы и США на основании убедительной доказательной базы в отношении эффективности и безопасности. НФГ практически вытеснен из практики.
Новые оральные антикоагулянты, такие как ривароксабан и дабигатран, дают возможность проводить профилактику ВТЭ достаточной длительности с дополнительным удобством для пациентов. Единственным ограничением для их применения в ортопедической хирургии, как указывают авторы зарубежных публикаций, считается возможность усиления кровотечений, которая недостаточно изучена. Поэтому при выборе антикоагулянта следует учитывать многие факторы: риск развития кровотечений, возможность длительной терапии НМГ после выписки из стационара, степень приверженности пациента к лечению и др.
– Какие еще методы тромбопрофилактики, помимо антикоагулянтной терапии, можно использовать у пациентов после ортопедических операций?
– Наряду с антикоагулянтной терапией не стоит преуменьшать роль механических средств тромбопрофилактики. Наиболее массовыми и доступными остаются компрессионные чулки. Реже применяется аппаратная методика перемежающейся пневматической компрессии нижних конечностей.
Ответственным моментом является начало мобилизации пациентов, перенесших ортопедические операции. Важно, чтобы в этот момент пациент еще находился под защитой антикоагулянтной терапии.
Подготовил Дмитрий Молчанов