15 квітня, 2020
Брентуксимабу ведотин у комбінації з хіміотерапією при III або IV стадії лімфоми Ходжкіна
Результати лікування пацієнтів з лімфомою Ходжкіна на пізніх стадіях значно покращилися за останні 50 років. Незважаючи на регіональні відмінності, схема першої лінії терапії, що найчастіше застосовується, – доксорубіцин + блеоміцин + вінбластин + дакарбазин (ABVD) – не зазнала змін з моменту її впровадження в 1975 р.
Після лікування за схемою першої лінії ABVD майже у 30% пацієнтів із III або IV стадією лімфоми Ходжкіна розвивається рефрактерна хвороба або рецидив. Застосування блеоміцину асоціюється з непередбачуваною, а іноді смертельною легеневою токсичністю, тому препарат часто виключають із подальших циклів хіміотерапії у зв'язку з виникненням легеневих симптомів. Результати останніх досліджень свідчать, що можна забезпечити більш індивідуалізований підхід до лікування, при якому інтенсивність терапії знижується або підвищується залежно від ранньої відповіді на лікування, яка оцінюється за допомогою проміжної позитронно-емісійної томографії (ПЕТ). Також докладаються зусилля для включення у загальноприйняті основні схеми терапії нових лікарських засобів для підвищення її ефективності та зниження токсичності.
CD30 – характерний поверхневий антиген, що експресується на клітинах Рід – Штернберга при класичній лімфомі Ходжкіна. Брентуксимабу ведотин є кон’югатом антитіла з лікарським засобом, який складається з моноклонального антитіла до CD30, кон’югованого за допомогою лінкера, що розщеплюється протеазою, до цитотоксичного агента (монометил-ауристатину Е), який руйнує мікротубули. Брентуксимабу ведотин був схвалений для лікування класичної лімфоми Ходжкіна після невдачі аутологічної трансплантації стовбурових клітин або після двох чи більше ліній поліхіміотерапії у пацієнтів, які не є кандидатами на трансплантацію. Препарат також затверджений для посттрансплантаційної консолідуючої терапії у пацієнтів з лімфомою Ходжкіна, які мають підвищений ризик розвитку рецидиву або прогресування захворювання.
У попередньому дослідженні I фази з ескалацією дози, в якому брали участь пацієнти з прогресуючою лімфомою Ходжкіна, оцінювали використання брентуксимабу ведотину як першої лінії терапії у поєднанні з ABVD або доксорубіцином, вінбластином і дакарбазином (AVD). Брентуксимабу ведотин + AVD (A+AVD) характеризувалися прийнятним профілем побічної дії та забезпечували повну відповідь у 24 (96%) з 25 пацієнтів. При лікуванні A+AVD 5-річна виживаність, не пов’язана з неефективністю лікування, становила 92%, а частота загальної виживаності – 100%. Для підтвердження цих результатів було проведено велике міжнародне відкрите рандомізоване багатоцентрове дослідження III фази ECHELON‑1 для порівняння A+AVD з ABVD як першої лінії терапії у пацієнтів із III або IV стадією класичної лімфоми Ходжкіна.
Методи
Дизайн дослідження
Пацієнтам випадковим чином у співвідношенні 1:1 було призначено лікування за схемою A+AVD (брентуксимабу ведотину – 1,2 мг/кг маси тіла, доксорубіцину – 25 мг/м2 площі поверхні тіла, вінбластину – 6 мг/м2 та дакарбазину – 375 мг/м2) або ABVD (доксорубіцину – 25 мг/м2, блеоміцину – 10 од./м2, вінбластину – 6 мг/м2 та дакарбазину – 375 мг/м2) внутрішньовенно в дні 1 та 15 кожного 28-денного циклу, до 6 циклів. Брентуксимабу ведотин вводили протягом 30 хв, приблизно через 1 год після завершення AVD. За результатами ПЕТ, проведеної наприкінці другого 28-денного циклу лікування (ПЕТ2), був можливий перехід на альтернативну першу лінію терапії на розсуд лікаря для пацієнтів із оцінкою 5 за шкалою Довіль (Deauville score).
Пацієнти
Пацієнти віком від 18 років мали гістологічно підтверджену класичну лімфому Ходжкіна (III або IV стадії за Енн-Арбор) за класифікацією Всесвітньої організації охорони здоров’я. Пацієнти, які раніше не отримували системну хіміотерапію або променеву терапію, могли брати участь у дослідженні. Не могли брати участь у дослідженні пацієнти з нодулярною лімфомою Ходжкіна та переважанням лімфоцитів, як і пацієнти з периферичною сенсорною чи моторною нейропатією, позитивним тестом на вагітність, відомим церебральним або менінгеальним захворюванням, будь-якими залишковими ознаками іншого онкозахворювання, діагнозом іншого онкозахворювання протягом 3 років до введення першої дози або будь-якою клінічно значущою серцево-судинною патологією.
Кінцеві точки
Первинною кінцевою точкою була модифікована виживаність без прогресування, визначена як час до прогресування захворювання, смерті або модифікованого прогресування (останнє трактується як ознаки неповної відповіді після завершення першої лінії терапії згідно з оцінкою незалежного комітету, з подальшою протипухлинною терапією наступної лінії). Ця кінцева точка була обрана спеціально для оцінки ефективності первинної хіміотерапії і охоплює три можливі результати, кожен з яких становить собою невдачу в лікуванні лімфоми Ходжкіна первинною хіміотерапією: документоване прогресування у будь-який час після початку первинної хіміотерапії, смерть з будь-якої причини та виявлення неповної відповіді при завершенні первинної хіміотерапії (оцінка за шкалою Довіль 3, 4 або 5 за ПЕТ-скануванням) з подальшим застосуванням наступної лінії протипухлинної терапії.
Ключовою вторинною кінцевою точкою була загальна виживаність, яка визначалася як час від рандомізації до смерті з будь-якої причини. Інші вторинні та дослідницькі кінцеві точки описані в протоколі.
Оцінювання
Відповідь та прогресування оцінювали за переглянутими критеріями відповіді на терапію з приводу злоякісної лімфоми. Комп’ютерну томографію проводили під час скринінгу, наприкінці 2-го циклу, після введення останньої дози першої лінії терапії та протягом періоду спостереження (через кожні 3 міс упродовж першого року та через кожні 6 міс після цього). ПЕТ-сканування проводилося при скринінгу, наприкінці 2-го циклу та в кінці лікування. Результатами з точки зору безпеки були випадки виникнення небажаних явищ (визначених відповідно до Медичного словника з регуляторної діяльності – MedDRA, версія 19.0, та Загальних критеріїв термінології для класифікації побічних реакцій Національного інституту раку США – CTCAE, версія 4.03) і зміни основних ознак життєдіяльності та результатів лабораторних досліджень.
Результати
Пацієнти
З 19 листопада 2012 р. по 13 січня 2016 р. загалом 1334 пацієнтам (популяція за призначеним лікуванням) у 218 центрах 21 країни був випадковим чином призначений прийом A+AVD (664 пацієнти) або ABVD (670 пацієнтів; рис. S1 у додатку). Загалом 58% пацієнтів становили чоловіки, а середній вік – 36 років (34% пацієнтів були старші 45 років), у 64% було захворювання IV стадії, у 62% – екстранодальні ураження на час встановлення діагнозу, 58% мали В-симптоми (втрата маси тіла, нічна пітливість і лихоманка). Характеристики на базовому візиті були, як правило, добре збалансовані між двома групами (детальний опис в табл. S3 у додатку, доступному у повному тексті цієї статті на NEJM.org).
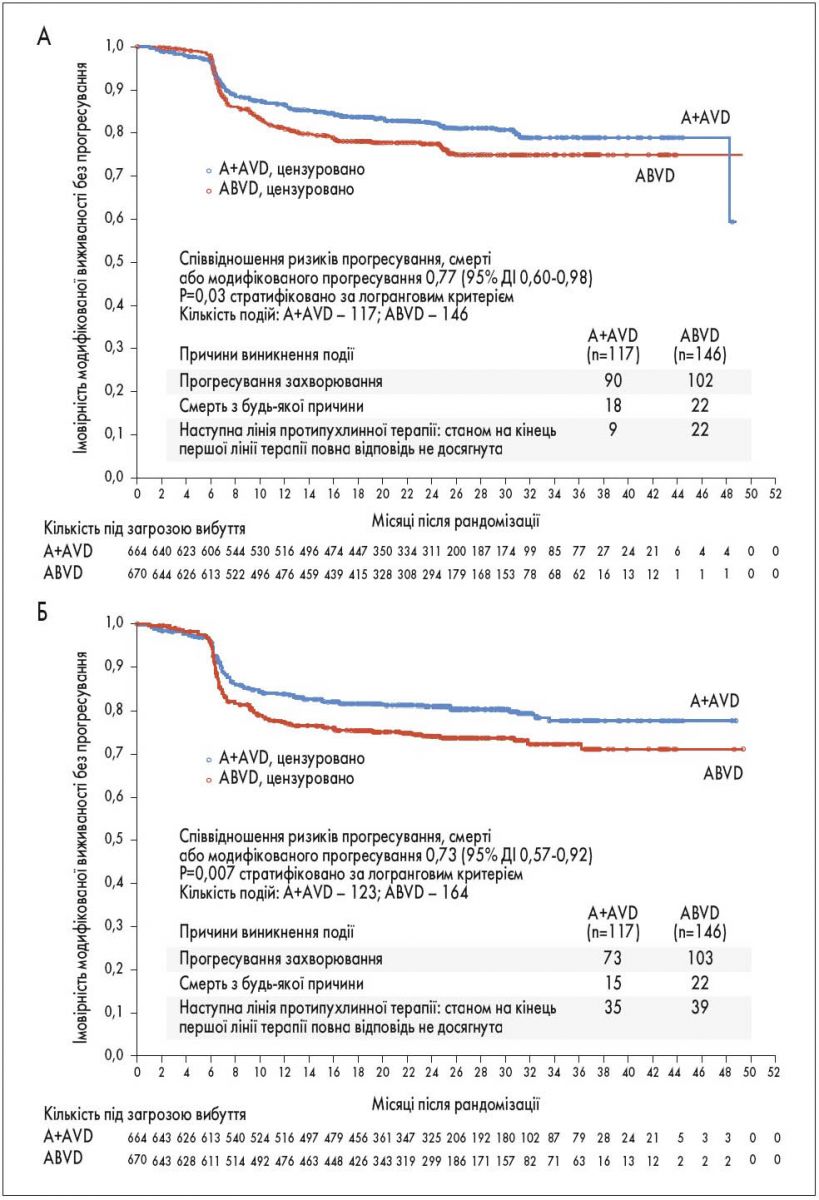
Рис. Модифікована виживаність без прогресування у популяції за призначеним лікуванням. A – оцінка Каплана – Маєра щодо модифікованої виживаності без прогресування за даними незалежного експертного комітету. Співвідношення ризиків для лікування A+AVD та ABVD та 95% ДІ базувалося на стратифікованій моделі пропорційної регресії ризиків Кокса, у якій регресором (пояснювальною змінною) було лікування. Фактори стратифікації включали регіон і групу ризику за IPS на базовому візиті. Б – оцінка Каплана – Маєра щодо модифікованої виживаності без прогресування за даними дослідників
Ефективність
Після медіани спостереження 24,9 міс (діапазон від 0 до 49,3 міс) частота досягнення первинної кінцевої точки – незалежно визначеної модифікованої виживаності без прогресування – була значно вищою у групі A+AVD, ніж у групі ABVD (2-річна модифікована виживаність без прогресування 82,1%; 95% довірчий інтервал – ДI – 78,7-85,0 проти 77,2%; 95% ДІ 73,7-80,4; відношення ризиків прогресування, смерті або модифікованого прогресування 0,77; 95% ДІ 0,60-0,98; P=0,03), що відповідає зниженню ризику на 23% (рис. А). Прогресування, смерть або модифіковане прогресування мали місце у 117 пацієнтів групи A+AVD та у 146 пацієнтів групи ABVD. Прогресування захворювання відбулося у 90 та 102 пацієнтів; смерть від будь-якої причини – у 18 та 22 пацієнтів; отримання наступної лінії протипухлинної терапії після неможливості досягти повної відповіді при завершенні першої лінії терапії (модифіковане прогресування) у 9 та 22 пацієнтів відповідно. У більшості (71% – 7 з 9 пацієнтів групи A+AVD та 15 з 22 пацієнтів групи ABVD) методом протипухлинної терапії була сальвадж-терапія, решта пацієнтів в обох групах отримала радіотерапію (табл. S4 у додатку).
Модифіковані події прогресування, визначені шляхом ПЕТ-сканування після лікування, та подальше лікування були пов’язані переважно з оцінкою 4 або 5 за Довіль (оцінка 3 була зафіксована у 7 (23%) з 31 пацієнта, оцінка 4 у 10 (32%) з 31 пацієнта, оцінка 5 у 14 (45%) з 31 пацієнта); ці події також відповідали критеріям прогресування за оцінкою дослідника. Зауважимо, що лише 7 з 21 пацієнта з оцінкою 3 за Довіль за результатами ПЕТ-сканування після закінчення лікування отримували додаткову терапію, і тому було встановлено, що вони мали модифіковане прогресування (2 пацієнти групи A+AVD та 5 пацієнтів групи ABVD).
За оцінкою дослідника дворічна модифікована виживаність без прогресування становила 81,0% (95% ДІ 77,6-83,9) при схемі A+AVD проти 74,4% (95% ДІ 70,7‑77,7) при схемі ABVD, що відповідає зниженню на 27% загального ризику настання події серед пацієнтів, які отримували A+AVD, порівняно з пацієнтами, яких лікували за схемою ABVD (співвідношення ризиків прогресування, смерті або модифікованого прогресування 0,73; 95% ДІ 0,57-0,92; P=0,007; рис. Б).
Відповідність між незалежним оглядом і визначенням події модифікованої виживаності без прогресування дослідником становила 91%.
Аналіз модифікованої виживаності без прогресування у заздалегідь визначених підгрупах показав співвідношення ризиків <1 для схеми A+AVD порівняно зі схемою ABVD для більшості підгруп. Окремі підгрупи пацієнтів мали переваги при лікуванні A+AVD порівняно з ABVD. Ці підгрупи включали пацієнтів з Північної Америки, пацієнтів із більш ніж одним екстранодальним ураженням, пацієнтів з IPS, що вказував на високий ризик невдачі лікування (від 4 до 7 балів), чоловіків, пацієнтів із захворюванням IV стадії та пацієнтів молодших 60 років. Частота негативного результату ПЕТ2 (оцінка за Довіль 1-3) становила 89% у разі використання A+AVD проти 86% у разі ABVD.
У групі A+AVD було 28 випадків смерті: 9 під час лікування (протягом 30 днів після введення останньої дози першої лінії терапії) та 19 під час спостереження (31 день і більше після введення останньої дози першої лінії терапії). У групі ABVD зафіксовано 39 випадків смерті: 13 під час лікування та 26 під час спостереження. Проміжна 2-річна загальна виживаність для групи A+AVD становила 96,6% (95% ДІ 94,8-97,7), а для групи ABVD – 94,9% (95% ДІ 92,9-96,4), що відповідало зниженню ризику смерті на 28% на користь схеми A+AVD (співвідношення ризиків 0,72; 95% ДІ 0,44-1,17; Р=0,19). Лише 15 з 662 пацієнтів, які отримували A+AVD, і 9 із 659 пацієнтів, які отримували ABVD, перейшли на альтернативну хіміотерапію під час першої лінії терапії з інших причин, ніж прогресування захворювання (оцінка за Довіль 5 балів в 1 з 15 та 4 із 9 пацієнтів відповідно; небажані явища у 12 з 15 та 1 з 9 пацієнтів відповідно; інші причини у 2 з 15 та 4 із 9 пацієнтів відповідно; табл. S5 у додатку).
Загалом у групі A+AVD менше пацієнтів, ніж у групі ABVD, отримували наступні лінії протипухлинної терапії. Методи цієї терапії були такими: променева терапія – у 52 пацієнтів у кожній групі, хіміотерапія – у 66 проти 99 пацієнтів, високодозова хіміотерапія + трансплантація – у 36 проти 54, імунотерапія – у 10 проти 16 та хіміотерапія + променева терапія у 2 проти 3 учасників.
Безпека
Медіана тривалості лікування та кількість завершених циклів були однаковими в обох групах.
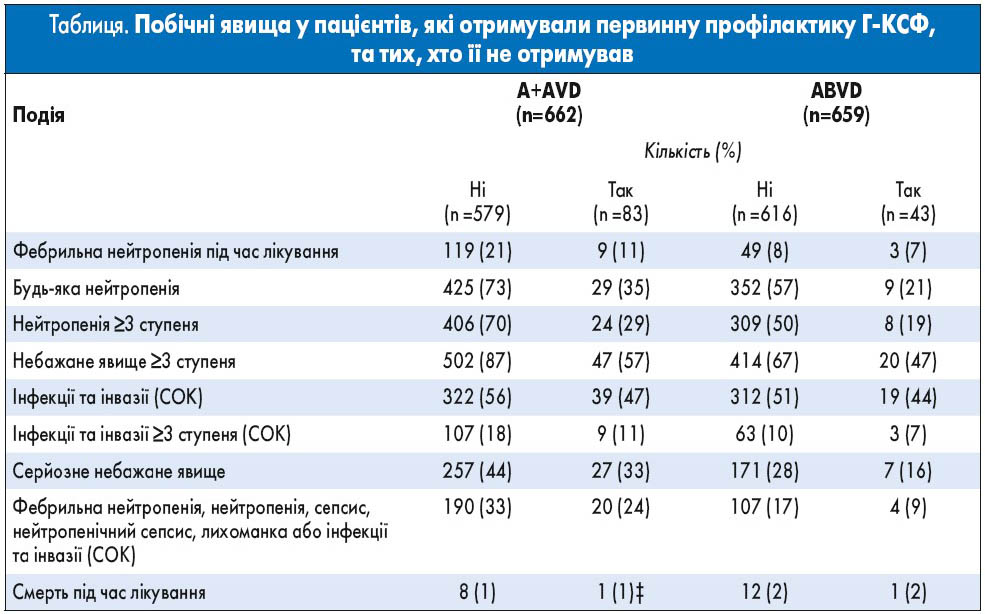
Загалом повідомлялося про нейтропенію у 58% пацієнтів, які отримували A+AVD, і у 45% хворих, які отримували ABVD, а про фебрильну нейтропенію – відповідно у 19 та 8%. В обох групах частота фебрильної нейтропенії була вищою серед пацієнтів віком 60 років або старших, ніж серед пацієнтів, молодших за 60 років (37 проти 17% у групі A+AVD і 17 проти 6% у групі ABVD). Частота фебрильної нейтропенії також була вищою при ранніх циклах терапії в обох групах, ніж пізніших (9% у циклі 1 та від 1 до 6% у циклах 2-6 у групі A+AVD; 4% у циклі 1 та ≤1% у циклах 2-6 у групі ABVD). Частота відміни будь-якого досліджуваного препарату через нейтропенію або фебрильну нейтропенію в обох групах становила 1% або менше.
Частота виникнення інфекцій, визначених відповідно до терміна первинного системно-органного класу MedDRA «інфекції та інвазії», у групі A+AVD склала 55% (у 361 з 662 пацієнтів), а у групі ABVD – 50% (у 331 з 659 пацієнтів); інфекції 3 ступеня та вище – 18% (у 116 з 662 пацієнтів) проти 10% (у 66 з 659 пацієнтів) відповідно.
Після обговорення з незалежним комітетом моніторингу даних і профілю безпеки (при досягненні 76% набору до дослідження) було рекомендовано первинну профілактику гранулоцитарним колонієстимулювальним фактором (Г-КСФ) для пацієнтів, які надалі будуть включені та отримають схему A+AVD, через вищу частоту фебрильної нейтропенії в цій групі. У групі A+AVD частота фебрильної нейтропенії була нижчою у 83 пацієнтів, які отримували первинну профілактику Г-КСФ (використання Г-КСФ до 5-го дня лікування), ніж серед тих, які не проходили профілактику: 11 (9 з 83) проти 21% (119 з 579) пацієнтів (табл.). Частота інфекцій 3 ступеня або вище також була нижчою серед пацієнтів, які отримували Г-КСФ, ніж серед тих, які не проходили профілактику: 11 (9 з 83) проти 18% (107 з 579) учасників.
Периферична нейропатія (визначається на основі стандартизованого запиту MedDRA) спостерігалася у 67% (442 з 662) пацієнтів, які отримували A+AVD, і у 43% (286 з 659) пацієнтів, які отримували ABVD. Периферична нейропатія 2 ступеня спостерігалася у 20% (130 з 662) пацієнтів у групі A+AVD та 9% (57 з 659) пацієнтів у групі ABVD. Периферична нейропатія 3 ступеня і вище зафіксована в 11% (70 з 662) пацієнтів першої групи (4 ступінь – в 1 пацієнта) та 2% (11 з 659) пацієнтів другої групи. Досліджуваний препарат було відмінено у 10% (44 з 442) осіб із периферичною нейропатією у групі A+AVD та 4% (11 з 286) у групі ABVD. У 2/3 (295 з 442) пацієнтів групи A+AVD з периферичною нейропатією симптоми зникли (43%; 191 з 442) або їх тяжкість зменшилася принаймні на один ступінь (24%; 104 з 442) порівняно з таким під час останнього візиту. У групі A+AVD 92% подій, пов’язаних із периферичною нейропатією, відповідали ступеню 1 (64%) або 2 (29%).
Про легеневу токсичність, визначену як події, пов’язані з інтерстиціальною хворобою легень (відповідно до стандартизованого запиту MedDRA), повідомлялося у 2% (12 з 662) пацієнтів у групі A+AVD проти 7% (44 з 659) у групі ABVD; про події 3 ступеня або вище повідомлялося менше ніж в 1% (5 з 662) пацієнтів у першій групі та 3% (21 з 659) пацієнтів у другій.
Під час лікування в групі A+AVD зафіксовано 9 випадків смерті проти 13 у групі ABVD. У групі A+AVD 7 випадків смерті були пов’язані з нейтропенією (всі – у пацієнтів, які не отримували первинну профілактику Г-КСФ до початку нейтропенії, за винятком 1 пацієнта, включеного до дослідження з наявною нейтропенією) та 2 були наслідками інфаркту міокарда. У групі ABVD 11 випадків смерті сталися внаслідок легеневої токсичності або були пов’язані з нею, а 1 – серцево-легеневої недостатності. Причина 1 випадку смерті невідома. Серед пацієнтів, які брали участь у дослідженні, 37% (242 з 662) у групі A+AVD та 28% (186 з 659) у групі ABVD були госпіталізовані під час дослідження.
Репродуктивну функцію формально не оцінювали, однак в обох групах лікування повідомлялося про подібну кількість вагітностей, це дозволяє припустити, що істотної різниці у впливі на репродуктивну функцію не було. На момент проведення цього аналізу разом було зареєстровано 78 випадків вагітності серед учасниць дослідження: 42 у групі A+AVD та 36 у групі ABVD.
Обговорення
Результати цього великого міжнародного рандомізованого дослідження III фази за участю пацієнтів, яким нещодавно було встановлено діагноз класичної лімфоми Ходжкіна III або IV стадії, показали, що лікування брентуксимабу ведотином + AVD порівняно зі стандартним лікуванням ABVD сприяло статистично та клінічно значущому покращенню частоти модифікованої виживаності без прогресування з різницею 6,6% на момент 4,9 року за оцінкою незалежного комітету, члени якого не знали про препарати, призначені групам, та 6,6% за оцінкою дослідників. Ці результати були пов’язані зі зниженням загального ризику невдачі первинної хіміотерапії на 23% за оцінкою незалежного експертного комітету та на 27% за оцінкою дослідників.
Результати проміжного аналізу загальної виживаності та всіх інших вторинних кінцевих точок ефективності показують перевагу A+AVD. Це додатково підтверджує висновок про те, що A+AVD є ефективнішою схемою першої лінії терапії при лімфомі Ходжкіна у пізній стадії, ніж ABVD. Крім того, перевага A+AVD спостерігалася послідовно у більшості попередньо визначених підгруп, включаючи пацієнтів із більш ніж одним екстранодальним ураженням, пацієнтів з IPS, що вказував на високий ризик невдачі лікування (від 4 до 7 балів), та пацієнтів із захворюванням IV стадії. Частота позитивних результатів ПЕТ2 була низькою, і більша частка пацієнтів, які отримували A+AVD, ніж пацієнтів, які отримували ABVD, мали негативні результати ПЕТ2 (89 проти 86%).
Отже, додавання брентуксимабу ведотину та виключення блеоміцину зі схеми A+AVD у першій лінії терапії знижує частоту легеневої токсичності при одночасному поліпшенні ефективності порівняно зі схемою ABVD. Не виявлено нових видів ризику для безпеки пацієнтів, хоча частота фебрильної нейтропенії була вищою, ніж очікувалося, й у групі A+AVD відмічена підвищена частота інфекцій. Більшість випадків смерті під час лікування у групі A+AVD були пов’язані з фебрильною нейтропенією. Однак первинна профілактика Г-КСФ, вочевидь, компенсувала підвищений ризик фебрильної нейтропенії та її наслідки у підгрупі 83 пацієнтів, яким її проводили, внаслідок чого знижувалась частота розвитку нейтропенії, фебрильної нейтропенії та серйозних інфекцій. Периферичну нейропатію частіше фіксували у пацієнтів групи A+AVD. Частота виникнення периферичної нейропатії 3 ступеня або вище була вищою на 9% у цій групі порівняно з групою ABVD, але це явище було переважно зворотним, зникало або його тяжкість зменшувалася у 67% пацієнтів. Частка пацієнтів, які отримували наступну хіміотерапію, а також високодозову хіміотерапію з подальшою трансплантацією, була приблизно на 33% меншою у групі A+AVD, ніж ABVD. В учасників дослідження, яких лікували за схемою A+AVD, була менша ймовірність виникнення токсичності, пов’язаної з агресивною терапією порятунку.
Результати дослідження ECHELON‑1 особливо важливі, тому що A+AVD можна призначати пацієнтам літнього віку, таке лікування щонайменше є еквівалентним ABVD за ефективністю і безпекою. Пацієнти літнього віку із запущеною лімфомою Ходжкіна є особливою групою, враховуючи частоту захворювання (приблизно 20% усіх випадків), нижчу ефективність лікування та, як правило, вищу виражену токсичність, особливо легеневу токсичність, пов’язану із введенням блеоміцину. Обираючи першу лінію терапії, важливо враховувати довічний тягар відстрочених і довготривалих несприятливих наслідків хіміотерапії, радіотерапії та трансплантації (включаючи безпліддя, легеневу та серцеву токсичність і вторинні онкозахворювання). Схема A+AVD асоціюється з вищою мієлотоксичністю (яка може бути пом’якшена за допомогою профілактичного застосування Г-КСФ) та нейротоксичністю (яка значною мірою зворотна), ніж ABVD, але значно нижчою легеневою токсичністю і, вочевидь, є більш ефективною для першої лінії терапії при класичній лімфомі Ходжкіна у пізній стадії.
Список літератури знаходиться в редакції.
Реферативний переклад з анг.
Connors J.M. et al. Brentuximab Vedotin with Chemotherapy for Stage III or IV Hodgkin’s Lymphoma. NEJM. 2017 Dec 10, at NEJM.org. DOI: 10.1056/NEJMoa1708984.
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 1 (62), 2020 р.