25 травня, 2020
Влияние диосмина на факторы ангиогенеза у пациентов с хроническими заболеваниями вен нижних конечностей
Целью данного исследования была оценка влияния диосмина на уровень отдельных факторов ангиогенеза, участвующих в патогенезе развития хронических заболевания вен нижних конечностей, таких как фактор некроза опухоли-альфа (ФНО-α), факторы роста эндотелия сосудов (VEGF-А и VEGF-С), ангиостатин, интерлейкин 6 (ИЛ-6), фактор роста фибробластов 2 (FGF‑2) и плазминоген. Через 3 мес после применения диосмина в дозе 600 мг по 2 раза в день значительно снизились уровни ФНО-α, VEGF-А и VEGF-С, ИЛ-6 и FGF‑2 и повысился уровень ангиостатина, что клинически сопровождалось уменьшением отечности ног.
Ключевые слова: диосмин, хронические заболевания вен нижних конечностей, ангиостатин, фактор роста эндотелия сосудов, фактор некроза опухоли-альфа, интерлейкин 6, фактор роста фибробластов, плазминоген.
Диосмин – это природное соединение класса флавоноидов, которое содержится в цитрусовых и в некоторых представителях семейства рутовых. Диосмин обладает широким спектром биологической активности; однако наибольшее значение имеет его влияние на сердечно-сосудистую систему. Доказано, что диосмин улучшает лимфодренаж и микроциркуляцию крови, повышает тонус и эластичность венозных сосудов, усиливает капиллярное сопротивление, а также снижает проницаемость капилляров [1-5]. Кроме того, диосмин оказывает противовоспалительное действие и уменьшает оксидативный стресс [6], что позволяет считать его важным инструментом в лечении хронических заболеваний вен нижних конечностей (ХЗВ).
ХЗВ – это патология, связанная с функциональными и морфологическими нарушениями венозной системы. Наиболее частые симптомы ХЗВ – отеки, поражения кожи и изменения структуры венозной стенки, такие как варикозное расширение вен и трофические язвы нижних конечностей [7, 8]. На начальной стадии ХЗВ из-за недостаточности венозных клапанов возникает обратный ток крови, вследствие чего развивается устойчивая венозная гипертензия, при которой повышается гидростатическое давление в поверхностных подкожных венах и капиллярах. Это приводит к транскапиллярной фильтрации с чрезмерным лимфатическим потоком, в результате чего образуются отеки [9, 10]. Проявления ХЗВ значительно снижают качество жизни пациентов.
 В соответствии с Международной классификацией хронических заболеваний вен нижних конечностей (CEAP), основанной на клинике, этиологии, анатомии и патофизиологии, выделяют несколько клинических стадий ХЗВ – от C0 до C6 (табл. 1).
В соответствии с Международной классификацией хронических заболеваний вен нижних конечностей (CEAP), основанной на клинике, этиологии, анатомии и патофизиологии, выделяют несколько клинических стадий ХЗВ – от C0 до C6 (табл. 1).
Кожные повреждения на поздних стадиях ХЗВ, обусловленные усилением пролиферации капилляров кожи и микроциркуляторными нарушениями, могут быть связаны с изменениями уровня таких факторов, как фактор роста эндотелия сосудов (VEGF), фактор роста фибробластов 2 (FGF-2) и ангиостатин.
VEGF представляет собой семейство из пяти белков, два из которых – VEGF- A и VEGF-C – играют значимую роль в патогенезе ХЗВ. VEGF-A и VEGF-C стимулируют формирование сосудов и повышают проницаемость эндотелиальных клеток путем образования везикуло-вакуолярных органелл, обеспечивающих транспорт фибриногена и плазминогена из кровеносного русла в окружающие ткани [11]. В свою очередь, FGF‑2 является гепарин-связывающим белком, способствующим пролиферации клеток разного типа. В частности, FGF‑2 способствует активизации ангиогенеза, что было доказано во многих опытах на животных [12].
С другой стороны, ангиостатин является мощным ингибитором ангиогенеза. Он образуется при расщеплении плазминогена различными протеазами, активными в нейтрофилах крови и периваскулярном пространстве (например, ММР‑3, -7, -12). Действие ангиостатина специфично и направлено исключительно на эндотелиоциты. Он ингибирует как пролиферацию и миграцию эндотелиоцитов, так и формирование эндотелиальной трубки, а также стимулирует апоптоз эндотелиоцитов. Кроме того, ангиостатин блокирует образование капилляров и снижает проницаемость сосудов [13, 14]. Плазминоген, как предшественник образования ангиостатина, также может принимать участие в патогенезе ХЗВ.
Следует отметить, что у пациентов с ХЗВ повышение гидростатического давления и стаз крови в капиллярах способствуют адгезии лейкоцитов к эндотелию капилляров и запускают каскад воспалительных реакций с участием различных медиаторов воспаления [15].
Положительный эффект диосмина на качество жизни пациентов с ХЗВ был доказан во многих научных работах [8, 16]; однако механизмы биологического действия этого соединения по-прежнему представляют интерес для многих исследователей.
Цель нашего исследования заключалась в изучении влияния диосмина у пациентов с ХЗВ на уровень некоторых факторов ангиогенеза, в соответствии с высказанными ранее предположениями о проангиогенном действии VEGF при ХЗВ [16-18]. Кроме того, в данном исследовании контролировался уровень провоспалительных цитокинов, включая фактор некроза опухоли-альфа (ФНО-α) и интерлейкин 6 (ИЛ‑6), поскольку они также могут способствовать образованию кровеносных сосудов, воздействуя на эндотелиоциты прямо или опосредованно через ангиогенные медиаторы [19].
Материалы и методы
Отбор пациентов и способ применения диосмина
 Исследование было одобрено Независимым комитетом по этике Люблинского медицинского университета. Письменное информированное согласие было получено от всех участников исследования. В период с апреля 2014 года по июнь 2016 года 38 пациентов с диагнозом «Первичное варикозное расширение вен нижних конечностей», соответствующие критериям отбора для фармакологического лечения ХЗВ, прошли скрининг для участия в данном исследовании на кафедре сосудистой хирургии и ангиологии Люблинского медуниверситета. Критериями исключения являлись сахарный диабет, аутоиммунные заболевания, онкологические процессы, почечная недостаточность, заболевания печени, недавние операции или травмы, предшествующие операции на вене, тромбоз глубоких и/или поверхностных вен, застойная сердечная недостаточность и беременность. Критерии включения представляли собой наличие первичного ХЗВ степени C2, C3 или C4 в соответствии с классификацией CEAP с двусторонним вовлечением в патологический процесс большой подкожной вены в области бедра и голени. Ни один из пациентов не принимал ни диуретики, ни вазоактивные препараты в течение не менее чем 3 мес до начала исследования. На протяжении всего периода исследования участники не использовали ни диуретики, ни компрессионную терапию. Ранее пациенты, отобранные для исследования, получали компрессионную терапию, но нашли ее «невыносимой» и «раздражающей». Трое пациентов не завершили терапию (по неизвестным причинам) и были исключены из исследования.
Исследование было одобрено Независимым комитетом по этике Люблинского медицинского университета. Письменное информированное согласие было получено от всех участников исследования. В период с апреля 2014 года по июнь 2016 года 38 пациентов с диагнозом «Первичное варикозное расширение вен нижних конечностей», соответствующие критериям отбора для фармакологического лечения ХЗВ, прошли скрининг для участия в данном исследовании на кафедре сосудистой хирургии и ангиологии Люблинского медуниверситета. Критериями исключения являлись сахарный диабет, аутоиммунные заболевания, онкологические процессы, почечная недостаточность, заболевания печени, недавние операции или травмы, предшествующие операции на вене, тромбоз глубоких и/или поверхностных вен, застойная сердечная недостаточность и беременность. Критерии включения представляли собой наличие первичного ХЗВ степени C2, C3 или C4 в соответствии с классификацией CEAP с двусторонним вовлечением в патологический процесс большой подкожной вены в области бедра и голени. Ни один из пациентов не принимал ни диуретики, ни вазоактивные препараты в течение не менее чем 3 мес до начала исследования. На протяжении всего периода исследования участники не использовали ни диуретики, ни компрессионную терапию. Ранее пациенты, отобранные для исследования, получали компрессионную терапию, но нашли ее «невыносимой» и «раздражающей». Трое пациентов не завершили терапию (по неизвестным причинам) и были исключены из исследования.
Пациенты 2 раза в день получали по 600 мг диосмина (Флебодиа, Laboratoires Innothera, Arcueil, Франция). Они были проинструктированы придерживаться своих каждодневных привычек в питании, работе и отдыхе. Контрольные осмотры проводились каждые 30 дней. Все анализы были проведены до (T0) и через 3 мес (T3m) терапии. Пациенты отметили отсутствие побочных эффектов после применения диосмина.
Конфликт интересов: авторы статьи заявляют об отсутствии конфликта интересов.
Результаты
Клинические симптомы
В соответствии с клиническими симптомами пациенты с ХЗВ были разделены на следующие группы: С2 – пациенты с варикозным расширением вен; С3 – пациенты с варикозным расширением вен и отеками; С4 – пациенты с варикозным расширением вен, отеками и поражениями кожи.
Первоначально было проведено допплеровское ультразвуковое исследование для оценки изменений в венозном кровотоке во время компрессионного теста [20]. У каждого пациента, включенного в исследование, при компрессии определялся обратный ток крови продолжительностью более 1 секунды.
Одним из критериев исключения был тромбоз венозных сосудов (определенный с помощью допплеровского ультразвукового исследования), поскольку у таких пациентов венозная недостаточность считается генетически обусловленной, тогда как данное исследование было направлено на изучение ХЗВ неизвестной этиологии.
Оценка патологических симптомов, обусловленных отеком нижних конечностей, проводилась путем мониторинга периваскулярных пространств. У 13 пациентов экстравазации жидкости в периваскулярное пространство по результатам УЗИ не наблюдалось, следовательно, эти пациенты были отнесены в группу С2. Жидкость в периваскулярном пространстве определялась у 22 пациентов, шесть из которых имели кожные поражения и потому были отнесены в группу C4; остальные же определялись как группа C3.
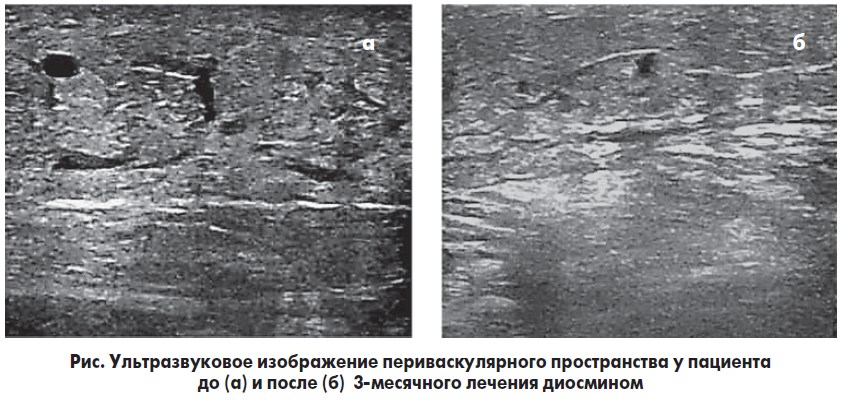
После 3-месячного лечения диосмином единственным изменением по результатам допплеровского ультразвукового исследования было уменьшение экстравазации жидкости в периваскулярное пространство, которое отмечалось у 78% пациентов из группы C3 и у 83% – из группы C4. При этом средняя окружность ног у пациентов значительно уменьшилась – с 30,74 (±0,58) см до 29,11 (±0,39) см (р<0,05). Примеры сонограмм с периваскулярным пространством до и после лечения диосмином показаны на рисунке (a и б соответственно).
Оценка интенсивности боли проводилась по визуально-аналоговой шкале (ВАШ). У 10 пациентов (28,5%) болевой симптом отсутствовал. Остальные 25 пациентов ощущали слабую боль (1-3 балла по ВАШ). Из них 19 отметили снижение интенсивности боли после применения диосмина.
Таким образом, облегчение симптомов ХЗВ после применения диосмина позволило перевести 13 пациентов из группы С3 в группу С2.
Основные биохимические показатели
Пациенты с уровнями триглицеридов, С-реактивного белка, креатинина, превышающими норму, не включались в исследование. Также для оценки возможных изменений проводился мониторинг некоторых биохимических показателей до и после 3-месячного курса диосмина. Значимых изменений (р<0,05) в уровнях исследуемых маркеров обнаружено не было.
Мониторинг уровней ФНО-α, ИЛ‑6, VEGF-A, VEGF-C, FGF‑2, плазминогена и ангиостатина в плазме
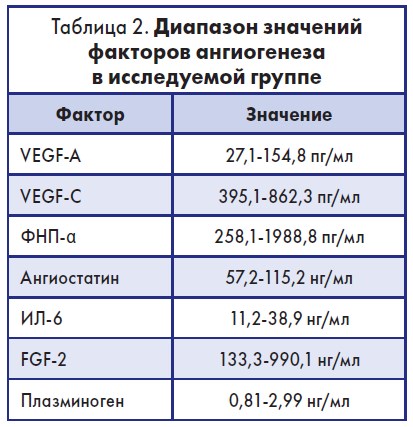 В исследуемой группе наблюдался большой разброс в уровнях вышеуказанных факторов ангиогенеза, особенно до применения диосмина (табл. 2).
В исследуемой группе наблюдался большой разброс в уровнях вышеуказанных факторов ангиогенеза, особенно до применения диосмина (табл. 2).
Разброс значительно снизился после терапии диосмином, особенно показательно – для VEGF-C (322,8- 444,3 пг/мл) и ФНО-α (201,2-599,8 пг/мл). Среднее содержание VEGF-A (р<0,05), VEGF-C (р<0,05), ФНО-α (р<0,001), ИЛ‑6 (р<0,01) и FGF‑2 (р<0,01) снизилось в значительной степени после применения диосмина, а также достоверно (р<0,05) возрос уровень ангиостатина в плазме крови. Существенных различий в сывороточной концентрации плазминогена до и после применения диосмина не наблюдалось.
Анализ данных по отдельным классам больных ХЗВ не выявил статистически значимых различий в уровнях VEGF-C, ФНО-α, ангиостатина и плазминогена между группами C2, C3 и C4 до лечения диосмином. Что касается VEGF-A, то значимые различия до начала терапии были продемонстрированы только между группами C4 и C2 (p=0,05), а также между C4 и C3 (p=0,05).
Уровни ИЛ‑6 и FGF‑2 значительно различались между исследуемыми группами как до, так и после введения диосмина. Для ИЛ‑6 статистически значимые различия наблюдались между группами С2 – С4 (р=0,001) и С3 – С4 (р=0,01). Вместе с тем для FGF‑2 были отмечены различия между группами C2 и C3 (p=0,01), а также между C2 и C4 (р=0,0001).
Различия между группами по уровню VEGF-C, ФНО-α и плазминогена после введения диосмина были статистически незначимыми. Отмечались различия в уровне ангиостатина между группами С2 и С3 (р=0,0005), а также между С2 и С4 (р= 0,0001). В каждой группе определялось снижение уровней VEGF-C, ФНО-α и VEGF-A, а также повышение уровня ангиостатина.
Изменение уровня исследуемых показателей у пациентов до и после терапии диосмином оценивалось путем корреляционного анализа с использованием критерия Спирмена (р<0,05, s<0,05). Были выявлены достоверные корреляции между уровнями VEGF-A T0/T3m и ангиостатином T0/T3m.
Обсуждение
Положительное влияние применения диосмина на качество жизни пациентов с ХЗВ, выражающееся в уменьшении отечности ног и облегчении болевого синдрома, было описано ранее в многочисленных исследованиях, и результаты нашей работы также подтверждают это наблюдение. Однако механизм действия диосмина изучен не полностью. Исследование факторов, участвующих в патогенезе ХЗВ, таких как ИЛ‑6, ФНО-α, FGF‑2 и VEGF, может оказаться полезным в попытке объяснить этот механизм. Наше исследование доказало, что 3-месячный курс диосмина в суточной дозе 1200 мг, разделенной на два приема (перорально), значительно снижает уровень некоторых провоспалительных и проангиогенных факторов, в частности ФНО-α, ИЛ‑6, FGF‑2, VEGF-A и VEGF-C. В результате такой терапии уменьшается интерстициальный отек, подавляется воспаление и снижается интенсивность боли, а также угнетаются VEGF-опосредованные процессы.
У пациентов с ХЗВ было обнаружено увеличение экспрессии общего VEGF по сравнению с контрольной группой, что подтверждает его роль в развитии патологии венозной системы [18]. VEGF-C стимулирует лимфангиогенез и регулирует рост лимфатических сосудов. Вазодилатация и повышенная проницаемость сосудов приводит к тому, что объем транскапиллярной фильтрации превышает лимфатический отток, вследствие чего через VEGF-опосредованные механизмы формируется интерстициальный отек. Кроме того, ФНО-α и VEGF участвуют в регуляции многих стадий ангиогенеза [21], а синергетическое действие FGF и VEGF известно как ключевой регуляторный механизм этого процесса [12]. FGF и VEGF также способствуют пролиферации капилляров на поздних стадиях ХЗВ. Известно, что пролиферация и извитость капилляров являются характерными признаками поздних стадий ХЗВ (C4, C5).
Ангиогенез является неблагоприятным процессом при заболеваниях венозной системы и может привести к кожным повреждениям на поздних стадиях ХЗВ. В свою очередь, активированные лейкоциты могут выделять в большом количестве эластазу и другие протеиназы, действие которых связано с повреждением тканей и липодерматосклерозом [24]. Протеиназы, высвобожденные лейкоцитами/нейтрофилами, способствуют образованию таких ингибиторов ангиогенеза, как ангиостатин. Развитие ХЗВ связывают с нарушением регуляции ангиогенеза, вызванным локальным дисбалансом между про- и антиангиогенными соединениями [21, 24]. С другой стороны, в местах хронического воспаления, повреждения тканей и при онкологических заболеваниях повышается уровень FGF‑2, поскольку клетки, участвующие в воспалительном процессе, включая мононуклеары, Т-лимфоциты и тучные клетки, увеличивают экспрессию этого фактора. Также было доказано, что FGF‑2 может усиливать провоспалительный ответ эндотелиоцитов [12]. Howlader et al. наблюдали повышение уровня VEGF в плазме у пациентов, имеющих значительные отеки, и пришли к выводу, что этот показатель коррелировал как со стадией CEAP, так и с субъективным ощущением отечности [25].
Механизм возникновения боли при заболеваниях вен связан с провоспалительными медиаторами, высвобождаемыми лейкоцитами, а также с активацией рецепторов в венозных стенках [26, 27]. В предыдущих исследованиях была выявлена положительная корреляция между венозным стазом (снижением оттока крови) и ИЛ‑6 [28], что свидетельствует о важной роли последнего в каскаде воспалительных реакций, связанных с различными сосудистыми заболеваниями [29]. В стенках варикозно-расширенных вен, измененных при хроническом воспалении, присутствуют немиелинизированные нервные С-волокна, которые играют ключевую роль в запуске болевого синдрома [27, 30].
Следует отметить, что боль не всегда присутствует при ХЗВ. В одном из исследований боль отсутствовала у 45% пациентов с рефлюксом, выявленным с помощью допплеровского ультразвукового исследования нижних конечностей, и не зависела от степени варикозного расширения вен [27]. В нашем исследовании незначительную боль ощущали 71,5% пациентов. После 3 мес лечения диосмином эти пациенты отмечали уменьшение как болевого синдрома, так и отека, что сопровождалось значительным увеличением уровня ангиостатина и снижением уровня VEGF в плазме. Значительных изменений уровня плазминогена в нашем исследовании не наблюдалось.
Повышение уровня ангиостатина предполагает усиление расщепления плазминогена (поскольку он является источником ангиостатина). Принимая это во внимание, можно сделать вывод, что 3-месячный курс диосмина увеличивает синтез плазминогена. С другой стороны, повышение уровня ангиостатина в сыворотке крови изменяет взаимодействие VEGF с ингибитором активатора плазминогена (PAI) и активатором плазминогена урокиназного типа (uPA), в результате чего уровень плазминогена остается прежним.
Одним из ограничений этого исследования является то, что пациенты не использовали средства компрессионной терапии. Другим недостатком была небольшая выборка пациентов, но, с другой стороны, благодаря небольшому количеству участников исследуемая группа была однородной.
Таким образом, 3-месячный курс диосмина снижает интенсивность как провоспалительных, так и про- и антиангиогенных процессов у пациентов с ХЗВ. Как вазоактивное фармакологическое средство диосмин способен предотвратить прогрессирование отеков, ингибируя процесс воспаления и изменяя баланс про-/антиангиогенных факторов путем снижения уровня первых и увеличения уровня вторых.
Реферативный обзор подготовила Екатерина Чернышова
По материалам M. Feldo,
M. Wójciak-Kosior, I. Sowa, J. Kocki et al.
Effect of Diosmin Administration in Patients
with Chronic Venous Disorders on Selected Factors Affecting Angiogenesis.
Molecules 2019, 24, 3316.
ФЛЄБОДІА 600 мг. Склад: діюча речовина: діосмін (diosmine); 1 таблетка містить діосмін, що відповідає 600 мг діосміну безводного чистого. Лікарська форма. Таблетки, вкриті плівковою оболонкою. Фармакотерапевтична група. Ангіопротектори. Капіляростабілізуючі засоби. Біофлавоноїди. Код АТХ С05С А03. Показання. Полегшення симптомів лімфовенозної недостатності: важкість у ногах, біль, трофічні розлади. Комплексне лікування функціональних станів, що супроводжуються підвищеною проникністю капілярів. Лікування функціональних симптомів гострого геморою. Протипоказання. Гіперчутливість до компонентів препарату, особливо у пацієнтів, схильних до алергічних реакцій на кошеніль червону А (Е 124). Препарат не рекомендується застосовувати у період годування груддю. Спосіб застосування та дози. Лімфовенозна недостатність: 1 таблетка на день вранці перед сніданком. Тривалість курсу лікування визначає лікар залежно від перебігу захворювання. Середня тривалість лікування становить 2 місяці. Гострий геморой: 2– 3 таблетки на день під час прийому їжі протягом 7 днів. Якщо після лікування симптоми геморою не зникають, слід звернутися до лікаря для корекції лікування. Максимальна добова доза – 1800 мг (3 таблетки). Побічні реакції. Можливі алергічні реакції, включаючи шкірні висипання, свербіж. Рідко можливі диспептичні розлади, головний біль. Поодинокі випадки шлунково-кишкових розладів, які рідко призводять до припинення лікування. Категорія відпуску. Без рецепта. Виробник. Іннотера Шузі, Франція / Innothera Chouzy, France. Реєстраційне посвідчення № UA/8590/01/01 Наказ MОЗ України 01.08.18 № 1422. ЗМІНИ ВНЕСЕНО Наказ MОЗ України 22.07.2019 № 1655.
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 1 (39), 2020 р.