13 червня, 2020
Успешное хирургическое лечение гигантской десмоидной опухоли забрюшинного пространства
Клинический случай и обзор литературы
 Десмоидный фиброматоз – доброкачественное новообразование, которое отличается агрессивным локальным ростом с возможным достижением опухолью гигантских размеров и значительной частотой рецидивов после хирургического лечения. В статье представлено описание клинического случая хирургического лечения пациента с гигантской десмоидной опухолью, сравнение эффективности различных подходов к лечению этой патологии на основании современных данных медицинской литературы.
Десмоидный фиброматоз – доброкачественное новообразование, которое отличается агрессивным локальным ростом с возможным достижением опухолью гигантских размеров и значительной частотой рецидивов после хирургического лечения. В статье представлено описание клинического случая хирургического лечения пациента с гигантской десмоидной опухолью, сравнение эффективности различных подходов к лечению этой патологии на основании современных данных медицинской литературы.
Ключевые слова: опухоль, десмоидный фиброматоз, агрессивный фиброматоз, хирургическое лечение.
Этиология и типы десмоидного фиброматоза
Десмоидный фиброматоз (ДФ) – агрессивная форма фиброматоза, относящаяся к редким доброкачественным опухолям. Несмотря на отсутствие потенциала к метастазированию, данные образования отличаются агрессивным локальным ростом, что может вызывать развитие выраженного болевого синдрома и функциональной недостаточности органов, что, в свою очередь, приводит к необходимости хирургического лечения. Кроме того, после хирургического лечения отмечается значительная частота локальных рецидивов. В соответствии с классификацией Всемирной организации здравоохранения (ВОЗ) ДФ относится к пограничным поражениям мягких тканей, которое гистологически характеризуется наличием клональной фибробластной пролиферации, выявляемой в глубине мягких тканей. Частота встречаемости данных опухолей – 0,2-0,5 на 100 тыс. населения в год.
Все случаи ДФ могут быть разделены на две группы: случаи спорадического агрессивного фиброматоза (первая группа), которые составляют 84-93% всех наблюдений, связанные с моноклональным дисбалансом. Точная этиология спорадического ДФ до сих пор остается невыясненной. Имеются исследования, которые сообщают о связи таких опухолей с перенесенной травмой и гормональным статусом. В 10-20% случаев (вторая группа) заболевание имеет наследственный характер, и выявление данного типа опухолей связано с наличием у пациентов семейного аденоматозного полипоза. Агрессивный фиброматоз встречается наиболее часто в возрасте 15-60 лет, причем выявляемость его выше у женщин (66-70%), чем у мужчин (30-34%).
Существуют два типа ДФ: экстра- и интраперитонеальный. При этом интраперитонеальная локализация в большинстве случаев связана с семейным аденоматозным полипозом и сочетается с различными опухолями желудочно-кишечного тракта. В настоящее время для лечения ДФ выработано несколько подходов к лечению, включая хирургический метод, химиотерапию, лучевую и гормонотерапию в комбинации с нестероидными противовоспалительными препаратами (НПВП). Каждая из этих лечебных тактик имеет свои преимущества и недостатки, а также риски для пациентов.
В связи с редкостью данной патологии и отсутствием единой тактики лечения пациентов интересным является следующий клинический случай.
Клінічний випадок
Пациент, мужчина, 43 лет, поступил в клинику ГУ «Институт общей и неотложной хирургии им. В.Т. Зайцева НАМН Украины» 04.02.2020 г. в плановом порядке с жалобами на наличие гигантских размеров образования в брюшной полости и периодическую боль в области образования.
Из анамнеза. Болеет с 2012 года, когда впервые отметил появление образования в брюшной полости. Был обследован в онкологическом диспансере. По данным компьютерной томографии (КТ) была выявлена опухоль забрюшинной локализации размерами 115×120 см. Пациенту была выполнена трепан-биопсия с последующим иммуногистохимическим исследованием с антителами к Vimentin (C1, V9), S-100 protein, Muscle Actin (HHF35), Ki-67 (MIB-1), по данным которого новообразование может соответствовать фиброматозу десмоидного типа: в препарате пролифераты из фибробластоподобных клеток без признаков ядерной атипии, экспрессирующие виментин, формирующие пучки грубых коллагеновых волокон с очагами гиалиноза; экспрессия Ki-67 в ядрах единичных клеток. С учетом представленной морфологической картины рекомендовано наблюдение в динамике.
В дальнейшем пациент отмечал медленный прогрессивный рост опухоли, которая в последнее время достигла гигантских размеров, стали появляться боли в области образования, в связи с чем больной обратился в клинику Института.
Обследование. При объективном осмотре – состояние пациента ближе к относительно удовлетворительному. Больной правильного телосложения, пониженного питания. Кожа и видимые слизистые оболочки физиологической окраски. Грудная клетка несколько деформирована верхним полюсом опухолевидного образования слева, симметрично участвует в акте дыхания. Пальпация грудной клетки – без особенностей. При аускультации с обеих сторон выслушивается везикулярное дыхание, незначительно ослабленное в базальных отделах слева. Хрипов нет. Частота дыхательных движений (ЧДД) – 18/мин. Тоны сердца ясные, ритмичные. Пульс симметричный, достаточного наполнения и напряжения. Частота сердечных сокращений (ЧСС) – 78 уд./мин, артериальное давление (АД) – 130/80 мм рт. ст.
Язык влажный, чистый. Живот увеличен в размерах, асимметричен за счет видимого объемного образования, распространяющегося от среднеключичной линии справа на переднебоковую поверхность живота слева вплоть до заднеподмышечной линии слева (рис. 1). 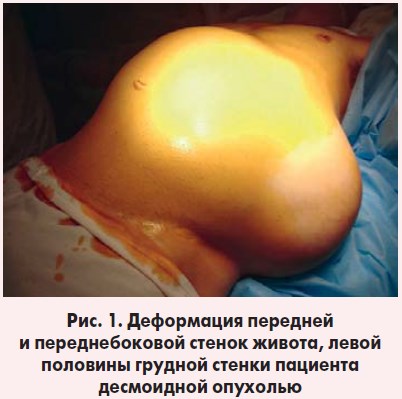
При пальпации определяется гигантское опухолевидное образование, субтотально занимающее всю брюшную полость, размерами 40×35 см, исходящее, по всей вероят ности, из забрюшинного пространства, неоднородной структуры, слабо болезненное, незначительно смещае мое. Мышцы передней брюшной стенки истончены, в области передне боковой стенки живота слева образование распространяется до уровня кожи без четких признаков инвазии брюшной стенки. Также в структуре образования определяются IX-XII ребра слева. Органы брюшной полости определяются по правому фланку живота. Печень не выступает из-под реберной дуги. Селезенка не пальпируется. Симптом Пастернацкого отрицателен с обеих сторон. Мочеиспускание свободное, безболезненное. Диурез достаточный. Дефекация – без особенностей. Пациент обследован.
Клинический анализ крови: гемоглобин – 166 г/л; эритроциты – 5,1×1012/л; цветной показатель – 0,9; лейкоциты – 7,4×109/л: палочкоядерные – 3%, сегментоядерные – 64%, лимфоциты – 22%, моноциты – 6%, эозинофилы – 5%, СОЭ – 9 мм/ч.
Клинический анализ мочи: цвет –желтый, прозрачность – умеренная, удельный вес – 1,043, рН – 7,0, эритроциты – не обнаружены, лейкоциты – 6-8 в поле зрения, эпителий – переходный (местами), белок, сахар – не обнаружены.
Биохимический анализ крови: общий белок – 64,4 г/л, билирубин: общий – 10,2 мкмоль/л, прямой – 3,0 мкмоль/л, глюкоза – 4,5 ммоль/л, аланинамино трансфераза (АлАт) – 24,1 Ед/л, аспартатаминотрансфераза (АсАт) – 25,8 Ед/л, щелочная фосфатаза – 88 Ед/л, альфа-амилаза – 49 Ед/л.
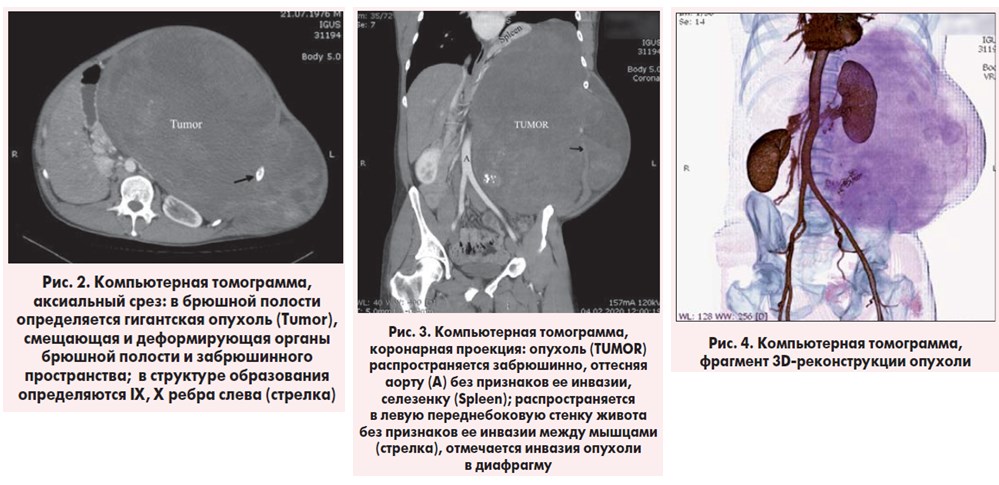
Больному выполнена КТ, по данным которой в левой половине брюшной полости, в забрюшинном пространстве, распространяясь на левые грудную и брюшную стенки, определяется многоузловое неопластическое образование размерами до 370×360×230 мм с неровными, довольно четкими контурами. Структура образования неоднородна за счет солидных и кистозных участков, множественных кальцинатов. Солидный компонент интенсивно накапливает контрастное вещество, в толще образования визуализируются сосуды, IX, X ребра слева, отмечается инвазия левого купола диафрагмы. Верхний полюс образования находится выше диафрагмы, выступает в базальные отделы левого легкого на исследуемом уровне, где также визуализируется жидкость в левой плевральной полости толщиной до 45 мм. Органы брюшной полости смещены вправо, сдавлены образованием. К образованию прилежат левая переднебоковая стенка аорты, левая общая печеночная артерия, левые почечные сосуды без признаков их инвазии. Печень, желчные протоки, желчный пузырь, надпочечники – без особенностей.
Поджелудочная железа не увеличена, деформирована, смещена кзади и вправо. Селезенка не увеличена в размерах, смещена образованием медиально. Правая почка без особенностей, левая почка деформирована, смещена кзади образованием, полостная система обеих почек, мочеточники не расширены. Выделительная функция обеих почек сохранена (рис. 2-4).
Заключение. Объемный неопластический процесс брюшной полости, забрюшинного пространства, брюшной и грудной стенки слева с инвазией левого купола диафрагмы, распространением на базальные отделы левого легкого – КТ-картина более всего соответствует десмоидной опухоли. Левосторонний гидроторакс.
С учетом результатов обследования, ранее выполненного иммуногистохимического исследования больному установлен диагноз: «Гигантская десмоидная опухоль забрюшинного пространства слева. Левосторонний малый гидроторакс».
В связи с прогрессивным ростом образования, его гигантскими размерами, приводящими к смещению и деформации органов брюшной полости и забрюшинного пространства мульти дисциплинарной онкологической комиссией Института принято решение об оперативном лечении. Больной оперирован в плановом по-рядке 06.02.2020 г.
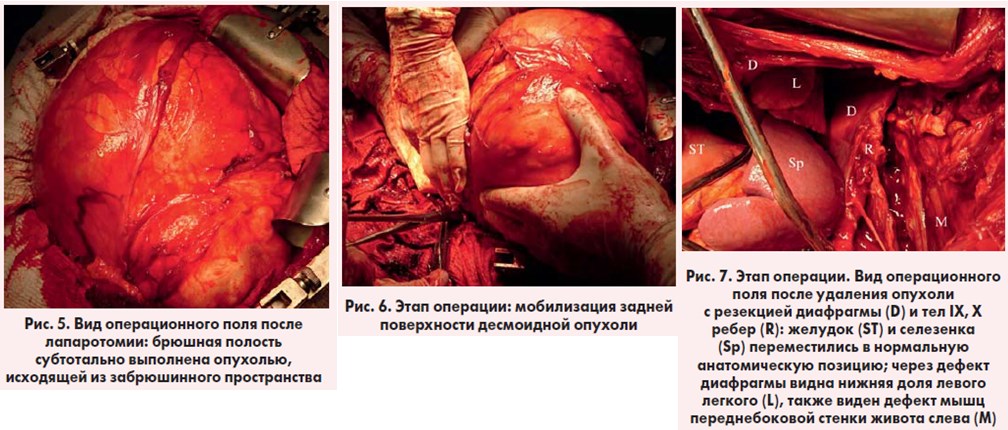
Оперативное вмешательство: лапаротомия; удаление гигантской опухоли забрюшинного пространства с резекцией диафрагмы, IX, X ребер слева, дренирование левой плевральной полос ти по Бюлау, дренирование брюшной полости. Из протокола операции: в условиях внутривенной анестезии с миорелаксантами и ИВЛ выполнена лапаротомия типа «мерседес». При ревизии: в брюшной полости, субтотально выполняя ее и исходя из забрюшинного пространства, определяется гигантское опухолевидное образование размерами до 40×35 см. Органы брюшной полости смещены образованием вправо и располагаются преимущественно по правому фланку. Селезенка, желудок смещены образованием вправо и кверху, нисходящая ободочная и сигмовидная кишки располагаются по правому краю образования. Признаков инвазии париетальной брюшины не выявлено. При пальпации опухоль неоднородна за счет кистозных и солидных компонентов, слабо смещаема (рис. 5).
Рассечение париетальной брюшины в области переходной складки слева – вскрыто забрюшинное пространство. Определяется гигантская забрюшинная опухоль, отграниченная от окружающих тканей четко выраженной капсулой, распространяющаяся вниз до малого таза, вверх до диафрагмы (по всей вероятности, исходя из нее). Вправо опухоль распространяется до среднеключичной линии, влево – до уровня кожи, расслаивая волокна левых поперечной, внутренней и наружной косых мышц живота без признаков их инвазии. Также в структуре образования определяются тела IX, X ребер слева. Частично острым, частично тупым путем последовательно мобилизованы нижний полюс, правые и левые полуокружности, задняя поверхность опухоли в направлении снизу вверх. Инвазии магистральных сосудов забрюшинного пространства не выявлено (рис. 6.).
При дальнейшей ревизии выявлено, что опухоль исходит из диафрагмы, локализуясь преимущественно в левой половине ее сухожильного центра, распространяясь практически до поясничной части и левой медиальной ножки, а также в ее реберной части слева, распространяясь в межреберные пространства VIII-XI ребер слева без достоверных признаков инвазии IX, Х ребер слева. Последние, однако, окутаны опухолью в области тел. Сухо жильный центр диафрагмы и ее поясничная часть слева частично «растянуты» опухолью. Произведено удаление опухоли с резекцией диафрагмы IX, X ребер слева. Признаков инвазии левого легкого не выявлено. Выполнен гемостаз (рис. 7).
Левая плевральная полость дренирована по Бюлау в VII межреберье по задней подмышечной линии слева.
С учетом дефекта диафрагмы выполнена ее пластика собственными тканями со стороны брюшной полости. Для профилактики образования грыжи левой переднебоковой стенки живота послойно ушиты дефекты наружной, внутренней косой и поперечной мышц живота со стороны брюшной полости. Париетальная брюшина не восстанавливалась. Выполнено дренирование брюшной полости из двух точек. Брюшная стенка ушита. Продолжительность операции – 225 мин, интраоперационная кровопотеря – 250 мл.
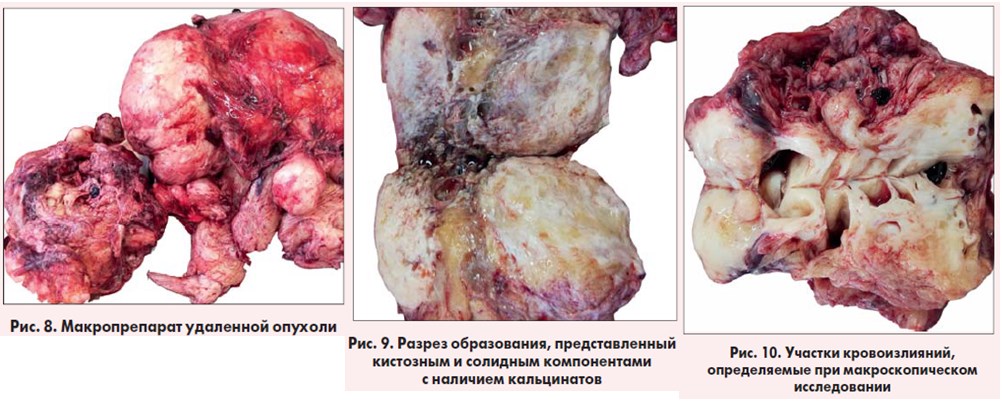
При макроскопическом исследовании опухоль состоит из кистозного и тканевого компонентов с наличием кальцинатов и кровоизлияний (рис. 8-10).
При гистологическом исследовании опухоль более всего соответствует мезенхимоме. Повторное иммуногистохимическое исследование повторяет результаты предыдущего. Течение послеоперационного периода спокойное. Пациент был переведен на спонтанное дыхание через 2 ч после операции, экстубирован – через 4 ч. По данным рентгенологического исследования отмечено полное расправление левого легкого к 2-м послеоперационным суткам. Признаков дыхательной недостаточности не отмечено. Дренаж Бюлау удален на 6-е послеоперационные сутки, дренажи из брюшной полости – на 8-е сутки. Раны зажили первичным натяжением. При контрольном исследовании перед выпиской, по данным УЗИ, – признаков наличия свободной жидкости в плевральных и брюшной полостях, забрюшинном пространстве не выяв лено. При рентгеноскопии органов грудной клетки – экскурсия диафрагмы не нарушена, левое легкое расправлено, прозрачно. Больной выписан на 13-е послеоперационные сутки, 19.02.2020 г. Осмотрен через 1 месяц: жалоб не предъявляет, прибавил в весе 6 кг, признаков дыхательной недостаточности нет, признаков грыжеобразования, рецидива опухоли нет.
Обсуждение
По данным Европейской организации по исследованию и лечению сарком мягких тканей и костей, хирургическое удаление опухоли с достижением негативного края резекции являлось золотым стандартом лечения больных с ДФ до 2000 года. Однако последующие результаты исследований 100 пациентов с позитивным краем резекции показали, что неполное удаление опухоли не может считаться однозначным предиктором локального рецидива при агрессивном фиброматозе. Таким образом, были продемонстрированы возможность локального рецидива у пациентов с отрицательным краем резекции и отсутствие локального рецидива у больных с положительным краем резекции, что подтверждает тот факт, что чистота края резекции не является окончательным предиктором развития локального рецидива. Кроме того, большинство исследователей отмечают большую вероятность развития осложнений и значительную летальность при хирургическом удалении десмоидных опухолей.
В связи с непредсказуемым поведением опухоли и значительным риском развития осложнений после хирургического лечения в последнее время применяется более консервативная тактика ведения таких пациентов с использованием этапного подхода (step-wise approach). При впервые выявленных бессимптомных десмоидных опухолях возможно применение выжидательной тактики (wait and watch). Так, D. Ganeshan et al. (2019), анализируя доступные исследования, посвященные агрессивному фиброматозу, определили, что 5-летняя выживаемость без опухолевой прогрессии у пациентов с ДФ составляет 50% при медиане времени до прогрессирования 14-19 месяцев. Кроме того, в 28% случаев при локализации десмоидных опухолей в брюшной стенке и в 20% наблюдений при локализации вне брюшной стенки возможен их спонтанный регресс.
И для первичной диагностики опухолей, и для динамического наблюдения применяются такие методы визуализации, как УЗИ, КТ и магнитно-резонансная томография (МРТ). Однако активная хирургическая тактика должна быть использована у пациентов, наблюдение за которыми невозможно, при прогрессивном росте опухоли и/или при симптомных опухолях, включая наличие косметического дефекта. При этом необходимо стремиться к достижению негативного края резекции, хотя, как уже было отмечено ранее, позитивный край резекции не является доказанным фактором локального рецидива. Факторами, при которых повышается вероятность развития локального рецидива после хирургического лечения ДФ, являются большие размеры опухоли, молодой возраст пациента и локализация объемного образования в брыжейке или конечностях. Также необходимо отметить, что хирургическое лечение больных с рецидивными десмоидными опухолями сопряжено со значительными осложнениями.
В связи с этим использование радиотерапии является одной из основных опций лечения рецидивного ДФ. Кроме того, лучевая терапия может быть использована при нерезектабельных опухолях больших размеров в качестве основного и единственного метода терапии. При этом комбинация хирургического и лучевого методов лечения позволяет снизить вероятность развития локального рецидива по сравнению с только лишь хирургическим методом.
Кроме того, имеются данные о высокой эффективности криоаблации, радиочастотной аблации и высокоинтенсивного фокусированного ультразвукового лечения (High Intensive Focused Ultrasound Treatment – HIFU) при ДФ небольших размеров.
Существенную роль в лечении пациентов с ДФ играет также системная терапия, для которой в настоящее время применяются химиотерапевтические агенты (доксорубицин, метотрексат и винбластин), таргетные препараты (иматиниб, сунитиниб, пазопаниб, сорафениб и сиролимус), а также комбинация антиэстрогенов (тамоксифен и торемифен) и НПВП (мелоксикам, индометацин, целекоксиб).
В работе Ch. Shen et al. (2019) показано, что, несмотря на использование для лечения ДФ как у мужчин, так и у женщин антигормональных препаратов, в частности тамоксифена, торемифена и прогестерона, опухолевый ответ был низким. Кроме того, частичный опухолевый ответ и стабилизация болезни отмечались соответственно у 48 и 28% больных с агрессивным фиброматозом. Поэтому комбинация антигормональной терапии и НПВП рекомендована в качестве первой линии лечения в руководстве Европейской организации по исследованию и лечению сарком мягких тканей и костей, что связано с ограниченной токсичностью, редкими побочными эффектами и эффективностью такого вида лечения. Однако, по данным The Desmoid Tumor Working Group (2020), несмотря на результаты ретроспективных исследований, демонстрирующих активность комбинации антигормональных препаратов и НПВП при десмоидных опухолях, только одно проспективное исследование во второй фазе демонстрирует ограниченную активность данной комбинации на основании критериев ВОЗ и уровней выживаемости без прогрессирования опухоли. Более того, опубликованные недавно данные демонстрируют отсутствие четкой связи между изменением размера опухоли, МРТ-сигнала и симптоматики при использовании тамоксифена. Таким образом, авторы приходят к выводу об отсутствии данных, позволяющих судить об эффективности антигормональной терапии и НПВП у пациентов с десмоидными опухолями.
Так, в работе K.M. Ingley et al. (2019) показана высокая эффективность комбинации метотрексата (25 мг/м2) и винорельбина (25 мг/м2) при лечении прогрессирующего ДФ, оцененная на основании данных МРТ. Однако в настоящее время отсутствуют завершенные клинические исследования, доказывающие эффективность и преимущества полихимиотерапии по сравнению с другими методами у пациентов с агрессивным фиброматозом.
Оценив возможность применения таргетных препаратов при ДФ, включая ингибиторы тирозинкиназы (иматиниб + вактосертиб), mTOR-ингибиторы (сиролимус), Notch-ингибиторы, PDGF-a/PDGF-ß/VEGFR (пазопаниб), M.J.M. Timbergen et al. (2019), пришли к мнению об отсутствии четких данных касательно их эффективности в связи с отсутствием завершенных клинических исследований по их применению при агрессивном фиброматозе. Кроме того, существуют определенные трудности при интерпретации результатов исследований, что связано с непредсказуемым поведением данных опухолей и возможностью их спонтанной регрессии либо со стабильным течением без лечения, что не позволяет дифференцировать эффект от медикаментозной терапии от естественного «опухолевого поведения».
Выводы
Таким образом, в настоящее время отсутствуют данные об эффективных методах лечения больных с ДФ. Это связано с редкостью данной патологии, непредсказуемым поведением данных опухолей с возможностью спонтанного регресса, а также отсутствием завершенных клинических исследований, посвященных эффективности различных методов лечения. Выжидательная тактика лечения в настоящее время является приоритетной. Хирургическое лечение показано больным с резектабельными десмоидными опухолями больших размеров и/или симптомными, что было продемонстрировано в приведенном клиническом случае. Комбинация хирургического и лучевого лечения, по всей вероятности, позволяют снизить риск развития локального рецидива. Однако вопросы выбора эффективного лечения ДФ требуют дальнейшего изучения.
Литература
- Umer M., Saeed J., Anwar I., Zahid N., Durrani Y. Management outcomes of extra abdominal fibromatosis among adult patients treated at a tertiary care hospital. J Ayub Med Coll Abbottabad 2019;31(4 Suppl 1):660-4.
- Jurui L., Kairui J., Shuizhang Q., Xuejun M., Ziqiang P., Weiqiang Y., Zhen Z., Xiaomao G., Xiaoli Y. Single institution experience of split course radiotherapy in patients with desmoid tumors OncoTargets and Therapy 2019;12: 1741-1748. http://dx.doi.org/10.2147/OTT.S189449.
- Timbergen M.J.M., Smits R., Grünhagen D.J., Verhoef C., Sleijfer S. and Wiemer E.A.C. Activated Signaling Pathways and Targeted Therapies in Desmoid-Type Fibromatosis: A Literature Review. Front. Oncol. 2019; 9:397. doi: 10.3389/ fonc.2019.00397.
- Wang J., Ning J., Lin Q., Huang Y., Li J., Jiang Q., Liu W., Xu J., Hou Y., Liu J. et al. Clinicopathological and molecular characteristics of abdominal desmoid tumors in the Chinese population: A single center report of 15 cases. Oncology Letters 2019; 18: 6443-6450. DOI: 10.3892/ol.2019.11038.
- Ganeshan D.M., Amini B., Nikolaidis P., Vikram R. Current Update on Desmoid Fibromatosis. J Comput Assist Tomogr. 2019; 43(1): 29-38. doi:10.1097/RCT.0000000000000790.
- Kim K.S., Kim H.J., Lee M.E., Moon K.C., Song S.G., Kim H.S., Han I., Kim H. Survival outcomes after adjuvant radiotherapy for aggressive fibromatosis depend on time frame and nuclear β-catenin. Radiat Oncol J 2019;37(1):37-42. https://doi.org/10.3857/roj.2018.00542.
- Wang Z., Wu J., Ang L., Tian X., Hao C. En bloc resection for intra-abdominal/retroperitoneal desmoid-type fibromatosis with adjacent organ involvement: A case series and literature review. BioScience Trends. 2018; 12(6):620-626. DOI:10.5582/bst.2018.01285.
- Wang J., Huang Y., Sun Y., Ge Y. and Zhang M. Value of imaging findings in predicting postoperative recurrence of desmoid-type fibromatosis. Oncology Letters 2020; 19: 869-875. DOI: 10.3892/ ol.2019.11129.
- Seinen J.M., Niebling M.G., Bastiaannet E., Pras B., Hoekstra H.J. Four different treatment strategies in aggressive fibromatosis: A systematic review. Clinical and Translational Radiation Oncology 2018; 12: 1-7. https://doi.org/10.1016/j.ctro.2018.03.001.
- Lacka D.E., Nasierowska-Guttmejer F. Fibro-matosis – immunohisto-chemical evaluation, differential diagnosis from gastrointestinal tumors, and other mesenchymal tumors. Gastroenterology Rev 2019; 14 (1): 79-85. DOI: https://doi.org/10.5114/pg.2019.83429.
- Penela N., Chibonb F., and Salas S.. Adult desmoid tumors: biology, management and ongoing trials Curr Opin Oncol 2017; 29:268-274 DOI:10.1097/CCO.0000000000000374.
- The Desmoid Tumor Working Group. The management of desmoid tumours: A joint global consensus-based guideline approach for adult and paediatric patients European Journal of Cancer 2020; 127: 96e107. https://doi.org/10.1016/j. ejca.2019.11.013.
- Zhao J., Wang Q., Li X., Hu X., Shen H. Effective high intensity focused ultrasound treatment in recurrent aggressive breast fibromatosis: a case report. OncoTargets and Therapy 2019; 12:5251-5256. http://doi.org/10.2147/OTT.S202933.
- Elkhouly A.G., Cervelli V., Sanese G., Pompeo E. Hump-like giant desmoid tumor of the chest: a postresectional reconstruction challenge. Enigma of recurrent strokes with literature review. AME Case Rep 2017; 1:6. doi: 10.21037/acr.2017.11.01.
- Shen C., Wang C., Yan J., He T., Zhou X., Ma W., He J., Yin Y., Yin X., Cai Z., Chen Z., Zhang H., Zhang B. Clinicopathological characteristics, treatment, and survival outcomes of retroperitoneal desmoid-type fibromatosis: a single-institution experience in China. Medicine 2019; 98:47(e18081). http://dx.doi.org/10.1097/MD.0000000000018081.
- Ingley K.M., Burtenshaw S.M., Theobalds N.C.et al. Clinical benefit of methotrexate plus vinorelbine chemotherapy for desmoid fibromatosis (DF) and correlation of treatment response with MRI. Cancer Med. 2019; 8:5047-5057. https://doi.org/10.1002/cam4.2374.
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 2 (40), 2020 р.