17 червня, 2020
Вплив лімфедеми на якість життя онкологічних пацієнтів
Досягнення сучасної медицини в діагностиці та лікуванні онкологічної патології істотно розширили терапевтичні можливості та покращили віддалені прогнози у пацієнтів. Важливим напрямом ведення онкологічних хворих є забезпечення високого рівня життя у довгостроковій перспективі, що передбачає уникнення/усунення можливих небажаних явищ, спричинених основними методами лікування, зокрема лімфедеми.
Визначення та класифікація
Лімфатичний набряк (лімфедема, лімфостаз) – це патологічний стан, який характеризується накопиченням рідини, багатої на білок, у міжклітинному просторі, що супроводжується набряком. Причиною лімфостазу є порушення нормального відтоку лімфи внаслідок ушкодження або обструкції лімфатичної системи. Виділяють первинну та вторинну лімфедему. Первинна лімфедема розвивається внаслідок гіпоплазії структур лімфатичної системи і спостерігається при рідкісних вроджених захворюваннях (хвороба Мілроя, хвороба Мейга, Lymphedema praecox). Первинна лімфедема може виникати і при інших генетичних аномаліях (синдромах Шерешевського – Тернера, Хеннекама тощо). Вторинні лімфедеми трапляються значно частіше, ніж первинні. Найчастішими причинами вторинної лімфедеми є хірургічні втручання (особливо після дисекції лімфатичних вузлів з приводу раку молочної залози – РМЗ), променева терапія, травма, обструкція лімфатичних судин пухлиною, лімфатичний філяріатоз (поширений у країнах, що розвиваються). У міру прогресування стаз лімфи призводить до розвитку запалення, активації ліпогенезу, накопичення жирової тканини та фіброзу (Т.J. Ryan, 1995). Експерти Міжнародного товариства лімфології виділяють 4 стадії лімфедеми (табл. 1).
Лімфедема при РМЗ
У практичній онкології лімфедема, пов’язана з хірургічним і променевим лікуванням РМЗ, зустрічається часто (наприклад, постмастектомічний синдром, який здебільшого супроводжується набряком верхнього плечового поясу). Говорячи про це ускладнення, онкологи в першу чергу мають на увазі набряк верхніх кінцівок, проте можливі й інші локалізації, а саме поверхня грудної клітки та молочні залози. Це ускладнення потребує особливої уваги фахівців, адже лімфоїдна тканина має підвищений ризик інфікування, порушення загоєння ран, що може призвести до виникнення хронічного целюліту (E.D. Staren, 1996; L.M. Baddour, 1999).
За останнє десятиліття завдяки ранній діагностиці та впровадженню нових ефективних методів лікування вдалося істотно покращити прогноз у пацієнток з РМЗ. У цьому аспекті все більшої актуальності набуває вирішення проблеми віддалених наслідків лікування раку, які впливають на якість життя хворих. Сьогодні органозберігальна терапія (органозберігальні операції з подальшою променевою терапією) вважається еталоном лікування РМЗ на ранніх стадіях, адже її ефективність не поступається мастектомії. З удосконаленням неоад’ювантної системної терапії та онкопластичної хірургії органозберігальна терапія розглядається як можливий варіант лікування пацієнток з великими пухлинами. Проте зі збільшенням частки пацієнток, котрі перенесли органозберігальне лікування з приводу РМЗ, істотно зросла частота випадків ізольованої лімфедеми молочних залоз.
Сьогодні доступно чимало результатів досліджень, присвячених асоціації лімфедеми верхніх кінцівок та якості життя хворого, проте даних стосовно впливу лімфедеми молочних залоз на якість життя недостатньо (A.C. Degnim et al., 2012). Зазвичай лімфедема молочних залоз описується як прояв токсичності під час досліджень лікарських втручань. Натомість досліджень, для яких оцінка цього явища була б первинною метою, вкрай мало. Також поза увагою дослідників залишається вплив сучасних методів лікування РМЗ (пластичні органозберігальні операції, неоад’ювантна терапія) на ризик виникнення лімфедеми молочних залоз. Для прийняття правильних клінічних рішень необхідне розуміння поширеності та факторів ризику виникнення цього ускладнення. Не менш важливим є адекватне інформування пацієнток про вплив лімфедеми на якість життя. Саме ці фактори мають стати відправною точкою для розроблення ефективних методів лікування цього стану.
Лімфедема та якість життя пацієнток після лікування РМЗ
Пропонуємо читачам ознайомитися з результатами найбільшого на сьогодні проспективного когортного дослідження, основною метою якого було вивчення поширеності та детермінант лімфедеми молочних залоз, а також зв’язку патології з якістю життя та болем у молочних залозах після перенесеної органозберігальної терапії РМЗ (D.A. Young-Afat et al., 2019).
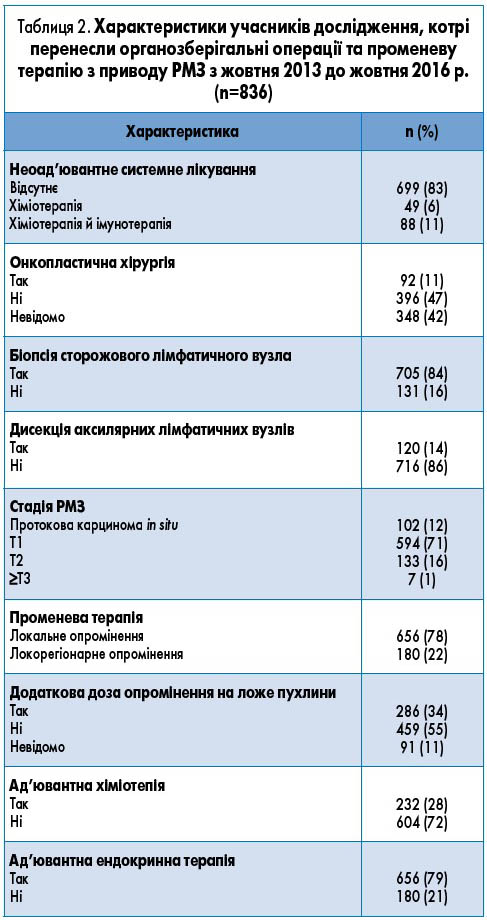 У дослідження було включено 836 пацієнток після перенесеного органозберігального лікування РМЗ, з них 734 (88%) мали інвазивний РМЗ та 102 (12%) – протокову карциному in situ. Характеристики пацієнток представлені у таблиці 2. Медіана спостереження за пацієнтками склала 28 міс. Лімфедему молочних залоз оцінювали за допомогою спеціального опитувальника Європейської організації дослідження та лікування раку (European Organisation for Research and Treatment of Cancer, EORTC) – QLQ-BR23.
У дослідження було включено 836 пацієнток після перенесеного органозберігального лікування РМЗ, з них 734 (88%) мали інвазивний РМЗ та 102 (12%) – протокову карциному in situ. Характеристики пацієнток представлені у таблиці 2. Медіана спостереження за пацієнтками склала 28 міс. Лімфедему молочних залоз оцінювали за допомогою спеціального опитувальника Європейської організації дослідження та лікування раку (European Organisation for Research and Treatment of Cancer, EORTC) – QLQ-BR23.
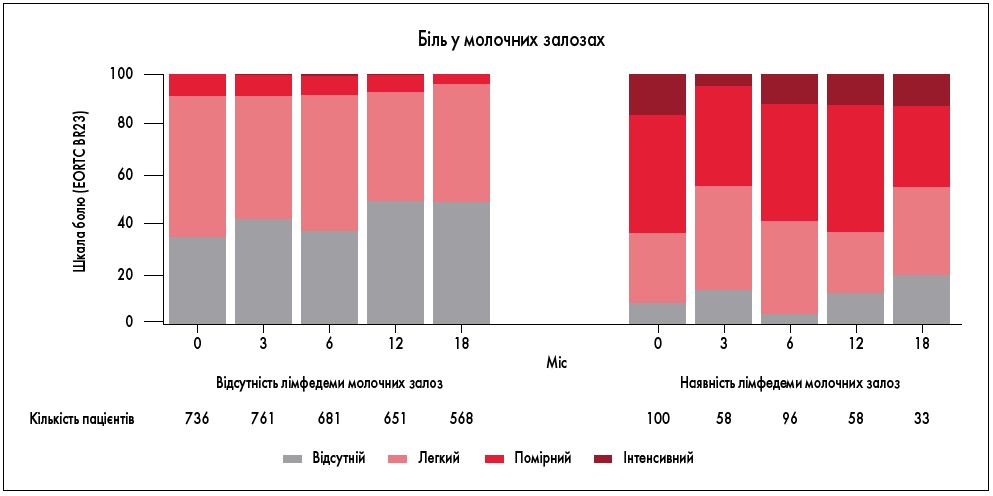
Протягом періоду спостереження після проведення органозберігального лікування з приводу РМЗ (18 міс) лімфедема молочних залоз була відмічена у 207 (24,8%) жінок. Перед початком променевої терапії 12% пацієнток мали набряк молочних залоз (100 з 836; 95% довірчий інтервал – ДІ – 9,8-14,1%). Поширеність набряку молочних залоз становила 7,1% (у 58 із 819; 95% ДІ 5,3-8,8%) за 3 міс; 12,4% (у 96 із 777; 95% ДІ 10,0-14,7%) через 6 міс; 8,2% (у 58 з 709; 95% ДІ 6,1-10,2%) за 12 міс і 5,5% (у 33 з 601; 95% ДІ 3,6-7,3%) за 18 міс (табл. 3).
Протягом дослідження були відмічені кілька факторів, асоційовані з розвитком набряку молочної залози. Онкопластична хірургія була пов’язана з виникненням цього ускладнення лише на початку періоду спостереження, дисекція аксилярних лімфатичних вузлів – протягом усіх 18 міс спостереження. Після локорегіонарної променевої терапії набряк молочних залоз розвивався через 3, 6 та 12 міс, додаткове локальне опромінення молочної залози було пов’язане з набряком молочних залоз через 18 міс. Ад’ювантна хіміотерапія асоціювалася з появою лімфатичного набряку через 6, 12 та 18 міс після початку променевої терапії. Ризик лімфатичного набряку молочних залоз був вищим у жінок із пухлинами великого розміру. Лімфатичний набряк молочної залози не був пов’язаний із віком, неоад’ювантною хіміотерапією з/без імунотерапії, біопсією сторожового лімфатичного вузла та ад’ювантною ендокринною терапією.
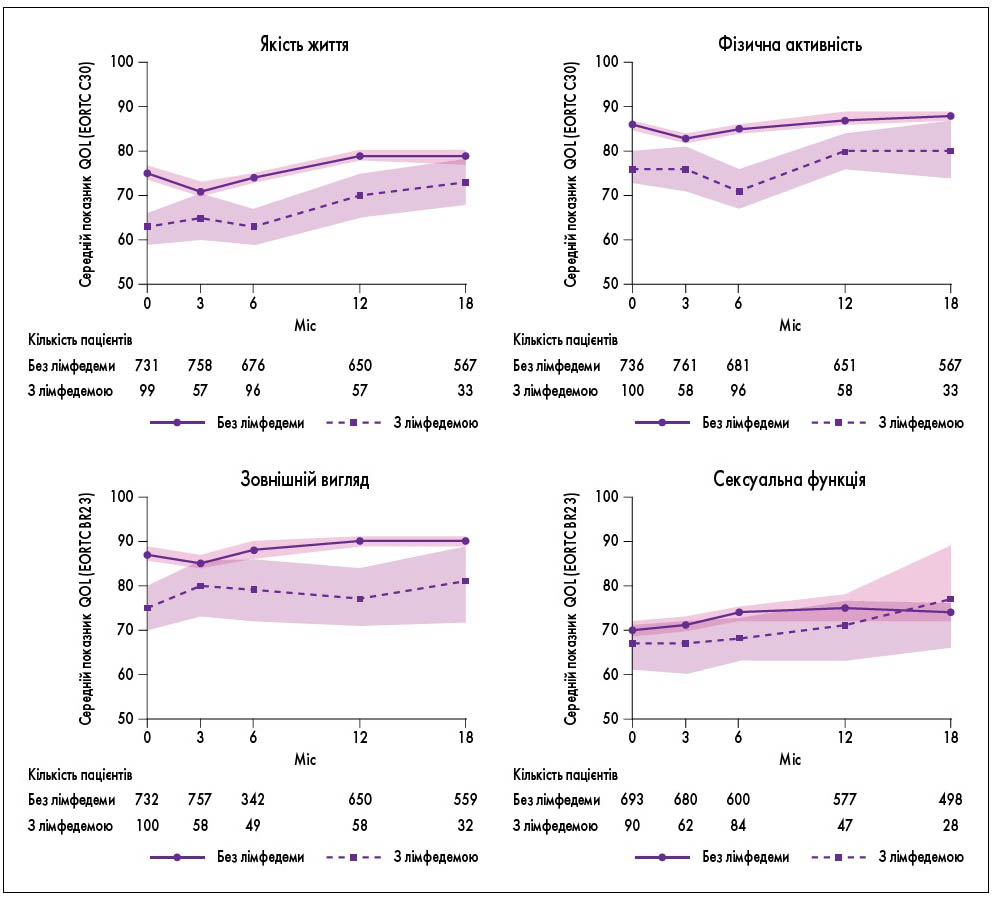
На усіх часових інтервалах спостереження (3, 6, 12, 18 міс) пацієнтки з лімфатичним набряком молочних залоз частіше повідомляли про біль у них (рис. 1), зниження якості життя, фізичної активності, погіршення зовнішнього вигляду (рис. 2), порівняно з жінками, у яких не було набряку. Найвища поширеність набряку молочної залози спостерігалася через 6 міс (12,4%), а найнижча – через 18 міс (5,5%) після початку променевої терапії.
За даними кількох досліджень поширеність набряку молочних залоз після органозберігального лікування коливалася в широкому діапазоні – 10-90% (H. Verbelen et al., 2014). Причиною такої гетерогенності є застосування різних методів оцінювання набряку молочних залоз і відсутність золотого стандарту. Тому часто цей стан взагалі не діагностується та не лікується.
Окрім вищезгаданого, набряк молочних залоз після органозберігального лікування оцінювали ще у 2 дослідженнях (H. Verbelen et al., 2014). В одному дослідженні взяли участь 100 пацієнток з РМЗ ранніх стадій, які отримували ад’ювантне часткове опромінення ураженої ділянки. Через 5 років після лікування у 9% жінок виник набряк молочної залози (S.C. Formenti et al., 2012). В іншому дослідженні спостерігали 131 пацієнтку після перенесеного органозберігального лікування РМЗ, з них 75% пацієнток повідомили про набряк молочних залоз протягом 60 міс (N. Adriaenssens et al., 2012).
У цьому дослідженні було виявлено шість факторів ризику виникнення набряку молочних залоз після органозберігального лікування: онкопластична хірургія, дисекція аксилярних лімфатичних вузлів, великий розмір пухлини, локорегіонарна променева терапія, додаткове місцеве опромінення та ад’ювантна хіміотерапія. Великий розмір пухлини, додаткове місцеве опромінення та ад’ювантна хіміотерапія також були визначені як фактори ризику в інших дослідженнях, тоді як асоціація набряку молочної залози з дисекцією аксилярних лімфатичних вузлів і локорегіонарною променевою терапією ще не виявлена у попередніх дослідженнях. Натомість біопсія сторожового лімфатичного вузла та ад’ювантна ендокринна терапія не збільшували ризик виникнення набряку молочної залози.
Рис. 1. Вплив лімфедеми молочних залоз на інтенсивність больового синдрому (D.A. Young-Afat et al., 2019)
Рис. 2. Вплив лімфатичного набряку молочних залоз на різні аспекти якості життя, пов’язаної зі здоров’ям, після проведення органозберігальної терапії з приводу РМЗ (D.A. Young-Afat et al., 2019)
Це дослідження є першим, у якому вивчали зв’язок набряку молочних залоз і якості життя пацієнток з РМЗ і яке демонструє лікарям достовірні дані, що можуть бути використані для прийняття клінічних рішень.
 Таким чином, віддалені наслідки специфічного лікування РМЗ (постмастектомічний набряк, лімфедема у ділянці грудної клітки, молочних залоз) є не лише медичною, а й соціально-економічною проблемою, адже більшість жінок після перенесеного лікування з приводу РМЗ є працездатного віку. Незадоволеність зовнішнім виглядом, зниження якості життя зумовлює психологічний дискомфорт пацієнтки та її сім’ї.
Таким чином, віддалені наслідки специфічного лікування РМЗ (постмастектомічний набряк, лімфедема у ділянці грудної клітки, молочних залоз) є не лише медичною, а й соціально-економічною проблемою, адже більшість жінок після перенесеного лікування з приводу РМЗ є працездатного віку. Незадоволеність зовнішнім виглядом, зниження якості життя зумовлює психологічний дискомфорт пацієнтки та її сім’ї.
Лікування
Лікування лімфедеми включає хірургічні та консервативні методи. Хірургічні методи лікування лімфедеми значно вдосконалено. Якщо раніше їх метою було зменшення об’єму кінцівок шляхом резекції, то сьогодні вони спрямовані на відновлення нормального лімфовідтоку завдяки реконструктивним операціям, зокрема з формуванням лімфатико-венозних та лімфолімфатичних анастомозів, колатеральних шляхів лімфовідтоку. Проте при веденні пацієнтів з лімфедемою після специфічного лікування з приводу РМЗ віддають перевагу консервативним методам.
Виділяють такі напрями консервативного лікування лімфедеми після специфічного лікування РМЗ (А.Х. Гайдарова и соавт., 2016):
- механічні методи (лікувальна гімнастика, масаж, компресійна терапія, контроль за масою тіла, кінезіотейпування);
- фізичні методи (застосування фізичних факторів реабілітації – ампліпульс, електрофорез, електростимуляція, пневмокомпресія, баротерапія, ультрафіолетове опромінення крові, бальнеотерапія);
- фармакотерапія.
При веденні пацієнток з лімфедемою після перенесеного лікування з приводу РМЗ використовують комплексний підхід: одночасно застосовують механічні, фізичні та медикаментозні методи, а саме – лікарські засоби, що стимулюють лімфодренажну функцію та впливають на тонус вен. Ці ефекти забезпечують засоби на основі біофлавоноїду діосміну (Флєбодіа 600 мг*, Lab. Innotech International), що міститься в рослинах родини Rutaceae, особливо багато в оплодні цитрусових (F. Imam et al., 2015). У клінічних дослідженнях було встановлено, що діосмін зменшує біль і набряк за рахунок покращення лімфодренажу і підтримки мікроциркуляції (K.A. Lyseng-Williamson et al., 2003; I.V. Batchvarov et al., 2010). Він також підвищує опір капілярів, тонус судин та еластичність вен і знижує капілярну фільтрацію та гіперпроникність (M. Perrin et al., 2011). Діосмін проявляє протизапальний ефект, пригнічуючи експресію прозапальних цитокінів за допомогою блокування активації шляхів NF-κB (F. Imam et al., 2015).
Отже, сучасний підхід до ведення пацієнтів передбачає не лише усунення основного захворювання, а й забезпечення адекватної якості життя, психологічного комфорту та сприяння соціальній адаптації. У цьому контексті застосування засобів, які сприяють усуненню лімфедеми, є важливим напрямом терапії пацієнток після перенесеного специфічного лікування РМЗ.
Підготувала Ілона Цюпа
*ФЛЄБОДІА 600 мг. Склад: 1 таблетка містить діосмін, що відповідає 600 мг діосміну безводного чистого. Фармакотерапевтична група. Ангіопротектори. Капіляростабілізуючі засоби. Біофлавоноїди. Код АТХ С05С А03. Показання. Полегшення симптомів лімфовенозної недостатності: важкості у ногах, болю, трофічних розладів. Комплексне лікування функціональних станів, що супроводжуються підвищеною проникністю капілярів. Лікування функціональних симптомів гострого геморою. Протипоказання. Гіперчутливість до компонентів препарату, особливо у пацієнтів, схильних до алергічних реакцій на кошеніль червону А (Е 124). Препарат не рекомендується застосовувати у період годування груддю. Побічні реакції. Можливі алергічні реакції, включаючи висип на шкірі, свербіж. Рідко можливі диспептичні розлади, головний біль. Поодинокі випадки шлунково-кишкових розладів, які рідко призводять до припинення лікування. Спосіб застосування та дози. Лімфовенозна недостатність: 1 таблетка на день вранці перед сніданком. Тривалість курсу лікування визначає лікар залежно від перебігу захворювання. Середня тривалість лікування становить 2 місяці. Гострий геморой: 2-3 таблетки на день під час прийому їжі протягом 7 днів. Якщо після лікування симптоми геморою не зникають, слід звернутися до лікаря для корекції лікування. Максимальна добова доза – 1800 мг (3 таблетки). Категорія відпуску. Без рецепта. Виробник. Іннотера Шузі, Франція / Innothera Chouzy, France. РП № UA/8590/01/01, наказ MОЗ України від 01.08.2018 № 1422. Зміни внесено наказом MОЗ України від 22.07.2019 № 1655.
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 2 (63) 2020 р.