17 червня, 2020
Топ-20 досягнень 2019 року
 Крок за кроком, рік за роком отримуємо нові перемоги у боротьбі з раком. Вже давно ніхто не чекає, що остаточна перемога станеться швидко і на усіх напрямах. Але постійний, нерідко малопомітний поступ приводить до істотного прогресу. Усе більше пацієнтів зі злоякісними пухлинами якщо і не мають шансів повністю одужати, то можуть жити тривалий час навіть при занедбаних стадіях раку.
Крок за кроком, рік за роком отримуємо нові перемоги у боротьбі з раком. Вже давно ніхто не чекає, що остаточна перемога станеться швидко і на усіх напрямах. Але постійний, нерідко малопомітний поступ приводить до істотного прогресу. Усе більше пацієнтів зі злоякісними пухлинами якщо і не мають шансів повністю одужати, то можуть жити тривалий час навіть при занедбаних стадіях раку.
Один рік – це зовсім невеликий термін у житті не лише суспільства, а й окремої людини. Упродовж десятиріч людство щороку підбаває певні підсумки у різних сферах життя – маємо найрізноманітніші відзнаки у науці, культурі, спорті. Офіційної відзнаки в онкології дотепер немає, але протягом кількох останніх років на сторінках «Медичної газети «Здоров’я України» аналізувалися здобутки клінічних онкологів за попередній рік. Спробуємо підсумувати, чого досягли у боротьбі з раком минулого 2019 року, на підставі 20 найсуттєвіших, на нашу думку, публікацій.
Важливо зауважити, що у цій статті проаналізуємо досягнення лише у галузі боротьби з солідними пухлинами, причому тільки за допомогою тих засобів, які вже зареєстровані в Україні. Ці відомості вже найближчим часом зможуть застосовувати наші спеціалісти. У частині найбільш значущих минулорічних публікацій ідеться про уточнення та переконливе підтвердження отриманих раніше даних, тоді як інші істотно розширюють наші знання та можливості лікування. Так склалося, що про найзначніші успіхи в боротьбі з раком спочатку повідомляють на найбільших щорічних спеціалізованих конференціях (Американського чи Європейського товариств клінічної онкології – ASCO та ESMO), а згодом публікують у журналах з найвищим рейтингом – це перш за все New England Journal of Medicine та Lancet, а також Lancet Oncology.
Недрібноклітинний рак легені
Імунотерапія стала важливою складовою лікування метастатичного недрібноклітинного раку легені (НДРЛ). Спочатку її застосовували у другій лінії, а згодом було продемонстровано ефективність імунотерапії на початку лікування (як з хіміотерапією, так і в монорежимі). Опубліковано результати тривалого спостереження хворих, які отримували таке лікування. Найбільш тривале на сьогодні спостереження проводилося у рамках дослідження KEYNOTE‑001. Трирічна виживаність при застосуванні пембролізумабу склала 26,4% у раніше не лікованих пацієнтів і 19,0% в осіб із резистентністю до попередньої лінії лікування. Медіана виживаності склала 22,3 і 10,5 міс відповідно [1]. Дотепер у цій групі інші методи медикаментозної терапії (наприклад, хіміотерапія в комбінації з бевацизумабом) давали можливість досягти лише у 2 рази меншої медіани виживаності.
Дослідження KEYNOTE‑042, у якому брали участь і українські онкологи (серед авторів статті у Lancet – професор Ігор Бондаренко з Дніпра), було своєрідним розширенням дослідження KEYNOTE‑024, що в ньому оцінювали ефективність імунотерапії порівняно з хіміотерапією при експресії рецепторів ліганда білка програмованої клітинної смерті 1 (PD-L1) >50%. У KEYNOTE‑042 ефективність імунотерапії пембролізумабом у монорежимі порівнювали з такою хіміотерапії (ХТ) на основі препаратів платини у хворих на метастатичний НДРЛ з експресією рецепторів PD-L1 понад 1%. Загальна виживаність була значно довшою у групі пембролізумабу – 20,0 проти 12,2 міс при PD-L1 понад 50% та 16,7 проти 12,1 міс при PD-L1 понад 1% [2]. Це стало підставою для розширення показань до застосування монотерапії пембролізумабом у першій лінії (достатньо експресії PD-L1 понад 1% замість 50%; рис. 1).
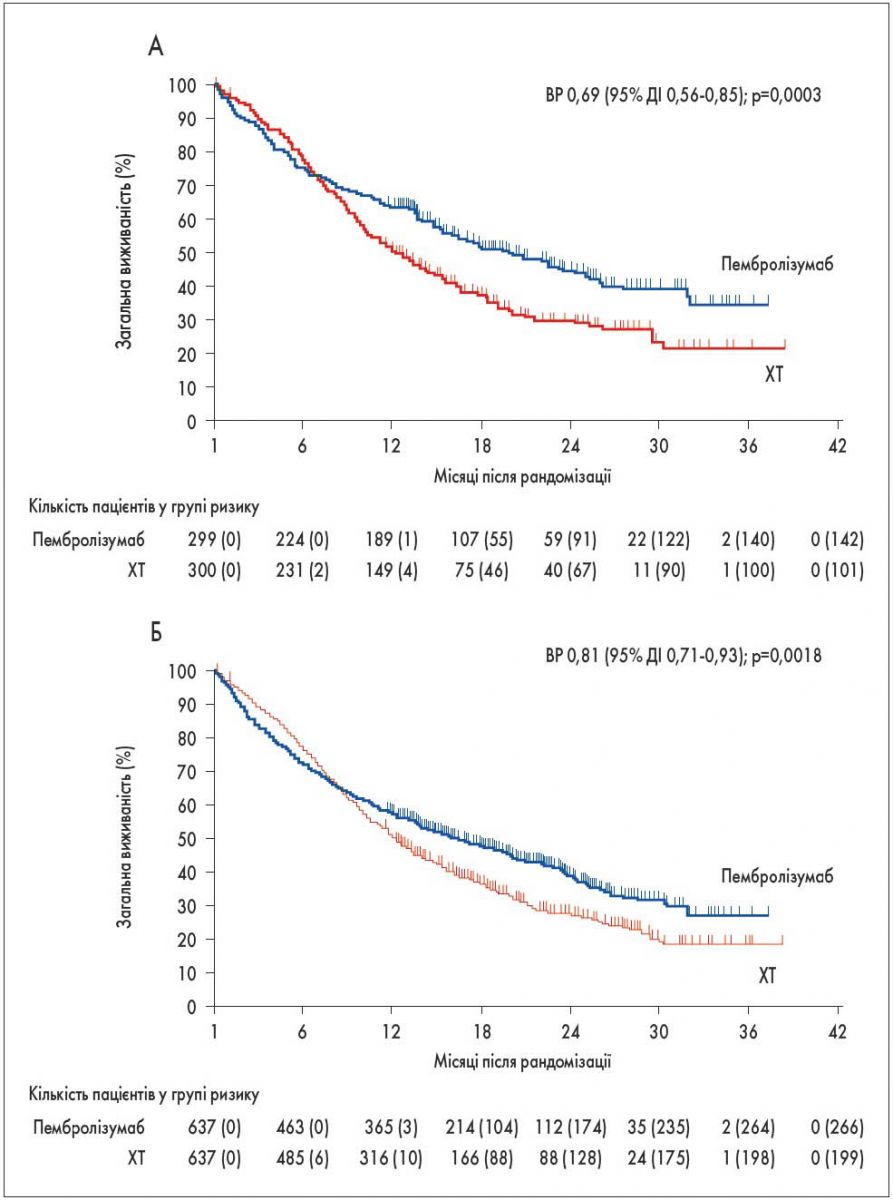 Рис. 1. Загальна виживаність при метастичному НДРЛ з рівнем експресії PD-L1 понад 50% (А) та понад 1% (Б) [2]
Рис. 1. Загальна виживаність при метастичному НДРЛ з рівнем експресії PD-L1 понад 50% (А) та понад 1% (Б) [2]
Іншим дуже ефективним методом лікування НДРЛ є таргетна терапія. Останнім часом уточнено результати такого лікування. У 2018 р. повідомлено, що у хворих на НДРЛ з мутацією рецептора епідермального фактора росту (EGFR) осимертиніб (інгібітор тирозинкінази третього покоління) показав перевагу щодо виживаності без прогресування над інгібіторами тирозинкінази першого покоління (ерлотинібом або гефітинібом). Минулого року на конференції ESMO доповіли, що медіана загальної виживаності у групі осимертинібу також була більша, ніж у групі стандартної терапії – 38,6 проти 31,8 міс відповідно. При цьому слід вказати, що у разі прогресування захворювання у пацієнтів контрольної групи у них була можливість отримувати осимертиніб (рис. 2) [3]. У дослідженні FLAURA брали участь 4 українських клініки.
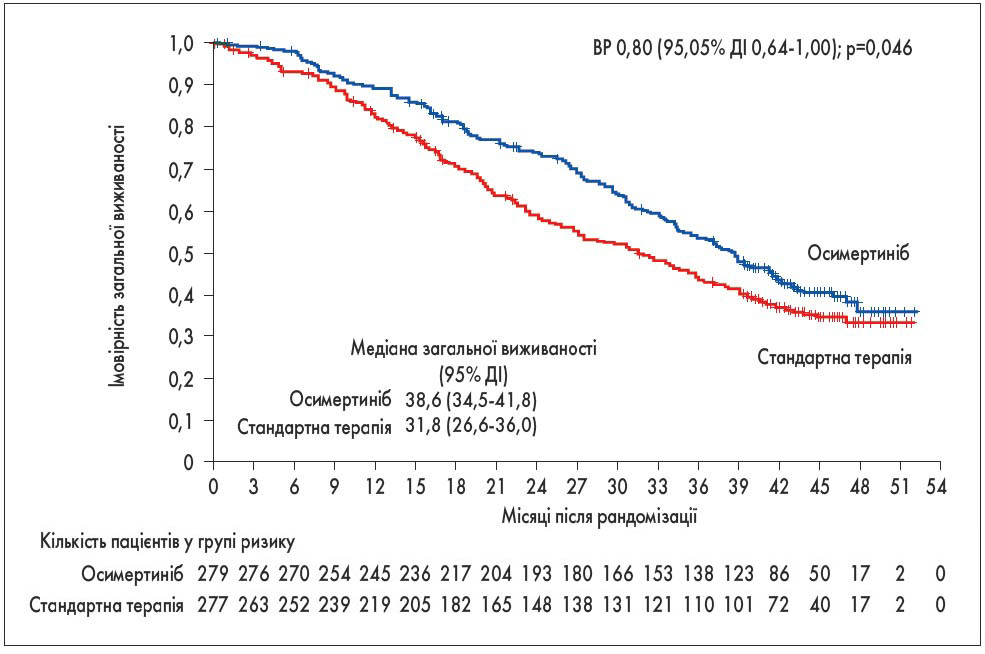 Рис. 2. Загальна виживаність при застосуванні осимертинібу або стандартної терапії у хворих на НДРЛ з мутацією гена EGFR [3]
Рис. 2. Загальна виживаність при застосуванні осимертинібу або стандартної терапії у хворих на НДРЛ з мутацією гена EGFR [3]
НДРЛ з мутацією ALK – рідкісне захворювання (5-7% НДРЛ), але упродовж останніх років досягнуто значних успіхів у його лікуванні. Спочатку було доведено, що таргетний препарат кризотиніб ефективніший при цьому типі НДРЛ, ніж традиційна ХТ (дослідження A8081014, у якому брали участь українські клініки). Невдовзі у цій групі з’явилися препарати наступних поколінь. Попередні результати дослідження ALEX (також проводилося і в 4 клініках України), в якому порівнювали ефективність кризотинібу (перше покоління ALK-інгібіторів) та алектинібу (третє покоління ALK-інгібіторів), опубліковано у 2017 р.: медіана виживаності без прогресування склала 25,7 міс у групі алектинібу проти 10,4 міс при застосуванні кризотинібу. Оновлені результати показали ще значнішу різницю – 34,8 проти 10,9 міс. Для оцінювання медіани виживаності даних ще недостатньо, але зрозуміло, що цей показник буде безпрецедентним для НДРЛ (рис. 3) [4].
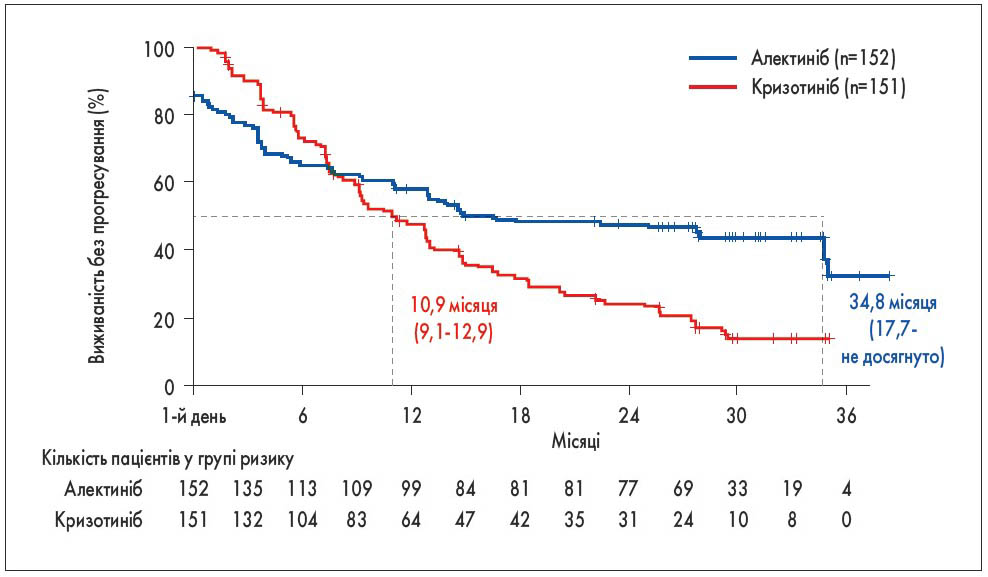 Рис. 3. Виживаність без прогресування у разі застосування алектинібу та кризотинібу при ALK-позитивному метастатичному раку легені [4]
Рис. 3. Виживаність без прогресування у разі застосування алектинібу та кризотинібу при ALK-позитивному метастатичному раку легені [4]
Рак грудної залози
Мабуть, найголовнішим минулорічним досягненням у лікуванні раку грудної залози (РГЗ) стало підтвердження ефективності імунотерапії в неоад’ювантному режимі при потрійному негативному РГЗ. Цей підтип навіть у ранній стадії має відносно несприятливий прогноз порівняно з іншими формами РГЗ. Прогноз поліпшується, якщо внаслідок застосування неоад’ювантної ХТ досягається повне морфологічне регресування пухлини. Тому сучасні дослідження спрямовані на пошуки способів підвищити частку пацієнток, у яких досягнуто такого ефекту. На минулорічній конференції ESMO повідомлено результати дослідження KEYNOTE‑522. Використання комбінації імунотерапії (4 цикли пембролізумабу) і ХТ (4 цикли паклітаксел + карбоплатин) при ІІ-ІІІ стадіях потрійного негативного РГЗ дало можливість досягти повного регресування у 64,8% хворих (порівняно з 51,2% у групі без імунотерапії). Прогресування захворювання упродовж спостереження з медіаною 15,5 міс відбулося у 7,4% пацієнток групи пембролізумабу та в 11,8% контрольної групи. Цілком імовірно, що короткі курси імунохіміотерапії невдовзі стануть стандартом неоад’ювантного режиму при потрійному негативному РГЗ [5].
Іншою складною з практичної точки зору проблемою є тактика лікування при HER2+ РГЗ після стандартної неоад’ювантної терапії (ХТ + трастузумаб). Приблизно у половини хворих вдається досягти повного морфологічного регресування пухлини, і віддалені результати лікування у таких пацієнтів значно кращі, ніж в осіб, у яких не вдалося отримати такого ефекту. У дослідженні KATHERINE порівнювали ефективність стандартної в таких випадках терапії трастузумабом (ще 14 циклів, тобто до 1 року) та T-DM1. Через 3 роки не мали інвазивних захворювань 88,3% пацієнтів у групі T-DM1 та 77,0% – у групі трастузумабу. Віддалений рецидив як перша подія інвазивного захворювання спостерігався у 10,5% хворих групи T-DM1 та 15,9% пацієнтів групи трастузумабу [6].
Злоякісні новоутворення шлунково‑кишкового тракту
Дуже важливою для клінічної практики онкологів України є публікація результатів застосування комбінації FLOT4 (флуорурацил, лейковорин, оксаліплатин, доцетаксел – 4 цикли у неоад’ювантному режимі і ще 4 в ад’ювантному) при резектабельному раку шлунка (клінічна стадія cT2 і вище і/або cN+, але без віддалених метастазів). Ця комбінація виявилася значно ефективнішою від традиційно застосовуваних раніше – ECF/ECX (епірубіцин, цисплатин і флуорурацил або капецитабін). Ще у 2016 р. повідомили, що повне морфологічне регресування зафіксовано у 20 проти 8% пацієнтів відповідно. Минулого року опубліковано результати розширення цього дослідження (всього лікували 716 пацієнтів). Медіана загальної виживаності склала 50 проти 35 міс, що дало можливість пропонувати цей режим як новий стандарт лікування при раку шлунка [7].
Результати лікування занедбаного раку підшлункової залози залишаються незадовільними. При застосуванні трикомпонентних режимів FOLFIRINOX чи FOLFOXIRI медіана виживаності без прогресування складає приблизно 6 міс, а медіана загальної виживаності не досягає 1 року. Відомо, що наявність гермінальної мутації генів BRCA1 або BRCA2 істотно підвищує ризик розвитку раку підшлункової залози. Упродовж останніх років доведено ефективність препаратів групи інгібіторів полі-(аденозиндифосфат-рибоза)-полімерази (PARP) у хворих на рак яєчника та грудної залози, які мають вказані мутації. У великому рандомізованому дослідженні POLO з 3315 пацієнтів, у яких зафіксовано стабілізацію після першої лінії платиновмісної ХТ, 154 (4,6%) мали BRCA-позитивний статус. Підтримувальна терапія інгібітором PARP олапарибом дала можливість продовжити час до прогресування захворювання до 7,4 міс (проти 3,8 міс у групі плацебо, коефіцієнт ризику склав 0,53). І хоча це не вплинуло на показники загальної виживаності (18,9 проти 18,1 міс) [8], Управління з контролю якості харчових продуктів і лікарських препаратів США (FDA) наприкінці 2019 р. зареєструвало це показання для олапарибу.
Рак голови та шиї
Результати кількох важливих клінічних досліджень стосуються раку голови та шиї (РГШ), при якому традиційно застосовується доволі агресивна хіміопроменева терапія з додаванням таргетних засобів. Ведуться пошуки деескалації лікування. У дослідженні De-ESCALaTE HPV при HPV-позитивному РГШ низького ризику (у некурців або курців з незначним стажем – менше 10 пачко-років) порівнювали результати променевої терапії в комбінації зі стандартним режимом цисплатину (100 мг/м2 площі поверхні тіла через кожні 3 тижні, 3 цикли) або в комбінації з цетуксимабом. Виявилося, що у першій групі дворічна загальна виживаність була вищою (97,5 vs 89,4%), а кількість рецидивів за цей час – меншою (6,0 проти 16,1%) [9]. Аналогічних висновків дійшли і в результаті іншого клінічного дослідження (NRG Oncology RTOG 1016): п’ятирічна виживаність без прогресування склала 78,4% при застосуванні цисплатину проти 67,3% у групі цетуксимабу [10]. Таким чином, комбінація опромінення з цисплатином залишається доведеним стандартом лікування занедбаного HPV-позитивного РГШ.
Натомість деескалації лікування вдалося досягти у разі застосування імунотерапії. У дослідженні KEYNOTE‑040 у другій лінії протипухлинної терапії при нечутливому до платини РГШ порівнювали ефективність традиційних для таких випадків режимів (метотрексат, доцетаксел або цетуксимаб) з імунотерапією пембролізумабом. Медіана загальної виживаності була вищою у групі пембролізумабу (8,4 проти 6,9 міс), при цьому токсичність імунотерапії була істотно нижчою, ніж стандартного лікування [11]. Ці результати стали підґрунтям до вивчення ролі пембролізумабу у першій лінії при метастатичному чи рецидивному РГШ. У дослідженні KEYNOTE‑048 порівняли ефективність трьох методів лікування: монотерапії пембролізумабом, пембролізумаб + ХТ (цисплатин + 5-флуорурацил) і цетуксимаб + ХТ. Виявилося, що за високого рівня експресії PD-L1 (CPS ≥20) загальна виживаність при монотерапії пембролізумабом (медіана 14,9 міс) і його комбінації з ХТ (14,7 міс) вища, ніж комбінації ХТ з цетуксимабом (10,7 міс; рис. 4) [12]. За результатами цього дослідження FDA зареєструвало пембролізумаб для першої лінії терапії при занедбаному плоскоклітинному РГШ.
 Рис. 4. Загальна виживаність у разі застосування комбінації пембролізумаб + ХТ порівняно з комбінацією цетуксимаб + ХТ при занедбаному РГШ із високим рівнем експресії PD-L1 (CPS ≥20) [12]
Рис. 4. Загальна виживаність у разі застосування комбінації пембролізумаб + ХТ порівняно з комбінацією цетуксимаб + ХТ при занедбаному РГШ із високим рівнем експресії PD-L1 (CPS ≥20) [12]
Рак нирки
Таргетна терапія (сунітиніб, пазопаніб тощо) вже 15 років є стандартом паліативної терапії при нирковоклітинному раку. Упродовж останніх років проведено кілька досліджень, які вказують на перспективність застосування імунотерапії при цьому захворюванні. За результатами великого рандомізованого дослідження KEYNOTE‑426, у якому брали активну участь українські онкологічні центри, доведено переваги комбінації імунотерапії з таргетними засобами (пембролізумаб + акситиніб) над стандартною таргетною терапією (сунітиніб). Однорічна виживаність склала 89,9 проти 78,3%, медіана виживаності без прогресування – 15,1 проти 11,1 міс. Переваги комбінації спостерігали в усіх прогностичних групах за критеріями International Metastatic Renal Cell Carcinoma Database Consortium, вони не залежали від ступеня експресії PD-L1 (рис. 5) [13]. Цей метод лікування затверджено FDA.
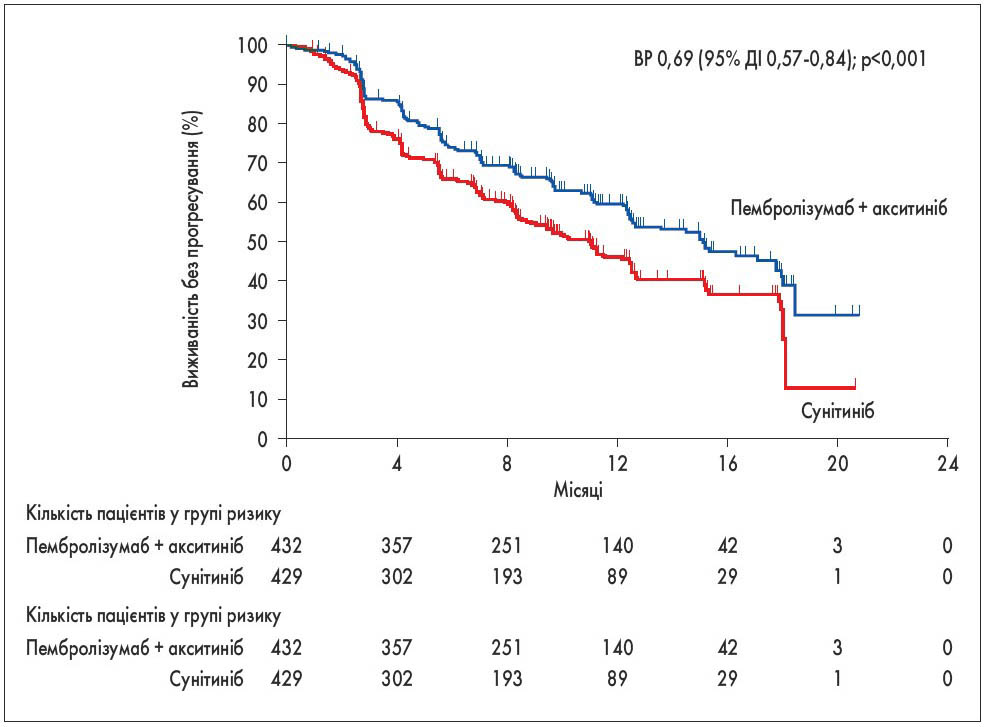 Рис. 5. Виживаність без прогресування при застосуванні пембролізумабу в комбінації з акситинібом при метастатичному нирковоклітинному раку [13]
Рис. 5. Виживаність без прогресування при застосуванні пембролізумабу в комбінації з акситинібом при метастатичному нирковоклітинному раку [13]
У дослідженні IMmotion151 також показано переваги імунотерапії (атезолізумаб у комбінації з бевацизумабом) над стандартною терапією сунітинібом. У групі хворих з PD-L1-позитивним статусом медіана виживаності без прогресування склала 11,2 проти 7,7 міс відповідно [14].
Рак передміхурової залози
Дослідження останніх років розширили можливості у лікуванні раку передміхурової залози. Зокрема, крім традиційних режимів першої лінії терапії метастатичного раку передміхурової залози (стандартна антиандрогенова блокада нестероїдними препаратами, доцетаксел чи абіратерон), стало можливо застосовувати ензалутамід. Загальна трирічна виживаність склала 80 проти 72% у групі стандартної терапії [15].
Є досягнення й у лікуванні кастраційно-резистентного раку передміхурової залози. Цитостатик кабазитаксел виявився ефективнішим від нових таргетних засобів, що блокують сигнальні шляхи андрогенів (абіратерон або ензалутамід) у хворих на рак передміхурової залози, у яких зареєстровано прогресування після гормонотерапії й упродовж 12 міс після терапії доцетакселом. Медіана загальної виживаності склала 13,6 проти 11,0 міс відповідно [16]. На минулорічній конференції ESMO оприлюднили результати дослідження, у якому при кастраційно-резистентному раку передміхурової залози та дефіциті гомологічної репарації (HDR, зокрема мутації генів BRCA1, BRCA2 або ATM) застосування PARP-інгібітора олапарибу дало можливість поліпшити результати лікування порівняно зі стандартним (абіратерон або ензалутамід). Медіана часу до прогресування хвороби склала 7,4 проти 3,6 міс (коефіцієнт ризику прогресування або смерті становив аж 0,34, що є суттєвим показником для досліджень в онкології) [17].
Рак яєчника
Підтримувальна терапія олапарибом уже кілька років успішно застосовується у другій лінії при раку яєчника. У клінічному дослідженні PAOLA‑1 доведено ефективність додавання підтримувальної терапії олапарибом при поширеному раку яєчника вже після першої лінії у пацієнток із HDR-позитивними пухлинами, у тому числі і без мутації генів BRCA. Застосування бевацизумабу в комбінації з олапарибом як підтримувального лікування після платиновмісної терапії першої лінії дало можливість досягти медіани виживаності без прогресування 22,1 міс порівняно з 16,6 міс у групі стандартної терапії бевацизумабом. Важливим виявилося й те, що у пацієнток з HRD-позитивними пухлинами без мутацій генів BRCA медіана виживаності без прогресування була ще помітнішою – 28,1 проти 16,6 міс (рис. 6) [18].
 Рис. 6. Виживаність без прогресування при застосуванні бевацизумабу в комбінації з олапарибом як підтримувального лікування після платиновмісної терапії першої лінії при раку яєчника [18]
Рис. 6. Виживаність без прогресування при застосуванні бевацизумабу в комбінації з олапарибом як підтримувального лікування після платиновмісної терапії першої лінії при раку яєчника [18]
Меланома
Зі схваленням таргетних препаратів та імунотерапії для лікування меланоми результати терапії навіть при метастатичних формах значно поліпшилися. Минулого року стало можливо оцінити ефективність тривалого лікування таких хворих. За результатами досліджень COMBI‑d та COMBI‑v, у яких взяли участь і українські онкологи, застосування комбінації траметинібу та дабрафенібу (інгібітори BRAF та MEK) у хворих на метастатичну меланому з мутаціями гена BRAF (V600E або V600K) дало можливість досягнути фантастичних з точки зору минулого десятиліття показників 4‑річної (37%) та 5‑річної (34%) загальної виживаності. У пацієнтів, у яких досягалося повне регресування пухлинного процесу (таких було 19%), п’ятирічна виживаність дорівнювала 71% (рис. 7) [19].
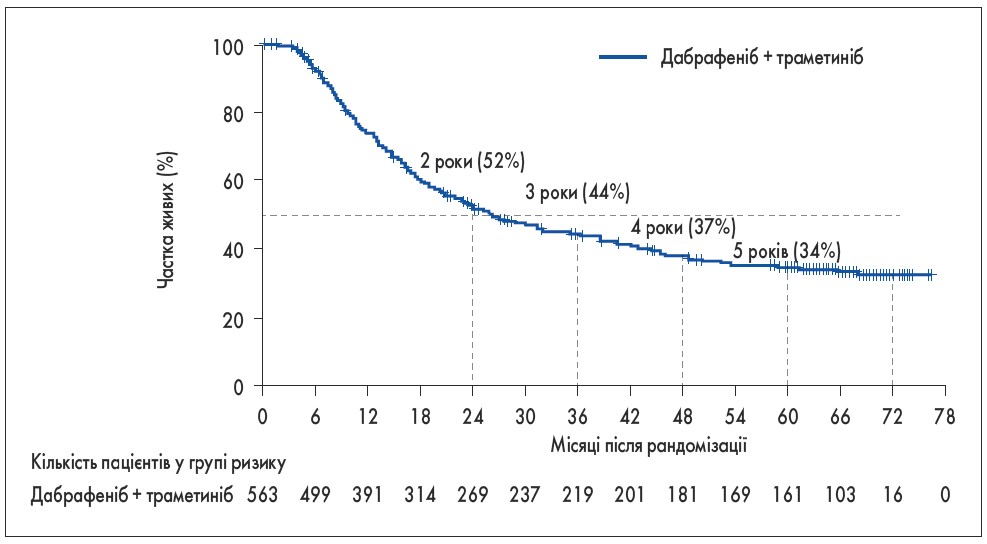 Рис. 7. Загальна виживаність при лікуванні комбінацією траметинібу та дабрафенібу хворих на метастатичну меланому [19]
Рис. 7. Загальна виживаність при лікуванні комбінацією траметинібу та дабрафенібу хворих на метастатичну меланому [19]
Ці результати стали підґрунтям до застосування вказаної комбінації для неоад’ювантної терапії при ІІІ стадії меланоми. Після 12-тижневої неоад’ювантної терапії у 46% пацієнтів зареєстрували повне регресування процесу за критеріями RECIST. Натомість повна морфологічна відповідь зафіксована у 51%, а у решти – значне регресування. На тлі неоад’ювантної терапії жодного разу не було виявлено прогресування хвороби [20].
Таким чином, минулий рік приніс істотний поступ у медикаментозне лікування солідних пухлин. Запроваджено принципово нові підходи до лікування:
- комбінація імунотерапії та таргетної терапії при занедбаному раку нирки, з метою підтримувальної терапії при раку яєчника;
- імунотерапія в першій лінії метастатичного РГШ;
- неоад’ювантна таргетна терапія при меланомі;
- неоад’ювантна імунохіміотерапія при РГЗ;
- таргетна терапія PARP-інгібіторами при раку підшлункової та передміхурової залози.
Крім того, отримано довготривалі результати лікування і розширено показання до застосування відомих препаратів і їх комбінацій. Все це є підставою для подальших досліджень і нових досягнень у лікуванні раку.
Література
- Leighl N.B. et al. Lancet Respir Med. 2019 Apr; 7(4): 347-357.
- Mok T.S.K. et al. Lancet. 2019 May 4; 393(10183): 1819‑1830.
- Ramalingam S.S. et al. N Engl J Med. 2020 Jan 2; 382(1): 41-50.
- Camidge D.R. et al. J Thorac Oncol. 2019 Jul; 14(7): 1233-1243.
- Schmid P. et al. N Engl J Med. 2020 Feb 27; 382(9): 810‑821.
- von Minckwitz G. et al. N Engl J Med. 2019; 380: 617‑628.
- Al-Batran S.E. et al. Lancet. 2019 May 11; 393(10184): 1948-1957.
- Golan T. et al. N Engl J Med. 2019 Jul 25; 381(4): 317‑327.
- Mehanna H. et al. Lancet. 2019 Jan 5; 393(10166): 51-60.
- Gillison M.L. et al. Lancet. 2019 Jan 5; 393(10166): 40-50.
- Cohen E.E.W. et al. Lancet. 2019 Jan 12; 393(10167): 156-167.
- Burtness B. et al. Lancet. 2019 Nov 23; 394(10212): 1915-1928.
- Rini B.I. et al. N Engl J Med. 2019 Mar 21; 380(12): 1116-1127.
- Rini B.I. et al. Lancet. 2019 Jun 15; 393(10189): 2404‑2415.
- Davis I.D. et al. N Engl J Med. 2019 Jul 11; 381(2): 121‑131.
- de Wit R. et al. N Engl J Med. 2019 Dec 26; 381(26): 2506-2518.
- de Bono J. et al. N Engl J Med. 2020 May 28; 382: 2091‑2102.
- Ray-Coquard I. et al. N Engl J Med. 2019 Dec 19; 381(25): 2416-2428.
- Robert C. et al. N Engl J Med. 2019 Aug 15; 381(7): 626-636.
- Long G.V. et al. Lancet Oncol. 2019 Jul; 20(7): 961-971.
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 2 (63) 2020 р.


