21 червня, 2020
Запалення як причина кашлю та розвитку ускладнень: можливості інноваційних муколітиків
Вислів «Amor еt tussis non celatur» (лат. «Кохання та кашель не приховаєш») є актуальним не лише для закоханої людини, а й для лікаря, котрий розуміє, що кашель приховувати не лише важко, це вкрай небезпечно і для пацієнта, і для суспільства. Кашель є однією з найчастіших причин звернення до сімейного лікаря та пульмонолога. В умовах пандемій туберкульозу та коронавірусної хвороби (COVID‑19) пацієнт із кашлем миттєво стає не тільки об’єктом пильної уваги з боку оточення, але й реальною загрозою поширення інфекції.
Однією з головних причин кашлю є запальний процес у своєму гострому чи хронічному прояві. Розвиток кашлю або як ознаки маніфестації запальної реакції, або як захисного евакуаційного фактора чітко зумовлений еволюцією фаз запалення [1-4]. Запалення завжди починається з пошкодження тканини, комплексу обмінних, фізико-хімічних і структурно-функціональних змін, тобто з альтерації тканини, що відіграє роль пускового чинника запального процесу й поділяється на дві стадії: первинну та вторинну [3].
Первинна альтерація – це сукупність змін обміну речовин, фізико-хімічних властивостей, структури та функції клітин і тканин, які виникають унаслідок прямого впливу етіологічного фактора запалення. Первинна альтерація як результат взаємодії етіологічного чинника з організмом зберігається та служить причиною запалення й після припинення цієї взаємодії [1, 3]. Реакція вторинної альтерації свого роду пролонгує дію причини запалення [3]. Якщо первинна альтерація є результатом безпосередньої дії пошкоджувального агента, то вторинна не залежить від нього та може тривати й тоді, коли цей агент уже не чинить впливу.
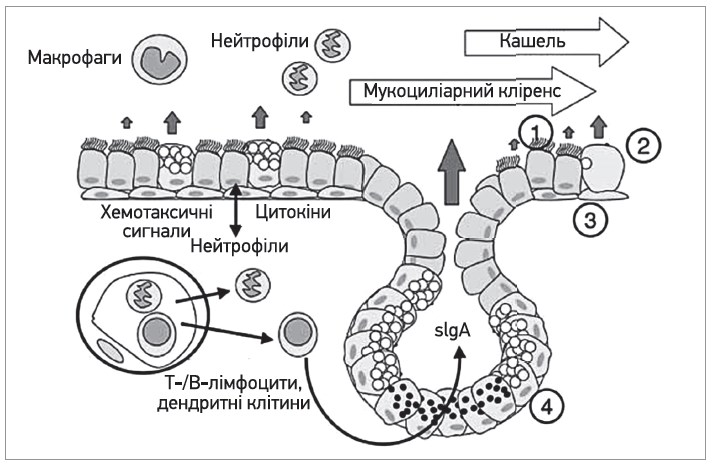
Суть першої фази запалення полягає в тому, що бактерії чи віруси, шкідливі фактори довкілля чи виробничого процесу призводять до місцевих змін у вигляді альтерації тканин і складових їхніх клітин, вивільнення біологічно активних речовин, серед яких ключовими компонентами балансу прогресування запалення та, відповідно, патології є інтерлейкін (ІЛ) -6 і -8 [1-4]. Ці біологічно активні сполуки здатні активувати ендотелій, нарощувати подальшу експресію адгезивних молекул, що супроводжується черговим виділенням низькомолекулярних медіаторів запалення – гістаміну, простагландинів, які генералізують розвиток запальної реакції (рис. 1) [4].
Рис. 1. Патогенез запального процесу [5]
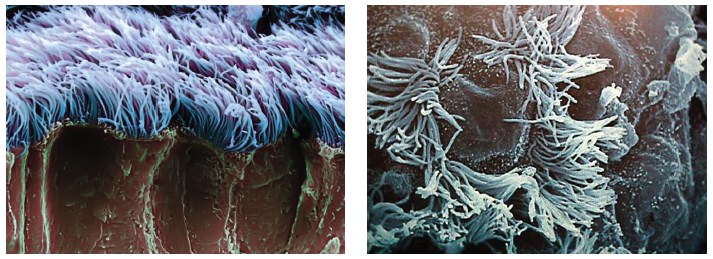
Наступна фаза – ексудація – вихід рідкої частини крові, електролітів, білків і клітин через судинну стінку в запальну тканину. Основний механізм ексудації – підвищення проникності судинної стінки – зумовлений дією низки патогенетичних факторів. До них належать: руйнування судинної стінки при альтерації; округлення ендотеліальних клітин й утворення складчастості плазматичної мембрани ендотеліоцитів при скороченні цитоскелета. Судинні реакції у вогнищі запалення, що супроводжуються зміною проникності судин стінки, призводять також до міграції лейкоцитів й інших формених елементів крові за межі мікросудин [1, 3, 4]. Виникає набряк слизової, збільшується в’язкість мокротиння (рис. 1, 2). Ескалатор мукоциліарного кліренсу зупиняється (functio laesa).Виникає захисний рефлекс – кашель. Найбільш ефективним і безпечним для оточуючих способом очищення дихальних шляхів є шлях, запропонований природою, – нормальна робота війок миготливого епітелію. Oported guod natura facied et fiat («Роби згідно з велінням природи») – так казав Гіппократ, і тому в даній фазі при запальних захворюваннях нижніх дихальних шляхів домінантну роль відіграватимуть препарати, здатні регулювати фізико-хімічні властивості мокротиння й евакуаційні системи на рівні війчастого епітелію [2, 4].
Рис. 2. Миготливий епітелій у нормі та при запаленні (растрова електронна мікроскопія) [6]
Підсумком запального процесу та його завершенням є проліферація, котра включає в себе три стадії [3]: власне проліферацію, тобто розмноження клітин; синтез позаклітинних компонентів сполучної тканини – колагену, еластину, протеогліканів, глікопротеїну‑1; інгібування ферментів α2-макроглобуліном, припинення руйнівних явищ, генерації вільних радикалів, пригнічення активності клітин запалення та лімфоцитів. Умови для її розвитку закладено вже в самому початку запального процесу, коли біологічно активні речовини, що виникають в осередку запалення, стимулюють розмноження місцевих клітинних елементів, насамперед фiброцитiв, гiстiоцитiв, клітин адвентиції, ендотелію тощо. Причому активність цих саногенетичних механізмів корелює з об’ємом первинної альтерації та первинної активації прозапальних цитокінів [1-3].
Важливо зазначити, що запалення – це не лише кашель, а й розвиток серйозних ускладнень: на тлі набряку слизової оболонки бронхів, надмірної кількості харкотиння та неможливості його евакуювати спостерігаються [7] бронхоспазм і колонізація дихальних шляхів патогенною флорою, наслідком чого є розвиток тяжкого бронхіту, пневмонії, загострення хронічного бронхіту та хронічного обструктивного захворювання легень (ХОЗЛ).
Власне, тому при подоланні кашлю особливої уваги набуває не тільки муколітична, але й протизапальна терапія. Останнім часом спостерігається справжня «гонитва» за молекулами, що завдяки плейотропності своїх ефектів мають кілька точок прикладання до патологічного процесу.
На думку світової медичної спільноти, гордістю серед таких сполук є молекула ердостеїну, що належить до фармакотерапевтичної групи муколітиків (код АТХ R05CB15), але має дві точки прикладання – кашель і запалення [8, 9]. Оригінальний ердостеїн, відомий під брендовою назвою Ермуцин (реєстраційне посвідчення: UA/14088/01/01), виробляється італійською компанією Еdmond Pharma, котра входить до складу Recipharm Group (Швеція), та представлений у більш ніж 40 країнах [10].
Показаннями до використання Ермуцину є стани, що потребують зменшення в’язкості та полегшення відхаркування бронхіального секрету при лікуванні гострих і хронічних захворювань верхніх і нижніх дихальних шляхів: бронхіт, риніт, синусит, ларингофарингіт, загострення хронічного бронхіту, ХОЗЛ, гіперсекреторна («волога») бронхіальна астма, бронхоектатична хвороба [8]. Препарат показаний як супутня терапія з антибіотиками при бактеріальних інфекціях дихальних шляхів і для профілактики рецидивних епізодів інфекцій та ускладнень після хірургічних втручань, таких як пневмонія чи ателектаз легень [8].
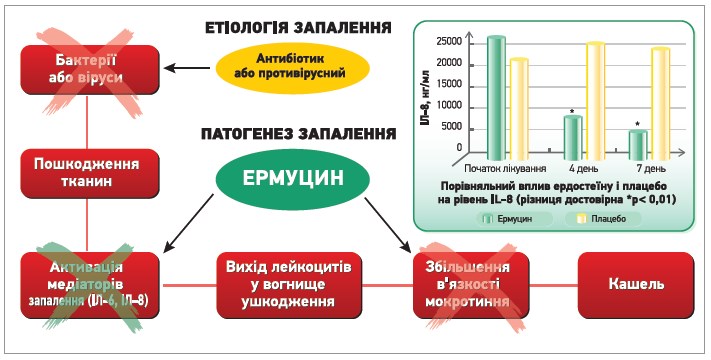
Муколітичний ефект реалізується завдяки руйнуванню дисульфідних містків, які зв’язують волокна глікопротеїнів, унаслідок чого зменшуються еластичність і в’язкість слизу. Метаболіти ердостеїну сприяють очищенню дихальних шляхів від секрету та підвищують ефективність мукоциліарного механізму евакуації слизових і слизово-гнійних виділень із верхніх і нижніх дихальних шляхів. Проте цей інноваційний муколітик на особливу увагу заслуговує, власне, через яскраво виражений додатковий плюс – вплив на каскад запального процесу (рис. 3).
Рис. 3. Механізм дії ердостеїну [8, 9, 14, 17]
Із метою впливу на запалення при патології органів дихання застосовуються такі лікарські засоби, як інгаляційні кортикостероїди (ІКС) [11, 12], зокрема як базова терапія в пацієнтів із бронхіальною астмою та ХОЗЛ. Під впливом ІКС зменшується вміст прозапальних клітин у тканинах легень, а також рівень основних медіаторів запалення та прозапальних цитокінів. Окрім того, ці препарати демонструють антиоксидантну дію. Зважаючи на зниження сприйняття ІКС під впливом оксидативного стресу, характерного для ХОЗЛ, ці засоби призначають у високих добових дозах.
Одним із механізмів протизапальної дії кортикостероїдів є здатність стимулювати синтез білка, котрий блокує активність фосфоліпази А2, що сприяє зменшенню утворення простагландинів, тромбоксану та лейкотрієнів. Інгібувальну дію на активність фосфоліпази А2, але відмінним від стероїдів шляхом – блокуючи транспорт іонів Са2+, що необхідні для активації фосфоліпази, чинить фенспірид – протизапальний засіб нестероїдної природи. Препарат має виражену протизапальну дію за рахунок зниження вмісту прозапальних клітин і цитокінів. Фенспірид має здатність нормалізувати бронхіальну секрецію та мукоциліарний кліренс, зменшувати набряк слизової оболонки при запаленні, довів свою клінічну ефективність при лікуванні гострого бронхіту та як базисна терапія ХОЗЛ [11, 12]. Але 2019 р. фенспірид був заборонений через вплив на подовження інтервалу QT [13].
Ермуцин має доведену протизапальну дію та демонструє відмінний профіль безпеки: навіть у разі тривалого прийому протягом 12 міс частка пацієнтів, які мали побічні ефекти, не відрізнялася від такої в групі плацебо [14]. Протизапальна дія препарату in vitro та in vivo ґрунтується на пригніченні синтезу ІЛ‑6 та ІЛ‑8 [8, 9, 15], які є ключовими цитокінами, що беруть безпосередню участь у формуванні нейтрофільного запального процесу в бронхіальному дереві та легеневій паренхімі [3, 4, 16]. Вони синтезуються різними імунокомпетентними клітинами у відповідь на вторгнення в організм патогенів, таких як віруси, бактерії, токсини, котрі є потенційними агентами, що спричиняють гострі запальні захворювання чи загострення хронічних запальних захворювань дихальних шляхів. ІЛ‑6 синтезується Т- і В‑лімфоцитами, макрофагами й іншими клітинами та є не тільки маркером запалення дихальних шляхів, а й предиктором потенційного ушкодження альвеолярного епітелію, що призводить до ремоделювання бронхіального дерева та втрати еластичності легеневої тканини [1-4].
Продуцентами ІЛ‑8 є лімфоцити, нейтрофільні гранулоцити, різні епітеліальні клітини, фібробласти, гепатоцити, проте найперше – моноцити/макрофаги й ендотеліоцити [1, 3, 4]. Основна роль ІЛ‑8 полягає в хемотаксичному й активувальному впливі на нейтрофіли [18], у посиленні міграції фагоцитів у вогнище пошкодження (легеневу паренхіму, слизову оболонку бронхів) та активації ними синтезу молекул адгезії. Цей факт є дуже важливим, оскільки при бронхіті, в тому числі хронічному, пневмонії, ХОЗЛ саме нейтрофіли відіграють ключову роль у виникненні запального процесу в locus morbi, на відміну від еозинофільного запального процесу, що домінує при бронхіальній астмі [3, 4]. Із підвищенням продукції IЛ‑6 та ІЛ‑8 пов’язують процеси ремоделювання бронхів і розвиток незворотної бронхообструкції, що є фундаментом для прогресування ХОЗЛ [3, 16].
Вплив Ермуцину на інгібування синтезу IЛ‑6 та ІЛ‑8 є особливо важливим у разі ХОЗЛ, оскільки для цієї патології характерне постійне підвищення продукції зазначених прозапальних трансмітерів, навіть у період ремісії захворювання [3], а їх блокування, безумовно, зменшує інтенсивність запального процесу та пов’язаних із ним ускладнень [8, 9].
Окрім того, ердостеїн перешкоджає інгібуванню тютюновим димом α1-антитрипсину та гранулоцитів, запобігаючи ураженням, які спричиняє смог або куріння; збільшує рівень IgA в дихальних шляхах у пацієнтів із ХОЗЛ [8, 15]. Відомо, що молекула ердостеїну діє також як акцептор вільних радикалів кисню, запобігаючи їх локальному утворенню, та значно зменшує рівень 8-ізопростану як маркера перекисного окислення ліпідів [8, 15].
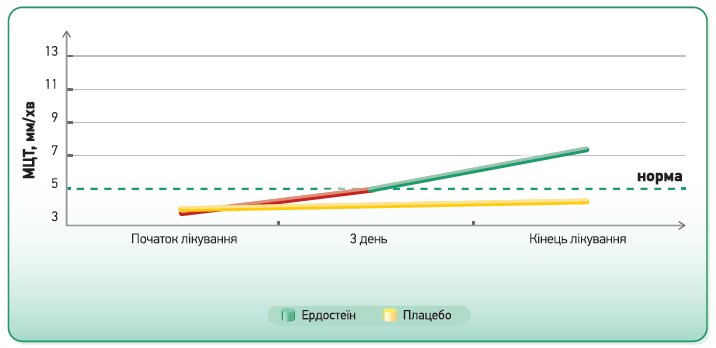
Поєднання муколітичної та протизапальної дії реалізується в низці особливо цінних для практичних лікарів ефектів. Завдяки тому, що препарат впливає не тільки на кашель, але й на його причину – запалення, робота мукоциліарного епітелію відновлюється вже на 3-й день лікування, а кашель стає нечастим, м’яким, минає швидше (рис. 4).
Рис. 4. Вплив ердостеїну на швидкість мукоциліарного транспорту [9, 21]
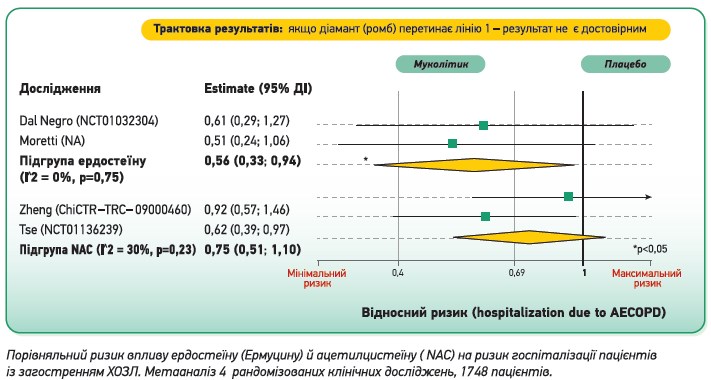
Як переконливо доводить метааналіз за участю 1748 пацієнтів (рис. 5), ердостеїн достовірно (на відміну від ацетилцистеїну) зменшує ризик ускладнень і госпіталізації при загостреннях ХОЗЛ, що є виявом поєднання муколітичного та протизапального ефектів [8, 9, 17]. На цьому варто наголосити, оскільки госпіталізація завжди зумовлює збільшення не тільки фінансового навантаження, а й ризику летальності [8, 19].
Рис. 5. Порівняльна характеристика впливу ердостеїну й ацетилцистеїну на ризик госпіталізації пацієнтів із загостренням ХОЗЛ [17]
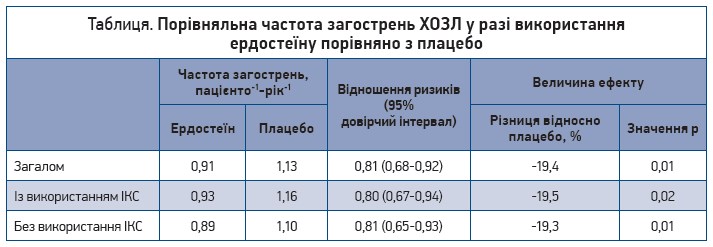
У досліджені RESTORE доведено вплив ердостеїну на частоту та тривалість загострень ХОЗЛ. Отримані результати дали змогу включити ердостеїн у міжнародні (GOLD, 2019) та національні (адаптована клінічна настанова, заснована на доказах) протоколи лікування ХОЗЛ [19, 20]. RESTORE [14] є проспективним рандомізованим подвійним сліпим плацебо-контрольованим дослідженням, до якого залучили 467 пацієнтів із ХОЗЛ віком 40-80 років. Ступінь тяжкості захворювання визначено приблизно порівно як GOLD II (помірний) і GOLD III (тяжкий). Базова терапія була такою: 60% пацієнтів приймали інгаляційний М‑холінолітик пролонгованої дії, тоді як 40% використовували комбіноване лікування пролонгованим β2-адреноміметиком з ІКС. Учасники отримували додатково до базової терапії 300 мг ердостеїну 2 рази на день або плацебо впродовж 12 міс. Капсули ердостеїну та плацебо було виготовлено компанією Edmond Pharma (Італія). Основною кінцевою точкою дослідження була кількість загострень.
При лікуванні ердостеїном спостерігалося (табл.) зниження частоти всіх загострень на 19,4% (0,91 проти 1,13 загострення на пацієнто‑1-рік‑1 для ердостеїну та плацебо відповідно; p=0,01), а помірних загострень – на 57,1% (0,23 проти 0,54 загострення на пацієнто‑1-рік‑1 для ердостеїну та плацебо відповідно; співвідношення ризиків 0,429; р=0,002) [14]. Важливо, що зменшення частоти загострень не залежало від того, чи використовували пацієнти ІКС. Найімовірніше, це можна пояснити плейотропними ефектами ердостеїну, а саме протизапальною дією.
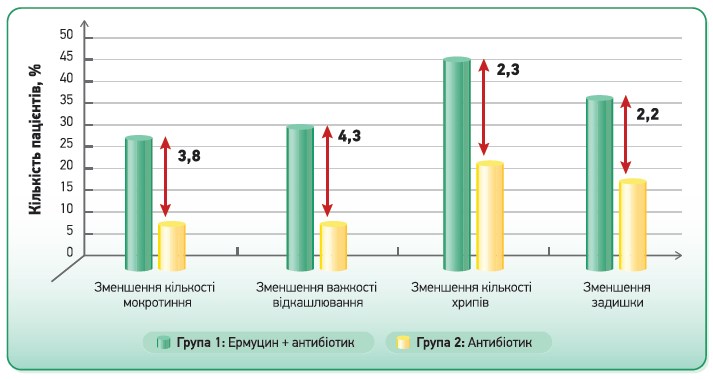
Ермуцин добре комбінується з антибіотиками. Ця молекула здатна знижувати адгезивну здатність грампозитивних і грамнегативних бактерій до епітелію дихальних шляхів, що зменшує їх бактеріальну колонізацію та ризик бактеріальної суперінфекції [8]. Антибіотик впливає на етіологію запалення, знищуючи бактерії, а ердостеїн – на його патогенез за рахунок блокади медіаторів запалення та модифікації евакуації слизу з дихальних шляхів. До того ж ердостеїн підвищує концентрацію амоксициліну в бронхіальному секреті [8]. Отже, клінічний ефект комбінації антибіотика й Ермуцину буде вищим, аніж у разі монотерапії антибіотиком (рис. 6) [9].
Рис. 6. Вплив комбінованої терапії Ермуцин + антибіотик і монотерапії антибіотиком на динаміку клінічних симптомів у разі загострення ХОЗЛ [9]
В умовах пандемії коронавірусу окремо потрібно зауважити, що ефекти регуляції цитокінового каскаду завдяки інгібуванню синтезу IЛ‑6 та ІЛ‑8 і перекисного окислення ліпідів, потенціювання антибіотикотерапії [8] надають можливості використання муколітика ердостеїну при СOVID‑19 і вторинних бактеріальних ускладненнях із боку органів дихання.
З огляду на вищезазначені факти можна констатувати, що Ермуцин має низку цінних для лікарів переваг перед іншими муколітиками. На відміну від ацетилцистеїну, його можна приймати разом з антибіотиками. Приймаючи ацетилцистеїн, згідно з інструкцією, необхідно дотримуватися 2-годинного інтервалу. Якщо це правило порушується, то мають місце відразу дві невдачі: не спрацьовує муколітик та інактивується антибіотик. Зважаючи на низький рівень дисципліни хворих, такий розвиток подій є цілком імовірним. Окрім того, ердостеїн порівняно з ацетилцистеїном достовірно зменшує ризик госпіталізації пацієнтів із тяжким бронхітом.
На відміну від амброксолу, Ермуцин включений у протоколи GOLD (2019) і національні адаптовані клінічні настанови з лікування ХОЗЛ. Той факт, що Ермуцин рекомендовано для лікування такого тяжкого захворювання, як ХОЗЛ, у ролі базової терапії поряд із бронхолітиками й ІКС, безперечно, свідчить про його високу клінічну ефективність.
Порівнюючи Ермуцин із генеричними засобами, слід зазначити, що генерик і оригінальний препарат явно відрізняються один від одного й однакова назва субстанції ще не гарантує однаковий клінічний ефект. Відмінності між генериком і оригінальним препаратом спостерігаються ще на етапі створення. Процес створення оригінального засобу тривалий і дорогий – від синтезу молекули до кількох етапів доклінічних і клінічних досліджень, після котрих препарат проходить реєстрацію. Дослідження оригінального лікарського засобу з дотриманням правил GCP тривають і після реєстрації.
У процесі створення генериків відсутні три етапи клінічних досліджень, перед реєстрацією проводиться тільки дослідження біоеквівалентності. До того ж допускається різниця у 20% щодо швидкості та ступеня всмоктування між оригінальним препаратом і генериком при проведенні аналізу біоеквівалентності. Отже, наявність останньої – лише припущення, що генерик виявиться таким самим, як і оригінальний засіб, а це не гарантує терапевтичної еквівалентності та безпеки препарату [12]. Призначаючи Ермуцин, лікар може бути впевнений у тому, що заявлений ефект буде досягнутий, тому що рекомендує оригінальний препарат, саме той, з яким проводилися клінічні дослідження [10].
Для лікування кашлю при гострих інфекціях нижніх дихальних шляхів, загостреннях ХОЗЛ і хронічного бронхіту Ермуцин призначається по 1 капсулі (300 мг) 2 рази на день до 10 днів [8], а для запобігання загостренням у пацієнтів із ХОЗЛ – по 1 капсулі (300 мг) 2 рази на день протягом 12 міс [14].
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 9 (478), травень 2020 р.