25 липня, 2020
Агонисты рецепторов глюканоподобного пептида‑1 и ингибиторы натрийзависимого котранспортера глюкозы 2 типа: конкуренты или союзники?
 Прогрессирующий характер сахарного диабета (СД) 2 типа диктует необходимость проведения поэтапной интенсификации сахароснижающей терапии в случае невозможности достижения целевых показателей гликемического контроля. Современные руководства по лечению СД 2 типа ставят во главу угла пациентоориентированный подход, который предусматривает более гибкий выбор препарата второй/третьей линии терапии из числа антигипергликемических средств, одобренных авторитетными международными организациями. Персонализированное управление СД 2 типа стало актуальной задачей для специалистов в их рутинной практике (American Diabetes Association 2020).
Прогрессирующий характер сахарного диабета (СД) 2 типа диктует необходимость проведения поэтапной интенсификации сахароснижающей терапии в случае невозможности достижения целевых показателей гликемического контроля. Современные руководства по лечению СД 2 типа ставят во главу угла пациентоориентированный подход, который предусматривает более гибкий выбор препарата второй/третьей линии терапии из числа антигипергликемических средств, одобренных авторитетными международными организациями. Персонализированное управление СД 2 типа стало актуальной задачей для специалистов в их рутинной практике (American Diabetes Association 2020).
В основу концепции персонализации лечения диабета легли результаты наиболее знаковых исследований (UKPDS, DCCT и др.), продемонстрировавших важность соблюдения равновесия между преимуществами гликемического контроля и его потенциальными рисками относительно развития сердечно-сосудистых заболеваний (ССЗ). С одной стороны, показано, что снижение уровня глюкозы независимо предотвращает формирование микрососудистых осложнений, однако влияние контроля гликемии на сердечно-сосудистые и почечные осложнения проявляется спустя много лет. С другой стороны, строгий гликемический контроль может увеличить риск гипогликемии, особенно у пациентов с длительным течением СД 2 типа, что, в свою очередь, повышает вероятность манифестации сердечно-сосудистых катастроф и снижение вследствие этого качества жизни пациента. Все эти аспекты указывают на значимость выбора класса препаратов, обладающих как кардио-вазо-нефропротекторными свойствами, так и низкой вероятностью развития гипогликемии на самых ранних этапах лечения (van Baar, 2018; Okahata, 2019).
Предпочтительным и наиболее часто используемым средством первой линии в фармакотерапии СД 2 типа, безусловно, является метформин. Однако большинству пациентов не удается достигнуть целевых показателей гликированного гемоглобина (HbA1c), используя метформин в качестве монотерапии, что диктует необходимость применения различных комбинаций. В лечебный арсенал противодиабетических препаратов заметный вклад внесли средства нового поколения: препараты инкретиновой группы – агонисты рецепторов глюкагоноподобного пептида 1 (арГПП‑1) и ингибиторы дипептидилпептидазы 4 (ДПП‑4), а также ингибиторы натрийзависимого котранспортера глюкозы 2 типа (НЗКТГ‑2). Учитывая благоприятный профиль безопасности, в частности преимущества в отношении сердечно-сосудистых и почечных осложнений у пациентов с СД 2 типа высокого и среднего риска, еще с 2018 года данные классы препаратов заняли стабильную позицию в руководствах по лечению диабета в качестве средств 2-3-й линии терапии (ADA 2018; NICE2018; Garber, 2018; Inzucchi, 2018; Melillo, 2019).
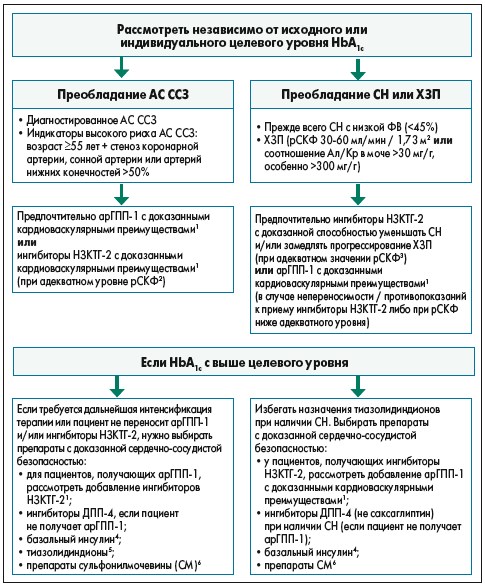
Однако в Стандартах по оказанию медицинской помощи при диабете 2020 года (Standards of Medical Care in Diabetes‑2020), на основании новых исследований с высокой степенью доказательности (уровень А), отмечено, что «для пациентов с СД 2 типа, у которых диагностированы атеросклеротические ССЗ (АС ССЗ) имеются показатели высокого риска, установлено заболевание почек или сердечная недостаточность (СН), ингибитор натрий-глюкозного котранспортера 2 (SGLT2) или агонист рецептора глюкагоноподобного пептида 1 (GLP‑1) с продемонстрированными сердечно-сосудистыми преимуществами рекомендуются как часть режима снижения гликемии независимо от уровня HbА1c и с учетом специфических для пациента факторов»… «У пациентов с диабетом 2 типа, которым необходимо большее снижение уровня глюкозы, чем при пероральном приеме, агонисты рецептора GLP‑1 предпочтительнее инсулина, когда это возможно» (рекомендация уровня В). В обновленном руководстве уточняются рекомендации по дифференциации показаний для применения ингибиторов НЗКТГ‑2 и арГПП‑1 (преимущественно СН в первом случае и атеросклеротический процесс во втором) (рис.). Причины данного разграничения связаны с уникальными механизмами действия, характерными для каждой группы препаратов, которые будут рассмотрены далее.
Примечания: ФВ – фракция выброса; ХЗП – хроническое заболевание почек; рСКФ – расчетная скорость клубочковой фильтрации; Ал/Кр – альбумин/креатинин; 1 – доказанные кардиоваскулярные преимущества – обозначенные в инструкции показания в отношении снижения риска кардиоваскулярных событий; 2 – уровни рСКФ для начала и продолжения терапии ингибиторами НЗКТГ‑2 могут варьировать в инструкциях в разных регионах; 3 – в исследовании CREDENCE DAPA-HF показано, что эмпаглифлозин, канаглифлозин и дапаглифлозин снижают риск СН и замедляют прогрессирование ХЗП; 4 – инсулин деглюдек и гларгин 100 Ед/мл продемонстрировали кардиоваскулярную безопасность; 5 – низкие дозы тиазолидиндионов могут лучше переноситься, хотя они хуже исследованы в отношении кардиобезопасности; 6 – использование производных СМ последних поколений позволяет снизить риск гипогликемии, уменьшить возможность увеличения массы тела и связанных с этим осложнений.
Рис. Основные принципы антигипергликемической терапии в зависимости от факторов кардиоваскулярного риска у больных СД 2 типа согласно рекомендациям ADA 2020 г.
Эффекты арГПП‑1
Установлено, что в ответ на прием пищи эндокринные клетки кишечника секретируют инкретиновые гормоны, главным из которых является ГПП‑1. Инкретины обладают глюкозозависимым инсулинотропным и подавляющим глюкагон эффектами, которые проявляются в том, что при пероральном введении глюкозы происходит увеличение секреции инсулина на 50-70% больше, чем при ее внутривенном введении (инкретиновый эффект) (Holst, 2009). Эндогенные инкретины оказывают преимущественно локальное паракринное и аутокринное действие, тогда как в крови они быстро расщепляются ферментом ДПП‑4. Эффект инкретинов при СД 2 типа снижен или отсутствует, что способствует нарушению гликемического контроля (Nauck, 2016).
В настоящее время Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA, Food and Drug Administration) и Европейским агентством по лекарственным средствам (EMA, European Medicines Agency) для лечения СД 2 типа одобрено 7 представителей класса арГПП‑1 (экзенатид короткого и длительного действия, лираглутид, ликсисенатид, семаглутид, дулаглутид, альбиглутид). Препараты этой группы имитируют эффекты нативного ГПП‑1, глюкозозависимо снижая уровень гликемии путем стимуляции секреции инсулина и подавления глюкагона. Агонисты рецепторов ГПП‑1 снижают уровень HbA1c приблизительно на 1%. Агонисты рецепторов ГПП‑1 короткого действия вводят препрандиально, что вызывает подавление секреции глюкагона после приема пищи и снижение скорости опорожнения желудка. Это замедляет проникновение глюкозы в двенадцатиперстную кишку, снижает поглощение глюкозы, получаемой из пищи, и в совокупности снижает постпрандиальную гипергликемию (ППГ). Агонисты рецепторов ГПП‑1 пролонгированного действия, как следствие глюкозозависимой стимуляции инсулина, оказывают более выраженное влияние на HbA1c и уровень глюкозы в плазме натощак (ГПН). Однако они нередко не обеспечивают долговременного снижения ППГ, что объясняется быстрой тахифилаксией – потерей чувствительности рецепторов к ГПП‑1 (Mihai, 2018; Nauck, 2011).
Доказано, что арГПП‑1 вызывают ряд положительных плейотропных эффектов. В рандомизированных открытых или двойных слепых плацебо-контролируемых исследованиях продемонстрирована кардиоваскулярная (LEADER, SUSTAIN‑6, EXSCEL) и нефрологическая (AWARD‑7, LEADER) безопасность и/или благотворное влияние у больных СД 2 типа со средней и высокой степенью риска указанных осложнений. К механизмам, ответственным за эти эффекты, относят снижение массы тела и артериального давления (АД), противовоспалительное действие, изменение гемодинамики, а также воздействие на нейрорегуляторные центры натриевого и водного гомеостаза (van Baar, 2018).
Согласно данным литературных источников, применение препаратов этого класса способствует снижению показателей систолического АД (САД) и диастолического АД (ДАД) и улучшению липидного профиля за счет снижения содержания холестерина липопротеинов низкой плотности (ЛПНП), общего холестерина и триглицеридов (Sun, 2015). Кроме того, арГПП‑1 активируют ряд противовоспалительных путей, включая снижение окислительного стресса через активные формы кислорода, связывание/активацию ядерного фактора-κB, экспрессию воспалительных цитокинов и С-реактивного белка и увеличение адипонектина (Drucker, 2017).
Результаты, полученные в рамках программы рандомизированных двойных слепых многоцентровых клинических исследований фазы 3а PIONEER‑6 , целью которых было изучение сердечно-сосудистых исходов при применении перорального семаглутида, послужили основанием для его одобрения FDA (торговое название Rybelsus) как противодиабетического средства с доказанным кардиопротекторным эффектом. В указанном исследовании пациенты с СД 2 типа (средний возраст – 58 лет; [стандартное отклонение] СО=10) были рандомизированы на 2 группы: для приема семаглутида 1 раз в день в дозе 3 мг (n=466), 7 мг (n=466) или 14 мг (n=465) и для приема 100 мг ситаглиптина (n=467). Первичной конечной точкой было изменение HbA1c, а ключевой вторичной конечной точкой было изменение массы тела от исходного уровня до 26-й нед; оценки на 52-й и 78-й нед использовалась в качестве дополнительных вторичных конечных точек. Показано, что пероральный семаглутид в дозах 7 мг/сут и 14 мг/сут привел к значимо большему снижению уровня HbA1с в течение 26 нед по сравнению с ситаглиптином (Rosenstock, 2019).
Следует отметить, что применение таблетированной формы семаглутида однозначно будет целесообразным для пациентов с СД 2 типа, имеющих избыточный вес и не желающих использовать инъекционный препарат. Поскольку в отличие от инъекционной формы, которую вводят 1 раз в неделю, оральную форму семаглутида принимают 1 раз в день (Rosenstock, 2019; Caffrey, 2019).
Нужно также подчеркнуть, что кроме установленного кардиопротекторного действия арГПП‑1 приводят к положительным изменениям в печени при неалкогольном стеатогепатите (НАСГ) как результат снижения массы тела, печеночного липогенеза de novo, уменьшения окислительного стресса, уровня воспалительных цитокинов и стресса эндоплазматического ретикулума (Armstrong, 2016).
Как уже упоминалось, одним из важнейших и уникальных плейотропных эффектов арГПП‑1 является возможность при их применении существенно снизить массу тела (3-6 кг) путем замедления опорожнения желудка, стимуляции периферической ветви блуждающего нерва и активации центральной нервной системы, что способствует более быстрому насыщению, уменьшению чувства голода и в конечном итоге – снижению потребления пищи.
Рандомизированное плацебо-контролируемое исследование фазы 2 (NCT0243711) с участием 957 пациентов с СД 2 типа, без ожирения, получавших в течение 52 нед семаглутид 1 раз в день (подкожно в дозах 0,05; 0,1; 0,2; 0,3 или 0,4 мг), показало, что средняя потеря веса составила от -6,0% (при дозе семаглутида 0,05 мг) до -13,8% (при дозе 0,4 мг) по сравнению с -2,3% в группе плацебо. Степень фиброза оценивали при помощи шкалы фиброза при неалкогольной жировой болезни печени [НАЖБП] (NAFLD fibrosis score, NFS) и индекса фиброза‑4 (fibrosis 4 calculator; FIB‑4). В начале исследования 52% пациентов (n=499) имели высокий уровень аланинаминотрансферазы (АЛТ), 18% – высокие значения NFS (>0,676). После курса лечения семаглутидом величины отношения AЛТ к первоначальному уровню (95% ДИ) у пациентов с высоким исходным уровнем АЛТ в группах с разными дозами семаглутида составили: 0,88 (0,76-1,01; доза 0,05 мг); 0,94 (0,82-1,08; доза 0,1 мг); 0,82 (0,71-0,95; доза 0,2 мг); 0,79 (0,68-0,91; доза 0,3 мг) и 0,82 (0,70-0,95; доза 0,4 мг). Лечение способствовало также гистологическому улучшению у больных неалкогольным стеатогепатитом (НАСГ) (Newsome, 2018).
Огромный интерес представляют данные, полученные в рамках клинической программы STEP (Semaglutide Treatment Effect in People with obesity), в которой исследовалась эффективность подкожного введения семаглутида (в дозе 2,4 мг 1 раз в неделю) для лечения взрослых пациентов с избыточным весом или ожирением. Клиническая программа STEP фазы 3а включила 4 исследования, в которых приняли участие около 4500 лиц с ожирением. Недавно фармацевтическая компания «Ново Нордиск» (Дания) сообщила о результатах STEP 4 – первого завершенного испытания в программе STEP. Это рандомизированное двойное слепое многоцентровое плацебо-контролируемое 68-недельное исследование, в ходе которого было изучено влияние подкожного введения семаглутида на массу тела у 902 пациентов без диабета, но с ожирением или избыточным весом. После 20-недельного периода у 803 участников, достигших целевой дозы семаглутида 2,4 мг, средняя масса тела снизилась с 107,2 до 96,1 кг, затем участники были рандомизированы для продолжения лечения с использованием подкожного введения семаглутида 2,4 мг или плацебо 1 раз в неделю сроком 48 недель. Применение семаглутида характеризовалось хорошим профилем безопасности и переносимости. Чаще всего нежелательные явления у лиц, получавших подкожно семаглутид 2,4 мг, возникали со стороны желудочно-кишечного тракта, большинство из которых были кратковременными, легкой или средней степени тяжести. Результаты STEP 4 показали, что пациенты из группы пролонгированного лечения семаглутидом продолжили терять вес, в то время как у лиц, переведенных на плацебо, напротив, наблюдалось увеличение массы тела. Итоговое снижение веса составило 17,4% от исходной массы тела, без учета приверженности пациентов к лечению. В случае оценки терапевтической эффективности семаглутида при обязательном условии строгого следования режиму лечения уменьшение массы тела составило 18,2%. Авторы подчеркивают, что ожирение является хроническим заболеванием, требующим длительного лечения, поскольку достижение постоянной потери веса без медикаментозной терапии, как известно, является очень сложной задачей. Применение семаглутида в данном наблюдении продемонстрировало многообещающие результаты, намного превосходящие все остальные известные на сегодняшний день средства для похудения (Semaglutide, 2020).
Эффекты ингибиторов НЗКТГ‑2
Установлено, что почечная реабсорбция глюкозы контролируется двумя симпортерами, которые котранспортируют натрий и глюкозу. НЗКТГ‑2 расположен в первых двух извилистых сегментах проксимального канальца и в физиологических условиях реабсорбирует около 90% отфильтрованной глюкозы, тогда как оставшиеся 10% реабсорбируются НЗКТГ‑1, расположенным в соседнем прямом сегменте. При СД 2 типа максимальная способность к реабсорбции повышается, что предотвращает глюкозурию и потерю энергии, однако приводит к гипергликемии (Ghezzi, 2018).
Ингибирование НЗКТГ‑2 в проксимальных канальцах почки оказывает широкий спектр влияния на функцию почек, показатели гомеостаза, объема плазмы и уровень гематокрита. Экскреция натрия и глюкозы после ингибирования НЗКТГ‑2 запускает динамические обратимые изменения энергетического обмена, почечной фильтрации и объема плазмы, не зависящие от потери глюкозы с мочой. В долгосрочной перспективе восстановление энергетического и водно-солевого обмена на фоне ингибирования НЗКТГ‑2 влияет не только на показатели массы тела, функции почек и АД, но также на прогрессирование кардиоваскулярных осложнений у пациентов с СД 2 типа (Thomas, 2018).
Сегодня для лечения пациентов с СД 2 типа одобрено 4 пероральных селективных ингибитора НЗКТГ‑2, которые угнетают почечную реабсорбцию глюкозы из мочи в кровоток, содействуя снижению уровня глюкозы в крови, – канаглифлозин, дапаглифлозин, эмпаглифлозин и эртуглифлозин. Кроме того, после оценки результатов новых клинических исследований Комитет по лекарственным средствам для человека (Committee for Medicinal Products for Human Use – CHMP) EMA рекомендует расширить показания к применению дапаглифлозина для некоторых пациентов с СД 1 типа в случае отсутствия у них адекватного контроля уровня глюкозы в крови, несмотря на оптимальную терапию инсулином. Однако клинико-лабораторные показатели пациентов, которым назначают указанный препарат, должны соответствовать определенным требованиям, в частности индекс массы тела (ИМТ) не должен быть <27 кг/м2 (Forxiga et al., 2019).
Согласно результатам метаанализа 2013 года глюкозоснижающая эффективность ингибиторов НЗКТГ‑2 у пациентов с СД 2 типа без тяжелой почечной недостаточности, при исходном уровне HbA1c 6,9-9,2%, составила в среднем -0,79% (при использовании в качестве монотерапии) и -0,61% (при использовании в качестве дополнительного лечения) (Vasilakou, 2013).
Доказано, что гипогликемическая эффективность ингибиторов НЗКТГ‑2 возрастает по мере повышения показателей глюкозы в крови, поскольку усиливается нагрузка последней в процессе почечной фильтрации. И наоборот, фильтрационная нагрузка глюкозой у пациентов с нарушенной функцией почек снижается, что уменьшает влияние ингибиторов НЗКТГ‑2 на реабсорбцию глюкозы. Таким образом, эффективность снижения глюкозы зависит от функции почек и постепенно убывает вплоть до снижения HbA1c на 0,3-0,4%, в диапазоне СКФ 30-59 мл/мин/1,73 м2, при этом оставаясь неизменной при СКФ <30 мл/мин/1,73 м2. Установлено, что у лиц без диабета и/или с пониженной СКФ гипогликемические эффекты ингибиторов НЗКТГ‑2 ослаблены (Thomas, 2018; van Bommel, 2017).
Отдельный интерес вызывает также следующий факт: ингибиторы НЗКТГ‑2 повышают уровень глюкагона в плазме и стимулируют продукцию глюкозы в печени, что несколько ограничивает их способность снижать уровень гликемии.
Особого внимания заслуживает ряд плейотропных эффектов ингибиторов НЗКТГ‑2:
- Положительно влияют на массу тела: быстрая потеря 1-3 кг в первые недели лечения (вероятно, в результате осмотического диуреза), с последующим постепенным снижением в течение 20 нед, что обусловлено уменьшением жировой массы, и достижением в результате фазы плато (Sha, 2014; Ferrannini, 2015).
- Оказывают стабильное снижение САД и ДАД на 5 и 2 мм рт. ст. соответственно (Baker, 2017). В качестве основы этого эффекта рассматриваются несколько механизмов (Muskiet, 2016):
- сокращение объема плазмы при осмотическом диурезе;
- потеря веса;
- улучшение эластичности (снижение жесткости) сосудов за счет снижения массы тела, уменьшения связанного с гипергликемией окислительного стресса и/или защиты эндотелиального гликокаликса от перегрузки натрием;
- снижение активности симпатической нервной системы;
- более низкие концентрации мочевой кислоты в сыворотке крови.
- Индуцируют натрийурез, в результате чего изменяется баланс натрия и объем плазмы, улучшается функция эндотелия, снижается жесткость сосудов, уменьшается нагрузка на сердечную мышцу (Heerspink, 2016; Lytvyn, 2017).
- Снижают уровень альбуминурии на 30-40%, предположительно благодаря уменьшению внутригломерулярного давления (Heerspink, 2016).
- Умеренно корректируют показатели липидов в плазме крови: снижение концентрации триглицеридов и повышение уровней холестерина ЛПВП и ЛПНП (van Bommel, 2017).
- Воздействие на факторы, играющие роль в развитии и течении НАСГ и НАЖБП, нивелируя их негативное воздействие (например, накопление висцерального жира) (Sumida, 2018).
Продемонстрировано также, что при СД 1 типа применение ингибиторов НЗКТГ‑2 снижает внутригломерулярное давление, усиливает влияние количества натрия в моче на macula densa, тем самым активируя тубулогломерулярную обратную связь и повышая афферентную резистентность почечных артериол. При СД 2 в исследованиях фазы 3 также показана тенденция к снижению клубочковой гиперфильтрации посредством первоначального снижения и последующей стабилизации почечной функции с течением времени, что тормозит естественное снижение СКФ (Cherney, 2014; Dekkers, 2018).
Сердечно-сосудистая безопасность и эффективность эмпаглифлозина, дапаглифлозина и канаглифлозина у больных СД 2 типа были оценены в исследованиях EMPA-REG OUTCOME, CANVAS и CANVAS-Renal [CANVAS-R], DECLARE–TIMI 58. Важно отметить, что почти все включенные в испытания пациенты получали адекватное лечение статинами и гипотензивными препаратами, в частности ингибиторами ренин-ангиотензин-альдостероновой системы (80%). В исследованиях EMPA-REG OUTCOME и CANVAS наблюдалось снижение госпитализации по поводу СН и возникновения или ухудшения течения нефропатии; кроме того, в EMPA-REG OUTCOME дополнительно показано снижение частоты сердечно-сосудистых смертей (Neal, 2017; Zinman, 2016; Wanner, 2016). Полученные эффекты связывают с сокращением объема плазмы, изменениями в метаболизме субстратов и прямым воздействием на кардиомиоциты (Inzucchi, 2018).
Целью исследования DECLARE-TIMI 58 была оценка сердечно-сосудистой безопасности дапаглифлозина у пациентов с СД 2 типа, имеющих установленное ССЗ или несколько факторов риска (артериальная гипертензия, дислипидемия, курение). Пациенты были рандомизированы на 2 группы: для приема дапаглифлозина 10 мг (n=8582) и для приема плацебо (n=8578). Продолжительность наблюдения составила 4,2 года, средний возраст пациентов был равен 64,0 года, уровень HbA1c – от 6,5 до 12%. Результаты показали, что дапаглифлозин превосходил плацебо в улучшении гликемического контроля и не уступал, но и не превосходил плацебо в отношении риска неблагоприятных сердечно-сосудистых событий (8,8 против 9,4%; отношение рисков (ОР) 0,93; 95% ДИ 0,84-1,03; р=0,17 для превосходства). Что касается вторичных конечных точек, то основная группа отличалась от группы плацебо меньшей частотой случаев госпитализаций по поводу хронической СН (4,9 против 5,8%; p=0,005), смертности от ССЗ и от всех причин и лучшей переносимостью, что проявлялось более низкой частотой генитальных инфекций (0,9 против 0,1%; p<0,001) (Zelniker, 2020; Wiviott, 2019).
В рандомизированном плацебо-контролируемом исследовании DAPA-HF (Dapagliflozin and Prevention of Adverse-Outcomes in Heart Failure) приняли участие 4744 пациента с СН, сниженной фракцией выброса левого желудочка (≤40%) и умеренным повышением концентрации N-терминального остатка натрий-уретического пептида про-В типа (NT-proBNP). Средний возраст пациентов составлял 66,3 года (СО=10,9). Участников рандомизировали в 2 группы: для приема дапаглифлозина в дозе 10 мг ежедневно (n=2373) и приема плацебо (n=2371), в дополнение к текущей терапии. Первичной конечной точкой было ухудшение течения СН (госпитализация по поводу CН или сердечно-сосудистая смерть). Через 18,2 мес наблюдения первичный конечный исход имел место у 386 (16,3%) пациентов в группе дапаглифлозина и у 502 (21,2%) участников в группе плацебо (ОР 0,74; 95% ДИ 0,65-0,85; р<0,001). Ухудшение СН отмечено у 237 (10,0%) пациентов в группе дапаглифлозина и у 326 (13,7%) – в группе плацебо (ОР 0,70; 95% ДИ 0,59-0,83). Смерть вследствие сердечно-сосудистых причин наступила у 227 (9,6%) участников исследования в группе дапаглифлозина и у 273 (11,5%) – в группе плацебо (ОР 0,82; 95% ДИ 0,69-0,98). Преимущества при использовании дапаглифлозина по сравнению с плацебо наблюдались для компонентов первичного исхода, смертности от всех причин и симптомов СН. Анализ в возрастных группах показал, что нежелательные явления и случаи прекращения приема исследуемого препарата коррелировали с более старшим возрастом, однако их частота была сопоставимой для подгрупп одного возраста, получавших дапаглифлозин или плацебо. В целом риск ухудшения СН или наступления смерти от сердечно-сосудистых причин был ниже у пациентов, получавших дапаглифлозин, чем у тех, кто получал плацебо, независимо от наличия или отсутствия диабета (McMurray, 2019; Martinez, 2020; Kosiborod, 2020).
Согласно клиническим наблюдениям ингибиторы НЗКТГ‑2 хорошо переносятся и не повышают риск гипогликемии. Как известно, основным побочным эффектом является развитие генитальной микотической инфекции в 4-5 раз (van Bommel, 2017), а также возникновение эпизодов диабетического кетоацидоза (ДКА), особенно у пациентов с длительным течением СД 2 типа, что побудило FDA сделать предупреждение об этом потенциальном осложнении. Склонность ингибиторов НЗКТГ‑2 приводить к ДКА связывают с вызванным гликозурией снижением доступности углеводов, что сопровождается сдвигом в использовании субстратов от глюкозы к окислению жиров и стимуляцией гиперглюкагонемии, стимулирующей кетогенез (Rosenstock, 2015). Кроме того, в программе CANVAS прием канаглифлозина ассоциировался с более высоким риском переломов костей и ампутаций нижних конечностей (Neal, 2017), о которых не сообщалось для других ингибиторов НЗКТГ‑2.
Сочетание ингибиторов НЗКТГ‑2 и арГПП‑1
Поскольку механизмы сахароснижающего действия ингибиторов НЗКТГ‑2 отличаются от таковых для арГПП‑1, а также для препаратов, стимулирующих функцию β-клеток или улучшающих чувствительность к инсулину, совместное применение этих двух классов препаратов может иметь существенные преимущества как для поддержания гликемического контроля, так и для предотвращения кардио-вазо-ренальных осложнений (DeFronzo, 2017; Scheen, 2016). Одновременное их использование может также способствовать повышению эффективности ингибиторов НЗКТГ‑2, снижающейся вследствие усиления продукции глюкозы в печени и избыточного потребления калорий. Кроме того, оба класса обладают преимуществами, которые в совокупности, возможно, приведут к аддитивному или синергетическому эффекту в отношении сохранения почечной функции. Так, предположительно, поскольку глюкагон индуцирует клубочковую гиперфильтрацию с помощью дилатации афферентной артериолы (опосредованной тубуло-гломерулярной обратной связью), снижение секреции глюкагона с помощью терапии инкретинами может усиливать почечные эффекты. К сожалению, сердечно-сосудистая безопасность или преимущества широко не были изучены для указанной комбинации, однако, поскольку оба класса снижают риск ССЗ с помощью различных механизмов, она с большой долей вероятности сможет обеспечить дополнительную пользу для надлежащего функционирования сердечно-сосудистой системы (Polidori, 2016). Кроме того, нельзя исключить возможность суммирования других плейотропных эффектов, что требует проведения дополнительных исследований в этом направлении.
Эффективность и безопасность ингибиторов НЗКТГ‑2 в комбинации с арГПП‑1 у пациентов с СД 2 типа изучались в рандомизированных контролируемых клинических исследованиях. Так, в исследовании DURATION‑8 с участием 695 больных СД 2 типа, не достигших адекватного контроля гликемии на фоне приема метформина (средний уровень HbA1c 9,3%), трем группам участников были назначены экзенатид (2 мг), дапаглифлозин (10 мг) или дапаглифлозин плюс экзенатид (2 мг/10 мг). Результат продемонстрировал, что комбинированная терапия снижала уровень HbA1c на 2,0% от исходного уровня, что значительно превышало результат, достигнутый при монотерапии экзенатидом или дапаглифлозином (Frіas, 2016).
В исследовании AWARD‑10 424 больным СД 2 типа к текущей терапии ингибитором НЗКТГ‑2 и метформином был добавлен дулаглутид (в дозах 1,5 мг и 0,75 мг) или плацебо. Комбинированная терапия в течение 24 нед привела к значительному снижению HbA1c (на 1,34 и 1,21% соответственно) по сравнению с 0,54% в группе плацебо (от среднего исходного уровня 8,0%) (Ludvik, 2018).
В DURATION‑8 у пациентов, получавших комбинированное лечение, наблюдалось почти аддитивное снижение массы тела (на 3,41 кг, при средней исходной массе 91 кг), а также снижение САД (на 4,2 мм рт. ст. при исходном уровне 131 мм рт. ст.). Не выявлено существенных различий в уровнях липидов между группами, получавшими разное лечение. В AWARD‑10 продемонстрировано, что добавление дулаглютида к ингибитору НЗКТГ‑2 дополнительно снижало массу тела на 3,1 и 2,6 кг и САД на 4,5 и 3,2 мм рт. ст. (для доз 1,5 и 0,75 мг соответственно).
В двойном слепом плацебо-контролируемом исследования CANVAS (CANagliflozin cardioVascular Assessment Study) был проведен пост-анализ подгруппы из 95 пациентов, ранее получавших инкретиномиметики. Добавление канаглифлозина к лечению арГПП‑1 приводило к дополнительному снижению HbA1c (на 1,00% для дозы 100 мг и на 1,06% для дозы 300 мг по сравнению с плацебо), уменьшению массы тела и АД, однако отмечена повышенная частота возникновения генитальных микотических инфекций и побочных эффектов, связанных с осмотическим диурезом. Достигнутая гипогликемическая эффективность комбинированной терапии являлась субаддитивной, что помимо непосредственно сахароснижающего эффекта можно объяснить совместным влиянием на секрецию глюкагона и печеночную продукцию глюкозы (Fulcher, 2016).
В рандомизированном двойном слепом клиническом исследовании SUSTAIN9 (NCT03086330) фазы 3 принимали участие 302 пациента с СД 2 типа с уровнем HbA1c 7,0-10,0%, получавшие на момент включения монотерапию ингибитором НЗКТГ‑2 или в комбинации с метформином или СМ. На фоне 30-недельного применения семаглутида в дозе 1,0 мг уровень HbA1c достоверно снизился на 1,5% против 0,1% в группе плацебо. Кроме того, применение семаглутида способствовало значительному уменьшению массы тела – на 4,7 кг в сравнении 0,9 кг в контрольной группе. Целевого уровня HbA1c <7,0% достигли 78,7% пациентов, получавших комбинацию семаглутид + ингибитор НЗКТГ‑2 против 18,7% в группе плацебо; строгого контроля HbA1c (6,5%) удалось достичь 56,1% пациентов, получавших семаглутид.
Суммируя немногочисленные данные относительно совместного применения арГПП‑1 и ингибитора НЗКТГ‑2, можно сделать вывод, что гипогликемическая эффективность комбинации является субаддитивной, поскольку, с одной стороны, стимуляция секреции инсулина и подавление выделения глюкагона препаратами группы арГПП‑1 дополняют инсулиннезависимое действие ингибиторов НЗКТГ‑2, однако, с другой стороны, не противодействуют повышению продукции глюкозы в печени (DeFronzo, 2017). Использование комбинация характеризуется низким риском гипогликемии вследствие глюкозозависимой эффективности обоих классов. Риск развития ДКА может быть нивелирован свойством арГПП‑1 подавлять секрецию глюкагона. Кроме того, во всех перечисленных исследованиях комбинированная терапия хорошо переносилась, а побочные эффекты не отличались от тех, которые характерны для каждого из этих лекарственных средств.
Более выраженная потеря массы тела при применении комбинированной терапии позволяет предположить, что замедление опорожнения желудка и снижение потребления пищи при применении арГПП‑1 усиливает снижение веса за счет глюкозурии, вызванной НЗКТГ‑2. Наконец, гипотензивный эффект был сверхаддитивным, что подразумевает синергизм, и может расцениваться как благоприятное воздействие.
Исходя из представленных данных, можно констатировать, что сегодня комбинация агонистов рецепторов ГПП‑1 и ингибиторов НЗКТГ‑2 является наиболее перспективной для решения основных проблем, связанных не только с компенсацией углеводного обмена, но и с профилактикой возникновения и прогрессирования основных инвалидизирующих осложнений сахарного диабета.
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 2 (50), 2020 р.