5 серпня, 2020
Тромбопрофілактика в госпіталізованих пацієнтів із гострими нехірургічними захворюваннями
За визначенням, госпітальні венозні тромбоемболії (ВТЕ) являють собою тромбоемболії, спричинені стаціонарним лікуванням або хірургічним втручанням. Госпітальні ВТЕ можуть розвинутись як під час стаціонарного лікування, так і в період до ≤90 днів після виписки (Spencer F. et al., 2007; Bagot C., Arya R., 2008).
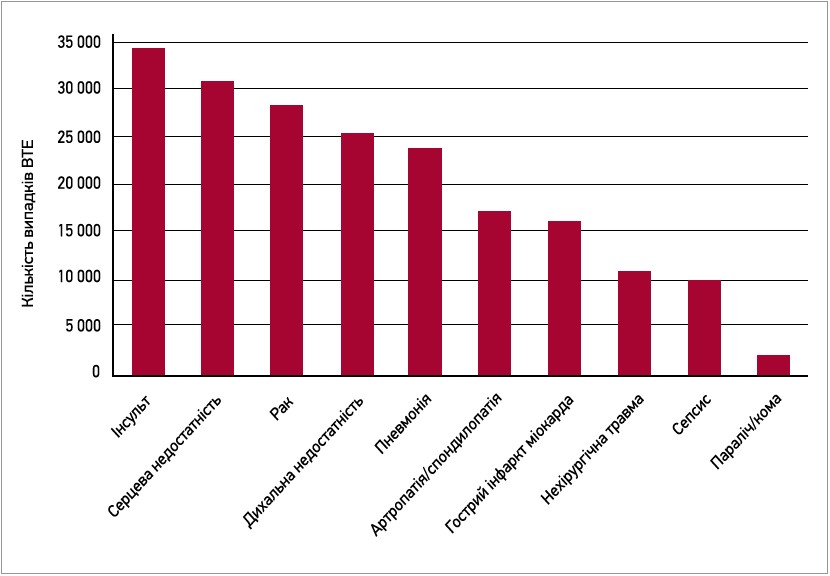
На рисунку 1 представлено розраховані показники частоти тромбоемболічних подій серед госпіталізованих пацієнтів із гострими нехірургічними захворюваннями (Piazza G. et al., 2009).
Рис. 1. Кількість ВТЕ в госпіталізованих пацієнтів із гострими станами
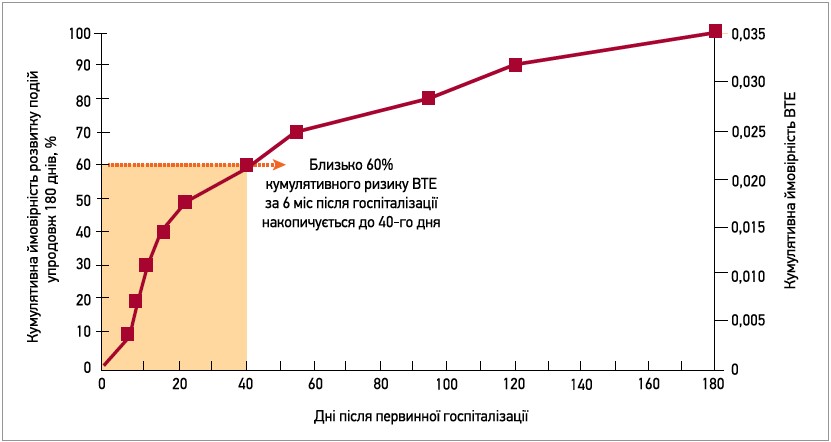
Огляд низки досліджень за участю госпіталізованих пацієнтів, які не отримували тромбопрофілактики, виявив поширеність ВТЕ в межах 3,65-17,1% (Khoury H. et al., 2011). Слід зазначити, що понад 50% ВТЕ відбулися після виписки (рис. 2) (Amin A. et al., 2012). Отже, тривала профілактика ВТЕ в пацієнтів високого ризику впродовж усього стаціонарно-амбулаторного континууму лікування залишається важливим клінічним питанням.
Рис. 2. Кумулятивний ризик ВТЕ в пацієнтів із гострими станами
Згідно зі статистичними даними Євросоюзу (2007), кількість пов’язаних із ВТЕ смертей за рік (543 454) більш ніж удвічі перевищила сумарну кількість смертей від СНІД, раку грудної залози, раку простати та дорожньо-транспортних пригод (Piazza G. et al., 2009). Своєю чергою, в пацієнтів, які змогли пережити ВТЕ, часто спостерігаються тяжкі та дорогі в лікуванні ускладнення на кшталт рецидивних тромбоемболій, венозної недостатності з посттромботичним синдромом, хронічної тромбоемболічної легеневої гіпертензії (Rathbun S., 2009; Beckman M. et al., 2010). Проспективне дослідження за участю близько 2000 пацієнтів із ВТЕ виявило: хоча ризик рецидиву є найвищим упродовж перших 6-12 міс, він зберігається навіть через >10 років після первинної події (Heit J. et al., 2000).
Для повноцінного усвідомлення важливості тромбопрофілактики необхідне розуміння причин підвищеного ризику ВТЕ в пацієнтів із гострими станами (Ageno W., Hunt B., 2018). Так звана тріада Вірхова включає 3 категорії чинників, які призводять до венозного тромбозу: гіперкоагуляція, зменшення кровотоку та пошкодження чи порушення функції ендотелію (Bagot C., Arya R., 2008). У пацієнтів із гострими станами спостерігається високий ризик ВТЕ у зв’язку з протромботичним станом унаслідок запальної природи цих захворювань та/або тривалою іммобілізацією. Визнаними чинниками ризику ВТЕ в стаціонарних пацієнтів є іммобілізація, активна злоякісна пухлина, наявність ВТЕ в анамнезі, гострі інфекційні та запальні захворювання, ожиріння, вік >70 років, уживання комбінованих пероральних контрацептивів і гормонозамісних препаратів, серцева та/або дихальна недостатність, вроджені та набуті тромбофілії тощо (Barbar S. et al., 2010; Kahn S. et al., 2012).
Профілактика нефракціонованим гепарином, низькомолекулярними гепаринами та пентасахаридом фондапаринуксом упродовж 6-14 днів дає змогу знизити частоту ВТЕ на 50-60% (Belch J. et al., 1981; Samama M. et al., 1999; Cohen A. et al., 2006).
Питання ефективної тромбопрофілактики ВТЕ в пацієнтів із гострими станами активно вивчається. Історично концепція рутинної тромбопрофілактики в нехірургічних пацієнтів вважалася суперечливою, хоча необхідність її застосування у хворих хірургічного профілю не підлягала сумніву (Samama M. et al., 1999). Однак усе змінилося після проведення кількох рандомізованих контрольованих досліджень. Так, у рандомізованому подвійному сліпому плацебо-контрольованому дослідженні MEDENOX госпіталізовані нехірургічні пацієнти з високим ризиком госпітальних ВТЕ отримували підшкірно еноксапарин (20 чи 40 мг) або плацебо протягом 6-14 днів. Станом на 14-й день частота ВТЕ була достовірно нижчою в групі еноксапарину (40 мг), аніж у групі плацебо (5,5 проти 14,9% відповідно; відносний ризик (ВР) 0,37; 97,6% довірчий інтервал (ДІ) 0,22-0,63; р<0,001). Цей протекторний ефект зберігався впродовж додаткових 3 міс спостереження (Samama M. et al., 1999). Отже, для стаціонарних пацієнтів із гострими станами чи іммобілізованих стаціонарних хворих у поточних рекомендаціях наведено пораду застосовувати антикоагулянтну тромбопрофілактику за допомогою низькомолекулярних гепаринів, нефракціонованого гепарину 2-3 р/добу чи фондапаринуксу до повного відновлення мобільності чи до виписки зі стаціонару (Kahn S. et al., 2012).
Автори дослідження MEDENOX закликали до проведення подальших досліджень із метою з’ясувати, чи здатна триваліша профілактика в популяції високого ризику надати додаткові переваги (Samama M. et al., 1999). Проведене згодом випробування EXCLAIM оцінювало подовжену тромбопрофілактику еноксапарином порівняно з плацебо в пацієнтів із гострими нехірургічними захворюваннями та нещодавнім обмеженням мобільності. Усі пацієнти (n=6085) без засліплення отримували підшкірні ін’єкції еноксапарину (40 мг) протягом 10±4 днів; надалі хворих, які взяли участь у подвійній сліпій частині дослідження, було рандомізовано до груп еноксапарину чи плацебо на додаткові 28±4 дні. Подовжена профілактика еноксапарином достовірно зменшила частоту ВТЕ порівняно з плацебо (2,5 проти 4,0%), проте збільшила частоту значущих кровотеч протягом 30 днів (еноксапарин – 0,8%, плацебо – 0,3%). Загалом у цьому дослідженні було підтверджено доцільність пролонгованої профілактики еноксапарином у певних підгрупах пацієнтів, зокрема в осіб із порушенням рухової функції І рівня (тих, які потребують допоміжних пристроїв), пацієнтів >75 років і жінок (Hull R. et al., 2010).
Систематичний метааналіз баз даних MEDLINE, EMBASE, Cochrane Central Register of Controlled Trials та Epistemonikos, проведений І. Neumann і співавт. (2020), зіставляв тривалу профілактику новими оральними антикоагулянтами (НОАК) із короткотривалою профілактикою еноксапарином у популяціях із визначеним високим ризиком ВТЕ. Метааналіз включав дослідження ADOPT (апіксабан 2,5 мг кожні 12 год протягом 30 днів проти еноксапарину 40 мг/добу протягом 6-14 днів), MAGELLAN (ривароксабан 10 мг/добу протягом 35±4 днів проти еноксапарину 40 мг/добу протягом 6-14 днів) та APEX (бетриксабан 80 мг/добу протягом 35-42 днів проти еноксапарину 40 мг/добу протягом 6-14 днів) (Goldhaber S. et al., 2011; Cohen A. et al., 2013, 2016). Середній вік учасників цих досліджень становив 66-76 років; близько половина з них – жінки. Найчастішими причинами госпіталізації були дихальна та серцева недостатність, а також інфекції.
На час завершення парентерального лікування (на момент однакового терміну застосування обох препаратів протягом 6-14 днів) НОАК не знижували ризику емболії легеневої артерії порівняно з еноксапарином (ВР 1,01; 95% ДІ 0,29-3,53) або симптоматичного тромбозу глибоких вен (ВР 1,03; 95% ДІ 0,34-3,08). Натомість на тлі застосування НОАК спостерігалося достовірне підвищення частоти значущих кровотеч (ВР 1,70; 95% ДІ 1,02-2,82). Загалом застосування НОАК упродовж такого самого терміну, як й еноксапарину, зумовлює збільшення кількості кровотеч на 2 епізоди на 1000 осіб загальної популяції та на 12 епізодів на 1000 осіб популяції високого геморагічного ризику.
Через 30-42 дні профілактики спостерігалася тенденція до зниження ризику емболії легеневої артерії та симптоматичного тромбозу глибоких вен на тлі застосування НОАК порівняно з еноксапарином, хоча різниця не досягла рівня статистичної значущості. Потенційні відмінності в абсолютному ефекті НОАК порівняно з низькомолекулярними гепаринами є досить невеликими: кількість випадків емболії легеневої артерії зменшується на 1 на 1000 пролікованих пацієнтів, а кількість випадків симптоматичного тромбозу глибоких вен – на 2. Що стосується кровотеч, то їх кількість зростає істотніше. Різниця в досягненні комплексної кінцевої точки (асимптоматичний проксимальний тромбоз глибоких вен + симптоматичний проксимальний або дистальний тромбоз глибоких вен + емболія легеневої артерії + смерть від ВТЕ + значна кровотеча) виявилася статистично незначущою. Оцінка лише симптоматичних подій (симптоматичний проксимальний або дистальний тромбоз глибоких вен + емболія легеневої артерії + значна кровотеча) з’ясувала, що тривала профілактика НОАК не мала жодних переваг над короткотерміновою профілактикою низькомолекулярними гепаринами (еноксапарином).
Проаналізувавши наявну доказову базу, Американське товариство гематологів (2018) надало потужну рекомендацію проводити тромбопрофілактику за допомогою низькомолекулярних гепаринів під час госпіталізації, а не за допомогою НОАК (Schünemann H. et al., 2018).
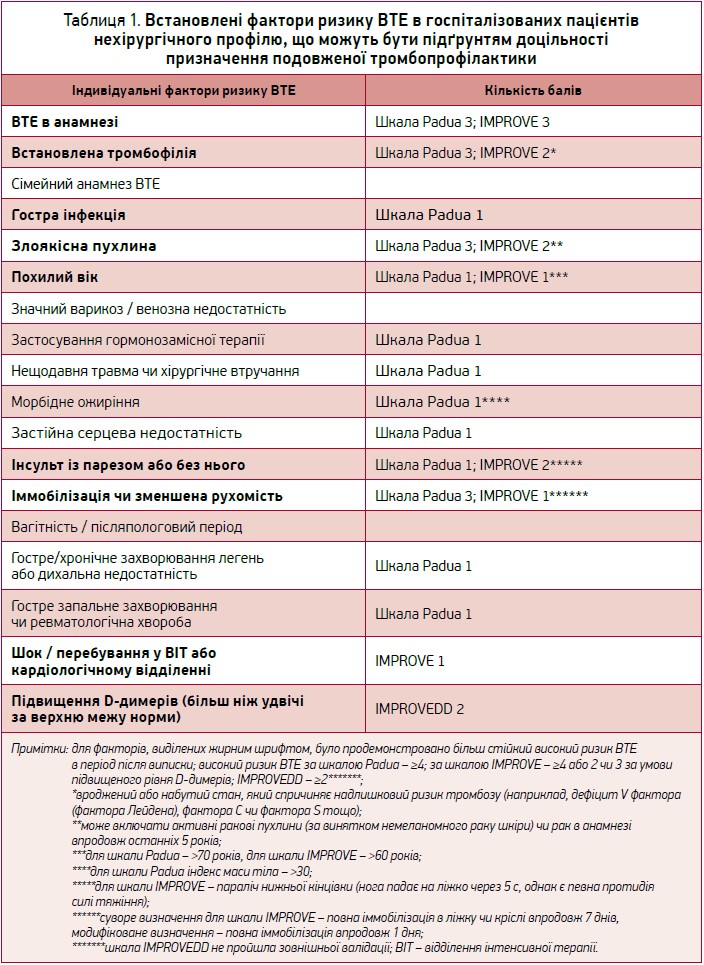
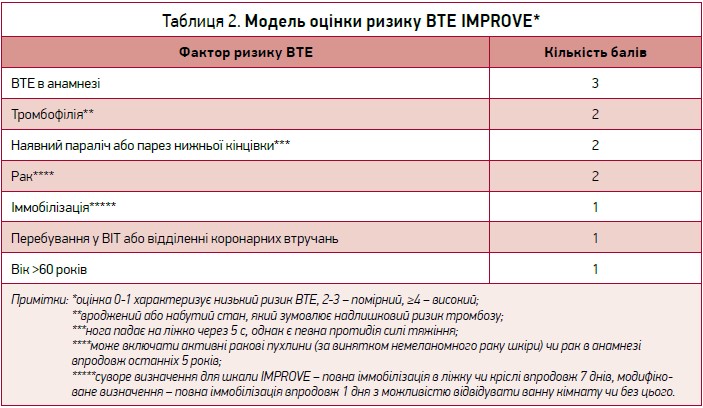
Вищезазначені дослідження дали змогу виявити ключові фактори ризику ВТЕ та виокремити групи пацієнтів, які потребують подовженої тромбопрофілактики (табл. 1). Ці фактори оцінюються окремо чи використовуються як частина моделей оцінки зваженого ризику ВТЕ на кшталт модифікованої моделі IMPROVE (International Medical Prevention Registry on Venous Thromboembolism) (табл. 2). Ця валідована модель є інструментом, який може допомогти лікарям у прийнятті рішень на основі оцінки індивідуального ризику ВТЕ (MacDougall K., Spyropoulos A., 2020).
Висновки
- Госпітальна ВТЕ є значною клінічною проблемою не лише для хворих хірургічного профілю, а й для всіх госпіталізованих пацієнтів та іммобілізованих осіб.
- Для оцінки ризику розвитку ВТЕ можуть застосовуватися шкала Padua та шкала IMPROVE.
- Профілактика еноксапарином упродовж 6-14 днів (під час стаціонарного лікування) є високоефективним і безпечним способом зменшити кількість ВТЕ.
- Проведені рандомізовані плацебо-контрольовані дослідження, їх метааналізи та наявні клінічні рекомендації однозначно доводять доцільність тромбопрофілактики еноксапарином для стаціонарних пацієнтів нехірургічного профілю.
- Для окремих пацієнтів із високим ризиком тромбозу необхідно розглянути можливість проведення подовженої тромбопрофілактики.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 12 (481), 2020 р.