7 серпня, 2020
Обґрунтоване застосування блокаторів ІЛ-6 для лікування ревматоїдного артриту на основі міжнародних і власних клінічних досліджень
Найпоширенішою патологією серед автоімунних захворювань є ревматоїдний артрит (РА). На жаль, незважаючи на лікування, РА нерідко спричиняє ранню інвалідизацію та втрату працездатності. Традиційно проблемам цієї недуги приділяється чимало уваги на ревматологічних конференціях і симпозіумах.
Не стала винятком і науково-практична конференція «Ревматичні хвороби: модифікація імунного статусу й запального процесу», проведена Асоціацією ревматологів України. Представляємо огляд доповіді професора кафедри терапії та ревматології Національної медичної академії післядипломної освіти (НМАПО) ім. П.Л. Шупика, доктора медичних наук Неоніли Михайлівни Шуби на тему сучасних можливостей терапії РА із застосуванням біологічних препаратів.
 РА є імунозапальним ревматичним захворюванням невідомої етіології, котре характеризується хронічним ерозивним артритом (синовітом) і системним ураженням внутрішніх органів, що спричиняє ранню інвалідність і скорочення тривалості життя пацієнтів. Сучасна концепція ведення хворих на РА орієнтована на досягнення повної чи часткової ремісії та передбачає призначення максимально активної (агресивної) терапії базисними протизапальними препаратами, починаючи з ранніх строків захворювання. Своєчасна діагностика критично важлива при РА, оскільки ранній діагноз і подальше адекватне лікування значно підвищують імовірність досягнення повної клінічної та лабораторної ремісії й позитивного прогнозу.
РА є імунозапальним ревматичним захворюванням невідомої етіології, котре характеризується хронічним ерозивним артритом (синовітом) і системним ураженням внутрішніх органів, що спричиняє ранню інвалідність і скорочення тривалості життя пацієнтів. Сучасна концепція ведення хворих на РА орієнтована на досягнення повної чи часткової ремісії та передбачає призначення максимально активної (агресивної) терапії базисними протизапальними препаратами, починаючи з ранніх строків захворювання. Своєчасна діагностика критично важлива при РА, оскільки ранній діагноз і подальше адекватне лікування значно підвищують імовірність досягнення повної клінічної та лабораторної ремісії й позитивного прогнозу.
Жорсткий контроль ревматичного запалення дав змогу істотно знизити показники інвалідності та непрацездатності, тому така тактика ведення хворих визнана бажаною терапевтичною стратегією. Суттєву роль у підвищенні ефективності терапії відіграли нові біологічні препарати, що блокують основні шляхи патогенезу запалення при РА.
Можливість розроблення й успішного та клінічного застосування цих препаратів нерозривно пов’язана з глибоким розумінням патогенезу ревматоїдного запалення. Сьогодні добре вивчені основні моменти патогенезу РА, котрі визначають основні методи лікувального впливу. Достеменно відомо, що необхідною умовою розвитку хронічного ревматоїдного запалення є спільна активація вродженого та набутого імунітету, котра запускається ефектами низки прозапальних цитокінів. Ключовим у цьому процесі вважається вплив інтерлейкіну‑6 (ІЛ‑6) і фактора некрозу пухлини (ФНП). Роль інших цитокінів і хемокінів (а їх близько сотні), що беруть участь у каскаді ревматоїдного запалення, наразі активно вивчається.
ІЛ‑6 найчастіше визначається в сироватці крові та синовіальній рідині хворих на РА й корелює з активністю захворювання та деструкцією суглобів. ІЛ‑6 також є основним індуктором С‑реактивного протеїну – білка гострої фази, вимірювання рівня котрого лікарі використовують при ревматичних захворюваннях для оцінки активності патологічного процесу.
Клітини вродженого імунітету високочутливі до дії ФНП. Цей прозапальний цитокін поряд з ІЛ‑1 та ІЛ‑6 відіграє важливу роль в активації саме вродженого імунітету.
ІЛ‑6 чинить вплив фактично на всі клітини вродженого та набутого імунітету за допомогою зв’язування з розчинними та мембранозв’язаними формами відповідних рецепторів (подвійний сигнальний механізм), при цьому розчинний рецептор диференціює сигнали лише від ІЛ‑6, на відміну від інших цитокінів, як-от ФНП й ІЛ‑1. Так, за рахунок різнобічного сигнального механізму ІЛ‑6 активує як вроджений, так і набутий імунітет.
ФНП насамперед активує сигнальний шлях нуклеарного фактора κВ (NF‑κВ), тоді як ІЛ‑6 – шлях янус-кіназ і сигнальних трансдукторів й активаторів транскрипції (JAK/STAT).
Окрім індукції шляху JAK/STAT, ІЛ‑6 впливає на сигнальний шлях мітогенактивувальних протеїнкіназ. Активація цих двох шляхів зумовлює експресію матриксних металопротеїназ і лігандів рецептора активатора NF‑κВ. Це спричиняє деградацію хрящової тканини та резорбцію кістки – типових структурних ушкоджень суглобів при РА. Крім того, ІЛ‑6 є фактором диференціювання В‑клітин. Саме він активує В‑клітини, що відповідають за вироблення ревматоїдного фактора, антитіл до циклічного цитрульованого пептиду й інших автоантитіл.
Зважаючи на описаний механізм патогенезу РА, стає зрозумілим, чому блокування ефектів ІЛ‑6 і ФНП має принципово важливе значення в терапії цього захворювання, при цьому блокування ІЛ‑6 вважається важливішим завданням, оскільки перекриває основні шляхи розвитку ревматоїдного запалення за кількома сигнальними механізмами.
Для пригнічення цитокінових ефектів використовують генно-інженерні біологічні препарати – лікарські засоби, синтезовані з використанням біотехнологій. Ці препарати здатні спрямовано блокувати запалення та можуть містити у своєму складі моноклональні антитіла, розчинні рецептори до цитокінів й інших біологічно активних молекул.
Сьогодні в лікуванні РА активно застосовують блокатори ФНП (інфліксимаб, адалімумаб, голімумаб тощо), блокатори рецепторів ІЛ‑6 (тоцилізумаб). Зокрема, препарат тоцилізумаб, який являє собою моноклональні антитіла до рецепторів ІЛ‑6, здатний зв’язуватися з мембранною й розчинною формою цих рецепторів. Відбувається блокування доступу ІЛ‑6 до активних центрів відповідних рецепторів, завдяки чому припиняються рецепторопосередкована передача сигналу й активація генів.
Оскільки ФНП зв’язується лише з мембранними рецепторами та насамперед активує шлях NF‑κВ, а ІЛ‑6 впливає на всі клітини вродженого й набутого імунітету за допомогою подвійного сигнального механізму, блокада ІЛ‑6 вважається пріоритетнішим завданням при виборі шляхів впливу на патогенез РА.
Наразі в терапії РА зазвичай використовують комбінований підхід, який передбачає одночасне застосування біологічних препаратів і засобів базисної терапії, що й відображено в рекомендаціях Європейської протиревматичної ліги (EULAR). Ця тактика дала можливість покращити результати лікування, проте має й певні недоліки.
Результати різних клінічних досліджень підтверджують, що застосування блокаторів ФНП у комбінації із синтетичними хворобомодифікувальними препаратами дає змогу досягти тривалої ремісії у 20-50% пацієнтів із РА, проте комбінація біологічних препаратів із метотрексатом асоціюється зі зростанням ризику інфекційних й інших ускладнень порівняно з їх використанням як монотерапії (Horneff G. et al., 2014). Відомо, що терапія метотрексатом асоціюється з ризиком розвитку пневмоніту, запаленням слизових оболонок, зниженням мінеральної щільності кісткової тканини й ураженням печінки. Перелічені ускладнення є серйозними причинами, що обмежують терапію цим препаратом.
Чи здатна монотерапія біологічними препаратами в пацієнтів із РА гарантувати вищу безпеку лікування порівняно з метотрексатом і його комбінаціями з іншими препаратами без зниження ефективності терапії? Відповісти на це запитання допомогли результати клінічних досліджень.
Виявилося, що монотерапія представниками інгібіторів ФНП, а також ритуксимабом і абатацептом не є достовірно ефективнішою порівняно з метотрексатом. Тільки тоцилізумаб як монотерапія продемонстрував сумісну ефективність із комбінованою терапією метотрексатом чи іншими синтетичними базисними препаратами за меншого ризику ускладнень. Зокрема, це було неодноразово підтверджено такими дослідженнями, як DREAM, ACT-RAY, SURPRISE, FUNCTION, TOCERRA тощо. Розглянемо докладніше їх результати.
Дослідження ACT-RAY, в якому взяли участь 556 пацієнтів із РА, продемонструвало відсутність клінічної переваги комбінованої терапії тоцилізумаб + метотрексат порівняно з монотерапією тоцилізумабом через 24 тиж після початку лікування, при цьому в групі комбінованої терапії частіше відзначали підвищення рівня печінкових трансаміназ. На тлі обох схем лікування вдалося досягти суттєвої клінічної та рентгенологічної відповіді. Отримані дані вказують на високу ефективність монотерапії тоцилізумабом у цієї категорії пацієнтів із РА (Dougados M. et al., 2013).
За даними дослідження SURPRISE, у пацієнтів із непереносимістю метотрексату (n=111) комбінація тоцилізумаб + метотрексат і монотерапія тоцилізумабом протягом 52 тиж показали схожу ефективність в обох групах, оцінену за індексами DAS28, CDAI, ACR70 і рахунком ерозій Шарпа. Проте в групі монотерапії тоцилізумабом частота тяжких інфекцій і серйозних небажаних явищ становила 4,5 та 8,1%, тоді як у групі комбінації тоцилізумаб + метотрексат – 5,2 та 14,0% відповідно. Отже, перехід на тоцилізумаб або додавання його до метотрексату в пацієнтів із непереносимістю до останнього мають сумісну ефективність (Takeuchi T. et al., 2013).
У дослідженні DREAM було показано, що монотерапія тоцилізумабом здатна спричинити стійку ремісію РА без супутнього застосування синтетичних базисних препаратів, при цьому рівні ІЛ‑6 і матриксної металопротеїнази‑3 у сироватці крові можуть бути корисними маркерами ідентифікації пацієнтів, які могли би припинити прийом тоцилізумабу без ризику загострення захворювання (Nishimoto N. et al., 2014).
Результати досліджень із вивчення ефективності тоцилізумабу (SAMURAI, SATORI тощо) продемонстрували можливість застосування цього препарату як монотерапії. Ця тактика дає змогу значно зменшити кількість побічних явищ, зумовлених застосуванням комбінацій із метотрексатом.
Результати дослідження TOCERRA свідчать, що монотерапія тоцилізумабом або комбінація тоцилізумаб + метотрексат є обґрунтованим терапевтичним варіантом у пацієнтів із неадекватною відповіддю на попередні біологічні препарати. Слід зазначити, що тоцилізумаб продемонстрував триваліший ефект запам’ятовування (здатність відтворювати позитивний клінічний ефект після відновлення терапії) порівняно з інгібіторами ФНП. Поновлення терапії тоцилізумабом після тривалої відміни його застосування супроводжувалося вираженим клінічним ефектом у близько 90% випадків (Lauper K. et al., 2018).
Пряме порівняльне дослідження серед пацієнтів із РА, котрі припинили прийом метотрексату, продемонструвало, що монотерапія тоцилізумабом ефективніша порівняно з монотерапією блокатором ФНП адалімумабом за більшістю кінцевих точок (Smolen J. et al., 2018).
Група дослідників вивчала ефекти метотрексату на моноцитах людини клітинної лінії U937. Автори дійшли висновку, що цей препарат індукує експресію прозапальних цитокінів, як-от ІЛ‑1, ІЛ‑6 і ФНП. Науковці припускають, що ці ефекти можуть бути причиною таких відомих побічних явищ метотрексату, як пневмоніт, запалення слизових оболонок, зниження мінеральної щільності тканин (Olsen N. et al., 2014).
Ризик перелічених ускладнень необхідно обов’язково враховувати, призначаючи метотрексат. Саме тому перевагу слід віддавати комбінації імунобіологічних препаратів із метотрексатом або монотерапії імунобіологічними препаратами, особливо за наявності показань.
Згідно з рекомендаціями оновленого консенсусу, за наявності несприятливих чинників терапію РА можна починати з біологічних агентів без попереднього призначення синтетичних базисних протизапальних препаратів. Якщо необхідна монотерапія, то вибір, безумовно, слід зробити на користь тоцилізумабу.
Професор Н.М. Шуба нагадала, що монотерапія тоцилізумабом є обґрунтованою в таких випадках:
1) неможливість застосування традиційних базисних препаратів:
- через побічні ефекти (порушення функції нирок, ураження печінки, гастроінтестинальна патологія, лейкопенія, анемія, тромбоцитопенія тощо);
- через дуже високу активність РА;
2) відсутність ефективності терапії метотрексатом, іншими традиційними базисними препаратами, блокаторами ФНП, ритуксимабом;
3) планована вагітність;
4) бажання хворого отримати швидкий ефект без попереднього застосування традиційних базисних препаратів.
З огляду на високу актуальність біологічної терапії РА, продовжуючи пошук ефективних і безпечних методів лікування цього захворювання, співробітниками кафедри терапії та ревматології НМАПО ім. П.Л. Шупика було проведено власне дослідження. У ньому оцінювали результати лікування пацієнтів із РА тоцилізумабом після попередньої терапії глюкокортикоїдами.
У дослідження було залучено 20 хворих на РА (17 жінок і 3 чоловіки) віком від 18 до 61 року з тривалістю захворювання від 3 міс до 10 років. Двох пацієнтів із тривалим перебігом РА було виключено з випробування у зв’язку з побічними ефектами. Із раннім РА спостерігалося 9 хворих, серед яких 4 були cеропозитивними із середнім ступенем активності та 5 – серонегативними з високим і середнім ступенями активності. Тривалий перебіг РА мали 11 пацієнтів, з яких 8 – серопозитивні з високим і середнім ступенями активності та 3 – серонегативні.
Для верифікації діагнозу РА застосовували критерії Американської колегії ревматологів (АСR) і EULAR (2010). Із метою визначення активності процесу підраховували кількість залучених суглобів, спостерігали вираженість болю за візуально-аналоговою шкалою, скутість і порушення функції суглобів, визначали швидкість осідання еритроцитів (ШОЕ), рівень С‑реактивного білка, ревматоїдний фактор.
Усім хворим перед включенням у терапію тоцилізумабом проводили загальноклінічні дослідження, скринінг на наявність маркерів вірусних гепатитів, оцінку ниркових і печінкових тестів, пробу Манту чи діаскінтест, рентгенографію легень і рентгенографічне дослідження найураженіших суглобів. Усім хворим, які отримували лікування тоцилізумабом, проводили загальноклінічні дослідження в динаміці, звертаючи увагу на вміст гемоглобіну, кількість еритроцитів, кількість лейкоцитів, ШОЕ, а також С‑реактивний білок і ревматоїдний фактор (перелічені дослідження проводилися перед кожним уведенням препарату).
Важливість монотерапії біологічними агентами при РА пов’язана насамперед із тим, що комбінація біологічних препаратів із метотрексатом підвищує ризик розвитку інфекційних ускладнень порівняно з монотерапією. Щоб уникнути додаткового токсичного впливу синтетичних базисних препаратів, а також з огляду на вищу ефективність тоцилізумабу порівняно з ними, у хворих у піддослідній групі синтетичні базисні препарати не застосовували.
Із метою швидкого купірування активності процесу були обрані найбезпечніші дози глюкокортикоїдів (у цьому випадку – метилпреднізолону). Стартова терапія проводилася в режимі мініпульс-терапії препаратом Солу-Медрол 250 мг внутрішньовенно № 4 з подальшим переходом на пероральний прийом препарату Медрол дозою 8 мг/добу (лише в 1 пацієнта дозою 12 мг/добу).
Застосування метилпреднізолону дало змогу уникнути розвитку лейкопенії на тлі терапії тоцилізумабом. Хороша відповідь на застосування глюкокортикоїдів виявилася сприятливим прогностичним тестом у лікуванні РА.
За відсутності позитивних тестів на вірусні гепатити, туберкульоз, за нормальних показників ниркових і печінкових проб, за відсутності вогнищ інфекції, змін при рентгенологічному дослідженні легень пацієнтам починали проводити терапію тоцилізумабом (препарат Актемра) дозою з розрахунку 8-4 мг/кг 1 раз на 4 тиж.
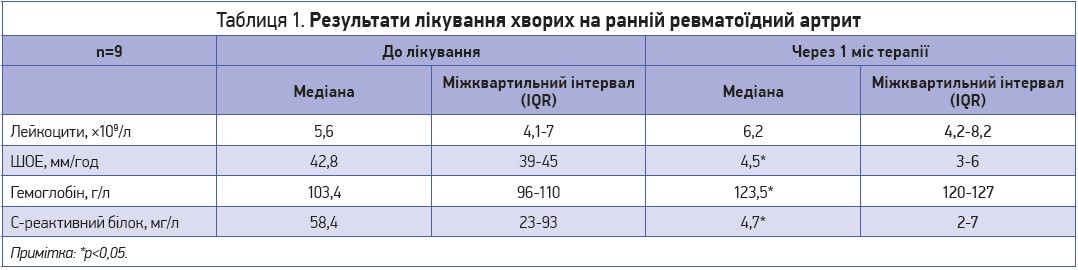
Результати лікування хворихна ранній ревматоїдний артрит
До групи було залучено 9 пацієнтів із тривалістю захворювання до 6 міс. Уміст лейкоцитів як до лікування тоцилізумабом, так і в динаміці терапії був нормальним у всіх учасників (у межах 4,1-7×10⁹/л). Спостерігалося помірне зниження рівня гемоглобіну – 96-110 г/л; підвищення ШОЕ – 39-45 мм/год. Показники С‑реактивного білка були підвищені в усіх пацієнтів – від 23 до 93 мг/л.
У процесі лікування (вже перед другим уведенням тоцилізумабу) вміст гемоглобіну підвищився до 120-127 г/л, ШОЕ знизилася до 3-6 мм/год. Рівень С‑реактивного білка перед другим уведенням був у межах нормальних значень (табл. 1).
Стосовно ревматоїдного фактора динаміки не виявлено. Клінічно в усіх пацієнтів відзначали відсутність суглобового синдрому як перед другим уведенням, так і перед наступними. Застосування тоцилізумабу у хворих на ранній РА продемонструвало високу ефективність, швидке купірування активності процесу та розвиток тривалої клінічної ремісії без терапевтичної підтримки.
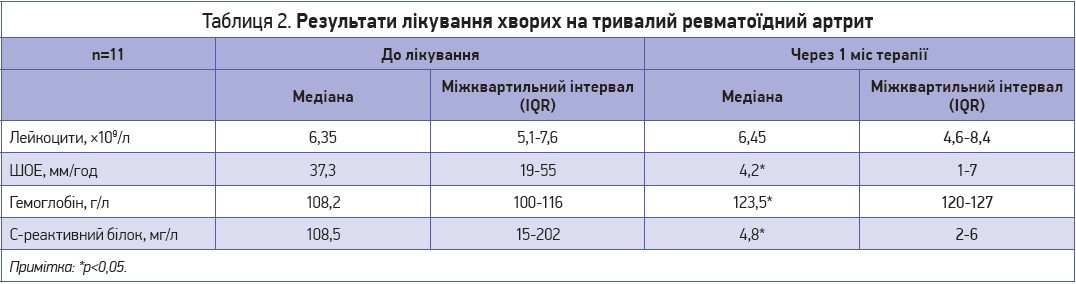
Результати лікування хворих на тривалий ревматоїдний артрит
До групи було залучено 11 пацієнтів із тривалістю захворювання від 4 до 11 років. Спочатку тільки у 2 пацієнтів відзначали зниження рівня гемоглобіну – 100 та 116 г/л, який у процесі терапії тоцилізумабом підвищився до 130 і 131 г/л. Рівень лейкоцитів як до лікування тоцилізумабом, так і в динаміці терапії був у межах нормальних значень – 5,1-7,6×10⁹/л.
Підвищену ШОЕ виявляли в усіх хворих – у середньому від 19 до 55 мм/год. Під час терапії ШОЕ знижувалася до норми (до 1-7 мм/год). Рівень С‑реактивного білка був підвищеним у всіх пацієнтів і становив від 15 до 202 мг/л. Нормалізація цього показника спостерігалася вже перед другим уведенням тоцилізумабу (табл. 2).
Це дійсно важливо, оскільки зниження рівня С‑реактивного білка є одним з основних критеріїв ефективності терапії тоцилізумабом. Значущих змін у динаміці показників ревматоїдного фактора виявлено не було.
Клінічна симптоматика, на котру насамперед звертають увагу пацієнти, також мала позитивну динаміку до другого введення тоцилізумабу та практично повністю зникала до третього введення. Зниження дози глюкокортикоїдів у цій групі хворих було поступовішим (протягом 3-4 міс). Один пацієнт продовжував приймати глюкокортикоїди дозою 4-6 мг/добу.
В усіх пацієнтів із тривалим перебігом РА застосування тоцилізумабу супроводжувалося позитивними клініко-лабораторними та рентгенологічними ефектами.
На особливу увагу заслуговує пацієнтка В., вік – 22 роки, з тривалим перебігом РА, котра надійшла до стаціонару з високими показниками активності запального процесу. Рівень гемоглобіну – 97 г/л, ШОЕ – 51 мм/год, С‑реактивний білок – понад 200 мг/л. Особливістю цієї пацієнтки було ураження колінних суглобів і суглобів стопи, відсутність ураження суглобів кистей і променезап’ясткових суглобів.
Уже через 1 міс після введення препарату Актемра відзначалися зміни таких показників: гемоглобін – 130 г/л, ШОЕ – 4 мм/год, лейкоцити – 6,8×109/л, негативний С‑реактивний білок. Суглобовий синдром значно зменшився, але не зникли припухлість і незначні болі в лівому колінному суглобі та суглобах стопи. Тривалість лікування становила 12 міс. У цей час зберігалися ШОЕ на рівні 3-6 мм/год, негативний С‑реактивний білок і гемоглобін у межах норми.
Уже через 6 міс лікування суглобовий синдром практично був відсутній. У пацієнтки відзначалася позитивна рентгенологічна динаміка при дослідженні стоп. Прийом глюкокортикоїдів було повністю скасовано, оскільки спостерігалася повна ремісія.
Через 3 міс після відміни терапії пацієнтка завагітніла та без ускладнень народила в установлений термін. У період вагітності та після народження відзначалася тривала ремісія (протягом 4 років і 3 міс) без терапевтичної підтримки. Надалі пацієнтка знову завагітніла та народила другу дитину.
Отже, на озброєнні лікарів є гідний препарат, здатний активно пригнічувати розвиток ревматичного запалення та повертати пацієнтів до нормального життя. На підставі доведених фактів ми можемо стверджувати, що тоцилізумаб дає змогу ефективно контролювати як окремі прояви РА (симптоматичний ефект), так і рентгенологічне прогресування захворювання.
Підготував В’ячеслав Килимчук
Медична газета «Здоров’я України 21 сторіччя» № 12 (481), 2020 р.