1 вересня, 2020
COVID‑19: від епідеміології до лікування
Пандемія COVID‑19 чинить значний тиск на щоденну клінічну практику кардіологів, кардіохірургів та медичного персоналу в усьому світі. В цьому огляді міжнародний колектив авторів J.M. Pericas et al. підсумовує дані стосовно вірусу SARS-COV‑2, епідеміології, механізмів інфікування та перебігу COVID‑19. Для спеціалістів буде цікавою інформація про серцево-судинні (СС) прояви коронавірусної інфекції, взаємодії кардіологічних та противірусних засобів, диференційовані підходи до лікування тощо. Окремим блоком обговорюються нова реальність функціонування закладів охорони здоров’я в умовах пандемії, заходи безпеки в палатах, операційних, блоках інтенсивної терапії, оптимізація розподілу ресурсів. Також наведені клінічні випадки із практичними висновками. Матеріал опублікований у виданні European Heart Journal (2020; 41 (22): 2092‑2112).
Починаючи із грудня 2019 р. і до сьогодні загроза COVID‑19 набула глобального поширення, внаслідок чого 11 березня 2020 р. Всесвітньою організацією охорони здоров’я було оголошено пандемію [1]. На дату збору даних для огляду (5 травня) у світі повідомлялося про більш як 3,5 млн інфікованих вірусом SARS-CoV‑2 і 250 тис. смертельних випадків [2]. Географічно інфекція поширювалася у три фази: спершу в Азії з епіцентром в Китаї та втягненням Південної Кореї. Після введення безпрецедентних заходів протиепідемічної безпеки в Китаї епідемію вдалося взяти під контроль, але з середини лютого розпочалася друга фаза, яка охопила країни Європи. Початком третьої фази вважається середина березня, яка характеризувалася стрімким зростанням випадків COVID‑19 у США [2‑5].
Згідно з епідеміологічними даними, отриманими здебільшого з Китаю, відомо, що COVID‑19 вражає переважно людей віком 30‑79 років (87%), тоді як частота випадків у вікових групах молодше 19 і старше 80 років була відносно низькою (2 і 3% відповідно) [6]. Середній вік варіює від 47 до 56 років відповідно до найбільших з описаних серій випадків; чоловіки переважають над жінками (65%). З-поміж захворілих 15% були курцями, 25‑30% мали фонові хронічні патології, з яких до 40% становили серцево-судинні захворювання (ССЗ). Артеріальна гіпертензія (АГ) вважається найчастішою коморбідністю – 15‑30% [7‑9].
Згодом в метааналізі було уточнено, що АГ, ССЗ, цереброваскулярні захворювання та цукровий діабет (ЦД) серед пацієнтів із COVID‑19 були поширені у пропорціях 17,1; 16,4 і 9,7% відповідно [10]. Медичні працівники є групою ризику, захворюваність варіює залежно від спеціальності та місця роботи; загалом вони становили 3,8% інфікованих за даними з Китаю та 15,5% – Іспанії [6, 11].
Клінічний випадок № 1
Чоловік, 59 років, 13.03.2020 переніс термінову операцію із приводу ускладненого ендокардиту протезованого клапану серця. Наступного дня при поглибленому вивченні анамнезу було встановлено, що протягом доби до операції пацієнт контактував із хворим на COVID‑19. Аналіз мазка з носоглотки методом полімеразної ланцюгової реакції (ПЛР) підтвердив інфікування вірусом SARS-CoV‑2. У хворого розвинулася двобічна пневмонія з гострим респіраторним дистрес-синдромом, від якої він помер 20.03.2020. При ретроспективному відслідковуванні контактів виявилося, що пацієнт контактував із 25 медичними працівниками, з яких в одного згодом також підтвердили інфекцію.
Висновки. У початкову фазу пандемії, коли вірус SARSCoV‑2 активно циркулює в популяції, система охорони здоров’я надзвичайно вразлива. Систематичний скринінг інфікування слід проводити у всіх пацієнтів, які поступають на лікування до стаціонарного закладу, щоб уникнути нозокоміальної передачі.
Що відомо про вірус та патогенез?
Коронавіруси поширені в популяціях птахів і ссавців в усьому світі та мають схильність викликати респіраторні захворювання, зокрема при передачі людині. За останні 20 років людство тричі зіткнулося з коронавірусами. Першим був SARSCoV 2002 р., за ним – середньосхідний респіраторний синдром (MERS)-CoV 2012 р., а нині ми маємо справу з вірусом SARS-CoV‑2 та хворобою COVID‑19, яку він викликає. Усі три віруси, ймовірно, походять від кажанів [12‑14]. SARS-CoV‑2 являє собою бета-b коронавірус, який генетично споріднений із SARS-CoV, проте має відмінності [15]. Щоб проникнути у клітину хазяїна, SARS-CoV‑2 своїм S-глікопротеїном прикріплюється до рецептора ангіотензинперетворювального ферменту 2 (АПФ‑2), який є рецептором зв’язування і для SARSCoV [13].
На рисунку 1 показано життєвий цикл вірусу SARS-CoV‑2. Генетичний матеріал SARS-CoV‑2 представлений одним позитивним ланцюгом РНК. Така РНК ще називається смисловою (sense-RNA), вона схожа на мРНК і тому, при потраплянні у клітину хазяїна, може одразу включатися до процесу трансляції без участі додаткових ферментів. У вірусній частинці РНК вміщена у «футляр» із чотирьох типів структурних білків: шипових (S), оболонкових (Е), мембранних (M) та нуклеокапсидних (N). Білки типу S формують характерні відростки (шипи), які мають вигляд корони при мікроскопії, за що родина Coronaviridae і отримала свою назву. Саме S-білок віруса зв’язується з рецептором АПФ‑2 на поверхні інфікованої клітини. Цікаво, що для злиття вірусу з мембраною клітини необхідно ще пройти етап перетворення (реаранжування) шипового глікопротеїну, і в цьому вірусу допомагають власні протеази клітини (TMPRSS2, катепсини, HAT, фурін тощо).
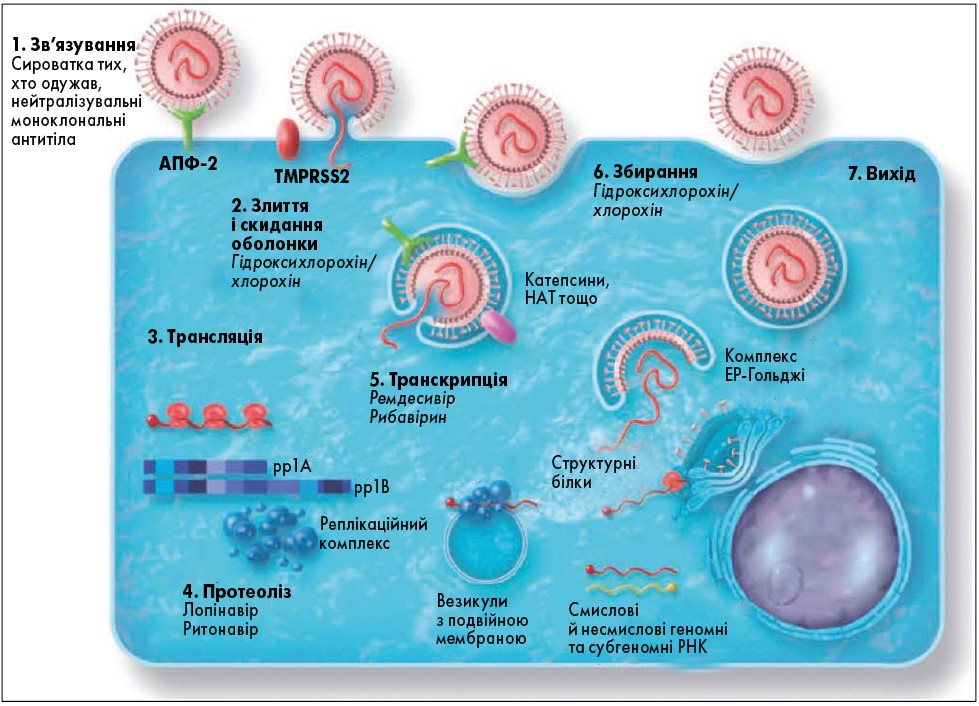 Рис. 1. Життєвий цикл вірусу SARS-CoV‑2 та точки впливу потенційних засобів терапії
Рис. 1. Життєвий цикл вірусу SARS-CoV‑2 та точки впливу потенційних засобів терапії
Примітка: Назви потенційних анти-SARS-CoV‑2-препаратів позначені курсивним шрифтом поряд із відповідними етапами життєвого циклу вірусу, на які вони можуть впливати.
Після потрапляння вірусної РНК у цитоплазму розпочинається процес трансляції генів ORF1a/b. Продуктами є поліпротеїни великої молекулярної маси, що підлягають подальшому розщепленню вірусними протеазами. В результаті вивільняються 16 неструктурних білків, які відповідають за процес реплікації вірусу. Реплікаційний комплекс формується на пухирцях із подвійною мембраною. Він продукує геномну РНК вірусу та субгеномні РНК, в яких закодовані структурні білки S, E, M, N, а також додаткові гени ORF, які, ймовірно, відіграють роль модуляторів імунної відповіді хазяїна. Нові вірусні частинки збираються на мембранах ендоплазматичного ретикулуму й апарату Гольджі, після чого виштовхуються назовні клітини як її секреторні продукти.
Репродуктивне число R0 показує, скільки людей у середньому заражаються від однієї інфікованої людини. Коронавіруси у своїй еволюції набувають вищої вірулентності: SARS-CoV має R0 1,8‑2,5, а MERS-CoV та SARS-CoV‑2 – вже 2,4‑3,8. Для порівняння, R0 вірусу грипу становить від 1,2 до 2 [14]. Передача здійснюється переважно повітряно-крапельним шляхом, краплини рідини з дихальних шляхів здатні поширюватися на відстань до 2 м. Також захворіти можна при тісному контакті з інфікованою особою або через інші предмети та поверхні, на яких вірус виживає до кількох днів [16, 17]. Найвище вірусне навантаження має місце в останні дні інкубаційного періоду та в перші дні появи симптомів. У цей час хвора людина є особливо заразною [18].
Цільовими клітинами для проникнення і розмноження вірусу є клітини респіраторного епітелію. Спектр клінічних проявів варіює від асимптомного перебігу інфекції до розвитку тяжкого ураження легень та гострого респіраторного дистрес-синдрому (ГРДС), що потребує механічної вентиляції [14]. Тяжкість захворювання визначається як прямою пошкоджувальною дією вірусу, так і характером імунної відповіді організму хазяїна. Запропоновано два механізми для пояснення коронавірусного ураження легень, яке призводить до ГРДС у людей [19]:
По-перше, зв’язуючись із рецепторами АПФ‑2 своїми S-глікопротеїнами, вірус спричиняє зниження функції рецепторів, що призводить до дисбалансу ренін-ангіотензинової системи і може бути причиною розвитку дифузного альвеолярного ураження.
По-друге, деякі білки коронавірусів виявили себе в експериментах сильними індукторами апоптозу клітинних ліній із різних органів, зокрема легень.
Альвеолярні макрофаги також відіграють важливу роль, оскільки їхня активація спричиняє так званий цитокіновий шторм – феномен масивного вивільнення фактора інгібування міграції макрофагів (MIF), фактора некрозу пухлин (TNF)-α, інтерлейкінів (ІЛ)‑1, ІЛ‑2R, ІЛ‑6, ІЛ‑8 та ІЛ‑10, що приваблюють нейтрофіли, які своєю чергою вивільняють лейкотрієни, окислювальні ферменти та протеази. Всі перелічені чинники викликають типовий ГРДС із гострим дифузним альвеолярним ураженням, набряком легень та формуванням гіалінових мембран.
На додачу, виділяють дві фази інфекції SARS-CoV‑2:
- у ранню фазу (до 7‑10 днів) домінує вірусний синдром із високим вірусним навантаженням у верхніх та нижніх дихальних шляхах;
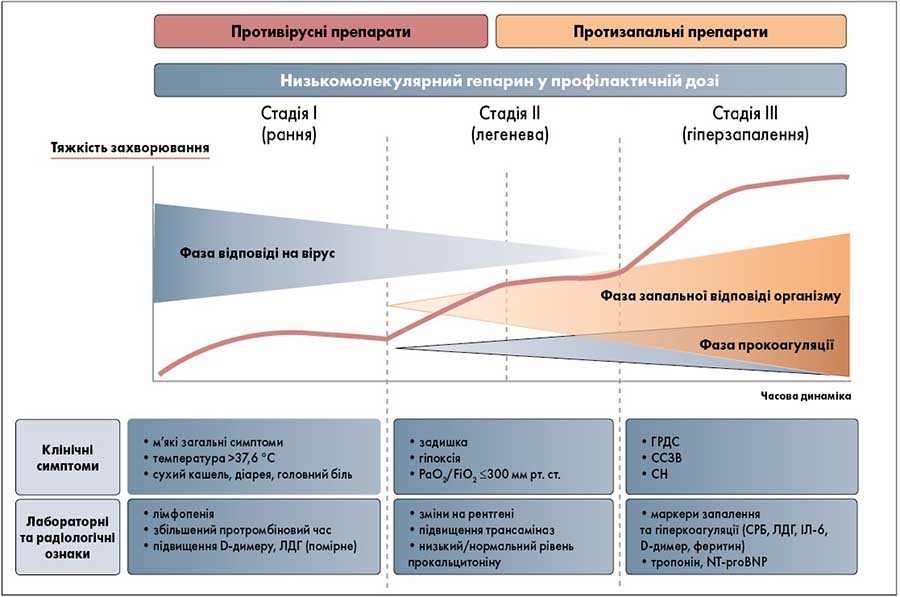
- у другу фазу може виникнути вірусна пневмонія; зрештою вірусна інфекція здатна спричинити запальну і прокоагулянтну відповіді організму з розвитком системної запальної реакції, ГРДС, шоку та серцевої недостатності (СН) (рис. 2).
Рис. 2. Клінічні стадії COVID‑19
Примітка: ССЗВ – синдром системної запальної відповіді.
Вважається, що плазма крові людей, які перехворіли на COVID‑19 та нейтралізувальні моноклональні антитіла, здатна протидіяти прикріпленню вірусу до рецепторів АПФ‑2 та його проникненню у клітини. Хлорохін/гідроксихлорохін, імовірно, перешкоджають злиттю з мембраною, входу вірусу та скиданню його оболонки. Інгібітори протеаз лопінавір та ритонавір вивчають як потенційні блокатори протеолізу поліпротеїну – первинного продукту вірусного геному. Нуклеозидні аналоги ремдесивір та рибавірин можуть перешкоджати ресинтезу вірусної РНК. Інтерферони індукують експресію антивірусних та імуномодуляторних генів, які впливають на численні аспекти реплікаційного циклу вірусу.
Прозапальні та прокоагуляційні стани як тригери СС-подій
Рецептори АПФ‑2 широко представлені в серці, нирках, мозку та шлунково-кишковому тракті, тому COVID‑19 може мати численні позалегеневі прояви, зокрема серцево-судинні [20]. Щодо патогенезу уражень серця при коронавірусній інфекції, за попередніми даними клітинами-мішенями для вірусу в міокарді можуть бути перицити, які у значній кількості експресують рецептори АПФ‑2. Внаслідок ураження ендотелію капілярів виникає порушення кровопостачання міокарда за типом мікроваскулярної дисфункції [21, 22].
На додачу до імунного та прозапального шляху, що призводить до ендотеліальної дисфункції, яка спричиняє ішемічні або аритмічні події, SARS-CoV‑2 викликає розлади коагуляції. Вони також можуть відігравати роль у декомпенсації фонового ССЗ [23]. Таким чином, пацієнти з COVID‑19 можуть мати вірогідність розвитку СС-подій за різних причин: внаслідок системної гіперзапальної відповіді, протромботичного порушення каскаду згортання крові, мікроваскулярної дисфункції міокарда, стресової кардіоміопатії, ураження міокарда, що виникає внаслідок невідповідності постачання і потреб кисню, а також нестабільності атеросклеротичних бляшок, яка спричиняє гострий коронарний синдром (ГКС) [21‑30]. Окрім того, соціальне дистанціювання та ізоляція як профілактичні заходи в умовах епідемії COVID‑19 також можуть підвищувати СС-ризик [22].
Клінічний перебіг
Найчастішими симптомами COVID‑19 є лихоманка та сухий кашель, що супроводжується утрудненням дихання. Нещодавно описані такі симптоми, як аносмія, гіпосмія та дисгевзія як типові для початкової фази хвороби COVID‑19 [31]. Повідомлялося про симптоми з боку травного тракту. Характерними змінами з боку крові є: лімфоцитопенія, підвищення ІЛ‑6, С-реактивного білка (СРБ), лактатдегідрогенази (ЛДГ), D-димеру, феритину, трансаміназ, високочутливого тропоніну та мозкового натрійуретичного пептиду (NT-pro-BNP). При цьому рівень прокальцитоніну зазвичай дуже низький, що допомагає диференціювати COVID‑19 від гострої бактеріальної інфекції. Слід враховувати, що перелічені маркери динамічно змінюються впродовж курсу захворювання. Наприклад, лейкоцитарне число прогресує від нормального показника, що супроводжується лімфоцитопенією, до лейкопенії у тяжких випадках. Високе співвідношення нейтрофілів та лімфоцитів, імовірно, асоційоване з тяжчим перебігом хвороби [32].
Радіологічні прояви варіюють від зображень без патології на рентгенівських знімках або сканах при комп’ютерній томографії (10% випадків) до ознак фіброзу легень [33]. Та все ж найчастіше COVID‑19 виявляється у вигляді пневмонії (двобічної десь у половині випадків), що діагностується рентгенологічно за наявності ретикулярних, нодулярних затемнень або симптому «матового скла».
Близько 5‑10% пацієнтів потребують госпіталізації до відділення інтенсивної терапії (ВІТ) для проведення механічної вентиляції легень [34]. Серед тих, в кого розвивається пневмонія, допомоги у ВІТ потребують 23‑26%, ГРДС виникає у 16‑42% [8, 9, 14, 35]. Шоковий стан розвивається з частотою до 20% [9], але в більшості випадків повідомлялося про 1‑8% критично хворих.
На рисунку відображено стадії перебігу COVID‑19 з патофізіологічними зв’язками. Початок легеневих симптомів відмічається при переході з фази відповіді на вірус, що характеризується високим вірусним навантаженням та відносно низьким рівнем запалення, до фази запальної відповіді, під час якої переважають запалення та порушення коагуляції. У типових випадках ускладнення розвиваються на 10‑12-й день від появи перших симптомів, що часто співпадає в часі з активацією каскаду прозапальних медіаторів – «цитокіновим штормом» [36].
У перші дні захворювання (стадія І) пацієнти зазвичай відмічають симптоми вірусної інфекції верхніх дихальних шляхів, найчастіше підвищення температури та кашель. На 8‑12-й день починається запальна фаза (стадія ІІ), під час якої можуть з’являтися легеневі симптоми, зокрема задишка. У пацієнтів, які прогресують до стадії гіперзапалення з відповідним залученням легеневої тканини, виникає ризик розвитку ГРДС. Крім того, впродовж пізньої фази пацієнти перебувають під загрозою тромботичних та емболічних ускладнень через стан гіперкоагуляції.
СС-прояви
Хоча даних для складання статистики СС-подій під час та після захворювання на COVID‑19 ще замало, за повідомленнями з різних частин світу вони виникають досить часто [37‑44]. Серед найбільш згадуваних – гострий міокардит, ГКС з елевацією сегмента ST, аритмії, гостра СН. З іншого боку, за час пандемії прослідковується тривожна тенденція до зниження частоти звернень по медичну допомогу осіб із СС-подіями, що не пов’язані з COVID‑19. Дослідження, виконані у США, Італії та Іспанії, виявили скорочення на 40% обсягів проведення інтервенційних втручань пацієнтам із ST-інфарктами міокарда та суттєве зменшення числа госпіталізацій із приводу всіх ГКС [45‑47]. З італійського дослідження отримані невтішні дані про зростання частки летальних випадків порівняно з минулим роком, що не можна цілком пояснити смертністю через COVID‑19. Це може бути спричинено ГКС, які взагалі не потрапили в поле зору медичних служб.
Особливу небезпеку становлять аритмічні ускладнення. За даними з регіону Ломбардія в Італії, виявлене підвищення частоти позагоспітальних випадків зупинки серця, що чітко асоційоване з кумулятивною захворюваністю на COVID‑19 [48]. Дослідження з китайського міста Ухань демонструє дуже низьку 30-денну виживаність хворих на COVID‑19, які перенесли госпітальну зупинку серця (2,9%) [49].
Надзвичайно важливими є питання диференційної діагностики легеневих проявів COVID‑19 із ССЗ. Зокрема, гостре ураження легень при COVID‑19 може набувати клінічних ознак накопичення рідини в легенях при декомпенсованій СН, тому слід ретельно збирати анамнез на предмет попередньої історії ХСН. Правильний діагноз важливий при прийнятті рішень щодо терапії, оскільки дворівнева вентиляція з позитивним тиском в дихальних шляхах (BiPAP) протипоказана пацієнтам з COVID‑19. Ще один діагностичний виклик – це пацієнт із COVID‑19, що скаржиться на біль у грудях та в якого виявлено підвищений рівень тропоніну. Такі зміни можуть бути зумовлені як розвитком вірусного міокардиту, так і ГКС.
Діагностика
Лабораторна діагностика COVID‑19 має першочергове значення і для прийняття клінічних рішень, і для контролю епідемічної ситуації. Матеріал із дихальних шляхів є найбільш цінним, аналізи крові та випорожнень також можна застосовувати, хоча доказів їхньої ефективності замало [50‑51]. ПЛР зворотної транскрипції в реальному часі є наразі «золотим стандартом» [50]. Визначення загальних антитіл, IgM та IgG проти SARS-CoV‑2 у зразках крові може бути недостатньо чутливим у перші 7‑14 днів захворювання [52]. Комбіноване тестування із ПЛР та визначенням антитіл підвищує чутливість діагностики до 90% [51]. Лабораторні тести на інші респіраторні патогени слід розглядати в індивідуальних випадках, оскільки вірусна пневмонія може супроводжуватися бактеріальною коінфекцією [53].
В умовах епідемії осіб із типовими клінічними та радіологічними проявами потрібно вважати такими, що мають COVID‑19, навіть якщо перший результат вірусологічної діагностики виявився негативним, або поки така методика тимчасово недоступна. Проте слід зауважити, що клінічна діагностика COVID‑19 базується на симптомах, які були описані на вибірках пацієнтів переважно з тяжким перебігом захворювання, тому не може бути точною для загальної популяції.
Прогноз перебігу з огляду на СС-фактори ризику
Старший вік – найчастіше згадуваний у публікаціях фактор ризику смерті, асоційований із COVID‑19. Летальні випадки серед пацієнтів, молодших за 50 років, загалом нетипові, але ризик подвоюється з кожною декадою віку: від 2% у групі 50‑60 років до 16% і більше серед тих, хто перетнув поріг 80 років. Широко обговорюється роль супутніх захворювань, серед яких АГ та ЦД найчастіше згадуються як обтяжливі чинники перебігу COVID‑19. Проте цей зв’язок може бути зумовлений і старшим віком осіб із коморбідністю. Li et al. встановили, що частки пацієнтів з АГ, цереброваскулярною патологією та ЦД були, відповідно, вдвічі, втричі та вдвічі вищими серед тих, кого довелося госпіталізувати до ВІТ, порівняно з тими, хто мав легку форму COVID‑19. Гостре ураження міокарда з-поміж критично хворих відмічалося у 13 разів частіше [10].
Shi et al. вивчали популяцію з 416 пацієнтів із COVID‑19 та виявили 10-разове збільшення смертності серед осіб з ознаками ураження серця. Дослідники виділили три групи предикторів ураження серця і, відповідно, гіршого прогнозу [54]:
- епідеміологічні (старший вік, коморбідність);
- лабораторні (лейкоцитоз, СРБ, прокальцитонін, креатинкіназа, міогемоглобін, високочутливий тропонін І, NT-proBNP, аспартатамінотрансфераза та креатинін);
- радіологічні (множинні вогнища та симптом «матового скла»).
В інших дослідженнях підтвердилося, що підвищені рівні D-димеру, NT-pro-BNP і високочутливого тропоніну І чітко асоційовані з гострим ураженням серця та несприятливим прогнозом [38]. Нещодавно Argulian et al. на великій серії госпіталізованих випадків COVID‑19 виявили, що дилатація правого шлуночка серця за даними ехокардіографії корелює з більшою госпітальною смертністю [55].
Висока лихоманка під час звернення та задишка, що прогресує до дихальної недостатності, часто згадуються як маркери несприятливого прогнозу. Крім того, негативним чинником є мала загальна кількість лімфоцитів та, зокрема, Т-клітин ліній CD3 і CD4. Двобічна пневмонія порівняно із залученням однієї легені не асоційована з підвищеною смертністю за даними більшості досліджень. Проте Zhang et al. повідомляли, що мультилобарна пневмонія достовірно корелює з тяжким перебігом COVID‑19 та критичним станом хворих [56].
Лікування COVID‑19 та серцево-судинні засоби
Наразі немає схвалених специфічних ліків проти коронавірусу. Деякі препарати призначають поза межами офіційних показань на підставі даних обсерваційних досліджень для лікування пацієнтів із COVID‑19 з метою зменшення тяжкості перебігу, зокрема противірусні засоби прямої дії та спрямовані на підсилення противірусного захисту організму, імуномодулятори [57]. Крім того, низку препаратів вивчають у рандомізованих контрольованих дослідженнях, які найближчим часом підтвердять або спростують ефективність [58‑59]. Серед них протималярійні та протизапальні (хлорохін, гідроксихлорохін), противірусні засоби (ритонавір, лопінавір, ремдесивір), інгібітори ІЛ‑6 (тоцилізумаб, сарілумаб, силуксимаб), інтерферони, колхіцин, блокатори рецепторів ангіотензину ІІ (БРА) (лозартан) тощо. Розпочато вже понад 300 досліджень потенційних ліків від COVID‑19 [60], які в доклінічних експериментах виявили здатність блокувати окремі ланки життєвого циклу SARS (рис. 1).
Виділяють три основні цілі терапії COVID‑19 (рис. 2):
- Зменшити вірусне навантаження в ранню фазу, перші 7‑14 днів.
- Запобігти цитокіновому шторму і розвитку ГРДС, уникнути механічної вентиляції, за якої смертність сягає 50%.
- Знизити ризик розвитку серйозних тромбоемболічних ускладнень, які також загрожують життю.
Клінічний випадок № 2
Чоловік, 42 роки, з історією некомпактної кардіоміопатії та імплантованим кардіовертером-дефібрилятором для первинної профілактики раптової серцевої смерті 3.03.2020 переніс планову трансплантацію серця. У післяопераційному періоді за ним доглядали медичні сестри, які водночас доглядали за пацієнтом з нещодавно отриманим позитивним тестом на SARS-CoV‑2. Коли це прояснилося, хворому, який переніс трансплантацію, також призначили тестування, і 16.03.2020 був отриманий позитивний результат. У наступні дні в нього розвинулася коронавірусна пневмонія середньої тяжкості. З 10 контактних осіб не захворів жоден. Терапію кортикостероїдами продовжили в дозі 0,5 мг/кг, такролімус відмінили на час проведення 10-денного курсу противірусної терапії (лопінавір/ритонавір). Сироваткові рівні такролімусу знизилися з 20 до 15 нг/мл під час 10-денної паузи. Пацієнтові також були призначені гідроксихлорохін та азитроміцин. При цьому пролонгації інтервалу QT не відмічали. Чоловік одужав в умовах загальнотерапевтичної палати без потреби у вентиляційній підтримці і був виписаний з лікарні.
Висновки. Нозокоміальна інфекція SARS-CoV‑2 – нова реальність, яку не можна ігнорувати при плануванні кардіологічної/кардіохірургічної допомоги. Препарати, що застосовують для терапії SARS-CoV‑2, можуть вступати у фармакодинамічні та фармакокінетичні взаємодії з кардіологічними засобами, зокрема викликають пролонгацію інтервалу QT. У даному випадку модифікація імуносупресивної терапії після трансплантації дозволила провести курс противірусного лікування, який виявився безпечним для пацієнта.
Гідроксихлорохін у монотерапії або в комбінації з азитроміцином, лопінавір/ритонавір та ремдесивір найчастіше використовують при лікуванні COVID‑19, поки що без офіційних на те показань. Гідроксихлорохін та хлорохін поодинці або в поєданні з азитроміцином можуть підвищувати госпітальну смертність і ризик шлуночкової аритмії через побічний ефект пролонгації інтервалу QT, тому застосування цих засобів не рекомендоване, якщо це не клінічне дослідження [61‑63]. Комбінований препарат лопінавір/ритонавір також може подовжувати інтервал QT, вступає в потенційно небезпечні взаємодії, до того ж у рандомізованому клінічному випробуванні його ефективність не підтвердилася [64]. У разі застосування цих препаратів обов’язковим є електрокардіографічне моніторування ритму серця. Ремдесивір 1 травня цього року отримав схвалення від Управління з санітарного нагляду за якістю харчових продуктів та медикаментів США (FDA) для лікування підозрюваних або лабораторно підтверджених випадків COVID‑19 у дорослих і дітей, госпіталізованих із тяжким перебігом захворювання [65‑67].
На онлайн-сторінці Ліверпульського університету Великої Британії (www.covid19-druginteractions.org) періодично оновлюється інформація про взаємодії лікарських засобів, зокрема тих, які застосовують для терапії COVID‑19. Перевірити сумісність препаратів можна за кілька секунд, після введення їхніх назв або вибору зі списку [68].
Рутинне застосування системних кортикостероїдів із метою профілактики або лікування ГРДС у пацієнтів з COVID‑19 не рекомендоване, якщо тільки немає інших показань для їхнього призначення [69‑70]. За попередніми результатами досліджень із залученням інгібіторів ІЛ‑6 (тоцилізумаб) показано їхню ефективність у пацієнтів із тяжким або критичним перебігом COVID‑19 [71, 72]. Надалі кортикостероїди або інші протизапальні препарати доцільно застосовувати у межах клінічних досліджень. З урахуванням прокоагуляційного стану, спричиненого інфекцією SARS-CoV‑2, всім госпіталізованим пацієнтам рекомендовано проводити профілактику тромбоемболічних ускладнень шляхом призначення низькомолекулярних гепаринів у підшкірних ін’єкціях [73]. З огляду на ранні повідомлення про вищу смертність від COVID‑19 серед пацієнтів з АГ, були ініційовані (переважно ЗМІ) дискусії стосовно припинення антигіпертензивної терапії іАПФ та БРА через можливе підвищення ризику інфікування й тяжкості перебігу COVID‑19 [9, 35]. Проте наявні докази спростовують зв’язок приймання зазначених препаратів з імовірністю заразитися або смертністю від COVID‑19 [74‑77]. Рада з гіпертензії Європейського товариства кардіологів (ESC) 13 березня випустила офіційну заяву, в якій наполегливо рекомендує лікарям і пацієнтам продовжувати використання антигіпертензивних засобів у звичайних режимах [78].
Згодом спеціальна робоча група Європейського товариства гіпертензії (ESH) провела критичний огляд доступних доказів і дійшла висновку про відсутність несприятливого ефекту блокаторів ренін-ангіотензинової системи при COVID‑19 [79]. Окрім того, Zhang et al. повідомили про статистично значуще зниження смертності серед осіб з АГ, які приймали іАПФ або БРА на момент звернення, порівняно з іншими госпіталізованими з COVID‑19 пацієнтами, які мали АГ [80].
З огляду на сучасні знання про патогенез коронавірусної інфекції, деякі автори просувають ідею клінічних досліджень для підтвердження гіпотези про ефективність БРА та статинів у лікуванні тяжкого COVID‑19, аргументуючи це тим, що підвищення активності рецепторів АПФ‑2 може знижувати тяжкість перебігу ГРДС [81]. Наразі розпочато два дослідження за участю пацієнтів без АГ, в яких тестують лозартан [60].
На додаток, варто зазначити ще три аспекти ведення критично хворих, які можуть бути важливими для спеціалістів у галузі ССЗ в умовах епідемії COVID‑19. По-перше, з огляду на високу завантаженість стаціонарів та можливий дефіцит вентиляторів, слід за можливості уникати інтубації пацієнтів без COVID‑19. По-друге, гостре ураження легень при COVID‑19 необхідно диференціювати від ознак накопичення рідини в легенях при декомпенсованій СН, оскільки режим дворівневої вентиляції ВiPAP при COVID‑19 протипоказаний. По-третє, високопотоковий режим кисневої терапії через назальну канюлю слід застосовувати для мінімізації альвеолярного ураження, перш ніж перейти до інтубації. Тоді, коли неможливо обійтися без інтубації та механічної вентиляції, рекомендований щадний режим з відносно високим тиском у кінці видиху і низькими об’ємами [34, 69].
Протиепідемічна безпека у кардіологічних і кардіохірургічних відділеннях
Щойно зафіксовано перший випадок COVID‑19 у лікувальному закладі, виникає небезпека експоненціального поширення інфекції в закладі та районі обслуговування. Заходи стримування включають відстежування контактів інфікованої особи та введення карантину [82]. Всі інфіковані пацієнти мають носити маски. Ізоляція осіб із підтвердженою чи підозрюваною інфекцією в межах лікувального закладу є обов’язковою. Медичний персонал має навчитися правильному використанню індивідуальних захисних засобів (ІЗЗ) та обмежити непотрібні контакти і переміщення для запобігання поширенню інфекції серед інших пацієнтів та колег. Запобіжні заходи в межах закладу можуть посилюватися, наприклад, шляхом обов’язкового носіння хірургічних масок пацієнтами і персоналом без підозри на інфекцію, скасування всіх очних візитів тощо [82].
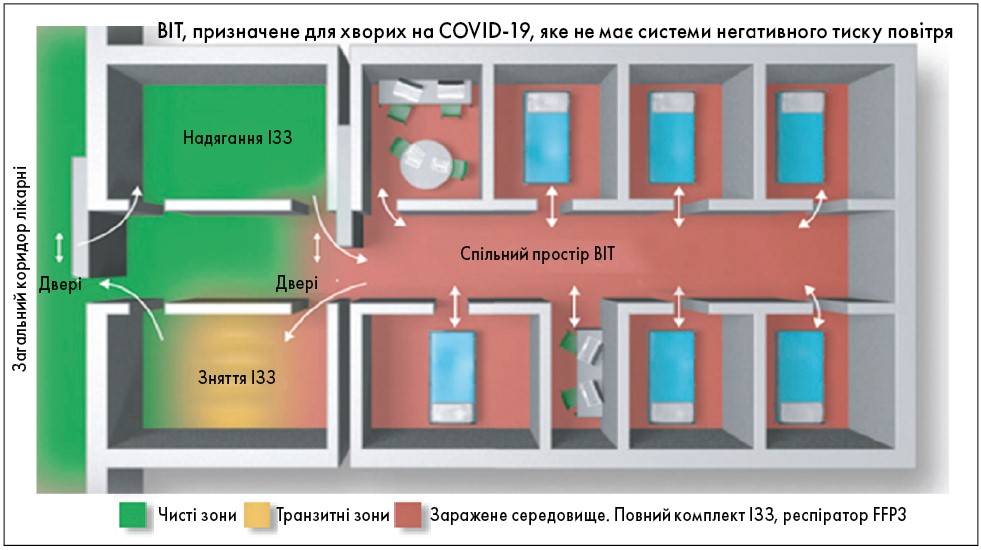
Важливими є часта дезінфекція поверхонь та миття рук із милом. ІЗЗ для медичного персоналу, що безпосередньо надає допомогу хворим на COVID‑19, має включати респіратори FFP3 (фільтрація 99% часточок у повітрі), хірургічні маски (тип IIR, захист від крапель), окуляри або щиток на обличчя, одноразові халати та рукавички. За відсутності FFP3 можна користуватися респіраторами FFP2 та N95 (фільтрація 94 і 95% часточок із повітря відповідно) [82, 83]. На додачу до обмеження контактів та крапельної передачі, доцільно обладнувати палати інтенсивної терапії, в яких перебувають хворі на COVID‑19, системами негативного тиску повітря для запобігання аерозольному поширенню вірусних часточок за межі відділення в умовно чисті зони лікарні.
Усі нетермінові рутинні процедури доцільно відкласти для обмеження відвідувань закладу. Для цього слід переглянути плани диспансерного спостереження, і з урахуванням поступового послаблення карантинних заходів рівномірно розподілити візити пацієнтів для запобігання скупченню відвідувачів. Щоб компенсувати скасовані візити і не пропустити випадків, які потребують невідкладної допомоги, необхідно максимально використовувати можливості телемедицини. В лікувальних закладах доцільно запроваджувати поділ на «чисті» та «забруднені» зони [84, 85]. В останніх мають перебувати пацієнти з подозрою на інфекцію або ті, що мали контакт з інфікованими особами. Також в умовно забрудненій зоні рекомендовано розташовувати приміщення для проведення всіх невідкладних процедур, вважаючи таких пацієнтів умовно інфікованими.
Операційні, катетерні та електрофізіологічні лабораторії
Швидкий доступ хворих до інвазивного лікування ST-інфаркту лишається пріоритетним завданням кардіологічної служби. Затримки у наданні екстреної допомоги через очікування результатів скринінгового тестування на SARS-CoV‑2 не можна вважати належною практикою. Те саме стосується надання допомоги при невідкладних СС-станах у пацієнтів із підтвердженим або підозрюваним COVID‑19. За можливості, інвазивні процедури слід відтермінувати, замінивши їх консервативним лікуванням, якщо не очікується, що це погіршить стан хворого. Рекомендовано звести до мінімуму переміщення пацієнтів у межах лікувального закладу, натомість усі необхідні діагностичні тести та процедури проводити біля ліжка.
При зупинці серця у пацієнта із COVID‑19 всі медичні працівники, які беруть участь у реанімаційних заходах, мають використовувати ІЗЗ. Слід уникати тривалої вентиляції через маску задля зменшення об’єму контамінованого аерозолю, що надходить у повітря. Зменшити контакт із хворим допомагають пристрої для автоматичної компресії грудної клітки. Інтубацію та компресії можна виконувати лише після того, як персонал буде належним чином екіпірований ІЗЗ [89].
На рисунку 3 показано рекомендовану організацію ВІТ для хворих на COVID‑19.
Клінічний випадок № 3
Чоловік, 65 років, був госпіталізований із ST-інфарктом міокарда 11.03.2020. Ургентна ангіографія показала критичний стеноз проксимальної частини передньої низхідної гілки лівої коронарної артерії. У катетерній лабораторії виконане інтервенційне втручання, встановлений стент із лікарським покриттям. 19.03.2020 у пацієнта розвинулася пневмонія COVID‑19 середньої тяжкості. Встановлено 20 осіб медперсоналу, які контактували із хворим під час перебування у кардіологічному відділенні, але не зафіксовано жодного випадку інфікування. Пацієнт одужав і був виписаний на 14-й день. Проте впродовж наступних днів на COVID‑19 захворіли три члени бригади катетерної лабораторії.
Висновки. Якщо в ургентних випадках (до яких відноситься ГКС) тестування на SARS-CoV‑2 не може бути виконане швидко, медичний персонал при наданні допомоги має застосовувати належні засоби індивідуального захисту, вважаючи хворого інфікованим, доки це не буде спростовано. До того ж слід пам’ятати, що ГКС може бути спричинений захворюванням COVID‑19. Бажано, щоб операційна або лабораторія інвазивних втручань для осіб із COVID‑19 мала систему негативного тиску, окремий вхід і знаходилася подалі від інших операційних [86].
Кардіохірургія під загрозою COVID‑19
Питання операбельності кардіологічних хворих, вибору тактики та оптимізації розподілу ресурсів кардіохірургічної служби під час пандемії залишаються дискусійними і мало вивчені. Затримка виконання необхідних втручань при невідкладних станах, що загрожують життю, не може бути виправдана, доки обмежувальні критерії (наприклад, на прийом хворих до ВІТ) не будуть застосовані до всієї системи охорони здоров’я. На щастя, в сучасній практиці більшість осіб із тяжкими формами захворювань серця можуть пережити затримку від тижнів до місяців завдяки оптимальній медикаментозній терапії.
Необхідний частий перегляд показників зайнятості ліжок та доступу до ресурсів, щоб вчасно перерозподіляти пацієнтів. В осіб із невідкладними станами, які не можуть чекати (здебільшого через нестабільну ішемічну хворобу серця), можна надавати пріоритет альтернативним методам лікування незважаючи на рекомендації. Через очікуваний ризик ускладнень в умовах пандемії доцільно тимчасово призупинити програми планової трансплантації серця.
Підготував Сергій Романюк
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 3 (70) 2020 р.