9 вересня, 2020
Побічні ефекти терапії глюкокортикоїдами
.jpg) У 2007 році робоча група Європейської протиревматичної ліги (EULAR) опублікувала рекомендації з менеджменту системної терапії глюкокортикоїдами (ГК) при ревматичних захворюваннях і визначила такі їхні основні побічні дії: серцево-судинні, ендокринні, дерматологічні й офтальмологічні захворювання, інфекції, психологічні розлади, патологія шлунково-кишкового тракту й опорно-рухового апарату (включаючи остеопороз).
У 2007 році робоча група Європейської протиревматичної ліги (EULAR) опублікувала рекомендації з менеджменту системної терапії глюкокортикоїдами (ГК) при ревматичних захворюваннях і визначила такі їхні основні побічні дії: серцево-судинні, ендокринні, дерматологічні й офтальмологічні захворювання, інфекції, психологічні розлади, патологія шлунково-кишкового тракту й опорно-рухового апарату (включаючи остеопороз).
Відомо, що всі побічні ефекти ГК є дозозалежними; потенційно їх можливо уникнути за рахунок раціонального підбору дози. Проте наразі питання визначення порогової дози та терміну прийому ГК, коли користь перевищує ризик, залишається невирішеним. У метааналізі результатів рандомізованих клінічних досліджень (РКД), опублікованому 2009 року (Hoes J., 2009), кількість побічних реакцій у разі прийому ГК у дозі <30 мг/добу в пацієнтів із ревматоїдним артритом (РА) становила 43/100 пацієнто-років (95% довірчий інтервал (ДІ) 30-55). Інший метааналіз, також опублікований у 2009 році, об’єднав результати 6 РКД, порівнюючи низькі дози ГК (5-10 мг/добу) з плацебо (Ravindran V., 2009). Відповідно до цього метааналізу, групи не відрізнялися за будь-якими побічними реакціями. За даними 11-річного спостереження за пацієнтами в дослідженні COBRA, захворюваність на артеріальну гіпертензію та цукровий діабет (ЦД) була вищою в групі, котра отримувала метотрексат (МТХ) + сульфасалазин (ССЗ) + преднізолон порівняно з монотерапією ССЗ, але частота серцево-судинних захворювань була однаковою між двома групами (van Tuyl L., 2010).
Семирічне дослідження французької когорти хворих на ранній артрит (ESPOIR) не виявило надмірного ризику розвитку ускладнень у разі прийому низьких доз ГК (середня доза – 3,1±2,9 мг/добу). Зареєстровано лише несуттєві чисельні відмінності кількості серцево-судинних подій, інфекцій та остеопоротичних переломів серед пацієнтів, які отримували дуже низькі дози ГК, порівняно з тими, хто ніколи не отримував ГК.
Вплив ГК на серцево-судинні захворювання та смертність
Уже понад 20 років у світовій літературі дискутується питання скорочення тривалості життя у хворих на РА (порівняно із загальною популяцією) переважно за рахунок серцево-судинної токсичності ГК (Wei L., 2004; Davis J., 2007). Американськими дослідниками було вивчено асоціацію між показниками загальної та серцево-судинної смертності залежно від добової та кумулятивної дози преднізолону (Inmaculada del Rincon, 2014). Протягом 5-річного (з 1996 по 2001 рік) спостереження за 779 хворими на РА було зареєстровано 237 летальних випадків, що дорівнює показнику загальної смертності 3,2 на 100 пацієнто-років (95% ДI 2,8-3,7), де серцево-судинна смертність становила 1,8 (95% ДI 1,5-2,1) пацієнто-років. Порівняно з тими, хто не приймав ГК, підвищення смертності було зареєстровано в разі прийому преднізолону в дозі 8-15 мг/добу (відносний ризик (ВР) 1,78; 95% ДІ 1,22-2,60) та було дозозалежним, де ВР зростав на 1,07 (95% ДI 1,05-1,08) на кожен міліграм преднізолону на добу. Мінімальна кумулятивна доза, котра спричиняла зростання загальної смертності, дорівнювала 40 г (ВР 1,74; 95% ДІ 1,25-2,44) зі зростанням ВР для загальної смертності на 1,12 (95% ДI 1,10-1,14) на кожен грам прийому ГК на рік і 1,16 для показника серцево-судинної смертності (95% ДІ 1,12-1,19). Кумулятивна доза в 40 г є реальною для багатьох пацієнтів із РА та потребує прийому 5 мг преднізолону щоденно протягом 20 років.
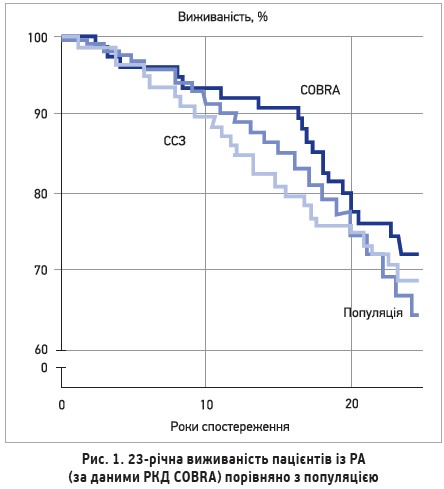 Однак результати 23-річного спостереження за хворими на ранній РА, котрі брали участь у дослідженні COBRA, продемонстрували зниження смертності нижче за популяційний рівень за рахунок раннього агресивного лікування «до досягнення мети» (рис. 1). Пацієнти із середньою тривалістю хвороби в 4 міс отримували в одній групі монотерапію ССЗ, а в другій – комбіновану терапію ССЗ (2 г/добу), МТХ (7,5 мг/тиж) і преднізолоном 60 мг/добу зі зниженням до 7,5 мг/добу протягом 7 тиж і відміною через 28 тиж. На основі даних дослідження було виокремлено 5 факторів, які суттєво впливали на підвищення смертності: ступінь рентгенологічного прогресування через 28 тиж лікування; високий рівень функціональної недостатності (за індексом HAQ); швидкопрогресивний перебіг артриту та наявність антигенів HLA-DR2 або 3.
Однак результати 23-річного спостереження за хворими на ранній РА, котрі брали участь у дослідженні COBRA, продемонстрували зниження смертності нижче за популяційний рівень за рахунок раннього агресивного лікування «до досягнення мети» (рис. 1). Пацієнти із середньою тривалістю хвороби в 4 міс отримували в одній групі монотерапію ССЗ, а в другій – комбіновану терапію ССЗ (2 г/добу), МТХ (7,5 мг/тиж) і преднізолоном 60 мг/добу зі зниженням до 7,5 мг/добу протягом 7 тиж і відміною через 28 тиж. На основі даних дослідження було виокремлено 5 факторів, які суттєво впливали на підвищення смертності: ступінь рентгенологічного прогресування через 28 тиж лікування; високий рівень функціональної недостатності (за індексом HAQ); швидкопрогресивний перебіг артриту та наявність антигенів HLA-DR2 або 3.
Спостереження майже 10 тис. пацієнтів із бази даних національної статистики Великої Британії протягом 5 років показало, що прийом ГК у пацієнтів із РА в поєднанні з ЦД підвищує ВР смертності в 4,4 раза порівняно з тими, хто не приймав ГК (95% ДІ 3,83-5,14). За даними тієї самої бази, вірогідність призначення ГК у разі поєднання РА з ЦД була втричі нижчою, ніж за відсутності ЦД у пацієнтів із РА. Доцільно зазначити, що пацієнти з РА, котрі мали ЦД, були старшого віку (з ЦД – 64 роки vs без ЦД – 59 років), переважно чоловічої статі (з ЦД – 37% vs без ЦД – 30%), мали в анамнезі ожиріння (з ЦД – 30% vs без ЦД – 27%) і курили (з ЦД – 58% vs без ЦД – 50%), частіше приймали ГК (із ЦД – 31% vs без ЦД – 23%) і мали значно більшу кількість макроваскулярних захворювань (із ЦД – 11% vs без ЦД – 4%).
Необхідно зазначити, що ГК-індукований ЦД має деякі особливості діагностики. Зважаючи на те що рівень глюкози підвищується через 4-6 год після прийому ГК і триває 13-16 год, дослідження глюкози натще не є інформативним (Eur. J. Rheumatol., 2018).
Для діагностики слід використовувати:
- рівень глюкози ≥11 ммоль/л при вибірковому визначенні (12:00 / 2 год після їди);
- глюкозотолерантний тест (2 год після їди глюкоза ≥11 ммоль/л);
- глюкоза натще ≥6,99 ммоль/л;
- HbA1c ≥6,5%.
ГК-індукована наднирникова недостатність
Останніми роками проблема ГК-індукованої наднирникової недостатності (НН) привертає увагу медичної спільноти. Серед ревматологічних хворих, які приймають ГК, розповсюдженість НН варіює від 14 до 63%. Її симптоми неспецифічні та в більшості випадків складаються зі втоми, нудоти, анорексії та втрати ваги, що часто трактується як загострення основного захворювання й зумовлює підвищення дози ГК. Особливістю перебігу ГК-індукованої НН є відсутність мінералокортикоїдної недостатності та (нерідко) наявних симптомів синдрому Кушинга.
Клінічний випадок, опублікований у 2019 році в журналі Indian Pediatrics, демонструє складнощі діагностики цього патологічного стану. У хворого 14 років з ювенільним ідіопатичним артритом, який протягом 3 років додатково до базисної терапії МТХ, ССЗ й адалімумабом отримував метилпреднізолон (МП) у дозі 80 мг 1 раз на 2-3 міс внутрішньосуглобово (в/с), з’явилися транзиторні епізоди значної втоми, гарячки до 39 °C, нудоти та болю в животі. Під час ретельного збору анамнезу було встановлено, що зазначені епізоди виникають через 4-5 тиж після в/с уведення МП. Пацієнт не мав відхилень зросту та розвитку, а також ознак синдрому Кушинга. За допомогою тесту із синактеном було діагностовано НН, відмінено в/с уведення МП і призначено гідрокортизон у дозі 10 мг 3 р/добу в перший день епізоду, що сприяло нормалізації показників тесту із синактеном.
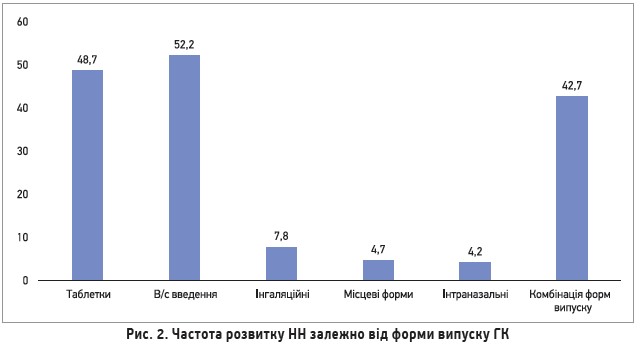
Згідно з наймасштабнішим метааналізом (1975-2014) щодо оцінки частоти розвитку НН під час прийому ГК при різних захворюваннях (онкологічні, дерматологічні, РА, запальні захворювання кишечнику, алергологічні та трансплантологія), 32% пацієнтів мали НН за даними тесту з адренокортикотропним гормоном (АКТГ) через 24 год після останнього прийому ГК, із них клінічні ознаки спостерігалися лише у 2% (J. Clin. Endocrinol. Metab., 2015). Найчастіше розвиток НН зареєстровано після в/с уведення (рис. 2). Відновлення функції наднирників за даними повторного тесту з АКТГ відбувалося менш ніж у половини пацієнтів через 1-6 міс. Дослідники зазначили, що всім пацієнтам із незрозумілими симптомами після відміни ГК необхідно проводити тести для діагностики НН і за потреби призначати замісну терапію гідрокортизоном.
За даними Karangizi та співавт. (2019), 46,3% пацієнтів з ураженням нирок при люпус-нефриті, АНЦА-асоційованих васкулітах і гломерулонефриті мали НН за даними тесту із синактеном без будь-яких клінічних проявів. Відновлення функції наднирників за даними повторного тесту із синактеном відбувалося від 8,7±4,6 (50% хворих) до 15,9±9,2 міс (50% хворих) й іноді тривало понад 3 роки. Аналізуючи такі фактори, як стать, вік, тривалість і дози ГК, наявність пульс-терапії, ступінь ураження нирок, не було встановлено жодного клінічного предиктора розвитку НН. Предиктором розвитку НН із чутливістю 100% виявився базальний рівень сироваткового кортизолу ≤119,5 нмоль/л за умови забору лабораторних зразків не пізніше 10-ї години ранку. Використання порогових значень кортизолу, на думку дослідників, дає можливість уникнути тесту із синактеном у 30% пацієнтів. Через відсутність в Україні можливості проводити тест із синактеном і складнощі при проведенні тесту з АКТГ визначення ранкового кортизолу перед початком зниження дози ГК у пацієнтів із підозрою на розвиток НН може бути доцільним для практичної медицини.
НН розвивається не лише при використанні великих доз, а й у разі прийому преднізолону в дозі <5 мг/добу коротким терміном (<4 тиж) із повільною відміною (Joseph R., 2016).
Саме тому Інститутом здоров’я Великої Британії було розроблено рекомендації (2013) щодо відміни ГК.
Повільна відміна здійснюється в разі:
- прийому ГК у дозі ≥40 мг/добу ≥1 тиж;
- багаторазового прийому ГК у вечірній час;
- прийому ГК у будь-якій дозі >3 тиж;
- прийому коротких курсів ГК протягом року після відміни ГК при попередньому довгостроковому застосуванні;
- наявності факторів ризику НН.
Після досягнення дози 7,5 мг/добу подальше зниження необхідно здійснювати повільно, приділяючи особливу увагу розвитку симптомів НН й освіті пацієнтів щодо своєчасного звернення до лікаря для діагностики та лікування НН під час зниження дози та після відміни ГК.
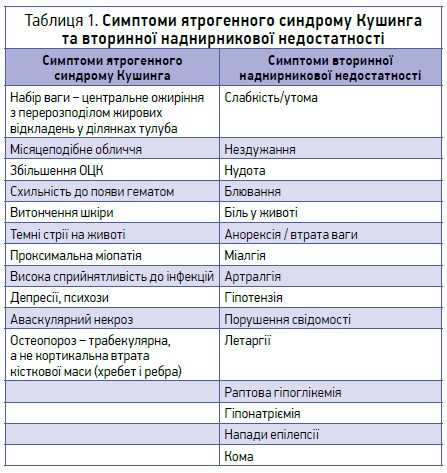
Механізм розвитку НН реалізується через патогенез синдрому Кушинга. Симптоми НН порівняно з клінічними проявами синдрому Кушинга наведено в таблиці 1 (Clinical Medicine, 2016).
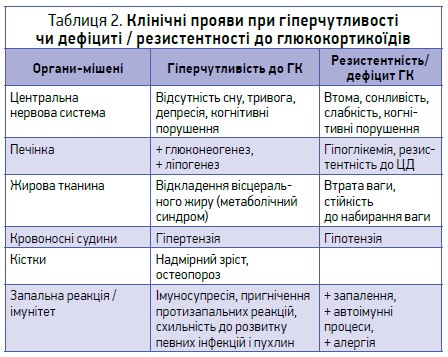
У таблиці 2 наведено клінічні ознаки гіперчутливості та резистентності до ГК, що зумовлює розвиток побічних реакцій з одного боку й неефективність ГК – з іншого.
ГК-індукована міопатія
Уперше ГК-індукована міопатія була описана в 1932 році Харві Кушингом у рамках клінічної картини однойменного синдрому (Cushing H., 1932).
Для ГК-індукованої міопатії характерні м’язова слабкість без больового синдрому, втома й атрофія м’язів; вона може розвиватися в гострій і хронічній формах як на етапі індукції ремісії, так і у фазі підтримувального лікування, а також у разі підвищення дози за умови загострення. Факторами ризику є призначення ГК пацієнтам похилого віку, з онкологічними захворюваннями, ураженням респіраторних м’язів, гіпопротеїнемією й обмеженими фізичними можливостями. Частіше НН розвивається в разі призначення фторованих ГК (дескаметазон, бетаментазон, тріамцинолон), аніж преднізолону та МП. Доза ГК, яка індукує розвиток ГК-міопатії, є індивідуальною. У деяких пацієнтів м’язова слабкість може розвинутися в разі прийому низьких доз, тоді як тривалий прийом великих доз може не супроводжуватися стероїдною міопатією. Після проведення пульс-терапії МП розвиток раптової м’язової слабкості було описано лише в стресових ситуаціях, як-от спінальна травма чи респіраторний дистрес-синдром.
Гостра форма найчастіше розвивається під час перебування пацієнта у відділенні інтенсивної терапії з приводу сепсису або інших станів, які лікуються великими дозами ГК. Характеризується швидкопрогресивною слабкістю проксимальних і дистальних м’язів (іноді із залученням респіраторних м’язів і багатомісячним періодом відновлення).
При хронічній формі до патологічного процесу залучаються переважно проксимальні відділи скелету, а саме м’язи тазового поясу. Значно рідше вражаються дистальні відділи. Хронічна міопатія спричиняє значну атрофію м’язів із тривалим періодом відновлення. Важливо зазначити, що ГК-індукована міопатія може бути ізольованою за відсутності інших клінічних проявів синдрому Кушинга.
На відміну від запальних міопатій лабораторні маркери не мають діагностичного значення. Рівень трансаміназ зазвичай залишається в межах норми, при гострих формах рівень креатинкінази може підвищуватися на 50%. На початку захворювання показники електронейроміографії залишаються в нормі, натомість на пізніших стадіях реєструється міопатичний патерн із наявністю короткочасних поліфазних потенціалів низької амплітуди та відсутністю спонтанної активності під час уведення голки. За результатами біопсії м’язів виявляються неспецифічна атрофія м’язових волокон IIb типу, відсутність запальних інфільтратів, а також явища некрозу (значно рідше).
Особливі складнощі в диференційній діагностиці ГК-індукованої міопатії з основним захворюванням виникають під час лікування запальних міопатій високими дозами ГК. Зазвичай неможливо відрізнити загострення дерматополіміозиту від розвитку стероїдної міопатії.
Після виникнення ГК-індукованої міопатії ГК необхідно відмінити чи знизити дозу, якщо стан пацієнта дозволяє. Якщо пацієнт отримує дексаметазон або будь-які інші фторовані ГК, необхідно замінити їх на преднізолон/МП у мінімально ефективній дозі. Відновлення м’язової сили після відміни ГК починається через 4 тиж. Специфічного лікування стероїдної міопатії не існує. В експериментальних дослідженнях було показано ефективність амінокислот із розгалуженим ланцюгом (BCCAs, які використовують для спортивного харчування), креатину, глутаміну, DHEA й аеробних і силових фізичних вправ.
Ускладнення ГК-терапії в пацієнтів похилого віку
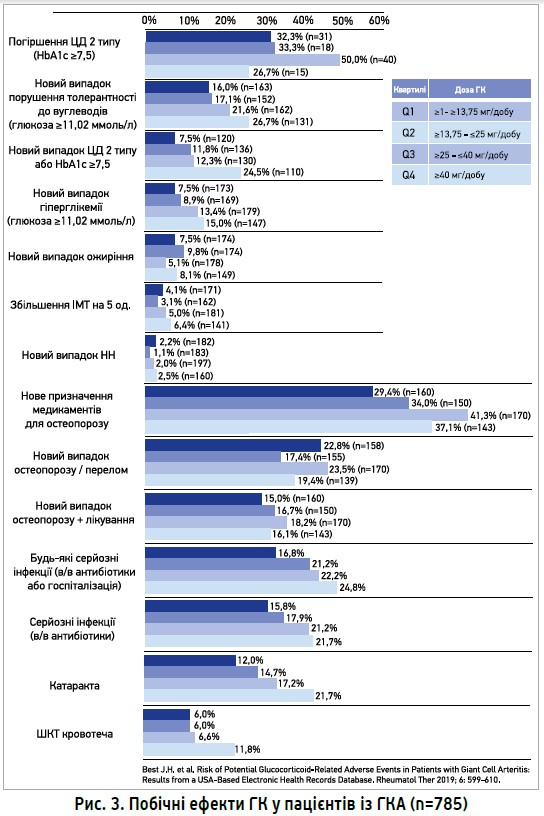 У 2019 році британськими й американськими дослідниками було опубліковано результати оцінки ризику інфекційних ускладнень при тривалому спостереженні за пацієнтами з ревматичною поліміалгією (РПМ) і гігантоклітинним артеріїтом (ГКА). Згідно з протоколами лікування цих захворювань, ГК використовуються у великих і середніх дозах (переважно в монотерапії), потребують тривалого прийому та призначаються пацієнтам похилого віку.
У 2019 році британськими й американськими дослідниками було опубліковано результати оцінки ризику інфекційних ускладнень при тривалому спостереженні за пацієнтами з ревматичною поліміалгією (РПМ) і гігантоклітинним артеріїтом (ГКА). Згідно з протоколами лікування цих захворювань, ГК використовуються у великих і середніх дозах (переважно в монотерапії), потребують тривалого прийому та призначаються пацієнтам похилого віку.
За даними 20-річного (1998-2017) спостереження, майже в 40 тис. пацієнтів із РПМ і ГКА кумулятивний ризик усіх інфекцій через 1 рік лікування становив 18,3%, через 5 років – 54,7% і через 10 – 76,9% (Jianhua Wu, 2019). Найчастіше спостерігалися інфекції респіраторного тракту (27,3%), кон’юнктивіти (8,6%) і herpes zoster (7,4%). Частота бактеріальних, вірусних і фунгальних інфекцій була зіставною, тоді як паразитарні інфекції розвивалися в 4-5 разів рідше.
Загалом 22 234 (55,7%) хворих мали щонайменше одну інфекцію протягом 5-річного спостереження, серед яких 5937 (26,7%) потребували госпіталізації, а 1616 (7,3%) померли через 7 днів після встановлення діагнозу, причиною чого стали пневмонія (52,6%), інфекції сечовивідних шляхів (3,0%) і перитоніт (2,2%).
Ризик розвитку інфекцій був дозозалежним і коливався від 1,3 у разі прийому преднізолону ≤5 мг/добу до 2,3, коли доза перевищувала 25 мг/добу; також ВР зростав на 1,5 на кожні 1000 мг протягом року, що особливо необхідно брати до уваги при плануванні та проведенні пульс-терапії. Частота інфекційних ускладнень не залежала від віку, тривалості основного захворювання, наявності супутніх станів і вакцинації й істотно збільшувалася при використанні будь-яких парентеральних ГК.
За даними проспективного когортного дослідження (2006-2016) з використанням американської електронної бази даних (USA-Based Electronic Health Records Database), частота серйозних інфекцій у пацієнтів із ГКА становила 16,8-24,8% у разі прийому преднізолону в середній дозі 28,9 мг/добу протягом перших 6 міс лікування (Best J., 2019). Однак перше місце серед ускладнень ГК-терапії в пацієнтів віком >50 років посідали метаболічні розлади у вигляді розвитку чи погіршення ЦД й остеопорозу (рис. 3). Середньодобова доза ГК >40 мг вірогідно корелювала з уперше виявленим ЦД 2 типу (24,5% пацієнтів), гіперглікемією (15%) та порушенням толерантності до глюкози (26,7%). Підвищення кумулятивної дози на кожен грам протягом 1 року (щоденний прийом 2,5 мг преднізолону протягом року) зумовлює підвищення ВР розвитку порушення толерантності до вуглеводів на 7-14% і ЦД на 12%. Погіршення перебігу вже наявного ЦД відбувалося в 50% хворих, але чіткої залежності від дози ГК не зареєстровано.
Варто зазначити, що частота ожиріння не перевищувала 10% і не залежала від дози ГК. Цей факт може бути пов’язаний із високою запальною активністю хвороби та переважанням катаболічних процесів на початку захворювання, що зумовлює втрату ваги.
Висновки
На довгострокову безпечність ГК впливають як добова доза, так і кумулятивна, а також тривалість застосування, тому в терапії ревматологічних захворювань ГК слід використовувати в мінімально ефективній дозі та найкоротшим терміном. При тривалій (≥6 міс) терапії ГК дозу ≤5 мг/добу експертами EULAR визначено як адекватну з огляду на ризик розвитку серцево-судинних ускладнень, гіперглікемії/діабету, остеопорозу й інфекцій для переважної більшості пацієнтів, але індивідуальний ризик необхідно оцінювати з урахуванням особливостей пацієнта (Strehl C., 2016). Дворічне прагматичне дослідження GLORIA, спрямоване на оцінку ефективності та безпечності застосування преднізолону в дозі 5 мг/добу в пацієнтів з РА віком >65 років, яке має завершитися у 2021 році, може надати додаткові докази щодо підтвердження безпечності цієї дози (Hartman L., 2018).
На сучасному етапі кожне призначення ГК необхідно проводити з огляду на баланс ризик/користь шляхом спільного рішення лікаря та пацієнта на основі наданої пацієнту докладної інформації.
Список літератури знаходиться в редакції.
Стаття друкується за підтримки
Представництва Пфайзер Експорт Бі Ві в Україні.
Медична газета «Здоров’я України 21 сторіччя» № 13-14 (481-482), 2020 р.