9 вересня, 2020
Ураты и когнитивное здоровье: до какого уровня безопасно снижать концентрацию мочевой кислоты?
 Мочевая кислота (МК) является конечным продуктом обмена пуриновых оснований в организме человека и образуется путем катализа при участии фермента ксантиноксидазы. В этом обзоре литературы обобщены современная информация и последние научные сведения о корреляции между МК и когнитивной функцией, которые оказались весьма противоречивы. Также обсуждаются потенциальные механизмы, которые могли бы объяснить это взаимодействие, возможную роль диеты и будущие направления исследований для улучшения текущих знаний.
Мочевая кислота (МК) является конечным продуктом обмена пуриновых оснований в организме человека и образуется путем катализа при участии фермента ксантиноксидазы. В этом обзоре литературы обобщены современная информация и последние научные сведения о корреляции между МК и когнитивной функцией, которые оказались весьма противоречивы. Также обсуждаются потенциальные механизмы, которые могли бы объяснить это взаимодействие, возможную роль диеты и будущие направления исследований для улучшения текущих знаний.
Уровень мочевой кислоты в сыворотке крови (сМК) определяется балансом между количеством потребленных в диете пуринов, почечной экскрецией МК и активностью ксантиноксидазы. Стойкая гиперурикемия характеризуется повышенными уровнями сМК >360 мкмоль/л (6 мг/дл) при повторных измерениях. Она может привести к отложениям кристаллов моноурата натрия и возникновению такого заболевания, как подагра – ведущей причины воспалительного артрита в развитых странах [7].
Целью лечения подагры, как указано в современных международных рекомендациях, является долгосрочное уменьшение концентрации сМК <360 ммоль/л, в тяжелых случаях (полиартикулярное поражение, наличие тофусов) – ниже 300 ммоль/л [27]. Кроме того, недавние доказательные данные свидетельствуют о том, что эффекты гиперурикемии выходят за рамки классических подагрических проявлений. Было продемонстрировано, что пациенты с гиперурикемией имеют повышенный кардиоваскулярный риск (КВР) независимо от других факторов риска, таких как гипертония и сахарный диабет [7]. В свою очередь гиперурикемия считается возможным независимым фактором КВР, даже когда сМК находится на высоком нормальном уровне. По этой причине коррекция высоких нормальных уровней сМК имеет решающее значение для оптимального управления КВР [7].
С другой стороны, учитывая важные антиоксидантные свойства МК, поддержание слишком низкого уровня сМК в долгосрочной перспективе может, наоборот, подвергать пациентов с подагрой повышенному окислительному стрессу и связанным с ним расстройствам. В частности, были подняты вопросы о предполагаемой обратной связи между концентрацией сМК и нейродегенеративными заболеваниями. Также обсуждается, существует ли корреляция между сМК и когнитивной функцией в зависимости от типа деменции – болезни Альцгеймера (БА), болезни Паркинсона (БП) или сосудистой деменции.
МК и БА
В семи крупных когортных исследованиях оценивали влияние уровня сМК на риск возникновения деменции. Стоит отметить, что полученные результаты несколько неоднородны и противоречат друг другу.
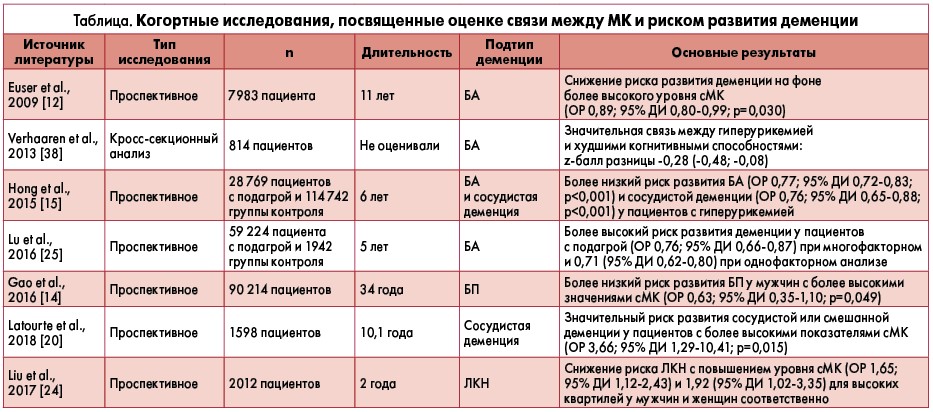
- Проспективное исследование (2009) включало 4618 участников 55 лет (61% женщин; средний возраст ± стандартное отклонение (СО): 69,4±8,6 года при среднем ± СО концентрации сМК 322,3±80,5 мкмоль/л). Было обнаружено снижение риска деменции у лиц с большим содержанием сМК после корректировки по факторам риска возникновения сердечно-сосудистых заболеваний: отношение рисков (ОР) 0,89; 95% доверительный интервал (ДИ) 0,80‑0,99; р=0,030 [12]. Среди 1724 пациентов, у которых не развилась деменция в течения периода наблюдения (в среднем 11,1 года), авторы наблюдали лучшие когнитивные функции у лиц с более высокими уровнями сМК. Это свидетельствует о том, что повышенное содержание сМК связано с улучшением когнитивных функций и снижением риска развития деменции независимо от КВР [12].
- В рамках кросс-секционного исследования Rotterdam Scan (2013) у 814 пациентов (средний возраст – 62 года) были выполнены магнитно-резонансная томография (МРТ) и нейропсихологические тесты. Авторы обнаружили достоверную и статистически значимую связь между гиперурикемией и уменьшением атрофии белого вещества мозга [38]. Полученные данные указывают на потенциальную роль гиперурикемии в стратификации степени когнитивных нарушений. Будущие исследования позволят оценить, может ли изменение уровней сМК повлиять на долговременные результаты МРТ.
- 3. Исследование, проведенное J.Y. Hong et al. (2015), включало 28 769 пациентов с подагрой, несосудистой (включая БА) и сосудистой деменцией, а также 114 742 лиц аналогичной контрольной группы (средний возраст – 63,5±9,7 года для обеих групп) [15]. В течение 6-летнего наблюдения у 1214 больных подагрой и 5905 – без подагры развилась деменция (в 102 и 542 случаях – БА соответственно). После коррекции по возрасту, полу и сопутствующим заболеваниям авторы обнаружили меньшую вероятность возникновения несосудистой деменции (в том числе БА) у лиц с гиперурикемией (ОР 0,77; 95% ДИ 0,72‑0,83; р<0,001) [15]. Снижение риска деменции, ассоциированного с гиперурикемией, вызывает некоторые сомнения относительно реальной необходимости уменьшать концентрацию сМК у всех категорий пациентов в связи с ее возможными протективными когнитивными функциями.
- Полученные J.Y. Hong et al. (2015) результаты были подтверждены в другом исследовании N. Lu et al. (2016), в котором также принимали участие лица с/без подагры. Обследовав пациентов из Великобритании, авторы обнаружили, что ОР развития БА среди подагрических больных составляет 0,76 (95% ДИ 0,66‑0,87) при многомерном и 0,71 (95% ДИ 0,62‑0,80) при одномерном анализе соответственно, что было ниже, чем у лиц без подагры с нормоурикемией – 0,86 (95% ДИ 0,76‑0,97) [25].
- Обратная связь между сМК и риском развития БА также была подтверждена в метаанализе N. Du et al. (2016). Ученые проанализировали 21 случай-контроль из трех когортных исследований (общее количество участников – 10 953). Пациенты с БА продемонстрировали более низкие уровни сМК, чем группа контроля (взвешенная разность средних – 0,77 мг/дл; 95% ДИ 2,28‑0,36; р=0,0002), а более высокие показатели сМК были связаны со значительным уменьшением риска БА (ОР 0,66; 95% ДИ 0,52‑0,85; р=0,001), подтверждая гипотезу о нейропротективной роли сМК [11].
- Еще в одном метаанализе 11 исследований, в которых сравнивали концентрацию сМК у лиц с БА и здоровых субъектов группы контроля (n=2708), не было обнаружено статистически значимой разницы в уровнях этого предполагаемого маркера (среднее абсолютное отклонение (САО) -0,50; 95% ДИ 1,23‑0,22) [8]. Однако авторы отметили значительную неоднородность данных в отдельных исследованиях и относительно высокий риск систематической ошибки для большинства включенных пациентов из-за гетерогенности данных по расе, среднему возрасту, размерам выборки и пр.
- Недавний метаанализ включал 46 исследований (n=16 688), касавшихся всех причин слабоумия и 22 – диагностики БА. Результаты показали более низкие значения сМК у пациентов с деменцией (САО -0,33; 95% ДИ; р<0,001), при более сильной ассоциации между сМК и БА по сравнению с теми, кто страдал БП (САО -0,33; 95% ДИ; p<0,001 и 0,67; 95% ДИ; p<0,001 соответственно). Эти данные могут указывать на нейропротективную роль МК в когнитивном снижении, демонстрируя более четкую связь с БА. Однако это утверждение также подвергнуто сомнению, поскольку не было обнаружено корреляции между краткой шкалой оценки психического статуса (MMSE) и уровнями сМК (r=0,08; р=0,27), за исключением подгруппы лиц с БП (r=0,16; р=0,003) [17].
МК и деменция при БП
Хотя в более ранних исследованиях не было обнаружено существенных различий в уровнях сМК у пациентов с БП и здоровых людей, нейропротективное влияние МК установили позже [2]. Первый метаанализ, включавший шесть исследований при участии 33 185 субъектов, выявил снижение частоты возникновения БП у пациентов с более высокими концентрациями сМК (ОР 0,67; 95% ДИ 0,50‑0,91). Анализ подгруппы подтвердил значимую нейропротективную роль сМК, возможно, благодаря ее антиоксидантному эффекту, но только у мужчин (ОР 0,60; 95% ДИ 0,40‑0,90) [33].
Недавний метаанализ семи исследований продемонстрировал более низкие значения сМК у пациентов с БП, чем в группе контроля (САО -0,67; 95% ДИ; р=0,001). Авторы также зафиксировали положительную корреляцию между уровнями сМК и баллами по шкале краткой оценки когнитивных функций (BACS) (r=0,155; p=0,003) [17]. При проведении анализа не было обнаружено значимой систематической ошибки, и полученные результаты подтверждают положительное влияние сМК на когнитивную функцию при БП.
Традиционно БП считается необратимым расстройством. Однако указанные выше результаты свидетельствуют о положительном влиянии сМК на нейродегенеративные процессы и возможность получения обратимых эффектов путем модулирования уровней сМК [17]. В исследовании «случай – контроль» (n=90 214) в подгруппе из 388 пациентов с БП (202 мужчин, 186 женщин) была показана обратная зависимость между сМК и началом БП у мужчин (р=0,049), но не у женщин (р=0,44). Установление факта связи более высоких показателей сМК с низким риском развития БП может подтвердить нейропротективную роль уратов у мужчин и их потенциальное влияние на замедление прогрессирования заболевания [14].
Еще один недавний метаанализ 13 исследований М. Wen et al. (2017), который включал 4646 участников (2379 с БП и 2267 группы контроля) подтвердил, что у пациентов с БП концентрация сМК ниже, чем у таковых группы контроля (стандартизированная разность средних – 0,49, ДИ 95% (0,67; 0,30), z=5,20; р<0,001), без существенной разницы по возрасту, полу и происхождению. У лиц со среднепоздним заболеванием и значимыми функциональными ограничениями показатели сМК были ниже, чем у пациентов на ранних стадиях патологии с менее выраженной неврологической симптоматикой (ОР 0,63; 95% ДИ (0,36; 0,89), z=4,64; р<0,001). Эти данные предполагают линейную корреляцию между уровнями сМК и снижением глобальной когнитивной функции [41]. Таким образом, сМК может играть ключевую роль в прогнозировании прогрессирования болезни и клиническом течении.
Кроме того, последние данные подчеркивают, что более высокий уровень сМК может быть связан с меньшей выраженностью немоторных симптомов на ранней стадии БП, таких как усталость, рассеянность внимания, снижение быстроты запоминания и др. (отношение шансов (ОШ) 0,693; р=0,0408). Эти результаты могут коррелировать с антиоксидантными эффектами сМК у пациентов с БП [16]. Некоторые авторы предполагают, что модуляция концентраций МК может быть полезна для предотвращения проявлений болезни [42].
МК и сосудистая деменция
Результаты исследований, посвященных ассоциации МК и сосудистой деменции, являются спорными. Так, в исследовании J.Y. Hong et al. (2015) обнаружен более низкий риск развития сосудистой деменции у пациентов с подагрой: 210 новых случаев сосудистой деменции у лиц с гиперурикемией по сравнению с 991 у таковых без подагры с нормоурикемией (средний период наблюдения – 4,5±2,0 и 4,4±2,0 года соответственно, ОР 0,76; 95% ДИ 0,65‑0,88; р<0,001). Авторы определяли диагноз деменции, используя критерии согласно клинической модификации Международной классификации болезней 9-го пересмотра (МКБ‑9-CM), сопоставив 28 769 пациентов по возрасту и полу с 114 742 субъектами группы контроля [15].
Метаанализ, проведенный А.А. Khan et al. (2016), наоборот, не подтвердил значительную связь между сМК и манифестацией сосудистой/смешанной деменции (САО -0,05; 95% ДИ и САО -0,19; 95% ДИ соответственно). Также не была установлена корреляция между уровнями сМК и показателями MMSE [17]. Неоднородность разных исследований, частое использование дизайна «случай – контроль» и отсутствие лонгитудинальных результатов с последующим клиническим наблюдением были наиболее значимыми ограничениями и основными источниками возможной систематической ошибки, что привело к гетерогенности выводов.
Популяционное когортное исследование, включавшее 1598 субъектов (средний возраст – 72,4±4,1 года, 38,3% мужчин), обозначило заболеваемость деменцией 8,2 на 1 тыс. человеко-лет (100 новых случаев) в течение 10,1 года наблюдения. При этом авторы обнаружили высокий риск развития сосудистой или смешанной деменции у пациентов с более высокими концентрациями сМК (ОР 3,66; 95% ДИ 1,29‑10,41; р=0,015), тогда как уровни сМК не предсказывали начало БА (ОР 1,55; 95% ДИ 0,92‑2,61; р=0,10) [20]. Возникновение инсульта во время последующего наблюдения и когнитивные расстройства, с ним связанные, могли повлиять на данный риск, демонстрируя обратную зависимость между сМК и развитием сосудистой деменции. Было высказано предположение о повреждающем воздействии сМК на сосудистую систему в противовес ее традиционным антиоксидантным эффектам, играющим протективную роль при нейродегенеративных формах деменции. Таким образом, исследователи указывают на необходимость проведения тщательной клинической оценки и профилирование факторов риска для стратификации пациентов с высоким риском развития инсульта и сосудистых когнитивных нарушений, которые могут быть частично обусловлены влиянием гиперурикемии.
МК и легкие когнитивные нарушения
Интересно, что связь между сМК и когнитивной функцией прослеживается не только при выраженной деменции, но и на ранних стадиях когнитивного снижения. Однако и это утверждение является противоречивым. Так, если в более ранних работах была показана защитная роль МК в отношении прогрессирования когнитивных нарушений, то более поздние не обнаружили существенного процентного изменения уровня сМК у пациентов с легкими когнитивными нарушениями (ЛКН) по сравнению с субъектами с нормальной познавательной функцией [13, 31]. Однако исследования, проведенные в 2016‑2017 гг., поддержали теорию о нейропротективной роли МК [39]. Были выявлены значительно более низкие концентрации сМК у 58 пациентов с ЛКН в отличие от 57 группы контроля (292,28±63,71 и 322,49±78,70 мкмоль/л соответственно; р<0,05). Несмотря на ограниченный размер выборки, полученные результаты продемонстрировали достоверную положительную корреляцию между оценкой по MMSE, подтвердившей наличие ЛКН, и низкими уровнями сМК (р<0,05). Таким образом, была поддержана теория о защитной антидементной роли МК при многомерном логистическом регрессионном анализе (ОШ 0,999; 95% ДИ 0,987‑0,999).
Указанные данные были подтверждены в большом перекрестном исследовании, проведенном при участии 2102 китайских пожилых пациентов (средний возраст – 71,2±6,6 года) в период с 2009 по 2010 гг. Авторы обнаружили линейное уменьшение распространенности ЛКН пропорционально увеличению концентрации сМК, а ОР составил 1,65 (95% ДИ 1,12‑2,43) и 1,92 (95% ДИ 1,02‑3,35) у мужчин и женщин соответственно, для самых высоких уровней сМК [24]. Так, нейропротективное влияние сМК проявляется задолго до начала клинических симптомов деменции, предполагая двойную пользу с точки зрения снижения риска когнитивных нарушений и клинического улучшения течения манифестной болезни.
В таблице приведены когортные исследования, в которых оценивали взаимосвязь между МК и риском развития деменции.
Механизмы, лежащие в основе взаимосвязи уровня МК и когнитивной функции
Окислительный стресс
На рисунке представлены основные механизмы участия МК в физиопатологии различных видов деменции.
.jpg) Рисунок. Основные механизмы участия МК в физиопатологии различных видов деменции
Рисунок. Основные механизмы участия МК в физиопатологии различных видов деменции
Механизмы, которые опосредуют позитивное влияние МК на когнитивную функцию, до сих пор точно не установлены. Окислительный стресс, по-видимому, играет ключевую роль в патогенезе большинства причин деменции, в частности, развития БА и БП. Метаанализ, проведенный М. Schrag et al. (2013), показал значительное уменьшение общей антиоксидантной активности на фоне снижения уровня сМК у пациентов с БА по сравнению с контрольной группой [31]. Эти результаты недавно были перепроверены и подтверждены. Так, снижение сМК наряду с другими сывороточными антиоксидантами, такими как α- и β-каротин, ликотин, лютеин и витамины А, С и E, способствует увеличению окислительного стресса у лиц с БА и другими когнитивными отклонениями [26].
Следует отметить, что у пациентов с БП окислительный стресс, вызванный, например, хроническим воздействием токсинов окружающей среды, низким уровнем антиоксидантов в головном мозге или ферментов, поглощающих свободные радикалы, а также митохондриальной дисфункцией, является одной из ведущих причин нейродегенерации, которые нарушают взаимодействие множества нейронных цепей и путей [1].
Согласно данным нескольких исследований, антиоксидантные эффекты сМК сходны с таковыми аскорбата – широко известного антиоксиданта. Уратам присущи следующие антиоксидантные эффекты: МК действует как прямой поглотитель кислорода и гидропероксиловых радикалов, синглетного кислорода, гем-содержащих оксидантов и способствует образованию стабильных комплексов с ионами железа [40]. Следовательно, можно сделать вывод, что меньшие концентрации сМК могут быть ассоциированы со сниженной защитой организма от окислительного стресса, что гипотетически повышает риск развития когнитивной дисфункции. Некоторые авторы обнаружили линейную корреляцию между уровнями сМК и МК в спинномозговой жидкости (СМЖ) (r=0,669; p=0,001), а также связь между нарушением гематоэнцефалического барьера с более высокими показателями МК в СМЖ (p=0,028), что поддерживает гипотезу о влиянии МК на мозг и когнитивную функцию [5]. Интересно, что обратная связь между уровнями МК и развитием БА и БП была подтверждена посмертно при гистопатологическом анализе корковой и стриарной тканей, подтверждая теорию нейропротективного действия МК [5].
Тем не менее, некоторые исследователи предположили, что МК способна оказывать обратное прооксидантное действие, и эта противоположная активность может зависеть от химической микросреды. На самом деле, МК может как уменьшать окисление нативных липопротеиднов низкой плотности (ЛПНП), так и увеличивать окисление частиц ЛПНП, которые уже окислены, в зависимости от наличия переходных металлов [34].
МК и взаимодействие с β-амилоидом
Нейротоксическое влияние МК может быть опосредовано путем усиления β-амилоидных эффектов, связанных с БА. В экспериментальных моделях некоторые авторы обнаружили, что инкубация клеток с МК в дозе 40 µМ значительно уменьшала жизнеспособность этих клеток, увеличивала индуцированный амилоидом проапоптотический эффект и βPPARβ/δ-экспрессию [10].
Однако другие исследователи обнаружили, что более высокие уровни МК снижают неблагоприятные эффекты амилоида β1‑42 – биомаркера когнитивных функций, находящегося в СМЖ, и клинически подтвердили это улучшение, используя данные MMSE и оценочной шкалы когнитивных функций болезни Альцгеймера (ADAS-cog) в течение периода наблюдения 2,9 года [43]. В целом полученная информация указывает на то, что между МК и β-амилоидом существует тесная связь. Тем не менее, точная роль МК в трансформации амилоидных отложений и гистологических аспектах БА далеко не полностью расшифрована.
Воспаление, эндотелиальная дисфункция и повреждение сосудов
Еще одна точка соприкосновения между БА и когнитивной системой, особенно у пациентов с сосудистой деменцией, может быть представлена сосудистым повреждением. Было задокументировано, что повышенные уровни сМК связаны с усилением воспалительного ответа на окислительный стресс, эндотелиальной дисфункцией, сосудистым повреждением и патологическим ремоделированием сосудов, что, вероятно, объясняет увеличение риска развития сосудистой деменции у некоторых пациентов с гиперурикемией [36].
Воспаление может выступать важным связующим звеном между гиперурикемией и риском возникновения сосудистой деменции. Некоторые исследования действительно обнаружили положительную корреляцию между более высоким уровнем C-реактивного белка (СРБ), содержанием интерлейкина (ИЛ)-6 и сМК, между маркерами воспаления и гиперинтенсивностью белого вещества на МРТ (p<0,01), меньшим объемом серого вещества (р=0,001) и гиппокампа (р=0,01) [19]. Они являются косвенными маркерами атрофии мозга, подтверждая гипотезу о тесной взаимосвязи между повышенными уровнями сМК, воспалением и сосудистой деменцией [19, 30]. Однако прямая корреляция между гиперурикемией, воспалением и когнитивной дисфункцией была продемонстрирована только недавно. Обнаружено, что снижение МК-связанного воспаления гиппокампа, полученного путем ингибирования сигнальных путей ядерного фактора (NF)-κB, связано с улучшением когнитивной функции у крыс, и что нокаутированные особи таким образом защищены от когнитивных нарушений. Исследователи также выявили значительное увеличение глиоза гиппокампа, ассоциированного с уровнями сМК как у людей, так и у крыс, но они не учитывали корреляцию между воспалением и когнитивной дисфункцией у человека [32].
Диета, МК и деменция
Диета играет одну из ведущих ролей в возникновении деменции. В недавнем обширном систематическом обзоре V. Solfrizzi et al. (2017) доказали, что диетические модели и синергетическое действие нутриентов, а не отдельных питательных веществ или продуктов, определяют риск развития деменции и ее более быстрого клинического течения [35]. Приверженность средиземноморской диете или диетическому подходу к лечению артериальной гипертензии (DASH) тесно ассоциируется со сниженным риском возникновения и прогрессирования деменции [35]. Интересно, что оба режима питания предполагают высокое потребление фруктов и овощей и коррелируют со снижением как уровня МК, так и риска развития гиперурикемии [35].
Данные мероприятия, по-видимому, противоречат предположению, что МК оказывает антидементное действие. Это значительно затрудняет понимание корреляции между диетой, МК и когнитивной функцией. Гиперурикемия классически связана с приемом продуктов, богатых пуринами, которые содержатся в большом количестве в белках. Однако V. Solfrizzi et al. (2017) подчеркнули, что потребление продуктов с высоким содержанием белка не ассоциируется с риском развития деменции. Вместо этого они указали, что насыщенные жирные кислоты, то есть жиры животного происхождения, коррелируют с деменцией и ее прогрессированием [35]. С другой стороны, некоторые исследования, проведенные в популяциях азиатского происхождения, продемонстрировали, что риск развития гиперурикемии, по-видимому, не связан с диетическим потреблением мяса, а зависит от низкого уровня потребления фруктов и овощей, высокого потребления морепродуктов и нездорового режима питания [23].
Таким образом, МК может представлять собой сложный медиатор рациона питания, а не изолированное питательное вещество, влияющее на когнитивные функции. МК нередко находится на перекрестке между диетой и физиопатологией развития деменции, и в некоторых случаях просто является метаболическим маркером комплексного феномена, а не активным посредником, определяющим прогрессирование заболевания. Интересно, что результаты проспективного популяционного исследования сосудистой системы у пожилых людей PIVUS при участии 850 шведских пациентов в возрасте 70 лет показали, что МК нельзя назвать независимым медиатором эндотелиальной функции, поскольку она подвержена влиянию типа конституции и гормонального фона [37]. Эффект МК на когнитивную функцию также следует интерпретировать в свете этих концепций.
Кроме того, у пожилых пациентов с незначительными когнитивными нарушениями или деменцией именно недостаточность питания часто является проблемой, предопределяющей отдаленные неблагоприятные результаты [6]. Так называемая анорексия старения, возникающая из-за возрастных перестроек желудочно-кишечного тракта и гормональной регуляции аппетита, – важный механизм, приводящий к недостаточности питания [18]. С этим состоянием ассоциирован низкий уровень сМК. Гипоурикемия считается общепризнанным маркером неполноценного питания, особенно у пациентов, подвергающихся хроническому гемодиализу [3]. Таким образом, предлагаемая связь между низким содержанием сМК и худшей когнитивной функцией, поддерживаемая большинством вышеупомянутых исследований, может отражать наличие недостаточного питания.
Деменция, особенно на поздних стадиях, является подтвержденным фактором риска развития недостаточного питания. Кроме того, существуют данные по поводу того, что наличие истощения у пожилых людей может влиять на появление когнитивных нарушений, деменции и ускорять ее клиническое течение [28]. Будущие исследования по изучению корреляции между МК и когнитивной функцией также должны включать скрининг питания и оценку наличия недостаточности питания в их дизайне, чтобы четко определить, возможна ли обратная связь между сМК и когнитивной функцией в пожилом возрасте, опосредованная недоеданием/нарушениям питания.
Ограничения исследований и связанная с ними противоречивость данных
Существуют некоторые ограничения, которые могут частично объяснить противоречивость доказательств относительно корреляции между МК и когнитивной функцией, в частности, дуалистического нейропротективного или нейротоксического действия МК.
В нескольких метаанализах сообщается о значительной гетерогенности проведенных исследований, не позволяющей сделать окончательные выводы. Кроме того, большинство из них кросс-секционные, с дизайном «случай – контроль» или посвящены анализу непосредственной, немедленной связи между МК и когнитивной функцией, без специфического лонгитудинального наблюдения [22]. Больше информации можно получить при помощи популяционных исследований с проспективным дизайном, направленным на оценку пациентов без деменции на исходном уровне для анализа влияния различных концентраций МК на когнитивную функцию, где тенденция нейропротекции вырисовывается при длительном наблюдении [17].
Дополнительным ограничением является то, что диагноз деменции в рамках исследований часто оценивался с использованием критериев МКБ‑9-CM и не основывался на стандартизированных клинических и визуализационных данных (например, МРТ). Критерии МКБ‑9-CM ограничены опытом врача, а иногда дают только общее определение деменции или снижения когнитивных способностей без конкретного описания подтипа патологии. Возможно, это очень важный источник предвзятости, учитывая, что деменция часто не диагностируется, когда пациенты оценивают врачи не гериатрической или неврологической специальности. В немногих исследованиях изучали когнитивную функцию с использованием стандартизированных шкал (например, MMSE).
Также представлено мало информации о потенциальном влиянии сопутствующих заболеваний (таких как метаболический синдром, артериальная гипертензия, почечная недостаточность) в отношении сМК и, следовательно, когнитивной функции. Учитывая сложное и тесное взаимодействие между когнитивной функцией, физическим статусом и коморбидными состояниями, было бы интересно изучить специфическое влияние типа питания, например с высоким содержанием МК, у пациентов с различными формами деменции.
Следует отметить, что текущее исследование COPPADIS‑2015 (2015) при участии испанских пациентов с БП посвящено оценке глобальных аспектов, включая коморбидность, биомаркеры и их влияние на когнитивную систему. Его завершение, которое ожидается примерно в мае 2022 г., обеспечит получение важной информации о естественном анамнезе и специфических аспектах этого заболевания [29].
Выводы
Таким образом, корреляция между сМК и сохраненным когнитивным здоровьем остается дискутабельным вопросом. Хотя имеющиеся данные подтверждают гипотезу нейропротективного влияния МК на когнитивную функцию у лиц с БА и БП, а также токсического эффекта у пациентов с сосудистой деменцией, некоторые исследования подрывают эту уверенность. Большинство причин конфликта между результатами обусловлены гетерогенностью полученных данных и небольшим количеством перспективных работ.
Будущие исследования должны быть направлены на оценку различных уровней сМК и их связи с функцией мозга в долговременной перспективе, поскольку наиболее важные эффекты наблюдаются при лонгитудинальном наблюдении. Другие направления исследований в будущем могли бы включать оценку последствий снижения уровня уратов при помощи лечения и потенциальное влияние сопутствующих заболеваний на когнитивную функцию.
Литература
- Anderson G., Maes M. Neurodegeneration in Parkinson’s disease: Interactions of oxidative stress, tryptophan catabolites and depression with mitochondria and sirtuins // Mol Neurobiol. – 2014. – Vol. 49. – P. 771‑783; doi: 10.1007/s12035‑013‑8554-z.
- Annanmaki T., Pohja M., Parviainen T. et al. Uric acid and cognition in Parkinson’s disease: A follow-up study // Parkinsonism Relat Disord. – 2011. – Vol.17. – P. 333‑337.
- Beberashvili I., Sinuani I., Azar A. et al. Serum uric acid as a clinically useful nutritional marker and predictor of outcome in maintenance hemodialysis patients // Nutrition. – 2015. – Vol. 31. – P. 138‑147; doi: 10.1016/j.nut.2014.06.012
- Bell S., Kolobova I., Crapper L., Ernst C. Lesch-Nyhan Syndrome: Models, Theories, and Therapies // Mol Syndromol. – 2016. – Vol.7. – P. 302‑311. doi: 10.1159/000449296
- Bowman G.L., Shannon J., Frei B. et al. Uric acid as a CNS antioxidant // J Alzheimers Dis. – 2010. – Vol.19. – P. 1331‑1336; doi: 10.3233/JAD‑2010‑1330.
- Cederholm T., Nouvenne A., Ticinesi A. et al. The role of malnutrition in older persons with mobility limitations // Curr Pharm Des. – 2014. – Vol. 20. – P. 3173‑3177.
- Chang C.C., Wu C.H., Liu L.K. Association between serum uric acid and cardiovascular risk in nonhypertensive and nondiabetic individuals: The Taiwan I‑Lan Longitudinal Aging Study // Sci Rep. – 2018. – Vol. 8. – P. 5234; doi: 10.1038/s41598‑018‑22997‑0
- Chen X., Guo X., Huang R. et al. Serum uric acid levels in patients with Alzheimer’s disease: A meta-analysis // PLoS ONE. – 2014. – Vol.9. – P. 94084; doi: 10.1371/journal.pone.0094084.
- Dalbeth N., Merriman T.R., Stamp L.K. Gout // Lancet. – 2016. – Vol. 388. – P. 2039‑2052; https://doi.org/10.1016/S0140‑6736(16)00346‑9.
- Desideri G., Gentile R., Antonosante A. et al. Uric Acid Amplifies A-Amyloid Effects Involved in the Cognitive Dysfunction/Dementia: Evidences From an Experimental Model In Vitro // J Cell Physiol. – 2017. – Vol. 232. – P. 1069‑1078; doi: 10.1002/jcp.25509.
- Du N., Xu D., Hou X. et al. Inverse Association Between Serum Uric Acid Levels and Alzheimer’s Disease Risk // Mol Neurobiol. – 2016. – Vol. 53. – P. 2594‑2599.
- Euser S.M., Hofman A., Westendorp R.G., Breteler M.M. Serum uric acid and cognitive function and dementia // Brain. – 2009. – Vol. 132. – P. 377‑382; doi: 10.1093/brain/awn316.
- Euser S.M., Irizarry M.C., Raman, R. et al. Plasma urate and progression of mild cognitive impairment // Neurodegener Dis. – 2009. – Vol. 6. – P. 23‑28; doi: 10.1159/000170883.
- Gao X., O’ReillyÉЕ.J., Schwarzschild M.A., Ascherio A. Prospective study of plasma urate and risk of Parkinson disease in men and women // Neurology. – 2016. – Vol. 86. – P. 520‑526; doi: 10.1212/WNL.0000000000002351.
- Hong J.Y., Lan T.Y., Tang G.J. et al. Gout and the risk of dementia: a nationwide population-based cohort study // Arthritis Res Ther. – 2015. – Vol. 17. – P. 139.
- Huang X., Ng S.Y., Chia N.S. et al. Serum uric acid level and its association with motor subtypes and non-motor symptoms in early Parkinson’s disease: PALS study // Parkinsonism Relat Disord. – 2018. – Vol. 55. – P. 50‑54; doi: 10.1016/j.parkreldis.2018.05.010.
Полный список литературы, включающий 43 пункта, находится в редакции
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 3 (70) 2020 р.