10 липня, 2016
Мужское бесплодие
Руководство Европейской ассоциации урологов, 2015 г.
Продолжение. Начало в № 1 (5).
Обструктивная азооспермия
Лечение
Интратестикулярная обструкция. На интратестикулярном уровне устранение обструкции невозможно, выполнение реканализации семявыносящего протока не даст результатов; поэтому рекомендуется выполнение TESE или пункционной биопсии. Выделенные сперматозоиды могут быть сразу же использованы для ИКСИ или подвергнуты криоконсервации. Оба метода – TESE и пункционная биопсия (TEFNA, TESA) – позволяют выделить сперматозоиды практически у всех пациентов с ОА.
Обструкция на уровне придатка яичка. Микрохирургическая аспирация сперматозоидов из придатка (MESA) показана пациентам с ВДОСП. Полученные таким методом сперматозоиды обычно используются для ИКСИ. Как правило, одна процедура MESA обеспечивает достаточным количеством генетического материала для нескольких попыток ИКСИ и сопровождается высокой способностью сперматозоидов к оплодотворению и высокой частотой наступления беременности. Пациентам с азооспермией вследствие приобретенной обструкции семенных путей на уровне придатка яичка рекомендуется выполнять микрохирургическую эпидидимовазостомию по типу «конец в конец» или «конец в бок», при этом наиболее предпочтительной техникой операции является микрохирургическая инвагинация эпидидимовазостомы. Реконструкция может быть как односторонней, так и двусторонней процедурой; восстановление проходимости и частота беременности обычно выше при двустороннем вмешательстве. До микрохирургического этапа операции необходимо удостовериться в сохранности проходимости семенных канальцев ниже придатка яичка. Анатомическая реканализация после операции может занять 3-18 мес. Перед микрохирургическим вмешательством (и во всех случаях, когда невозможна реканализация) сперматозоиды придатка яичка должны быть аспирированы и подвергнуты криоконсервации для последующего ИКСИ, если хирургическая реканализация окажется неэффективной. Проходимость восстанавливается в 60-87% случаев, а общая частота наступления беременности составляет 10-43%. Успех реканализации может снижаться в результате пред- или интраоперационных находок (например, сопутствующие нарушения морфологии яичка, отсутствие сперматозоидов в семенной жидкости при изучении малых канальцев придатка яичка, выраженный фиброз придатка яичка).
Обструкция проксимальной части семявыносящего протока. Проксимальная обструкция семявыносящего протока после вазэктомии требует микрохирургического восстановления его проходимости. Вазо-вазостомия может потребоваться и в редких случаях проксимальной непроходимости семявыносящего протока (ятрогенной, посттравматической, поствоспалительной). Если при исследовании жидкости из семявыносящего протока во время операции сперматозоидов не обнаружено, следует предполагать наличие вторичной обструкции на уровне придатка яичка, особенно если семенная жидкость из проксимального отдела протока представлена тонкими нитями по типу «зубной пасты». В таких случаях показано выполнение микрохирургической вазоэпидидимостомии.
Обструкция дистальной части семявыносящего протока. Обычно невозможно исправить протяженные двусторонние дефекты семявыносящего протока, образующиеся при непреднамеренном пересечении/иссечении протока при герниопластике в раннем детстве или при предшествующей орхипексии. В этих случаях проводят аспирацию сперматозоидов из проксимальной части семявыносящего протока или применяют методы TESE/MESA для последующей криоконсервации сперматозоидов и ИКСИ. При обширном одностороннем поражении семявыносящего протока, ассоциированном с атрофией контралатерального яичка, для перекрестной вазо-вазостомии или вазоэпидидимостомии возможно использование здорового семявыносящего протока от атрофированного яичка.
Обструкция семявыбрасывающего протока. Лечение при обструкции семявыбрасывающего протока зависит от этиологии поражения. При обширных поствоспалительных обструкциях, а также при опорожнении одного или обоих семявыбрасывающих протоков в интрапростатическую срединную кисту может применяться трансуретральная резекция выходных отделов семявыбрасывающих протоков в зоне семенного бугорка (TURED – transurethral resection of the ejaculatory ducts). Резекция может привести к удалению части семенного бугорка. В случаях обструкции вследствие срединной интрапростатической кисты требуется выполнение ее вскрытия и иссечения. Интраоперационное применение трансректальной ультрасонографии с ригидным датчиком (TRUS) делает эту процедуру безопаснее. Если оценка дистальной части эякуляторного пути проводится во время этой процедуры, введение метиленового синего (индигокармина) в семявыносящий проток поможет документировать восстановление проходимости семявыбрасывающих протоков. Необходимо оценить ограниченные данные по эффективности хирургического лечения обструкции семявыбрасывающего протока, определяемой в плане наступления спонтанной беременности по сравнению с аспирацией сперматозоидов и ИКСИ. К осложнениям после TURED относят ретроградную эякуляцию при повреждении шейки мочевого пузыря и рефлюкс мочи в семявыбрасывающие протоки, семенные пузырьки и семявыносящие протоки (что приводит к низкой подвижности сперматозоидов, к окислению среды в эякуляте и эпидидимиту). Альтернативой TURED служат MESA, TESE, аспирация сперматозоидов из проксимальной части семявыносящего протока, из семенных пузырьков под контролем УЗИ и прямая аспирация семенной жидкости из кисты. В случаях функциональной обструкции дистальных отделов семявыбрасывающих протоков TURED часто улучшает выброс эякулята. В дальнейшем сперматозоиды могут быть получены при антеградном промывании семенного тракта. Сперматозоиды, выделенные с помощью любой из вышеупомянутых хирургических методик, в обязательном порядке должны быть подвергнуты криоконсервации для последующих экстракорпоральных репродуктивных процедур.
Варикоцеле
Варикоцеле – это распространенная патология со следующими признаками, связанными с андрологическими изменениями:
- нарушение роста и развития ипсилатерального яичка;
- симптомы: боль и дискомфорт;
- бесплодие.
Классификация
Следующая классификация варикоцеле успешно используется в клинической практике.
- Субклиническая форма: вены семенного канатика не пальпируются, нет видимых изменений мошонки в покое и при пробе Вальсальвы, но выявляются специальными методами исследования (допплеровское ультразвуковое сканирование).
- I степень: пальпируется только при пробе Вальсальвы.
- II степень: пальпируется в покое, видимого расширения вен семенного канатика нет.
- III степень: расширение вен определяется и визуально, и пальпаторно.
Обследование
Диагноз варикоцеле определяется при физикальном осмотре и подтверждается данными цветной допплеросонографии. В клинических центрах, где проводится лечение с помощью антеградной или ретроградной склеротерапии или эмболизации, диагноз должен дополнительно подтверждаться рентгенофлебографией.
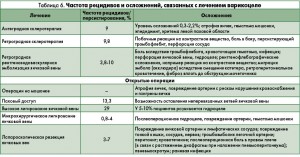
Метаанализ рандомизированных контролируемых исследований и клинических наблюдений показал, что хирургическая варикоцелэктомия приводит к значительному улучшению параметров эякулята у мужчин с нарушениями его качества только при клинически выраженном варикоцеле. Однако до сих пор продолжается дискуссия по вопросу, приводит ли лечение варикоцеле к повышению шанса естественного зачатия. Системный обзор рандомизированных контролируемых клинических исследований в Кокрановской базе данных (Cochrane Database), сравнивающих лечение варикоцеле/наблюдение, показал, что в настоящее время нет доказательств того, что лечение варикоцеле повышает частоту наступления беременности. Однако этот метаанализ критиковался, так как он включал в себя исследования низкой достоверности (плохого качества), в том числе исследования с участием мужчин с субклиническим варикоцеле и нормальными параметрами эякулята. В 3 рандомизированнных клинических исследованиях (РКИ) субклинического варикоцеле было показано, что его лечение неэффективно в индукции беременности. Также в 3 РКИ, включавших в основном мужчин с нормальными параметрами эякулята, не доказано преимуществ оперативного лечения варикоцеле перед наблюдением.
Лечение
Существует несколько вариантов лечения варикоцеле (табл. 6). Тип вмешательства определяется в основном опытом врача. И хотя в настоящее время в арсенале имеется и такой метод лечения, как лапароскопическая варикоцелэктомия, при выборе метода необходимо
также руководствоваться соотношением цена/эффективность.
Гипогонадизм
Гипогонадизм характеризуется нарушением функции яичка и/или синтеза тестостерона, подтверждаемыми лабораторными и гормональными исследованиями. Клиническая картина определяется степенью андрогенодефицита и тем, когда развивается этот синдром – до или после пубертатного развития вторичных половых признаков. Симптомы и признаки гипоандрогенизации, развивающиеся до или после пубертатного периода, представлены в таблице 7.
Этиологические и патогенетические механизмы развития гипогонадизма можно разделить на 3 основные группы:
- первичный (гипергонадотропный) гипогонадизм, связанный с поражением яичек;
- вторичный (гипогонадотропный) гипогонадизм, вызванный недостаточностью гонадотропин-рилизинг-гормона (ГнРГ) и/или секреции гонадотропинов (ФСГ, ЛГ);
- отсутствие чувствительности к андрогенам органов-мишеней (нормогонадотропный гипогонадизм).
Наиболее частые состояния, при которых развиваются различные варианты гипогонадизма, представлены в таблице 8.
Гипогонадотропный гипогонадизм
Идиопатический гипогонадотропный гипогонадизм (ИГГ) характеризуется низким уровнем гонадотропина и половых гормонов и отсутствием анатомических или функциональных нарушений в гипоталамогипофизарно-гонадной оси. ИГГ может быть изолированным состоянием или сочетаться с аносмией, гипосмией (синдром Каллмана). Генетические факторы, вызывающие дефицит гонадотропинов, могут воздействовать на уровне гипоталамуса или гипофиза. Мутации в генах-кандидатах (сцепленные с Х-хромосомой или аутосомальные) могут быть обнаружены приблизительно в 30% «врожденных» случаев. Скрининг на их выявление необходимо проводить до индукции беременности. Приобретенный гипогонадотропный гипогонадизм может быть вызван некоторыми лекарственными средствами, гормонами, анаболическими стероидами и опухолями. При подозрении на опухоль требуется компьютерная (КТ) или магнитно-резонансная (МРТ) томография для исключения синдрома турецкого седла и полное эндокринологическое обследование. Нарушение гормональной регуляции легко выявляется. Эндокринный дефицит приводит к отсутствию сперматогенеза и выработки тестостерона, что вызывается снижением секреции ЛГ и ФСГ. После исключения вторичных форм (лекарственные препараты, гормоны, опухоли) выбор терапии зависит от цели: достижение нормального уровня андрогенов либо фертильности. Только заместительная терапия нормализует уровень андрогенов с последующим развитием вторичных половых признаков (в случаях появления гипогонадизма до пубертатного периода), развитием эугонадного состояния. Тем не менее стимуляция продукции сперматозоидов также требует назначения хорионического гонадотропина (ХГ) в комбинации с рекомбинантным ФСГ. В редких случаях (фертильного евнухоидизма) отмечается достаточная продукция ФСГ, но не ЛГ. В такой ситуации терапия при помощи одного ХГ может быть достаточной для стимуляции продукции сперматозоидов и достижения нормального уровня тестостерона. Если гипогонадотропный гипогонадизм имеет гипоталамическую природу, альтернативой лечению ХГ является пульс-терапия ГнРГ. Пациентам, у которых гипогонадизм развился до наступления пубертатного периода и которые не получали терапии гонадотропинами или ГнРГ, для достижения нормальной продукции сперматозоидов требуется 1-2 года лечения. Как только беременность наступает, можно вернуться к заместительной терапии препаратами тестостерона.
Гипергонадотропный гипогонадизм
С гипергонадотропным гипогонадизмом у мужчин связано множество факторов. Большинство из них нарушают только репродуктивную функцию яичек, поэтому повышается лишь уровень ФСГ. Тем не менее имеются сообщения о том, что у мужчин с инфертильностью повышен риск развития нарушения функции клеток Лейдига, а у мужчин с синдромом Клайнфельтера часто повышен уровень ЛГ и с возрастом развивается гипоандрогения. После расширенной биопсии яичка для проведения TESE/ИКСИ наблюдается снижение уровня тестостерона в крови, что делает необходимым наблюдение этих пациентов у эндокринолога в течение длительного времени. Гипергонадотропный гипогонадизм с нарушением репродуктивной и эндокринной функций яичек возникает после лечения препаратами ГнРГ или хирургической кастрации при раке простаты. Лабораторная диагностика при гипергонадотропном гипогонадизме основана на повышении уровня ФСГ и ЛГ и снижении уровня тестостерона. Уровень тестостерона следует определять исходя из концентрации в плазме крови глобулина, связывающего половые гормоны (ГСПГ). С учетом уровней тестостерона и ГСПГ может быть рассчитан уровень свободного и биодоступного тестостерона. Так как концентрация тестостерона в плазме варьирует в течение дня, необходимо проводить забор крови для анализа до 10:00. Существующие рекомендации по заместительной терапии андрогенами основываются главным образом на общем уровне тестостерона. При уровне общего тестостерона >12 нмоль/л (350 нг/дл) заместительной терапии не требуется. Также имеется основывающийся на данных обследования молодых мужчин консенсус о том, что при уровне общего тестостерона < 8 нмоль/л (230 нг/дл) заместительная терапия, как правило, эффективна. Если уровень общего тестостерона 8-12 нмоль/л, необходимость в терапии определяется на основании клинических проявлений. У тучных мужчин для определения тактики может быть полезно измерение уровня общего тестостерона и ГСПГ для расчета свободного тестостерона или измерение свободного тестостерона путем равновесного диализа. Для клинического применения доступны следующие формы тестостерона: инъекционная, пероральная и трансдермальная. Наилучшим препаратом считается тот, который поддерживает концентрацию тестостерона в пределах физиологической нормы.
Крипторхизм
Крипторхизм – наиболее частая врожденная аномалия развития половых органов у мужчин – обнаруживается у 2-5% новорожденных мальчиков, зависит от внутриутробного возраста плода (частота крипторхизма выше у недоношенных детей) и возраста после рождения. В течение первых 3 мес жизни распространенность крипторхизма снижается до уровня 1-2%. Приблизительно в 20% случаев крипторхизма яички не пальпируются и локализуются в брюшной полости. В этиологии крипторхизма выделяют множество причин как эндокринного, так и генетического характера. Для процесса нормального опущения яичек требуются адекватное функционирование и взаимодействие гипоталамо-гипофизарно-гонадной оси. Эндокринные расстройства во время I триместра беременности могут приводить к нарушению развития гонад и неопущению яичек в мошонку. Однако у большинства мальчиков с неопущенными яичками после рождения отсутствуют какие-либо нарушения со стороны эндокринной системы. Считается, что крипторхизм может быть частью так называемого синдрома дисгенезии яичек – нарушения развития гонад, которое возникает в результате действия факторов внешней среды или генетических нарушений на ранних сроках беременности. Синдром дисгенезии гонад помимо крипторхизма включает в себя гипоспадии, снижение фертильности, повышенный риск развития злокачественных опухолей и дисфункцию клеток Лейдига.
Эпидемиология и патогенез
У недоношенных детей распространенность крипторхизма выше, чем у доношенных. В английском исследовании встречаемость крипторхизма среди 3 тыс. мальчиков с массой тела > 2500 г составила 2,7%, а у недоношенных детей с массой тела <2500 г распространенность крипторхизма увеличилась до 21%. К возрасту 3 мес спонтанное опущение яичек наблюдается у большинства мальчиков, частота выявления крипторхизма снижается до 0,9 и 1,7% в группах массой тела <2500 г и >2500 г соответственно.
Механизм опущения яичек и его нарушения
Процесс опущения яичек проходит в 2 этапа: трансабдоминальный и паховый. На первом этапе – трансабдоминального опущения – развитие направляющей связки яичка и генитально-паховой связки играет наиболее важную роль. Антимюллеровский гормон регулирует трансабдоминальный этап опущения яичек. Индукция направляющей связки яичка у мышей зависит от функционирования гена инсулиноподобного фактора 3 (Insl3). Данный ген экспрессируется в клетках Лейдига, и его инактивация приводит к билатеральному крипторхизму со свободно мигрирующими яичками и семявыносящими протоками. Андрогены играют важную роль в обеих фазах опущения яичка. Другие семейства генов, играющие важную роль в развитии половых органов, также могут влиять на процесс миграции яичек в мошонку.
Неопущение яичек может быть обусловлено действием 2 гормональных причин: гипогонадизмом и нечувствительностью к андрогенам. Повышение количества мужчин с патологией со стороны репродуктивной системы может быть объяснено повышением экспозиции к эстрогенам во время вынашивания. Некоторые пестициды и химические вещества часто обладают эстрогенной активностью (ксеноэстрогены) и действуют как гормональные модуляторы. На животных моделях эстрогенные и антиандрогенные свойства этих веществ могут являться причиной гипоспадии, крипторхизма, снижения плотности (концентрации) сперматозоидов и повышения риска развития опухолей яичка за счет как рецепторопосредованных механизмов, так и прямого токсического воздействия, связанного с дисфункцией клеток Лейдига.
Патофизиологические эффекты
Дегенеративные изменения герминогенных клеток. После первого года жизни в герминогенных клетках крипторхированных яичек наступают дегенеративные изменения, степень которых зависит от уровня расположения яичек. В течение 2-го года жизни число герминогенных клеток снижается. У 10-45% больных наблюдается полная потеря герминогенной ткани. Поэтому для сохранения сперматогенеза рекомендуется проводить лечение в раннем возрасте, особенно при двустороннем крипторхизме. Хирургическое лечение является наиболее эффективным и испытанным методом перемещения яичек в мошонку. Гормональная терапия хорионическим гормоном человека (ХГЧ) применялась повсеместно в прошлом, но сейчас от нее отказались из-за высокого уровня апоптоза герминогенных клеток после лечения.
Связь с фертильностью. У мужчин с крипторхизмом в анамнезе часто обнаруживаются нарушения в спермограмме. Хирургическое лечение в течение первых 2 лет жизни положительно сказывается на последующей фертильности. Тем не менее не существует убедительных доказательств протекторного эффекта ранней орхипексии. При одностороннем крипторхизме в анамнезе отцовство достигается практически так же, как и среди мужчин без крипторхизма: в 89,7 и 93,7% случаях соответственно. У мужчин с односторонним крипторхизмом наступление отцовства не зависит от возраста пациента, предоперационной локализации яичка и его размеров. Вместе с тем наличие в анамнезе одностороннего крипторхизма может приводить к снижению фертильности. Время наступления беременности в этом случае удлиняется. У мужчин с билатеральным крипторхизмом олигозооспермия наблюдается в 31% случаев, азооспермия – в 42%. При двустороннем крипторхизме отцовство наступает в 35-53% случаев. При двустороннем крипторхизме и азооспермии выполнение орхипексии даже во взрослом возрасте может привести к появлению сперматозоидов в эякуляте.
Герминогенные опухоли. Крипторхизм является фактором риска развития опухолей яичка и ассоциируется с микрокальцинатами в яичке и карциномой in situ (CIS). У 5-10% больных с опухолями яичка отмечается крипторхизм в анамнезе. Риск развития герминогенной опухоли в 3,6-7,4 раза выше, чем в общей популяции, и у 2-6% мужчин с крипторхизмом в анамнезе развивается опухоль яичка. Выполнение орхипексии до пубертатного возраста снижает риск возникновения опухолей яичка. Тем не менее эта и другие схожие публикации опираются на ретроспективные данные, и мы не можем ислючить вероятность того, что мальчики, которым была выполнена ранняя и поздняя орхипексия, представляют собой различные патогенетические группы крипторхизма.
Лечение
Гормональная терапия. В прошлом ХГЧ или ГнРГ широко применялись для лечения крипторхизма. В 15-20% случаях яички опускаются в мошонку на фоне гормональной терапии. Однако в 20% из них яички позже вновь поднимаются. Также прием ХГЧ может быть вредным для будушего сперматогенеза, вызывая повышение апоптоза герминогенных клеток. Именно поэтому гормональная терапия больше не рекомендуется.
Хирургическое лечение. Эффективность хирургического лечения крипторхизма составляет 70-90%. Если семенной канатик и сосуды слишком коротки для мобилизации и перемещения яичка в мошонку, возможно проведение ступенчатой орхипексии (по Фаулеру – Стивенсу). Применяются открытые оперативные вмешательства, лапароскопическая или микрохирургическая орхипексия. Вопрос об оптимальном возрасте для выполнения операции вызывает споры. Некоторые исследования показывают положительный эффект раннего (во время первых 2 лет жизни) лечения в плане сохранения фертильности в будущем. Тем не менее эти сообщения основываются на ретроспективно собранных данных. В РКИ было показано, что хирургическое лечение в возрасте 9 мес приводит к частичному наверстыванию роста яичка до возраста по меньшей мере 4 года по сравнению с орхипексией в 3-летнем возрасте. Эти данные ясно говорят о том, что раннее выполнение операции оказывает положительное влияние на рост яичка. Объем яичка – ориентировочное (непрямое) отражение сперматогенной активности, дающее надежду на улучшение сперматогенеза в будущем. Выполнение биопсии при орхипексии позволяет выявить карциному in situ, удаление которой предотвращает развитие злокачественной опухоли. Если до наступления половой зрелости крипторхизм не был устранен, то удалять неопустившееся яичко не стоит, так как оно секретирует тестостерон. Более того, как отмечено выше, коррекция двустороннего крипторхизма даже во взрослом возрасте может привести к выработке сперматозоидов у мужчины с азооспермией. Наиболее серьезным осложнением после орхипексии является повреждение сосудов, кровоснабжающих яичко, что в 1-2% случаев может привести к тестикулярной атрофии. В случае непальпируемых яичек и при достаточной длине сосудистой ножки послеоперационная атрофия наблюдается у 12% пациентов. При выполнении ступенчатой орхипексии сообщается о частоте развития послеоперационной атрофии 40%.
Идиопатическое мужское бесплодие
Мужское бесплодие при отсутствии достоверных причин его возникновения (идиопатический ОАТ-синдром) обнаруживается у 44% мужчин с бесплодием.
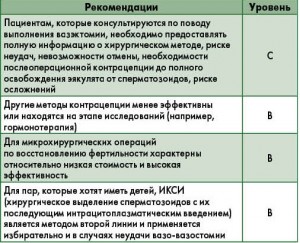
Хотя и имеется большой выбор препаратов для лечения идиопатического мужского бесплодия, доказательная база эмпирического подхода в терапии невелика. Андрогены, ХГЧ/человеческий менопаузальный гонадотропин, бромкриптин, альфа-блокаторы, системные кортикостероиды и восполнение магния неэффективны в лечении ОАТ-синдрома. Препараты ФСГ и антиэстрогены в комбинации с тестостероном могут оказывать положительное воздействие на определенных пациентов. Однако требуется дальнейшая оценка использования этих препаратов в многоцентровых исследованиях.
Мужская контрацепция
«Вклад мужчин в контрацепцию» – более правильное название, чем «мужская контрацепция», так как мужчины не могут забеременеть. Развитие контрацептивных методик у мужчин имеет важное практическое значение, так как 40% женщин не удовлетворены в части планирования семьи. Ежегодно около 80 млн женщин имеют незапланированную беременность. Из 4 методов мужской контрацепции 3 используются уже на протяжении сотен лет (презервативы, периодическое воздержание и прерванный половой акт). В течение первых лет полового партнерства отмечается более частый отказ от применения традиционных методов мужской контрацепции (прерывание полового акта – 19%, периодическое воздержание – 20% и использование презервативов – 3-14%) по сравнению с уровнем отказов от применения методов обратимой женской контрацепции – 0,1-3%. Для мужчин, которые с ответственностью подходят к планированию семьи, методы мужской контрацепции должны быть приемлемыми, недорогостоящими, обратимыми и эффективными. Исследователи стремятся к:
- предупреждению продукции сперматозоидов путем применения андрогенов, прогестинов и препаратов ГнРГ в различных комбинациях;
- воздействию на фертильность сперматозоидов за счет торможения их созревания в придатках яичек (например, производные нитроимидазола);
- совершенствованию методов барьерной контрацепции; при аллергии на латекс у мужчин могут применяться полиуретановые презервативы, однако у последних вероятность механического повреждения выше;
- производству антисперматозоидной контрацептивной вакцины;
- ингибированию взаимодействия сперматозоидов и яйцеклетки.
Все эти подходы являются экспериментальными. Наиболее близким к практическому применению методом мужской контрацепции служит гормональная мужская контрацепция, основанная на подавлении выработки гонадотропина и использовании заместительной терапии тестостероном в концентрациях, необходимых для поддержания мужской сексуальной функции, минерализации костной ткани и сохранения мышечной массы. Изучаются и тестируются различные контрацептивные режимы, включая монотерапию тестостероном, комбинации андрогенов и прогестинов, сочетание тестостерона и аналогов ГнРГ, применение селективных модуляторов к рецепторам андрогенов и прогестинов. Существуют межрасовые различия в ответе на монотерапию андрогенами. Однако комбинация тестостерона с прогестинами приводит к полному подавлению сперматогенеза независимо от расы и обеспечивает контрацептивный эффект подобно женским гормональным контрацептивам.
Вазэктомия
Вазэктомия – эффективный метод хирургической контрацепции у мужчин. Перед проведением вазэктомии паре следует предоставить полную информацию о преимуществах и недостатках метода. Телефонный опрос в Австралии обнаружил, что 9,2% мужчин сожалеют о том, что сделали эту операцию.
Вазэктомия не приводит к значимому нарушению сперматогенеза и функции клеток Лейдига. Объем эякулята также не меняется. Потенциальные системные эффекты вазэктомии, включая атеросклероз, пока не доказаны, также как и повышение риска системных заболеваний. Повышения риска развития рака предстательной железы у мужчин после вазэктомии не обнаружено.
К непосредственным местным осложнениям, ассоциированным с вазэктомией, относятся гематома, раневая инфекция и эпидидимит, которые развиваются в 5% случаев. О возможных отсроченных осложнениях (например, хроническая тестикулярная боль) пациентов следует предупреждать до операции. Распространенным осложнением является повреждение канальцев придатка яичка, которое ассоциировано с последующим развитием семенной гранулемы и вторичной эпидидимальной обструкцией, ограничивающей возможность хирургического восстановления проходимости семявыносящих протоков.
При применении окклюзионных вмешательств риск реканализации после вазэктомии составляет менее 1%. Тем не менее перед операцией пациентов следует предупреждать о редкой, но возможной отсроченной реканализации. Через 3 мес после вазэктомии подвижных сперматозоидов не обнаруживается. Сохранение подвижности сперматозоидов – признак неэффективности выполненной операции и показание к проведению повторной процедуры.
Консультирование в отношении вазэктомии должно затрагивать следующие моменты.
- Вазэктомию следует рассматривать как необратимый метод контрацепции.
- Вазэктомия ассоциирована с низким риском развития осложнений; однако, учитывая элективность (избирательность) этой операции, необходимо до подписания информированного согласия обсудить с мужчиной и его партнершей возможные хирургические риски и осложнения.
- Вазэктомия может быть неэффективной, однако неудачи являются редкостью.
- Парам следует рекомендовать продолжать использование других методов контрацепции до лабораторного подтверждения эффективности хирургической контрацепции (достижение азооспермии).
- Все доступные данные показывают, что вазэктомия при длительном наблюдении не ассоциирована с серьезными нежелательными последствиями для здоровья.
- Наиболее эффективной методикой является вазэктомия с фасциальной интерпозицией и прижиганием просвета семявыносящего протока.
Сообщается о большом количестве успешных случаев при хирургической коррекции вазэктомий (до 90%), это зависит от времени, прошедшего между вазэктомией и планируемым вмешательством, типа вазэктомии (например, допускающая восстановление или окончательная), типа восстановления семявыносящего протока (вазо-вазостомия или вазоэпидидимостомия) и успешности восстановительных операций с одной или обеих сторон. Вазо-вазостомия может быть выполнена как макроскопически, так и микроскопически. Предпочтительными признаются микрохирургические методы восстановления проходимости с применением операционного микроскопа и использованием шовных нитей 9/0-10/0.
Эффективность вазо-вазостомии достигает 90%. Результаты исследования свидетельствуют о том, что чем больше времени проходит после вазэктомии, тем ниже шансы наступления беременности. Исследовательская группа изучила 1469 пациентов, подвергшихся микрохирургической реконструктивной операции после вазэктомии. По результатам исследования восстановление сперматогенеза и частота наступления беременности составили:
- менее 3 лет после вазэктомии: восстановление сперматогенеза 97%; частота наступления беременности 76%;
- от 3 до 8 лет после вазэктомии: восстановление сперматогенеза 88%; частота наступления беременности 53%;
- от 9 до 14 лет после вазэктомии: восстановление сперматогенеза 79%; частота наступления беременности 44%;
- ≥15 лет после вазэктомии: восстановление сперматогенеза 71%; частота наступления беременности 30%.
Криоконсервация сперматозоидов (эякулята)
Криоконсервация – это хранение биологических материалов при температуре, близкой к абсолютному нулю, например -80 или -196 °C (температура кипения жидкого азота), при которой биохимические процессы клеточного метаболизма замедляются либо прекращаются. При температуре -196 °C прерываются биохимические реакции, которые лежат в основе гибели клетки.
Криоконсервация впервые была применена ветеринарами в 1940-х гг., адаптирована для хранения человеческого эякулята (сперматозоидов) в 1950-х гг. Первая беременность, наступившая от эякулята после криоконсервации, описана в 1954 г. В репродуктивной медицине подвергать криоконсервации можно следующие ткани: семенную жидкость (эякулят), ткань яичка или яичников и эмбрионы на ранних стадиях развития.
Эякулят принимают на хранение во многих клиниках по следующим показаниям.
- Перед потенциально стерилизующей химиотерапией или лучевой терапией по поводу злокачественных опухолей и неопухолевых заболеваний.
- Перед предстоящей операцией, после которой возможно резкое снижение фертильности мужчины (например, при операциях на шейке мочевого пузыря у молодых мужчин или удалении яичка у мужчин при опухоли).
- Для мужчин с прогрессирующим снижением качества эякулята в результате заболеваний, ассоциированных с риском последующей азооспермии (к примеру, гигантские аденомы гипофиза, краниофарингеомы, синдром «пустого» турецкого седла, хронические нефропатии, неконтролируемый сахарный диабет, рассеянный склероз).
- Для мужчин с параплегией, когда эякулят получен с помощью трансректальной электростимуляции.
- Для мужчин с психогенной анэякуляцией, после получения сперматозоидов с помощью электростимуляции эякуляции или с использованием хирургических процедур по выделению сперматозоидов.
- После терапии гонадотропином у мужчин с гипогонадотропным гипогонадизмом в случае успешной индукции сперматогенеза.
- Для мужчин с НОА шанс выделить сперматозоиды с использованием техники TESE составляет приблизительно 60-70%; криоконсервация может быть использована для выделения сперматозоидов для ИКСИ в количестве, позволяющем избежать дополнительной индукции суперовуляции у партнерши. Криоконсервация также применяется во избежание повторных процедур по выделению сперматозоидов в будущем.
- При любой ситуации, когда сперматозоиды получены с использованием хирургических процедур по их выделению (например, из-за неудач восстановительной операции после вазэктомии или в некоторых случаях эпидидимальной обструкции, не устранимой хирургическим путем).
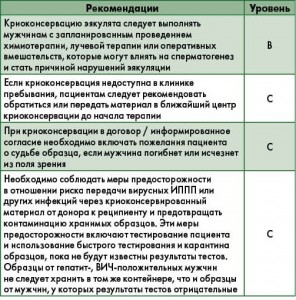
- Криоконсервация и 3-6 мес карантинного периода при хранении донорского эякулята снижают риск передачи инфекций; в большинстве стран свежий эякулят уже не используется.
Техники криконсервации, используемые в настоящее время, не полностью оптимальны, так как и при криоконсервации, и в процессе хранения отмечается повреждение клеток. Наибольшие повреждения наблюдаются при замораживании и размораживании. Основная причина повреждения в процессе заморозки – формирующиеся кристаллы льда и клеточная дегидратация, приводящие к разрыву клеточных мембран и внутриклеточных органелл. Морфология, подвижность и жизнеспособность сперматозоидов значительно снижаются после размораживания. Криоконсервация также повышает риск повреждения ДНК сперматозоидов. Кроме того, повреждения могут быть вызваны контаминацией образцов микроорганизмами и высокой концентрацией свободных радикалов кислорода. С целью редуцирования процесса формирования кристаллов льда до заморозки добавляется специальный раствор для криоконсервации. Различные растворы для криоконсервации доступны в продаже, большинство из них содержат различные пропорции глицерина и альбумина. После замораживания материал погружают в жидкий азот. С целью снижения риска повреждения клеток при замораживании и размораживании разработан ряд методик.
- Быстрый метод: в течение 10 мин образцы предварительно держатся в парах жидкого азота до их непосредственного погружения в жидкий азот.
- Медленный метод: постепенное замораживание в паровой фазе жидкого азота в течение 40 мин.
- Программное (автоматическое, аппаратное) замораживание путем снижения температуры со скоростью 1-10 °C/мин.
Выбор методики определяется возможностями лаборатории. Независимо от методики замораживания следует проводить контрольный анализ донорского эякулята после его размораживания, регулярно применять программы по контролю за качеством.
С увеличением длительности хранения и повторными замораживаниями и размораживаниями уменьшается вероятность жизнеспособности сперматозоидов. Максимальная длительность хранения живых сперматозоидов неизвестна. Большинство лабораторий и регуляторных органов устанавливают лимит длительности хранения не более 10 лет; однако иногда требуется более длительное хранение (например, для 17-летнего мужчины, у которого перед проведением химиотерапии по поводу герминогенной опухоли был взят эякулят для хранения).
Стандартная криоконсервация в полипропиленовых капиллярах – эффективный способ хранения большого объема эякулята (например, в программах донорского оплодотворения). В то же время при microTESE получают совсем небольшое количество сперматозоидов, поэтому выбор делается между замораживанием собственно ткани яичка с последующим выделением сперматозоидов после размораживания и замораживанием полученного количества сперматозоидов. Если эякулят замораживается в капиллярах, то после размораживания сперматозоиды в нем обнаруживаются с трудом. После хирургической экстракции сперматозоидов более эффективна их заморозка в форме шариков (микросфер) или в микроконтейнере.
Основной мерой предосторожности является взятие материала для хранения только у пациента, которому был проведен бактериальный анализ эякулята и подтверждена его стерильность. Донорские образцы следует тестировать на вирусы (гепатита В и С, ВИЧ) и ИППП (C. trachomatis, гонорея, сифилис). До получения результатов микробиологических анализов образцы должны храниться в индивидуальных карантинных емкостях. Некоторые лаборатории используют дополнительные меры предосторожности в виде двойного обертывания капилляров перед заморозкой. Этот дорогостоящий вариант может влиять на процесс замораживания и, таким образом, снижает качество эякулята после размораживания. Некоторые центры выполняют анализ на цитомегаловирусную инфекцию (ЦМВ), в результате ЦМВ-отрицательные и ЦМВ-положительные образцы хранятся раздельно.
Заслуживают внимания и этические аспекты по хранению гепатит- или ВИЧ-положительных образцов мужчин, сдавших эякулят до начала химиотерапии по поводу злокачественных опухолей. Очень небольшое количество клиник имеют возможность хранить ВИЧ-положительные образцы. Тем не менее успехи противовирусной терапии увеличивают число ВИЧ-положительных мужчин, которые хотят сохранить сперму. Нужно отметить, что передача ВИЧ детям при использовании ВИЧ-положительного эякулята снизилась до 5% благодаря технике «отмывания» сперматозоидов перед ЭКО.
Для предотвращения потери сохраняемого материала по возможности следует соблюдать следующие меры безопасности.
- Все используемые для хранения емкости необходимо оснастить системой оповещения, которая активируется при повышении температуры или утечке жидкого азота.
- Система оповещения персонала в лаборатории должна функционировать 24 ч в сутки 365 дней в году.
- Идеально, если имеются запасные контейнеры для хранения, в которые можно будет переместить образцы при повреждении прежней емкости.
При злокачественных новообразованиях и некоторых других заболеваниях могут пройти годы, прежде чем понадобится сохраненный материал. В течение этого времени владельцы образцов могут исчезнуть из поля зрения или умереть, и в дальнейшем с хранящимися «сиротскими» образцами они никак не соприкасаются. Обязанности лаборатории и законных владельцев таких материалов могут создавать немалые проблемы. Наилучшим вариантом следует считать инструкции владельца, в которых указывается, сколько должен храниться материал и что с ним делать в случае смерти владельца или при его исчезновении из поля зрения. В некоторых странах от владельцев требуют подписания инструкций-соглашений. Варианты использования образцов владельца определяются законами страны, возможностями их присвоения во всех ситуациях; они включают:
- указание на то, что данный образец должен быть уничтожен;
- использование данного образца женой или партнером;
- использование данного образца в исследовательских целях;
- дар данного образца для помощи другой бесплодной паре.
Криоконсервация ухудшает качество эякулята. После разморозки образца подвижность и морфология ухудшаются, включая митохондриальные акросомальные повреждения и повреждения хвоста сперматозоидов. После разморозки у 31% сперматозоидов снижается подвижность, у 36% – митохондриальная активность, морфологическое разрушение наступает в 37% случаев. Подвижность лучше всего коррелирует со способностью размороженного образца к ЭКО. Дальнейшее улучшение метода может достигаться путем селекции субпопуляции сперматозоидов с наилучшей подвижностью и целостностью ДНК, замораживанием этих сперматозоидов в составе семенной плазмы.
Перевел с англ. Александр Гладкий