15 грудня, 2015
Биластин в лечении аллергического ринита
Аллергический ринит (АР) – широко распространенное заболевание, которое ежегодно поражает от 10 до 30% взрослых и до 40% детей [1]. АР не несет угрозы жизни, но существенно снижает ее качество и продуктивность [2-5]. Более того, АР часто ассоциируется с коморбидной астмой и при отсутствии должного лечения может повлечь за собой другие проблемы со здоровьем, включая острый/хронический синусит, рецидивирующий назальный полипоз, средний отит, апноэ во сне, респираторные инфекции, а также может послужить усугубляющим или предрасполагающим фактором астмы [6].
Традиционно АР в зависимости от времени возникновения симптомов и природы основных аллергенов классифицировали на сезонный (САР) и круглогодичный (КАР). Позже экспертная группа ARIA (Allergic Rhinitis and its Impact on Asthma) совместно со Всемирной организацией здравоохранения предложили классифицировать АР на «интермиттирующий» и «персистирующий» в зависимости от длительности симптомов [7].
Симптомы АР обусловлены в первую очередь действием гистамина, который высвобождается из тучных клеток. Гистамин осуществляет свои биологические эффекты, действуя на рецепторы четырех подгрупп: H1-H4 [8]. Рецепторы H1 играют самую важную роль при аллергии. Они опосредуют образование аллергических папул и гиперемию в ответ на поступление гистамина в кожу, а также сокращение гладких мышц и повышение секреции слизи в дыхательных путях. В носовой полости гистамин стимулирует чувствительные нервные окончания, в результате чего возникают зуд и чихание, повышает проницаемость сосудистой стенки, что приводит к назальной
обструкции, усиливает секрецию желез, вызывая ринорею.
Поскольку большинство симптомов аллергии обусловлены действием гистамина на H1-рецепторы, для лечения аллергических заболеваний, включая АР, в течение многих лет успешно применялись H1-антигистаминные препараты.
В зависимости от эффектов в отношении центральной нервной системы (ЦНС) все H1-антигистаминные молекулы классифицируются на препараты первого и второго поколений (табл. 1) [7]. Препараты первого поколения подавляют функцию ЦНС, что клинически отражается в седации, сонливости и нарушении психомоторной деятельности. Препараты второго поколения минимально или совсем не влияют на ЦНС в терапевтических дозах [7]. Некоторые H1-антигистаминные препараты применяются как топические средства для лечения назальных и глазных симптомов (табл. 1). H1-антигистаминные препараты второго поколения характеризуются высокой избирательностью к H1-рецепторам, а их сродство к другим рецепторам (холинергическим, адренергическим или серотонинергическим) намного меньше, чем к H1. Более того, в отличие от
препаратов первого поколения H1-антигистаминные препараты второго поколения медленно метаболизируются, поэтому могут применяться один раз в день [7].
Хотя H1-антигистаминные препараты имеют одинаковый механизм действия, они различаются по химической структуре, фармакокинетике, клинической эффективности и профилю побочных эффектов.
Химическая структура, фармакокинетика и фармакодинамика биластина
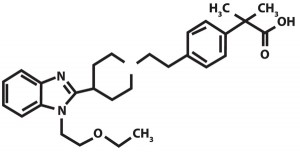
Биластин, 2-[4-(2-(4-(1- (2-этоксиэтил 1)-H-бензимидазол-2-ил) пиперидин-1-ил) этил-фенил 1]-2-метилпропионовая кислота, – новый селективный H1-антигистаминный препарат, принадлежащий к производным пиперидина (рис.).
Биластин является сильным и специфичным антигистаминным средством. Исследования по изучению связывания с H1-рецепторами, которые проводились на препаратах мозжечка морских свинок и культурах эмбриональных почечных клеток человека, показали, что аффинность биластина к H1-рецепторам меньше, чем у кетотифена и пириламина, сопоставима с астемизолом и дифенгидрамином и выше, чем у широко применяемых антигистаминных препаратов второго поколения – цетиризина и фексофенадина [9]. В исследованиях in vitro на препаратах подвздошной кишки морских свинок биластин, как и цетиризин, проявлял смешанный H1-антагонизм – конкурентный и неконкурентный [9]. При этом биластин в 5,5 раз сильнее цетиризина как конкурентный антагонист и в 10 раз – как неконкурентный [9].
Потенциал биластина продемонстрировали исследования in vivo на моделях аллергии у крыс и морских свинок [10]. У крыс биластин эффективно уменьшал проницаемость капилляров, вызванную внутрикожными инъекциями гистамина [10]. При пероральном введении
биластин проявлял дозозависимую антигистаминную активность, начиная с дозы 1 мг/кг. Показатель ED50 (доза, которая вызывает эффект у 50% популяции – прим. ред.)
составил 2,45 мг/кг. При этом эффект был сопоставим с цетиризином и в 4 раза сильнее, чем у фексофенадина [10].
В дозе 5 мг/кг максимальный эффект достигался через 30 мин, а достоверное снижение проницаемости капилляров наблюдалось в течение 16-18 ч после введения препарата [10]. При внутривенном введении биластин примерно в 3 раза превосходил цетиризин по антигистаминному действию с показателями ED30 0,083 и 0,281 мг/кг соответственно [10]. На экспериментальной
модели отека, вызванного внутрикожными инъекциями активатора тучных клеток 48/80 у крыс, биластин проявил эквипотентное цетиризину свойство уменьшать проницаемость капилляров [10]. У морских свинок биластин не уступал цетиризину и примерно в 4 раза превосходил фексофенадин по способности уменьшать микрососудистое пропотевание, вызванное гистамином, а также в 11 раз
сильнее, чем цетиризин, подавлял гистамин-индуцированный бронхоспазм [10]. После инъекций летальных доз гистамина морским свинкам и активатора тучных клеток 48/80 крысам биластин оказывал выраженный защитный эффект, схожий с таковым цетиризина [10].
Биластин не только обладает H1-антигистаминной активностью, но оказывает и другие противоаллергические эффекты in vitro и in vivo. Антиаллергические свойства биластина in vitro изучались на модели реакции гиперчувствительности немедленного типа Шульца-Даля на сенситизированной подвздошной кишке морских свинок [9]. Биластин продемонстрировал выраженную и зависимую от концентрации антианафилактическую активность: показатель IC50 (количество вещества, которое вызывает полумаксимальное ингибирование – прим. ред.) составил
95,5 нмоль, причем этот эффект был в три раза сильнее, чем у фексофенадина, и в 8 раз сильнее, чем у цетиризина [9]. В экспериментах in vivo биластин слабее, чем цетиризин, и сильнее, чем фексофенадин, подавлял активные и пассивные кожные анафилактические реакции [10].
Однако только биластин эффективно устранял отек, вызванный введением овечьих эритроцитов (аллергическая реакция III типа). Ни один из антигистаминных препаратов не подавлял аллергические реакции IV типа [10].
В эксперименте in vitro биластин, в отличие от цетиризина, проявил свойство подавлять анафилактоидные реакции посредством ингибирования ванкомицин-индуцированного выброса гистамина из мышиных тучных клеток линии C57 [9].
Специфичность связывания с рецепторами была показана в серии экспериментов in vitro, в которых биластин в концентрации 100 мкмоль не влиял на кривые концентрация-ответ при введении различных агонистов, таких как серотонин, брадикинин, лейкотриен D4, хлорид кальция, ацетилхолин, норадреналин, изопротеренол, аденозин и дофамин, в изолированные органы крыс,
морских свинок и кроликов [9]. Аналогично кривые концентрация-ответ при введении H2-агониста димаприта или Н3-агониста (R)-α-метилгистамина не изменялись под влиянием биластина в концентрациях 100 и 30 мкмоль соответственно [9].
Исследования фармакокинетики на животных. Абсорбция биластина быстрая, линейная и пропорциональная назначенной дозе [11, 12]. У крыс и собак площадь под кривой (AUC) концентрация-время и максимальная концентрация в плазме крови (Cmax) растут пропорционально дозе, указывая на линейную фармакокинетику препарата в дозах до 50 мг/кг [11, 12]. Биодоступность биластина составляла 25-61 и 42-69% у крыс и собак соответственно [11]. У крыс
линии Sprague-Dawley при пероральном введении меченный радиоизотопом биластин быстро абсорбировался с достижением Cmax через 1-2 ч [13]. Значительная часть циркулирующей радиоактивной метки (83,2-94,2%) была связана с неизмененным исходным препаратом, что указывает на незначительную метаболизацию биластина in vivo [13]. Примерно 75% дозы было выведено с фекалиями, 17% – с желчью, 8% – с мочой [13]. В фекалиях и моче биластин обнаруживался преимущественно в неизмененной форме, а в желчи определялся его метаболит –
окисленный конъюгат биластин-глюкуронид [13]. Повторные введения биластина подтвердили линейность кинетических параметров [12]. При повторном пероральном введении биластина в течение 26 нед в дозах до 2000 мг/кг мышам и крысам и в течение 56 нед в дозах до 1000 мг/кг собакам не наблюдалось аккумуляции препарата [12]. Гендерных или возрастных различий кинетики биластина не установлено [12]. У крыс линии Wistar биодоступность биластина преимущественно зависит от активности Р-гликопротеина; ингибирование Р-гликопротеина приводит к повышению Cmax и увеличению AUC [14].
В исследованиях in vitro при инкубации с гепатоцитами человека и других видов не было обнаружено иных путей метаболизации биластина [15]. Более того, биластин не влияет на активность печеночных ферментов семейства CYP450 (CYP2B6, CYP2A6, CYP2C8, CYP2CI9, CYP3A4, CYP1A2, CYP2C9 и CYP2EI) [15].
Исследования фармакокинетики у людей. У людей биластин демонстрирует линейную фармакокинетику в диапазоне доз 10-100 мг однократно или в качестве суточной дозы в течение 14 дней [16]. После однократного приема биластина в дозах 10, 20, 50 или 100 мг AUC концентрация время и Cmax растут дозозависимо и линейно (табл. 2) [16].
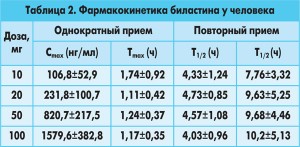
Похожие результаты были получены после приема одной дозы здоровыми добровольцами, которые уже принимали биластин в течение 2 недель [16]. Показатель Cmax у пациентов, которые регулярно принимали биластин, составлял от 99,1±24,1 до 1277,9±404,9 нг/мл для доз 10-100 мг/сут соответственно [16]. При этом аккумуляции препарата не происходило [16].
Биластин характеризуется большим объемом распределения в тканях (Vd/F): 262,7±148,4 л для дозы 10 мг/сут и 294,6±153,3 л для дозы 100 мг/сут, а также медленным выведением (Cl/F): 23,16±5,82 л/ч для дозы 10 мг/сут и 20,22±3,67 л/ч для дозы 100 мг/сут [16]. Средний период
полувыведения из плазмы (T1/2) существенно не изменялся при однократном приеме от 10 до 100 мг биластина [16]. При регулярном ежедневном приеме T1/2 увеличивался [16].
Не установлено значимых влияний возраста или пола на изучавшиеся параметры [17], хотя обсуждается необходимость коррекции дозы у пожилых пациентов.
В исследовании фармакокинетики препарата у больных почечной недостаточностью было показано, что почечный и плазменный клиренс биластина после приема одной дозы 20 мг напрямую зависит от скорости клубочковой фильтрации [18]. Однако даже у пациентов с тяжелой почечной недостаточностью концентрация биластина в плазме через 24 ч после приема составляла <5% от
Cmax, указывая на то, что аккумуляция биластина у данной категории больных маловероятна, поэтому коррекция дозы не нужна [18].
Также изучались возможные взаимодействия биластина с другими лекарственными препаратами и пищей. У 24 взрослых здоровых добровольцев, которые 7 дней получали биластин в дозе 20 мг/сут, сопутствующее назначение кетоконазола – известного ингибитора Р-гликопротеина и фермента CYP3A4 – в дозе 200 мг дважды в сутки привело к увеличению системной экспозиции биластина более чем в 2 раза, что определялось по показателям Cmax и AUC концентрация-время [19]. Прием биластина с 240 мл грейпфрутового сока (ингибитор фермента системы цитохрома CYP3A4 – прим. ред.) приводил к уменьшению Cmax на 33%, а AUC на 24% по сравнению с запиванием препарата таким же объемом воды [20]. Это говорит о том, что грейпфрутовый сок ограничивает системную экспозицию биластина сходным образом, как это происходит с фексофенадином.
Клинические исследования
Эффективность пяти доз биластина (2,5; 5; 10; 20 и 50 мг) при аллергической кожной сыпи изучалась в двойном слепом плацебо-контролируемом перекрестном исследовании у 21 здорового добровольца, которые перорально принимали одну дозу препарата [21]. Все дозы биластина обеспечивали сопоставимую с цетиризином (10 мг) или более высокую эффективность от начала исследования до 12 ч после приема; ингибирование аллергической реакции достигало 50%. Через 24 ч только самая высокая доза биластина по-прежнему обеспечивала ингибирование кожной реакции на 50% [20]. Сравнение площади под кривыми, отражающими динамику размера аллергических папул во времени, показало, что биластин в дозе 20 мг не уступал по эффективности цетиризину в дозе 100 мг [21].
Баланс между периферическими H1-антигистаминными эффектами биластина и нежелательными влияниями на ЦНС изучали в рандомизированном перекрестном двойном слепом исследовании с двойным контролем у 20 здоровых молодых добровольцев [22]. Эффекты биластина сравнивали с плацебо и гидроксизином – H1-антигистаминным препаратом первого поколения с известным подавляющим влиянием на ЦНС [22]. Антигистаминную активность биластина оценивали после приема одной дозы и через 7 дней терапии в трех дозах (20, 40 и 80 мг), измеряя объективный показатель – уменьшение размеров гистамин-индуцированной кожной сыпи, а также по субъективным данным – выраженности боли, зуда и жжения по визуальной аналоговой шкале (ВАШ). Действие на ЦНС изучали с использованием психомоторного теста (PPT), в котором оцениваются двигательная активность, восприятие, внимание и ассоциативная интеграция [22]. Кроме того, учитывалась и субъективная оценка влияния препарата на жизнедеятельность по ВАШ. Биластин показал себя как мощный H1-антигистаминный препарат с быстрым началом действия, во всех изучавшихся дозах достоверно превосходил плацебо, уменьшая размеры гистамин-индуцированной сыпи с 2 до 8 ч после приема [22]. Магнитуда супрессивного эффекта через 4, 6 и 8 ч после приема дозы была сопоставимой с таковой у гидроксизина в дозе 25 мг. Через 1 ч после приема однократная доза 20 мг биластина была менее эффективной, чем дозы 40 и 80 мг, но все-таки превосходила по эффективности плацебо. Через 1 и 2 ч после приема гидроксизин в дозе 25 мг уступал по эффективности всем дозам биластина. Две высшие дозы биластина обеспечивали достоверную редукцию гистамин-индуцированной сыпи через 24 ч после приема; величина эффекта была сравнимой с действием гидроксизина в дозе 25 мг. Похожий профиль периферической анти-Н1-активности наблюдался после 7 дней повторного приема препарата [22].
Как при однократном, так и при повторном приеме биластина в дозе 20 мг не отмечалось ни объективных, ни субъективных признаков подавляющего влияния на ЦНС [22]. Назначение более высоких доз ассоциировалось с субъективным ощущением седации, но объективное ухудшение результатов теста РРТ наблюдалось только после приема 80 мг биластина, при этом действие на ЦНС все же было достоверно меньшим, чем у гидроксизина в дозе 25 мг. Подавление ЦНС происходило между 1 и 8 ч после приема дозы. При повторном приеме биластина в течение 7 дней через 24 ч после приема последней дозы не наблюдалось отклонений результатов теста РРТ или субъективных жалоб на седацию [22].
Эффективность биластина при АР. Эффективность биластина изучали у пациентов с САР и КАР. Терапевтические эффекты биластина при САР оценивали в двух больших международных двойных слепых плацебо-контролируемых исследованиях с участием 1400 пациентов [23, 24]. В исследованиях применялись почти идентичные дизайны, критерии эффективности и безопасности, но только в первом из них оценивалось влияние на качество жизни. В обоих исследованиях применяли двойной контроль: плацебо и альтернативный Н1-антигистаминный препарат второго поколения. В качестве первичного исхода оценивали площадь под кривой общего счета симптомов (TSS), в котором учитывали назальные и неназальные симптомы. Пациенты отмечали симптомы в дневнике с первого по 14-й день. Назальные (заложенность, ринорея, чихание и зуд) и неназальные симптомы (глазной зуд, жжение, покраснение, ощущение постороннего тела в глазу, слезотечение, зуд в ушах или области неба) ранжировали в баллах от 0 до 3, где 0 – отсутствие симптома, 1 – легкий симптом, иногда возникающий, но не тревожащий; 2 – умеренно выраженный симптом, который появляется часто и беспокоит; 3 – резко выраженный симптом, который присутствует постоянно и нарушает сон и работоспособность [23, 24]. Вторичными исходами служили общая оценка дискомфорта, вызванного ринитом, и общее клиническое впечатление исследователя (GCI). Дискомфорт измеряли по ВАШ, а общее впечатление врача основывалось на выраженности терапевтического эффекта и побочных явлений. Дополнительно в одном из исследований оценивали семь доменов качества жизни, связанных с риноконъюнктивитом: ограничения активности, эмоциональный фон, глазные симптомы, неполлинозные симптомы, назальные симптомы, влияние на трудоспособность, расстройства сна. Каждый из аспектов пациенты оценивали по 7-балльной шкале, где 0 – не беспокоящие проявления, 7 – резко нарушающие жизнедеятельность проявления [22].
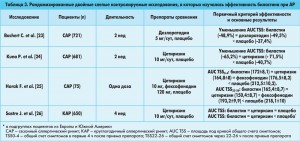
В обоих исследованиях у пациентов с САР (n=1402) первичный критерий (площадь под кривой общего счета симптомов) достоверно уменьшился относительно исходного в группе биластина сопоставимо с группой активного препарата сравнения, и этот эффект достоверно превосходил эффект плацебо (табл. 3). Назальные и неназальные симптомы АР прогрессивно уменьшались в группах активной терапии с достоверными отличиями от группы плацебо [23, 24]. Оценка пациентами дискомфорта от ринита и GCI исследователей на 14-й день также указывали на преимущества биластина и активных компараторов перед плацебо [24]. В исследовании с оценкой влияния на качество жизни пациентов биластин и дезлоратадин достоверно превосходили плацебо по этому критерию: оба препарата улучшали общую оценку на 1,6 балла, плацебо – на 1,3 балла; р<0,005 [23].
Достоверное преимущество активной терапии перед плацебо отмечалось уже с первого дня согласно оценкам TSS, которые пациенты делали дважды в день [24]. По сравнению с плацебо на фоне терапии биластином и цетиризином значительно уменьшились индивидуальные оценки назальных и неназальных симптомов через 7 дней и, за исключением покраснения глаз, через 14 дней лечения [24]. Улучшение оценок назальных и неназальных симптомов по сравнению с исходными было достоверно большим в группах биластина (42,4 и 49,8% соответственно) и цетиризина (48,2 и 51,0% соответственно), чем в группе плацебо (26,9 и 27,6% соответственно; р<0,001 для всех сравнений). Подобным образом субъективные оценки дискомфорта, вызванного ринитом, а также GCI исследователей на 14-й день указывали на преимущества биластина и цетиризина перед плацебо [24].
Эффективность биластина при САР также была показана в исследовании с контролируемой экспозицией аллергена (Vienna Challenge Chamber) [25]. Биластин в дозе 20 мг не уступал по эффективности 10 мг цетиризина и 120 мг фексофенадина в первые 4 ч после приема, достоверно уменьшая общий счет симптомов по сравнению с плацебо. Через 22-26 ч после приема последней дозы биластин и цетиризин были эффективнее фексофенадина и плацебо [25].
В большом международном двойном слепом плацебо-контролированном исследовании у пациентов с КАР биластин в дозе 20 мг один раз в сутки не уступал по эффективности 10 мг цетиризина и превосходил плацебо только в подгруппах пациентов из Европы и Южной Америки [26]. Причиной недостаточной эффективности биластина в общей популяции исследования была большая вариабельность оценок симптомов, поступавших из разных стран, особенно у пациентов из Южной Африки [26].
Безопасность
В целом терапия биластином была безопасной и хорошо переносилась в дозах от 2,5 до 80 мг/сут [16, 17, 22, 23, 24]. Как доклинические, так и клинические исследования с участием 2000 пациентов установили, что биластин в дозе 20 мг/сут чаще всего вызывает такие побочные эффекты, как головная боль, сонливость, утомляемость и диспноэ, но они регистрировались реже, чем у больных, принимавших Н1-антигистаминный препарат первого поколения гидроксизин, и реже, чем у пациентов, которые принимали 10 мг цетиризина в день [23, 24]. Частота побочных эффектов биластина в дозе 20 мг один раз в сутки, которая использовалась для лечения АР, была сравнима с таковой у дезлоратадина [23]. Частота сонливости и психомоторной заторможенности была выше, чем в группе плацебо, только у пациентов, которые получали биластин в дозе 40 мг/сут [22]. Однако она была по-прежнему меньшей, чем у больных, принимавших 10 мг цетиризина [22]. Ни одна из доз биластина (20, 40 или 80 мг) не вызывала антихолинергических эффектов, таких как сухость во рту [22-24], что согласуется с данными о высокой селективности биластина, полученными в экспериментах in vitro [9].
Биластин не вызывал побочных эффектов со стороны сердечно-сосудистой системы, в том числе не изменял интервал QT в дозах до 100 мг/сут [16, 21-24]. Одновременный прием биластина и кетоконазола – известного пролонгатора QT, – не усиливал изменения на ЭКГ [19]. Канцерогенность биластина в экспериментах на крысах и мышах не установлена.
Заключение
Биластин является мощным и высокоселективным антигистаминным препаратом второго поколения с доказанной эффективностью и безопасностью при лечении САР. В терапевтических дозах биластин хорошо переносится и не вызывает нарушений психомоторных функций.
Литература
1. Settipane R.A., and Schwindt C. Chapter 15: Allergic rhinitis. Am J Rhinol Allergy 27(suppl): S52-S55, 2013.
2. Meltzer E.O., Blaiss M.S., Nacleiro R.M. et al. Burden of allergic rhinitis: Allergies in America, Latin America and Asia-Pacific adult surveys. Allergy Asthma Proc 33: S113-141, 2012.
3. Kakumanu S., Glass C. and Craig T. Poor sleep and daytime somnolence in allergic rhinitis: Significance of nasal congestion. Am J Respir Med 1: 195-200, 2002.
4. De la Hoz Caballer B., Rodriguez M., Fraj J. et al. Allergic rhinitis and its impact on work productivity in primary care practice and a comparison with other common diseases: The cross-sectional study to evaluate work productivity in allergic rhinitis compared with other common diseases (CAPRI) study. Am J Rhinol Allergy 26: 390-394, 2012.
5. Thompson A.K., Juniper E. and Meltzer E.O. Quality of life in patients with allergic rhinitis. Ann Allergy Asthma Immunol 85: 338-347, 2000.
6. Leynaert B., Neukirch F., Demoly P. et al. Epidemiologic evidence for asthma and rhinitis comorbidity. J Allergy Clin Immunol 106 (suppl 5): S201-S205, 2001.
7. Bousquet J., van Cauwenberge P. and Khaltaev N. Allergic rhinitis and its impact on asthma. J Allergy Clin Immunol 108 (suppl 5): S147-S334, 2001.
8. Bachert C. The role of histamine in allergic disease: Re-appraisal of its inflammatory potential. Allergy 57: 287-296, 2002.
9. Corcostegui R., Labeaga L., Innerarity A. et al. Preclinical pharmacology of bilastine, a new selective histamine H1 receptor antagonist. Drugs R D 6: 371-384, 2005.
10. Corcostegui R., Labeaga L., Innerarity A. et al. In vivo pharmacological characterization of bilastine, a potent and selective histamine H1 receptor antagonist. Drugs R D 7: 219-231, 2006.
11. Gonzalo A., Lucero M., and Orjales A. Preclinical pharmacokinetics of bilastine, a new antihistamine drug, in rats and dogs. AAPS J 2007.
12. Ganza A., Gonzalo A., Lucero M.L. and Orjales A. Toxicokinetics of bilastine in animals: The effects of the dose and route of administration. Toxicol Lett 180 (suppl): S70, 2008.
13. Mumford R., Allan L., Hoey R. et al. The disposition, metabolism and elimination in rats of bilastine, a potent, selective H1 receptor antagonist. Drug Metab Rev 39 (suppl I): 200-201, 2007.
14. Gonzalo A. and Lucero M.L. Identification of processes involved in bilastine bioavailability in rats. Drug metab Rev 40 (suppl I): 42-43, 2008.
15. Lucero M.L., Orjales A. and Morag N. In vitro hepatic metabolism of [14C]-bilastine. Drug Metab Rev 39 (suppl I): 114, 2007.
16. Roupe K., Sologuren A., Crean C. and Valiente R. The pharmacokinetics of bilastine after single and 14 days once daily administration. Basic Clin Pharmacol Toxicol 101(suppl 1): 148, 2007.
17. Roupe K., Sologuren A., Crean C. and Valiente R. Effects of age and gender on the pharmacokinetics and pharmacodynamics of bilastine. J Clin Pharmacol 47: 1198, 2007.
18. Lasseter K.C., Sologuren A., La Noce A. and Dilzer S.C. Evaluation of the single-dose pharmacokinetics of bilastine in subjects with various degrees of renal insufficiency. Clin Drug Investig 33: 665-673, 2013.
19. Sologuren A., Crean C., Veliente R. and McLeverty D. The drug-drug interaction of ketoconazole on bilastine pharmacokinetics. Basic Clin Pharmacol Toxicol 101(suppl 1): 148-149, 2007.
20. Crean C., Valiente R., Sologuren A. and McLaverty D. Effect of grapefruit juice on the pharmacokinetics of bilastine. J Clin Pharmacol 47: 1198, 2007.
21. Sologuren A., Valiente R., Crean C. and McLaverty D. Relationship of dose to inhibition of wheal and flare for 5 doses of bilastine and 10 mg cetirizine. J Clin Pharmacol 47: 1198, 2007.
22. Garcia-Gea C., Martinez-Colomer J., Antonijoan R.M. et al. Comparison of peripheral and central effects of single and repeated oral dose administrations of bilastine, a new H1 antihistamine: A dose-range study in healthy volunteers with hydroxyzine and placebo as control treatments. J Clin Psychopharmacol 28: 675-685, 2008.
23. Bachert C., Kuna P., Sanquer F. et al. The Bilastine International Working Group. Comparison of the efficacy and safety of bilastine 20 mg vs desloratadine 5 mg in seasonal allergic rhinitis patients. Allergy 64: 158-165, 2009.
24. Kuna P., Bachert C., Nowacki Z. et al.; The Bilastine International Working Group. Efficacy and safety of bilastine 20 mg compared with cetirizine 10 mg and placebo for the symptomatic treatment of seasonal allergic rhinitis: A randomized, double-blind, parallel-group study. Clin Exp Allergy 39: 1338-1347, 2009.
25. Horak F., Zieglmayer P., Zieglmayer R. and Lemell P. The effects of bilastine compared with cetirizine, fexofenadine, and placebo on allergen-induced nasal and ocular symptoms in patients exposed to aeroallergen in the Vienna Challenge Chamber. Inflamm Res 59: 391-398, 2010.
26. Sastre J., Mullol A., Valero A. and Valiente R. Bilastine Study Group. Efficacy and safety of bilastine 20 mg compared with cetirizine 10 mg and placebo in the treatment of perennial allergic rhinitis. Curr Med Res Opin 28: 121-130, 2012.
Am J Rhinol Allergy 28, 312-316, 2014
Перевод с англ. Дмитрия Молчанова