9 грудня, 2016
Анемия и диализ: возможности медикаментозной коррекции анемического синдрома у пациентов с хронической почечной недостаточностью
Анемия – характерный сопутствующий синдром хронической болезни почек (ХБП), особенно у пациентов с терминальной стадией заболевания, получающих почечно-заместительную терапию. Тяжелая форма анемии (уровень гемоглобина <90 г/л) у пациентов на программном диализе ассоциируется с повышением риска смерти, когнитивными нарушениями, ухудшением качества жизни и требует своевременной, адекватной коррекции.
Согласно данным регистра Европейской почечной ассоциации (European Renal Association), в программном гемодиализе (ПГ) нуждаются 300 человек с терминальной хронической почечной недостаточностью (ХПН) на 1 млн населения. Ежегодный прирост числа больных, нуждающихся в лечении ПГ, составляет 150-200 на 1 млн жителей, а с учетом уже получающих данное лечение – от 460 до 900 на 1 млн жителей. Коррекция терминальной ХПН проводится с помощью ПГ, перитонеального диализа и трансплантации почки.
Эффективное лечение таких больных и снижение общей смертности возможно только благодаря ранней диагностике и своевременной коррекции возникающих осложнений. Известно, что анемия усугубляет гипоксию головного мозга и ускоряет развитие уремической полинейропатии, повышает риск неблагоприятных исходов у пациентов с ХБП, таких как смертность, прогрессирование ХБП и сердечно-сосудистых заболеваний, госпитализация.
Анемия является наиболее ранним и частым осложнением ХБП, развивается уже на ранних стадиях заболевания и наиболее выражена при снижении скорости клубочковой фильтрации (СКФ) до 40-60 мл/мин/1,73 м2. Анемия отмечается у 50-80% больных с компенсированной ХПН и у 100% с терминальной ХПН (Astor B. C. et al., 2002; Ермоленко В. М., Филатова Н. Н., 2004; Статинова Е. А., 2008).
Распространенность и выраженность анемии у больных ХБП в Украине значительно превышает аналогичные показатели развитых стран. Так, по данным Европейского исследования по лечению анемии (European Survey of Anaemia Management – ESAM), в странах Западной Европы целевого уровня гемоглобина >110 г/л достигают 53% пациентов с ХБП, в Украине же, по данным реестра больных ХБП, – не более 20% (Милованова Л. Ю. и соавт., 2009).
! Как правило, у диализных пациентов анемия вызвана дефицитом эритропоэтина. Но известны и другие факторы, способствующие развитию и прогрессированию анемического синдрома (АС):
• укорочение длительности жизни эритроцитов;
• тромбоцитарная дисфункция, которая обусловливает повышенную кровоточивость;
• влияние на эритроциты уремических токсинов;
• снижение уровня железа вследствие неадекватного всасывания в кишечнике и при гемодиализе;
• выведение при гемодиализе фолиевой кислоты;
• индуцированный паратгормоном остеофиброз.
Для ХПН характерным является изменение обратной линейной зависимости между уровнем эритропоэтина в плазме крови и концентрацией гемоглобина, которая свойственна здоровым людям: синтез эритропоэтина не повышается пропорционально тяжести анемии (Johansen K. L. et al., 2012; KDIGO Anemia Work Group, 2012). Известно также, что при ХБП увеличивается уровень гепсидина, который участвует в развитии нефрогенной анемии и резистентности к стимуляторам эритропоэза (Моисеев С. В., 2012).
В клинической практике для выявления анемии опорным лабораторным маркером является уровень гемоглобина крови. Определение только гемоглобина уже дает возможность установить наличие и степень тяжести АС.
! Критерием анемии у пациентов с ХБП служит уровень гемоглобина:
• <130 г/л у мужчин и женщин в менопаузе;
• <120 г/л у женщин до менопаузы.
Степени тяжести анемии:
• легкая – уровень гемоглобина <130 г/л ≥100 г/л для мужчин и <120 г/л ≥100 г/л для женщин;
• среднетяжелая – <100 г/л ≥70 г/л;
• тяжелая – <70 г/л.
Диагностика анемии включает в себя: общий анализ крови с подсчетом количества эритроцитов и эритроцитарных индексов, лейкоцитов и лейкоцитарной формулы, тромбоцитов; уровень ферритина сыворотки; подсчет числа ретикулоцитов сатурация трансферрина; уровень фолатов и витамина В12 (Колесник Н. А., 2015).
Тестирование на наличие анемии следует проводить всем пациентам с ХБП, независимо от уровня почечной функции. При отсутствии анемии пациентам с ХБП І-ІІІ стадии обследование проводят 1 раз в течение года или чаще при наличии показаний. Пациентам с ХБП IV-V стадии – при наличии клинических показаний, но не реже 1 раза в 6 мес, у больных с ХБП V стадии на ПГ – 1 раз в 3 мес или чаще. Если уже имеется АС, но препараты эритропоэтина не применяются, лабораторное тестирование проводят 1 раз в 3 мес пациентам с ХБП І-V или V стадии на перитонеальном диализе и 1 р/мес для пациентов на ПГ (The Kidney Disease: Improving Global Outcomes – KDIGO, 2012).
О каких клинических показаниях идет речь? Сидеропенический синдром может проявляться у пациентов уже на стадии латентного железодефицита, когда АС еще нет. Характерные клинические проявления сидеропенического синдрома хорошо известны практикующему врачу: изменения со стороны кожи и ее придатков (сухость и шелушение кожи, ломкость и истончение волос и ногтей, пастозность голеней); слизистых (ангулярный стоматит, глоссит, пародонтоз); патология желудочно-кишечного тракта (атрофия слизистой пищевода, дисфагия, атрофический гастрит); мышечной системы (недержание мочи, императивные позывы к мочеиспусканию); извращение вкуса (желание есть мел, глину, песок, уголь, сырое тесто и т. д.), тяга к определенным запахам (резина, ацетон, бензин); сидеропеническая миокардиодистрофия (тахикардия, анемия, гипотония); иммунные нарушения (увеличение частоты инфекций); функциональная печеночная недостаточность; нарушения менструального цикла; сидеропенический субфебрилитет (Колесник Н. А., 2015).
Помимо снижения уровня гемоглобина и клиники гипосидероза на железодефицитный характер анемии также указывают низкий цветовой показатель, гипохромия эритроцитов (табл.), снижение уровня железа в плазме крови, повышение общей железосвязывающей способности плазмы.
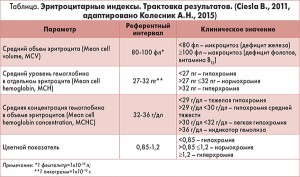
Количество ретикулоцитов в норме составляет 0,5-2,5%. Нормальное количество ретикулоцитов при наличии анемии говорит о дефиците либо снижении чувствительности костного мозга к эритропоэтину.
В последние годы особое внимание уделяют коррекции анемии у пациентов, находящихся на начальных стадиях развития ХБП. Установлено, что ранняя, проводимая на преддиализных стадиях ХБП, коррекция анемии препаратами эритропоэтина и железа улучшает качество жизни и снижает риск смерти от сердечно-сосудистых осложнений у пациентов с ХБП при последующем лечении ПД (Волгина Г. В. и соавт., 2000; The National Kidney Foundation Kidney Disease Outcomes Quality Initiative, 2000; Милованова Л. Ю. и соавт., 2009; Карманов Е. В., 2010). Поэтому коррекцию анемии можно рассматривать как важную часть стратегии снижения риска заболеваемости и смертности пациентов с ХБП как до, так и после начала диализной терапии (Курята А. В., Митрохина О. С. и соавт., 2014).
Эффективность препаратов, содержащих эритропоэтин, значительно снижается при наличии железодефицита. Поэтому восполнение дефицита железа является одним из ключевых моментов в лечении анемии. Назначение препаратов эритропоэтина увеличивает потребность организма в железе, что создает условия для развития железодефицита. При усилении эритропоэза под действием эритропоэтина скорость мобилизации железа из депо становится недостаточной для обеспечения возросших потребностей костного мозга.
Пролиферирующим эритробластам необходимо все большее количество железа, что приводит к истощению лабильного пула железа и снижению сывороточного уровня ферритина. Для мобилизации и растворения железа из гемосидерина требуется определенное время. В результате уменьшается количество поступающего в костный мозг железа, что приводит к развитию его функционального дефицита. Поэтому одной из самых частых причин низкой эффективности препаратов эритропоэтина является именно дефицит железа (Моисеев С. В., 2012; Дударь И. А. и соавт., 2014).
Необходимо отметить, что препараты эритропоэтина стимулируют синтез приблизительно 2 млн новых эритроцитов за 1 с. При недостатке доступного железа из костного мозга в кровь поступают ретикулоциты со сниженным содержанием гемоглобина. При глубоком дефиците железа нарушается синтез гемоглобина и развивается железодефицитное кроветворение (Locatelli F. et al., 2004; Добронравов В. А., Смирнов А. В., 2005). Адекватное количество доступного железа стимулирует эритропоэз и снижает потребность в эритропоэтине (Rozen-Zvi B. et al., 2008; Курята А. В. и соавт., 2014). В соответствии с последними рекомендациями KDIGO коррекцию железодефицита пациентам с ХБП и анемией следует начинать при снижении уровня ферритина менее 500 мкг/л, коэффициенте насыщения трансферрина сыворотки (КНТС) до 30%.
Пероральные препараты железа, как правило, малоэффективны у этой категории пациентов, они плохо всасываются и вызывают ряд нежелательных реакций со стороны желудочно-кишечного тракта. Внутривенные препараты железа содержат декстраны железа либо недекстрановые соединения (глюконат, сахароза, карбоксимальтоза). Применение декстрановых соединений железа ассоциировано с большой частотой реакций гиперчувствительности, в том числе анафилактическими. Поэтому предпочтение следует отдавать недекстрановым соединениям (Дударь И. А. и соавт., 2014). Применение железа сахарата ассоциировано с хорошей переносимостью, что подтверждено в исследовании, проведенном на базе 61 центра США: на фоне введения 8590 доз железа сахарата 665 больным, находящимся на гемодиализе, побочных явлений не отмечено (Yee J., Besarab A., 2002). В связи с этим рассматривается возможность применения железа сахарата в высоких дозах у пациентов с ХБП и прекращения применения низкомолекулярного декстрана железа как препарата первого ряда у пациентов с анемией при заболеваниях почек.
Назначение высоких доз внутривенного железа с малой частотой введения имеет ряд преимуществ. Уменьшается кратность посещений врача, в результате чего образ жизни пациентов (особенно если они работают) подвергается меньшим изменениям. С клинической точки зрения, целевые уровни гемоглобина и ферритина могут быть достигнуты быстрее, чем при использовании нескольких малых доз. Снижение частоты внутривенных инъекций уменьшает риск инфицирования и сохраняет вены для последующих доступов. Один из важных потенциальных клинических эффектов высокой дозы – преодоление блока, вызванного гепсидином, у пациентов с анемией хронических заболеваний. Польза от разовой дозы, по сравнению с назначением нескольких меньших доз, заключается в быстром достижении стабильного метаболизма железа. На додиализной стадии ХБП целевой уровень гемоглобина может поддерживаться только препаратами железа, хотя у большинства пациентов при неуклонном прогрессировании заболевания потребуется подключение препаратов эритропоэтина (Gozzard D., 2011).
Сегодня стратегия внутривенного применения препаратов железа зависит от доступности конкретных препаратов в различных странах. В Украине зарегистрирован и разрешен к применению железа сахарат для внутривенного применения Суфер® («Юрия-Фарм»). Данный препарат уже не первый год представлен на украинском рынке, поэтому имеется весомый клинический опыт его применения у пациентов с ХБП.
• Так, А. В. Курята, О. С. Митрохина, Т. Д. Ященко (2014) обследовали 12 пациентов с ХПН. Причинами ХПН были хронический пиелонефрит (25%), хронический гломерулонефрит (41,7%) и сахарный диабет (33,3%). Обследование включало определение содержания гемоглобина, железа, ферритина в плазме крови, характеристику клинических симптомов анемии. Критерии включения в исследование: наличие ХБП I-III стадии, железодефицитной анемии, уровень гемоглобина <110 г/л, СКФ 30-89 мл/мин/1,73 м2, отсутствие приема препаратов эритропоэтина, согласие пациента. Из исследования исключали пациентов с анемией иного генеза, связанной с острой кровопотерей, гипотиреозом, синдромом мальабсорбции. В зависимости от уровня гемоглобина пациентов распределили на две группы: 1-я (n=4) – с уровнем гемоглобина 90-110 г/л, 2-я (n=8) – 70-90 г/л. Достоверных различий между группами не выявлено. С целью коррекции анемии пациентам назначали препарат Суфер® в форме раствора для парентерального введения, 1 мл которого содержит 20 мг железа в виде железа (ІІІ) гидроксид сахарозного комплекса. Дозу препарата рассчитывали индивидуально, в соответствии с общим дефицитом железа в организме больного.
Проведенное лечение обусловило достоверное повышение показателей гемоглобина, ферритина, железа в плазме крови (p<0,01). Через 2 нед лечения уровень гемоглобина в 1-й группе повысился на 10,5%, во 2-й – на 14,5% соответственно (p<0,01). Повышение уровня гемоглобина начиналось уже с 5-го дня терапии. Для оценки функции почек на фоне анемии у пациентов определяли уровень креатинина и рассчитывали СКФ. По окончании наблюдения статистически значимых изменений со стороны СКФ среди участников исследования не отмечено, однако выявлено достоверное снижение уровня креатинина в обеих группах (p<0,01). При применении препарата Суфер® существенных побочных эффектов не выявлено. В конце наблюдения по сравнению с исходным состоянием значительных изменений уровней печеночных трансаминаз, билирубина не отмечено, что свидетельствует о хорошей переносимости терапии.
• Сходные данные были получены и в исследовании О. Д. Никитина (2015), в которое вошли 17 пациентов с ХПН. Пациенты получали препарат Суфер® в дозе 200 мг 3 р/нед. Длительность лечения составила 2-4 нед в зависимости от индивидуально рассчитанной дозы. Лечение препаратом Суфер® у всех пациентов улучшало самочувствие и уменьшало жалобы на слабость, утомляемость, снижение аппетита и головную боль. Отмечен рост уровня гемоглобина с 82,71±2,34 до 88,67±4,01 г/л на 2-й нед лечения, до 91,32±3,84 г/л – на 3-й нед, до 97,84±5,31 г/л – к концу курса лечения препаратом Суфер®. При этом ферритин плазмы крови увеличился с 138,12±9,54 до 253±10,19 нг/мл через 2 нед и до 417,82±11,08 нг/мл через 4 нед лечения.
• И. А. Дударь, Ю. И. Гончар, И. М. Шифрис и соавт. (2014) провели исследование, целью которого была проспективная оценка эффективности и переносимости препарата Суфер® при коррекции анемии у пациентов с ХБП V стадии, которые лечатся ПГ и получают эритропоэтинстимулирующие препараты. В исследование были включены 30 пациентов с ХБП V стадии на ПГ в возрасте 18-65 лет, которые лечатся гемодиализом более 3 мес и имеют уровень гемоглобина ≤100 г/л. Препарат Суфер® назначали 3 р/нед в дозе 200 г в соответствии с рекомендациями производителя: предварительно разводили раствором 0,9% NaCl в соотношении 1:20 и вводили в венозную диализную магистраль в течение не менее 30 мин. Длительность коррекции анемии составляла от 2 до 4 нед (в среднем 2,87±0,11) в зависимости от индивидуально рассчитанной дозы.
В результате проведенного лечения гемоглобин увеличился в сравнении с исходным уровнем в среднем на 5,87г/л (с 87,28±2,81 г/л до 93,15±3,04 г/л; p>0,05) – на 6,73%. Уровень ферритина достоверно увеличился на 250,41 нг/мл (с 125,15±21,46 нг/мл до 375,56±64,12 нг/мл; p<0,001) – на 200,09%. Целевого уровня ферритина достигли 23 пациента (76,67%), из них 12 человек (40% от общего числа) достигли целевого уровня гемоглобина 100 г/л. Хотя у 7 пациентов не были достигнуты целевые уровни ферритина и КНТС, эти показатели у них возросли на 189 и 124% соответственно. Вместе с тем у 4 пациентов отмечалась гиперкоррекция уровней ферритина и КНТС (ферритин – 800 нг/мл, КНТС – 50%). Терапия препаратом Суфер® имела хорошую переносимость, нежелательных побочных явлений отмечено не было. Таким образом, своевременная коррекция осложнений ХБП, в т. ч. АС, способствует улучшению качества жизни и повышению выживаемости больных.
Внутривенное введение больших доз железа более эффективно, чем прием пероральных препаратов при ХПН. Сочетанное назначение препаратов эритропоэтина и железа обеспечивает оптимальный клинический эффект. В качестве препарата выбора для насыщения депо железа может быть рекомендован Суфер® – железа (ІІІ) гидроксид сахарозный комплекс, продемонстрировавший свою эффективность и безопасность в коррекции железодефицитных состояний у пациентов с ХБП и ХПН, которые лечатся гемодиализом.
Подготовила Мария Маковецкая



