22 липня, 2021
Імунотерапія при недрібноклітинному раку легені – що нового?
20-29 травня відбувся мультидисциплінарний конгрес з міжнародною участю «Рак у молодих пацієнтів – проблеми профілактики, скринінгу, лікування, реабілітації», у рамках якого було обговорено найактуальніші медичні та біологічні проблеми, а також соціальне значення злоякісних пухлин у молодого населення України.
Серед усіх злоякісних новоутворень рак легені залишається провідною причиною захворюваності та смертності, що зумовлює необхідність активного пошуку нових підходів до його лікування. Впровадження у клінічну практику інгібіторів контрольних точок зумовило значні зміни у лікуванні багатьох злоякісних новоутворень, у тому числі й раку легені.
 Про значення пембролізумабу в першій лінії терапії пацієнтів із раком легені розповів завідувач відділення торакальної хірургії для дорослих КНП «Київська міська клінічна лікарня № 17», кандидат медичних наук Віталій Валерійович Соколов.
Про значення пембролізумабу в першій лінії терапії пацієнтів із раком легені розповів завідувач відділення торакальної хірургії для дорослих КНП «Київська міська клінічна лікарня № 17», кандидат медичних наук Віталій Валерійович Соколов.
– Медіана загальної виживаності (ЗВ) при раку легені пов’язана з його клінічною та патоморфологічною стадією (за системою стадіювання TNM). Якщо при I стадії 5-річна ЗВ становить 68-92%, то при прогресуванні захворювання вона істотно зменшується. Так, при II стадії раку легені ЗВ складає 53-60%, при III – 13-36%, а при IV – 0-10% (P. Goldstraw et al., 2016). Широкий діапазон ЗВ при I стадії раку легені зумовлений можливою наявністю пухлини розміром >4 см (T2b >4 см; TNM, версія 8), що є додатковим фактором ризику метастазування, за рахунок чого ЗВ знижується до менш ніж 70%. При підтвердженому злоякісному новоутворенні легені невеликого розміру крім морфологічної верифікації рекомендується проведення позитронно-емісійної томографії. Цей метод дає змогу виявити уражені бронхолегеневі лімфатичні вузли, що водночас із такими факторами, як гістологічний тип аденокарцинома, пухлина розміром >3 см та її центральне розташування, є додатковим показанням до проведення інвазивного стадіювання.
Найбільше протиріч щодо тактики ведення пацієнтів сьогодні виникає при виявленні ІІІА стадії (N2) недрібноклітинного раку легені (НДРЛ), яка характеризується залученням у процес лімфатичних вузлів середостіння.
Нещодавно на 101-й щорічній конференції Американської асоціації торакальних хірургів (AATS) були представлені результати дослідження, які продемонстрували переваги сегментектомії порівняно з лобектомією при периферичному НДРЛ малого розміру (інвазивна периферична карцинома ≤2 см, солідна частина/пухлина >0,5 см). Так, 5-річна ЗВ у групі сегментектомії становила 94,3 проти 91,1% у групі лобектомії, а 5-річна виживаність без прогресування (ВБП) – 88,0 проти 87,9% відповідно. При цьому функція зовнішнього дихання знижувалась меншою мірою у хворих, яким була проведена сегментектомія (середнє зниження об’єму форсованого видиху за 1 с через 6 міс складало 10,4 проти 13,1%, а через 12 міс – 8,5 проти 12,0% у групах сегментектомії та лобектомії відповідно; H. Asamura et al., 2021).
У дослідженнях EORTC08941 (2007) та ESPATUE (2015) не виявлено переваги хірургічного лікування над променевою терапією та над хіміопроменевою терапією у пацієнтів із ураженням лімфатичних вузлів середостіння (J.P. Van Meerbeeck et al., 2007; W.E. Eberhardt et al., 2015).
Метааналіз 13 рандомізованих контрольованих досліджень продемонстрував перевагу неоад’ювантної хіміотерапії (ХТ) при НДРЛ (W.A. Song et al., 2015). При цьому комбінована хіміопроменева неоад’ювантна ХТ не покращує виживаність пацієнтів та зумовлює більшу кількість побічних ефектів, ніж неоад’ювантна ХТ при ІІІА стадії НДРЛ (A. Asad et al., 2012).
Дані мережевого метааналізу показали, що оптимальною схемою лікування НДРЛ ІІІА стадії (N2) є неоад’ювантна ХТ + хірургічне втручання + ад’ювантна ХТ (Zhao et al., 2019). Це дає змогу оцінити біологічні властивості пухлини, чутливість та резистентність до лікарських засобів на основі рентгенологічної гістологічної відповіді та пухлинних маркерів у крові, забезпечує ранній вплив на мікрометастази та дозволяє провести відбір хворих із низькою функціональною здатністю.
Якщо при I стадії раку легені на сьогодні лікування залишається суто хірургічним, то у разі прогресування хвороби хірургічного втручання вже недостатньо. Революційними препаратами у лікуванні раку легені стали моноклональні антитіла – інгібітори імунних контрольних точок, зокрема блокатори білка програмованої клітинної смерті 1 (PD‑1) та його ліганда – PD-L1. Представником цієї групи препаратів є пембролізумаб (Кітруда® компанії MSD). Ефективність пембролізумабу у пацієнтів із раком легені була підтверджена у рандомізованому дослідженні III фази KEYNOTE‑024. У ньому взяли участь 305 пацієнтів із метастатичним НДРЛ з високим рівнем експресії PD-L1. Так, при медіані спостереження 11,2 міс ВБП склала 10,3 міс (95% довірчий інтервал – ДІ – 6,7 – не досягнуто) у групі пембролізумабу та лише 6,0 міс (95% ДІ 4,2-6,2) у групі ХТ (рис. 1). Частота об’єктивної відповіді на лікування була майже вдвічі вищою у групі пембролізумабу, ніж у групі ХТ (44,8 проти 27,8%; M. Reck et al., 2016).
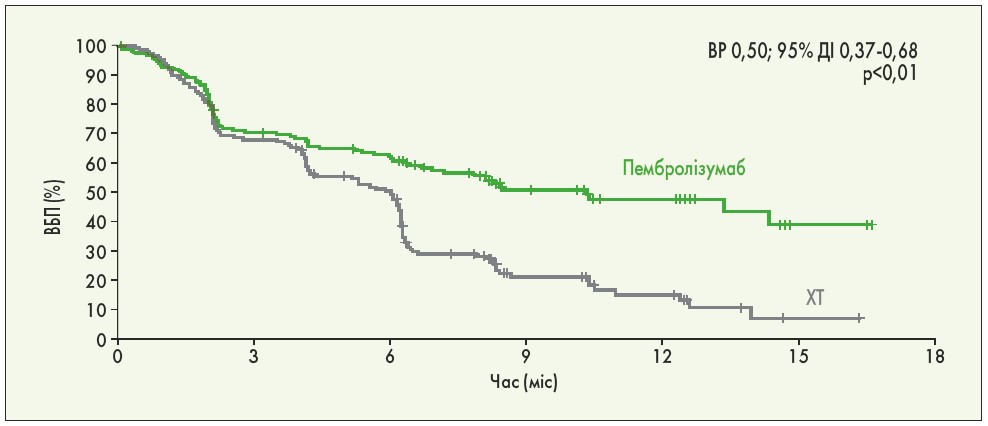 Рис. 1. ВБП у дослідженні KEYNOTE‑024
Рис. 1. ВБП у дослідженні KEYNOTE‑024
На конференції AATS у 2020 р. були представлені результати дослідження, у якому вивчали ефективність неоад’ювантної імунотерапії пембролізумабом у пацієнтів із резектабельним НДРЛ ІВ‑ІІІА стадії. Згідно з дизайном, пацієнти отримували 2 цикли пембролізумабу (200 мг) до операції, а після хірургічного втручання їм призначали ад’ювантну ХТ з променевою терапією або без неї та 4 цикли пембролізумабу (200 мг). У 25 із 35 включених у дослідження пацієнтів проведено оперативне лікування. У всіх оперованих пацієнтів було досягнуто анатомічної резекції R0 з медіастинальною лімфодисекцією. Патогістологічна відповідь була отримана у 20 (80%) з 25 пацієнтів, виражена патогістологічна відповідь – у 7 (28%) з 25.
На сьогодні для підтвердження безпеки й ефективності імунотерапії пембролізумабом у комбінації з ХТ в неоад’ювантному режимі та продовження терапії пембролізумабом в ад’ювантному режимі у пацієнтів із резектабельним НДРЛ ІІ‑ІІІВ стадії (T3N2М0) триває дослідження ІІІ фази KEYNOTE‑671.
Пембролізумаб залишається стандартом лікування метастатичного НДРЛ IV стадії, що підкріплено остаточними результатами подвійного сліпого рандомізованого дослідження ІІІ фази KEYNOTE‑189. У пацієнтів, які завершили 35 циклів введення пембролізумабу (близько 2 років), а це 56 із 410 хворих у групі пембролізумаб + ХТ, об’єктивна відповідь склала 85,7% (у 4 – повна відповідь, у 44 – часткова та у 8 – стабілізація захворювання), а медіана ЗВ досягнута не була. При медіані спостереження 31 міс (26,5-38,8 міс) були отримані достовірно кращі показники ВБП (відносний ризик – ВР – 0,49; 95% ДІ 0,41-0,59; p <0,001) та 2-річної ЗВ (ВР 0,56; 95% ДІ 0,46-0,69; p <0,001). 2-річна ЗВ склала 45,7% в групі пембролізумаб + ХТ та 27,3% в групі плацебо + ХТ, 2-річна ВБП – 22,0 та 3,4% відповідно (рис. 2-3). Позитивний вплив пембролізумабу на ЗВ був продемонстрований у всіх групах, незалежно від рівня експресії PD‑L1, проте кращі показники отримано у пацієнтів з PD-L1 TPS ≥50% (D. Rodriguez-Abreu et al., 2020).
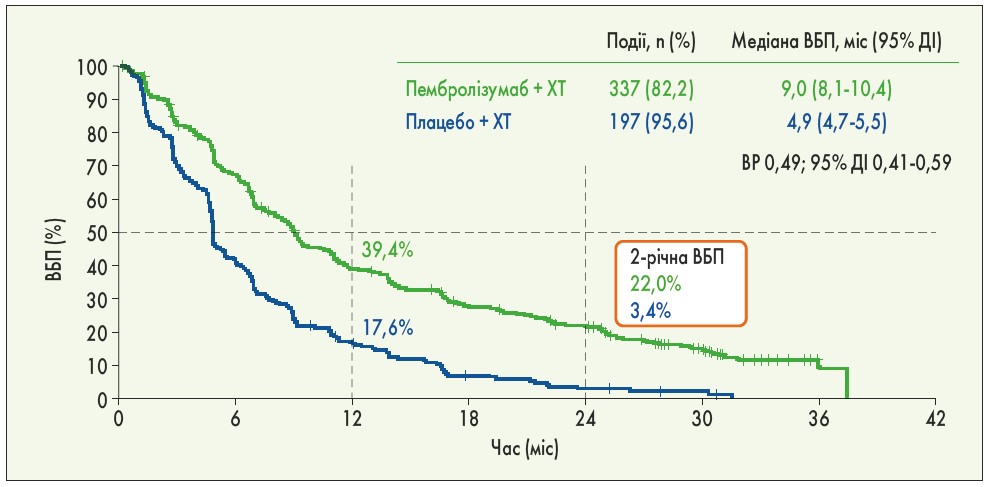 Рис. 2. 2-річна ВБП у загальній популяції хворих дослідження KEYNOTE‑189
Рис. 2. 2-річна ВБП у загальній популяції хворих дослідження KEYNOTE‑189
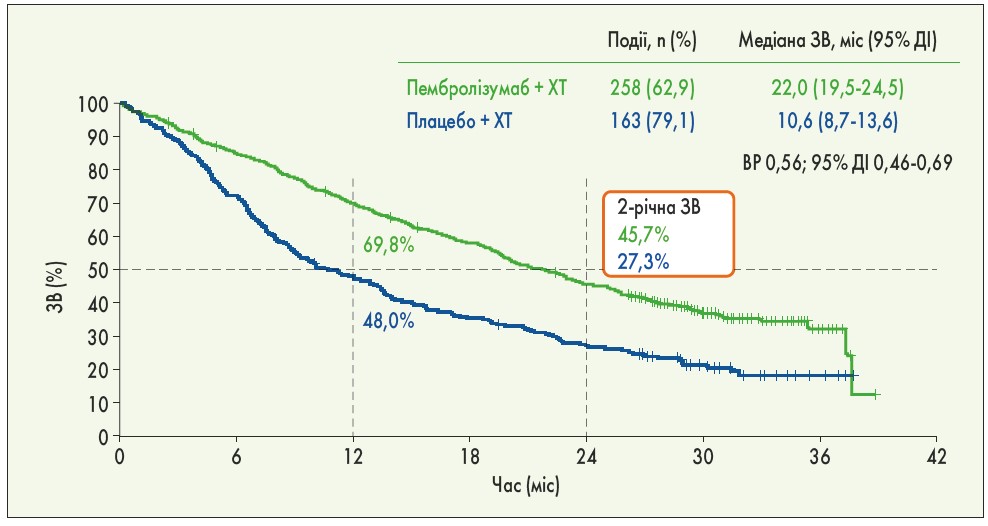 Рис. 3. 2-річна ЗВ у загальній популяції хворих дослідження KEYNOTE‑189
Рис. 3. 2-річна ЗВ у загальній популяції хворих дослідження KEYNOTE‑189
Отже, лікувальний алгоритм при раку легені передбачає насамперед проведення геномного тестування та оцінки PD-L1 статусу. При виявленні геномних таргетних змін призначають відповідні таргетні препарати. У разі відсутності геномних таргетних змін та експресії PD‑L1 ≥50% рекомендована монотерапія пембролізумабом, а за відсутності геномних таргетних змін та PD-L1 статусу <50% – пембролізумаб + ХТ. Лікування при ІА стадії НДРЛ залишається суто хірургічним, при ІВ‑ІІІА стадії (N2) дослідження ІІ фази демонструють обнадійливі результати застосування пембролізумабу в неоад’ювантному режимі, а при ІІІВ-IVстадіях пембролізумаб залишається стандартом першої лінії моно- або комбінованої терапії.
 Завідувачка відділення хіміотерапії Клініки Спіженко, кандидат медичних наук Наталія Юріївна Лісовська розповіла про дані щодо лікування раку легені, представлені на Всесвітній конференції з раку легені (WCLC‑2020).
Завідувачка відділення хіміотерапії Клініки Спіженко, кандидат медичних наук Наталія Юріївна Лісовська розповіла про дані щодо лікування раку легені, представлені на Всесвітній конференції з раку легені (WCLC‑2020).
– Сучасні стандарти медикаментозного лікування раннього та місцево-поширеного НДРЛ передбачають проведення системної терапії починаючи з ІВ стадії захворювання. Ад’ювантна ХТ рекомендована пацієнтам із НДРЛ ІВ стадії, які належать до групи високого ризику, або після резекції R1. Ад’ювантна хіміопроменева терапія є стандартом лікування пацієнтів із резектабельним НДРЛ І-ІІ стадії, при цьому ХТ проводять паралельно або після променевого лікування. Пацієнтам з місцево-поширеним потенційно резектабельним НДРЛ ІІ-ІІІ стадії рекомендована неоад’ювантна хіміопроменева терапія (NCCN, 2021). У разі виявлення мутації гена рецептора епідермального фактора росту (EGFR) та при неможливості отримувати чи неефективності платиновмісної ХТ рекомендоване призначення осимертинібу. Нині триває дослідження ІІІ фази ALINA, у якому вивчають ефективність застосування алектинібу порівняно з платиновмісною ХТ як ад’ювантного лікування для пацієнтів з ALK-позитивним НДРЛ ІВ‑ІІІА стадії. На підставі результатів дослідження PACIFIC імунотерапія моноклональним антитілом дурвалумабом ввійшла до стандартів лікування пацієнтів з нерезектабельним НДРЛ ІІІА стадії, у яких не досягнута відповідь на хіміопроменеве лікування.
Окремо варто звернути увагу на наявність імуномоделюючих ефектів променевої терапії. Зокрема, це зменшення об’єму пухлини, посилення експресії антигенів, таких як PD-L1, головний комплекс гістосумісності (MHC) та молекули міжклітинної адгезії (ICAM), на пухлинних клітинах, посилення секреції цитокінів тривоги, а саме інтерферону гамма, фактора некрозу пухлини альфа та інтерлейкіну‑1b, залучення більшої кількості антигенспецифічних Т-лімфоцитів у клітину, покращення антигенпрезентуючої функції дендритних клітин, зменшення пулу супресорних Т-клітин, підвищення активності пухлиноасоційованих макрофагів і відсутність загальної імуносупресивної відповіді.
Диференційований підхід до вибору варіанта системного лікування метастатичного НДРЛ забезпечується попередньо проведеним молекулярним тестуванням з метою виявлення тих чи інших мутацій та оцінкою PD-L1 статусу. Визначення PD-L1 статусу необхідне незалежно від гістологічного підтипу НДРЛ, імунотерапія в першій лінії у поєднанні з ХТ рекомендована навіть при негативному PD-L1 статусі за умови хорошого стану пацієнта за шкалою EGOC та відсутності протипоказань до її проведення. У разі помірної експресії PD-L1 (≥1-49%) перевагу надають комбінованим режимам (імунотерапія + ХТ), а при високопозитивному PD‑L1 статусі пухлини передусім розглядають варіант імунотерапії в монорежимі.
У рекомендаціях NCCN наголошується на необхідності проводити широке молекулярне профілювання для виявлення таргетних мутацій і маркерів чутливості до імунотерапії, що особливо актуально для пацієнтів молодого віку. Алгоритм ведення пацієнтів із поширеним плоскоклітинним і неплоскоклітинним НДРЛ передбачає тестування на визначення статусу PD-L1. Так, при неплоскоклітинному НДРЛ та відсутності драйверних мутацій, а також при плоскоклітинному НДРЛ та PD-L1 ≥50% як перша лінія лікування рекомендована монотерапія пембролізумабом, а при PD-L1 ≥1-49% – пембролізумаб + ХТ. У разі виявлення драйверних мутацій при неплоскоклітинному НДРЛ лікування розпочинають із призначення відповідних таргетних препаратів, а при їх недостатній ефективності як другу лінію лікування розглядають призначення імунотерапії залежно від PD-L1 статусу.
Показання до застосування інгібіторів PD‑1 продовжують розширюватись. Сьогодні тривають дослідження ІІІ фази, такі як KEYNOTE‑012, в якому вивчають призначення пембролізумабу (Кітруда® компанії MSD) з хіміопроменевою терапією та з наступним прийомом пембролізумабу з олапарибом або без нього при НДРЛ ІІІ стадії. У дослідженні KEYNOTE‑867 вивчають ефективність та безпеку стереотаксичної променевої терапії з пембролізумабом та без нього у дорослих пацієнтів з неоперабельним за медичними показаннями НДРЛ І або ІІА стадії.
Таким чином, за результатами клінічних досліджень імунотерапія посіла провідне місце як перша лінія лікування метастатичного НДРЛ. Оскільки дослідження тривають, очікується подальше розширення показань до застосування імунотерапії для лікування ранніх стадій НДРЛ, в поєднанні з хіміопроменевою терапією при ІІІ стадії та з радіохірургією при І-ІІА стадії.
Слід нагадати, що для встановлення когорти пацієнтів, які найкраще відповідатимуть на лікування, та для стратифікації ризиків імунотерапії важливим є визначення предиктивних біомаркерів.
Підготувала Ольга Нестеровська
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 3 (70) 2021 р



