28 листопада, 2016
Інфекційні ускладнення після накісткового та внутрішньокісткового остеосинтезу
В Україні щороку травмуються близько 2 мільйонів дорослого населення і понад 300 тисяч дітей. Серед головних причин смертності та у структурі первинної інвалідності в Україні наслідки травм стабільно посідають третє місце, поступаючись лише серцево-судинним та онкологічним захворюванням. Щорічні економічні витрати держави в результаті травм становлять понад 5,2 млрд грн. Серед ушкоджень опорно-рухової системи близько 25% становлять відкриті переломи, які у 64% випадків супроводжуються ускладненнями, що призводять до обмеження якості життя і встановлення інвалідності. Щороку в Україні понад 20 тисяч потерпілих від травм стають інвалідами, з них близько 90% – особи працездатного віку [1].
Усі вищезазначені факти спонукають до проведення профілактичних заходів та удосконалення лікування потерпілих із травмами, у тому числі з переломами кісток. У цьому плані однією із сучасних тенденцій є розвиток і широке впровадження у практику травматолога-ортопеда сучасних методів остеосинтезу, спрямованих на скорочення термінів стаціонарного лікування, оптимізацію умов консолідації уламків кісток, забезпечення ранньої функції ушкодженої кінцівки, зниження рівня інвалідності та швидку соціальну адаптацію потерпілого [1, 2].
Починаючи з другої половини XX століття інтенсивне застосування імплантатів у травматології та ортопедії поряд зі значними перевагами у тактиці хірургічного лікування й подальшим поліпшенням якості життя пацієнтів в окремих випадках супроводжувалось інфекційними ускладненнями. Це зумовлено не тільки збільшенням частоти випадків тяжкої механічної травми, а і ятрогенними дефектами лікування, зміною спектра мікроорганізмів, здатних спричинити нагноєння, а також порушеннями діяльності імунної системи організму [2, 3]. Залежно від ступеня тяжкості ушкоджень кінцівок і часу надання допомоги після травматичного впливу виникнення гнійних ускладнень фіксують в 1,2-75,4% випадків. Доволі часто (від 3 до 80% після відкритих переломів і близько 8% – після оперативного лікування закритих переломів із застосуванням імплантів) це завершується виникненням остеомієліту – найбільш грізного, тяжкого, складного і не завжди ефективного, а також фінансово витратного лікування. Понад 70% хворих на остеомієліт на тривалий час стають непрацездатними, піддаються оперативним втручанням по 5-10 і більше разів, із них майже 90% згодом стають інвалідами. Загальні витрати на лікування хворого на остеомієліт довгих кісток можуть сягати 500 тисяч євро [1].
Усі основні сучасні імплантати, які застосовують для остеосинтезу, можна поділити на дві великі групи. Це стрижні, які вводять у кістковомозковий канал (інтрамедулярні фіксатори), і пластини (накісткові фіксатори). Накістковий остеосинтез набув «слави» найбільш травматичного і з великою кількістю інфекційних ускладнень, навіть на сучасному рівні, яка перевищує відповідну після застосування інтрамедулярних фіксаторів: після відкритих переломів від 7 до 85%, після закритих – від 5 до 23%. У травматології та ортопедії залишається високою кількість ятрогенних ускладнень, які призводять до виникнення інфекції від 15 до 80% [1].
У літературних джерелах існує багато класифікацій інфекційного процесу, який виникає у разі застосування імплантів для остеосинтезу [3]. Останні два десятиліття велику кількість робіт було присвячено проблемі інфікування рани після хірургічного лікування – інфекції області хірургічного втручання (ІОХВ), у закордонній літературі – surgical site infection (SSI). ІОХВ – інфекція області хірургічного розрізу органа чи порожнини, яка виникла в терміни до 30 діб після втручання без імплантації, або до одного року після операції з імплантацією [4]. Еквівалентом такого стану в статистичній класифікації міжнародної класифікації хвороб (МКХ-10) є такі пункти:
T84.5. Інфекція та запальна реакція, пов’язані з внутрішніми протезами суглоба;
T84.6. Інфекція та запальна реакція, пов’язані з внутрішнім фіксуючим приладом (будь-якої локалізації);
T84.7. Інфекція та запальна реакція, пов’язані з іншими внутрішніми ортопедичними протезними пристроями, імплантатами та трансплантатами.
За даними Національної системи спостереження за нозокоміальними інфекціями США, частота ІОХВ становить 38% усіх випадків госпітальних інфекцій у хірургічних стаціонарах. Летальність у хірургічних пацієнтів з госпітальними інфекціями в 77% випадків зумовлена ІОХВ. Виникнення ІОХВ збільшує термін госпіталізації одного хворого на 7-10 діб, а вартість стаціонарного лікування пацієнта – на 2000-3152 долари США на день [4].
У Росії ІОХВ при планових операціях розвивається в 6,5% випадків і призводить до летальних наслідків після планових та екстрених операцій у 12 та 27% випадків відповідно [1, 4].
Незважаючи на удосконалення профілактичних заходів, суттєвого зменшення кількості ІОХВ не спостерігається. Причинами цього є такі чинники: більш складні й тривалі операції; зростання кількості пацієнтів старшого віку з тяжкими хронічними супутніми захворюваннями та імунодефіцитними станами; операції з масивною імплантацією; впровадження у клініку нових інвазивних діагностичних та лікувальних втручань; зростання резистентності мікроорганізмів до антибіотиків.
Загальноприйнятою є класифікація ІОХВ при ортопедичних втручаннях, розроблена Surgical Site Infection Surveillance Service (Служба нагляду за ІОХВ у Великій Британії). Так, згідно з цією класифікацією інфекції покривів тіла поділяють на поверхневі (шкіра, підшкірна жирова клітковина), глибокі (фасція, м’язи); порожнинні та органні (щодо анатомічних утворень – порожнина суглоба, кістка) [4].
Для встановлення ІОХВ сформульовано стандартні діагностичні критерії. При цьому достатньо наявності навіть однієї з таких ознак: гнійні виділення; висів збудника з отриманого матеріалу; абсцес або інші ознаки інфекції, які визначені під час повторної операції або рентгенологічного чи гістологічного дослідження.
У США (National Nosocomial Infection Surveillance, NNIS) запропоновано індекс ризику інфекційних ускладнень, який визначають у балах за сумою трьох ознак: бала шкали ASA (фізичний статус пацієнта), контамінації рани та тривалості операції.
За кордоном триває велика робота з дослідження ІОХВ, що дає змогу вчасно виявити ускладнення й запобігти його прогресуванню. Крім того, діють стандартизовані профілактичні програми, що сприяє зменшенню кількості ІОХВ та, відповідно, покращенню результатів лікування хворих. На жаль, у нашій країні вивченню цього питання приділяється мало уваги, що призводить до хронізації ранніх форм інфікування, виникнення полірезистентних штамів мікрофлори та розвитку інших ускладнень. Тому в останніх публікаціях багатьох медичних центрів розглядаються можливості створення Національного реєстру ІОХВ. Щодо кількості ІОХВ після ортопедо-травматологічних втручань та перебігу цієї нозології, то повідомлень у вітчизняній літературі не знайдено.
У сучасній літературі багато уваги присвячено визначенню факторів ризику, які сприяють виникненню інфекції після оперативних втручань з імплантацією [3]. Серед найбільш поширених загальних факторів згадуються похилий вік; ожиріння; цукровий діабет; кортикостероїдна терапія; куріння; інфекційні процеси в інших органах; схильність до алергічних реакцій; порушення згортальної системи крові; запальні захворювання судин нижніх кінцівок; тривале перебування в стаціонарі; досвід хірурга; тривалий доопераційний ліжко-день; незадовільний санітарний стан лікувальної установи. Серед місцевих факторів, які збільшують ризик інфекції при остеосинтезі, наводяться такі: тяжкість травми; нестабільний або некоректний остеосинтез; ушкодження судин та нервів; повторні оперативні втручання тощо.
На переконливу думку переважної більшості авторів, існує пряма залежність між тяжкістю травми, її локалізацією та кількістю інфекційних ускладнень при остеосинтезі. Наприклад, множинні травми можуть збільшувати ризик виникнення інфекції на 3-27%, а поєднані – до 75%. При цьому зберігається чітка залежність від локалізації травми та ступеня ураження того чи іншого органа або системи [3].
Збільшення частоти інфікування при остеосинтезі визначено також при уламкових переломах. Тому їх лікування потребує досвіду й гарних знань лікаря-травматолога для оцінки стану уламків та вибору адекватної фіксації. Інші автори зауважують, що навіть при переломах типу С кількість інфікувань може бути невеликою і все залежить від стану м’яких тканин і травматичності втручання [5].
Велику роль у виникненні інфекційних ускладнень після остеосинтезу відіграє нестабільність фіксатора. Доведено, що у більш ніж половині випадків нестабільність призводить до розвитку остеомієлітичного процесу. Незважаючи на переконливість проведених досліджень, деякі автори вважають, що значення гематогенного шляху проникнення інфекції в ділянку імпланту перебільшене [2].
Найважливішим патогенетичним фактором у розвитку інфекційного процесу є порушення кровопостачання, що виникає унаслідок ушкодження кістки й навколишніх м’яких тканин при травмі та оперативному втручанні [6]. За спостереженням низки авторів, аваскулярність кісткової тканини після накісткового остеосинтезу має більш тривалий характер і може тривати до 6-9 місяців або бути фатальним для сегмента кістки.
Тим часом в асептичних умовах система кровопостачання довгих кісток має значні компенсаторні можливості. Джерелом відновлення кровопостачання при асептичному інфаркті стають епіметафізарні й періостальні судини. У разі приєднання інфекції – за первинним порушенням кровопостачання розвивається вторинна запальна блокада потенційних шляхів відновлення кровопостачання, що призводить до незворотного виключення кровопостачання кістки [5, 6].
Важливими у розвитку інфекційних ускладнень є організаційні (6,3%) й тактичні (8,1%) помилки при оперативному лікуванні переломів кісток [3]. Досі хворі з переломами кісток лікуються у відділеннях загальної хірургії центральних районних лікарень і навіть у дільничних лікарнях. При цьому остеосинтез хворим виконують лікарі, що не мають достатньої кваліфікації, кількість помилок у лікуванні переломів сягає 35,0%, а виникнення остеомієліту при оперативному лікуванні закритих переломів у неспеціалізованих відділеннях – близько 9,6% [7].
На думку багатьох авторів, соматичні причини інфекційних ускладнень під час лікування переломів довгих кісток виникають унаслідок недостатнього обстеження хворих у доопераційному періоді. Цукровий діабет, місцеві трофічні розлади оперованої кінцівки на тлі атеросклерозу артерій, наявність гнійничкових захворювань шкіри на оперованому сегменті кінцівки, хронічні вогнища інфекції в організмі, зниження імунної реактивності хворих тощо належать до ендогенних причин розвитку інфекційних ускладнень [9].
Клініко-лабораторні прояви інфекції після остеосинтезу
Існує багато варіантів перебігу гнійно-запального процесу. Найбільш частим варіантом прояву ІОХВ є тривалі виділення з ділянки післяопераційної рани або навколо рубця, що може свідчити про інфекцію. Проте в деяких випадках цей процес не пов’язаний з імплантом, а може бути викликаний наявністю стороннього тіла або інфікованої лігатури, трофічної виразки тощо. Відсутність чіткого розуміння локалізації цього процесу призводить до вибору неправильної тактики лікування.
Деякі дослідники вважають, що стійкий біль в оперованому сегменті у стані спокою може бути основною діагностичною клінічною ознакою інфекції, оскільки є найбільш частим симптомом інфекційного процесу й спостерігається у понад 90% хворих [3].
Інші автори вважають, що тільки наявність класичних клінічних симптомів, а саме гіперемія, підвищення температури, наявність фістули або рани, явно підтверджує діагноз інфекції. Такі симптоми, як, наприклад, лихоманка, локальна інфільтрація і набряк, є ознаками, що мають середню чутливість і специфічність та спостерігаються у менш ніж половини хворих [4].
У літературі описано симптоми, характерні для гострого прояву інфекції, які клінічно відповідають сепсису, – спостерігаються спонтанне підвищення температури, тахікардія, тахіпное, нерідко блювання. Особливо гостро стоїть питання тривалої інтоксикації та розвитку септичного стану, оскільки вони є причиною соматичних ускладнень.
У більшості літератури критерієм оцінки вираженості інфекційного процесу є синдром системної запальної реакції (ССЗР), який характеризується двома або більше клініко-лабораторними ознаками, серед яких: підвищення температури тіла більше 38 °C або зниження менше 36 °C; тахікардія понад 90 ударів на хвилину; частота дихання понад 24 за 1 хвилину; підвищення рівня лейкоцитів периферичної крові >12x109/л або зниження <4x109/л. У роботах деяких авторів зазначається, що ССЗР може проявлятися лише у 37% хворих з ІОХВ та виключно у разі загострення травматичного остеомієліту [5].
Інші сучасні автори наголошують на зниженні відсотка гострих проявів цього ускладнення, пов’язуючи це з інтенсивною антибіотикопрофілактикою, що приводить до стертих клінічних проявів запального процесу. Дослідники зауважують, що септичні ускладнення, спричинені низьковірулентною флорою, мають перебіг, що більш притаманний асептичному, ніж запальному процесу [5].
Актуальним є припущення про інфекційну етіологію ранньої нестабільності імплантатів. Незважаючи на досягнення сучасної діагностики, визначення межі між асептичним розхитуванням та хронічною інфекцією із в’ялим перебігом залишається великою проблемою, як після остеосинтезу, так і після ендопротезування [8].
Для лабораторної діагностики інфекційних ускладнень широко застосовують різні дослідження і тести. В літературі, особливо іноземній, наявні досить грунтовні роботи з визначенням інформативності того чи іншого методу, а також його специфічності у разі нагноєння [4, 5].
Однак часто деякі автори вказують на первинно-хронічний перебіг за наявності нориць або у разі незагоєння післяопераційної рани, коли загальна кількість лейкоцитів не виходить за межі норми й практично неінформативна для клініциста. За деякими даними, чутливість цього параметра дорівнює 20%, а специфічність – 93% [6].
Раніше показник швидкості осідання еритроцитів (ШОЕ) розглядали як вагомий критерій при інфікуванні. Водночас було показано, що навіть при неускладненому остеосинтезі спостерігається підвищення ШОЕ до 65 мм/год, яке може не зменшуватися протягом декількох місяців [3].
Більш інформативним, за даними літератури, є показник активності С-реактивного білка (СРБ). Доведено, що рівень СРБ досягає піка на 2-й день після операції і повертається до своїх нормальних значень протягом 2-3 тижнів. Але при ІОХВ рішення про хірургічне лікування потрібно прийняти за декілька днів, тому цей показник не є вирішальним, а при хронічному остеомієліті не завжди виходить за межі норми [4].
Інші автори зауважують, що ні ШОЕ, ні СРБ не є специфічними для пацієнтів за наявності супутніх захворювань або політравми, оскільки можуть свідчити про запальні процеси інших локалізацій.
Останні роки за кордоном набув поширення метод молекулярної діагностики. Найбільш часто для цього застосовують метод детекції патогенних мікроорганізмів за допомогою полімеразної ланцюгової реакції (ПЛР). На думку багатьох авторів, цей метод дозволяє на ранніх стадіях інфекційного процесу ідентифікувати будь-який патоген шляхом визначення специфічних ділянок геному, а також виявити наявність генів, які забезпечують можливу антибіотикорезистентність. Порівняно з традиційними методами досліджень ПЛР має низку переваг: високі чутливість та специфічність (близько 100%), оперативність та можливість повної автоматизації процесу, універсальність [7].
Проте, незважаючи на великі переваги ПЛР перед іншими методами детекції ранніх форм нагноєнь, необхідно зауважити, що це дослідження мабуть просто ще недостатньо широко використовують у клінічній практиці, особливо в рутинних та скринінгових дослідженнях. Але в літературі вже є перші повідомлення про можливість застосування цього методу при ІОХВ для швидкого визначення збудника.
Основними у розвитку інфекційного процесу та адекватному лікуванні є рання та адеватна діагностика збудника інфекції, вивчення його властивостей, а також оцінка вірогідності формування та стадійності розвитку мікробного співтовариства у формі так званої біоплівки. Біологічна плівка, бактеріальна плівка, мікробне співтовариство, biofilm, microbial community, bacterial film – саме такі назви форми існування більшості бактерій зустрічаються в публікаціях. Уява про особливу форму існування бактерій сформувалась у світі наприкінці XX століття [7-10]. Безперечно, що основним поштовхом під час вивчення цієї проблеми був прогрес електронної мікроскопії, а поява таких пристроїв, як скануючий конфокальний мікроскоп, дозволила виявити біоплівки в їх природному стані [7, 9].
Про невизначеність ключових аспектів проблеми біоплівок свідчать численні сучасні дослідження в хірургічних спеціальностях медичної науки [9]. Особливим питанням є дослідження мікробних співтовариств у травматології та ортопедії як галузі, в якій широко застосовують масивні імпланти та в якій кількість післяопераційних інфекційних ускладнень сягає 10% [9]. Саме питанню біоплівки присвячені основні публікації європейських та американських фахівців із хірургічної інфекції кісток та суглобів. Так, на щорічному Європейському конгресі з інфекції кісток та суглобів (ЕBJIS) останні 5 років окрему сесію присвячують дослідженням мікробних співтовариств. Проте, незважаючи на високу актуальність цієї проблеми у світі, більшість аспектів залишаються невирішеними [9, 10].
На цей час доведено, що біоплівка на імпланті формується від 2 до 10 діб. Тобто при перших ознаках запального процесу необхідно розпочати адекватне лікування інфекції, інакше несвоєчасний початок боротьби з мікробами призводить до утворення біоплівки та неефективності подальших заходів.
Відсутність адекватних ранніх діагностичних методів спонукає лікарів до призначення емпіричної терапії, яка не тільки є малоефективною, а й призводить до збільшення маси біоплівки та удосконалення її захисних властивостей, виникнення резистентних штамів мікроорганізмів [7, 8, 10].
Лікування
«У зв’язку з відсутністю досліджень із достатнім періодом спостереження лікування імплант-асоційованих інфекцій базується здебільшого на традиції, особистому досвіді та юридичних аспектах, а отже, істотно відрізняється між установами в одній країні та між країнами», – сказав у 2012 році член президії Європейської асоціації інфекцій кісток та суглобів (EBJIS), професор Wagner із Німеччини. Тобто як за кордоном, так і в нашій країні немає чіткого регламенту лікування зазначеної патології. На нашу думку, це пов’язано з наявністю великої кількості варіантів захворювання, що ускладнює уніфікацію заходів боротьби з ним. Проте в багатьох світових центрах проаналізовано численний матеріал і розроблено локальні стандарти лікування інфекції після остеосинтезу.
Звичайно, що основним радикальним етапом лікування інфекції після остеосинтезу є хірургічна санація з видаленням імпланту. Проте досі в літературі та на світових зібраннях не регламентовано терміни проведення цієї процедури. Багато хто вважають, що неефективна антибактеріальна терапія є показанням до видалення фіксаторів, інші пропонують орієнтуватися на стабільність конструкції і не втручатися, поки не з’явиться резорбція навколишньої кісткової тканини. Багато авторів переконані, що у разі появи перших ознак запального процесу імплантат необхідно видаляти.
Суперечливими залишаються не тільки терміни видалення імпланту, а й обсяг оперативного втручання. В деяких провідних клініках вважають, що некректомія або дмент мають бути cуперрадикальними – з видаленням усіх нежиттєздатних та сумнівних тканин одразу після початку інфекції, із заміною фіксації на позавогнищевий черезкістковий остеосинтез. Інші спеціалісти радять не поспішати як із видаленням фіксаторів, так і з видаленням кісткової тканини сумнівної життєздатності. На їхню думку, не потрібно замінювати фіксацію на зовнішню, а можливою є імплантація внутрішніх фіксаторів з елементами локального антибактеріального впливу, а в деяких ситуаціях навіть видалення металоконструкції необов’язкове.
Беззаперечно одне: всі фахівці свідчать про необхідність застосування комплексної тактики лікування [1, 5, 6,]. Хірургічний метод є обов’язковим і спрямований не тільки на видалення імпланту, а й на висічення або механічне очищення осередку запалення, що приводить до зниження маси біоплівки, сприяє руйнуванню зв’язків між бактеріями [9]. Однак дотепер немає явних критеріїв візуалізації патологічних тканин під час хірургічних втручань, що, на жаль, часто призводить до нерадикальності санації та рецидиву патологічного процесу. Навіть сучасні діагностичні заходи не дають відповіді хірургу на деякі важливі запитання під час планування втручання: чи завершиться все дебридментом із видаленням фіксатора, чи утвориться в результаті санації кістковий або м’якотканинний дефект, чи не порушиться зрощення перелому під час видалення металоконструкції.
Важливе місце в сучасному лікуванні інфекції в ортопедії належить місцевому застосуванню антибактеріальної терапії [6]. Останні дослідження показують, що в більшості випадків лише парентеральної терапії недостатньо для адекватної дії на мікробні співтовариства. Стандартні дозування антибіотиків, які зазвичай ефективно знищують чутливі планктонні бактерії, вирощені в лабораторії, можуть мати слабку антимікробну дію або взагалі бути неефективними щодо того ж типу бактерій у біоплівці, виділених з рани [7, 9]. Тому для руйнувальної спрямованої дії на інфекційний агент необхідне застосування місцевої антибіотикотерапії. Для цього останні десятиліття в імплантології використовують матеріали, насичені антибактеріальними препаратами. Такі лікувально-профілактичні заходи застосовують і в ортопедії та у травматології [2, 3]. Як систему локальної доставки антибіотика використовують акриловий кістковий цемент, ауто- або алокісткові трансплантати, біодеградуючі системи на основі кісткового цементу, полімерів, солей кальцію, імпланти з покриттям, тощо [9].
На цей час у клінічній практиці найбільшого застосування набули антибіотико-імпрегновані кісткові цементи (Antibiotic-Loaded Bone Cement – ALBC). З цього приводу проведено масштабні дослідження, виявлено цементи, з яких найбільш легко елюрує антибіотик, визначено оптимальні розміри пор у матеріалах, описано можливості та способи змішування компонентів, проведено дослідження щодо застосованих антибіотиків [6]. Експериментально, клінічно, лабораторно та статистично доведено, що унаслідок застосування ALBC досягається високий рівень концентрації препарату в патологічному осередку порівняно із системним використанням [6, 10].
На сьогодні розроблено велику кількість варіантів застосування кісткового цементу з антибіотиком. У разі виникнення інфекції після травматологічних або ортопедичних операцій найчастіше використовують цементні гранули, ланцюг у вигляді цементного намиста на нитці або на дроті. У деяких країнах такі імпланти ліцензовані, їх запроваджено у промислове виробництво, але в більшості вітчизняних та закордонних клінік цементні кульки виготовляють експрес-методом, з додаванням антибіотика з визначеною чутливістю [5, 6, 7]. Цементні болванки або медулярні штифти виготовляють як у вигляді монолітного цементного імпланту, так і металевого стержня з антибіотико-цементною мантією.
Крім локального антибактеріального впливу, застосування цементу з антибіотиком має ще одну мету, яка позиціонується в сучасній літературі як боротьба з так званим «мертвим простором». Звідти й назва «спейсер» (space – простір). Заповнення кісткових дефектів та м’якотканинних порожнин бактерицидними матеріалами суттєво зменшує вірогідність розмноження та поширення мікроорганізмів, що підвищує ефективність сануючих втручань. Професор з Італії K. Romano вважає, що основним є вплив від заповнення «мертвого простору», а не дія антибіотиків у цементі.
Крім кісткового цементу, на цей час на ринку представлені матеріали у вигляді гранул трикальційфосфату, остеоапатиту, колагену з різними антибактеріальними препаратами [10]. Проте застосування всіх перерахованих способів локального депо антибіотиків, окрім досягнення бактерицидної або бактеріостатичної дії, має свої недоліки. За деякими даними, вони пришвидшують розвиток резистентності флори, токсично діють на макроорганізм, викликають алергічні реакції. Під час застосування навіть сертифікованих спейсерів лікарі стикаються з такими ускладненнями, як міграція, злам, звих і навіть нагноєння тимчасового імпланту. Крім того, застосування антибактеріальних препаратів у кістковому цементі та їх дозування строго регламентовано. Більшість з антибіотиків є термонестабільними, тому імпрегнація ними взагалі неможлива. Через це 30% ортопедів критично ставляться до застосування локальної антибактеріальної терапії в будь-якому вигляді. Їх переконлива позиція грунтується на позитивних результатах альтернативного лікування або на негативному клінічному досвіді використання спейсерів [8, 10].
Доволі часто, крім ліквідації інфекційного процесу, перед лікарем стоїть завдання з відновлення цілісності кістки. Для цього здебільшого застосовують апарати зовнішньої фіксації. За допомогою апарату є можливість не тільки стабілізувати уламки кістки, а й у разі необхідності замістити сегментарний дефект. Проте зовнішня фіксація сегментів кінцівок має й суттєві недоліки – необхідність постійного нагляду за апаратом, запалення м’яких тканин навколо стержнів або cпиць, контрактури в суглобах тощо. Тому останнім часом у світі спостерігається тенденція до застосування внутрішніх конструкцій для стабілізації кісток – з цемент-антибактеріальною мантією, або з бактерицидним нанопокриттям, або звичайних – другим етапом через певний час після сануючого втручання.
До загальних принципів комплексного лікування інфекції після остеосинтезу належить і системна антибактеріальна терапія. Зазвичай антибіотики призначають за результатами бактеріологічного дослідження виділень із нориці чи рани або досліджують тканини навколо імпланту. За словами K. Romano, «сучасна мікробіологічна діагностика базується на цілеспрямованому пошуку в патологічному матеріалі мікроорганізмів, роль яких в етіології нагноєння доведена». Для більш точної діагностики збудника патологічного процесу застосовують сонікацію як метод, яким виділяють мікроорганізм у біоплівці, знятій безпосередньо з імпланту. За деякими даними, розбіжності між звичайними дослідженнями та після сонікації можуть становити близько 20%.
Аналізуючи сучасні літературні дані з антибактеріальної терапії, виникає чимало запитань, серед яких, зокрема: застосування антибактеріальних препаратів – це необхідність чи юридичний фактор; яка тривалість терапії (описано випадки від 10 днів до 1 року); які препарати призначати при резистентній мікрофлорі; що призначати при інфекції області хірургічного втручання.
Аналіз світової літератури свідчить, що головними збудниками інфекції після остеосинтезу є золотистий та коагулазонегативний стафілококи, переважно S. epidermidis – до 60,0-80,0% усіх ізолятів. Серед стафілококів дедалі більшу частку становлять мультирезистентні до антибіотиків та метицилінрезистентні – до 50,0% виділених культур, що, відповідно, суттєво ускладнює лікування. Роботи, присвячені полімер-асоційованій інфекції, яка тяжко лікується і призводить до септичних станів, що загрожують життю, з’явились в Україні лише в останні роки.
З інших мікроорганізмів важливого значення надають анаеробам – пептококам, пептострептококам, Propionibacterium species, стрептококам – Streptococcus pyogenes, пневмококам, ентерококам; коринебактеріям. Грамнегативні бактерії виділяли значно рідше, здебільшого як асоціантів грампозитивних мікроорганізмів.
Відтак основними групами антибактеріальних препаратів у лікуванні є фторхіналони, сучасні цефалоспорини та глікопептиди. В більшості рекомендацій емпіричною терапією або для тривалого лікування імплант-асоційованої мікрофлори застосовують фторхіналони. В сучасних дослідженнях виявлено високу руйнівну дію рифампіцину на біоплівку, тому радять застосовувати його в комбінації з іншими препаратами. В більшості країн у протоколах лікування цієї категорії хворих рекомендовано застосовувати кліндаміцин як препарат не тільки з доведеною антимікробною дією, а й низьким рівнем розвитку резистентності мікроорганізмів до нього.
Зазвичай після видалення імпланту та ліквідації проявів інфекційного процесу ніхто не може запевнити, що результат є стійким та рецидивів не буде. Біоплівка може відновитись у цій самій зоні із залишених в організмі планктонних форм бактерій або якщо вони знову потраплять до організму. Тому існують загальні емпіричні попереджувальні принципи: поверхнево активні розчини для очищення ран, тривала антибактеріальна терапія для знищення планктонних форм, спеціальні перев’язувальні матеріали з покриттям [3, 8]. Однак до сьогодні не визначено, яких саме антимікробних заходів необхідно вживати в першу чергу, як конкретизувати момент звільнення рани від біоплівки, який ступінь ризику рецидиву в тому чи іншому випадку та від яких факторів це залежить.
Ми проаналізували власний клінічний матеріал за останні 5 років – випадки інфекції після остеосинтезу накістковими фіксаторами та інтрамедулярними блокованими стержнями.
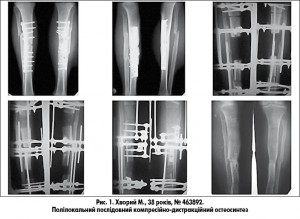
Більшість пацієнтів були з локалізацією процесу у великогомілковій кістці після накісткового остеосинтезу, у більш ніж половини з них захворювання перебігало з різного ступеня порушеннями трофіки м’яких тканин. Лише у 15% хворих цієї групи переломи були консолідованими, й хірургічна допомога передбачала фістулнекректомію з видаленням фіксатора. В усіх інших хворих з локалізацією інфекційного процесу на гомілці в результаті некректомії утворився крайовий, а у третини – сегментарний кістковий дефект. Останні роки при крайових дефектах великогомілкової кістки ми застосовуємо двоетапну тактику лікування. Першим етапом проводять некректомію із застосуванням цементного спейсера з антибіотиком у вигляді намиста або цільноцементного шматка, на другому етапі – заміщення аутокісткою за необхідності з додаванням гранул трикальційфосфату або алокістки. При незрощеннях, сегментарних дефектах кісток гомілки ми застосовували черезкістковий остеосинтез. Заміщення середніх та великих сегментарних дефектів проводили за Ілізаровим – бі- або полілокальним методом (рис. 1).
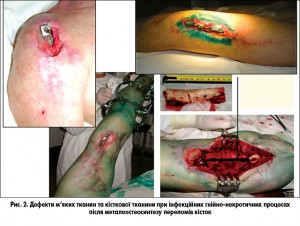
Тактика хірургічного лікування інфекції після остеосинтезу на стегні схожа, але за цієї локалізації патологічного процесу ми майже не зустрічали порушень трофіки м’яких тканин сегмента, що покращує прогноз лікування. На відміну від локалізації процесу на гомілці у цій групі значно менша кількість сегментарних дефектів, і всі вони виникли після накісткового остеосинтезу (рис. 2).
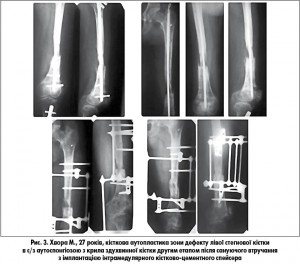
Останні кілька років у разі інфекційних ускладнень після блокованого інтрамедулярного остеосинтезу при незрощених переломах кісток ми застосовуємо інтрамедулярні спейсери у вигляді цвяха або пучка спиць, вкритих мантією цементу з антибіотиком (рис. 3).
Проблеми з черезкістковим остеосинтезом на стегні (часте запалення навколо стержнів та спиць, контрактури в суміжних суглобах тощо) спонукало до більш широкого застосування інтрамедулярних спейсерів. У деяких хворих ми спостерігали консолідацію переломів на спейсері, у решти пацієнтів виконували блокуючий остеосинтез.
У комплексному лікуванні інфекції після остеосинтезу ми застосовуємо системну антибактеріальну терапію протягом 4-8 тижнів. Тривалість призначення антибактеріальних препаратів залежить від лабораторних показників активності процесу (загальноклінічні та серологічні дослідження). Також хворі перебувають під динамічним імунологічним моніторингом. Імуномодулюючі препарати призначають за результатами стану клітинної та гуморальної ланок імунітету.
Рецидиви інфекційного процесу, як правило, пов’язані з розвитком хронічного остеомієліту й виникають у середньому в 7,0% хворих; у 3,0% пацієнтів цієї групи виконано ампутації кінцівок.
Замість висновків. Результати наших досліджень встановили певну залежність між термінами початку адекватного лікування та отриманими результатами (до 4-6 місяців – ефективність безрецидивного лікування становить близько 90,0%), а також зворотну залежність між кількістю попередніх втручань на конкретному сегменті та ефективністю лікування.
Враховуючи неоднозначність як діагностичних заходів, так і лікування інфекційних ускладнень після накісткового та внутрішньокісткового остеосинтезу, найбільш доцільним є надання кваліфікованої та адекватної допомоги в спеціалізованих відділеннях хірургічної інфекції кісток та суглобів. Це також є головним мотивом тексту спільної Декларації SICOT та EBJIS щодо боротьби з хірургічною інфекцією, яку було ухвалено в листопаді 2014 року в Ріо-де-Жанейро за підписом президента SICOT Keith Luk, керівника комітету з інфекції SICOT Ferdinando Da Rin de Lorenzo та президента EBJIS Heinz Winkler.
Література
- Сергеев С.В., Эзмекна С., Зеленкина Л.И. и др. Тактика комплексной профилактики и лечения гнойно-септических осложнений в клинической травматологии // Вестник травматол. и ортоп. им. Н.Н. Приорова. – 2003. – № 3. – С. 79.
- Грицай Н.П. О результатах лечения больных с посттравматическим остеомиелитом / Н.П. Грицай // Ортопедия, травматология и протезирование. – 1991. – № 9. – С. 15-18.
- Міцкевич О.О. Діагностика та профілактика гнійних ускладнень після металоостеосинтезу переломів довгих кісток у віддаленому післяопераційному періоді (експериментально-клінічне дослідження) // Автореф. дис. на здобуття наук. ступ. канд.мед.наук. – 2003. – 18 с.
- Lee J., Singletary R., Schmader K., et al. Surgical site infection in the elderly Following orthopaedic surgery. Risk factors and outcomes. J Bone Joint Surg Am 2006; 88: 1705-12.
- Lynde M.J., Sautter T., Hamilton G.A., Schuberth J.M. Complications after open reduction and internal fixation of ankle fractures in the elderly. Foot Ankle Surg. 2012; 18: 103-107.
- Григоровский В.В. Острые травматические ишемические поражения костей: патогенез, морфогенез, дифференциальная диагностика / В.В. Григоровский // Журн. НАМН Украины. – 2008. – Т. 14, № 1. – С. 116-133.
- ShapiroI M., Hickok N.J., Parvizi J., Stewart S. Molecular engineering of an orthopaedic implant from bench to bedside // Euro pean Cеlls and Materials. – Vol. – 23. – 2012. – Р. 362-370.
- Esteban J., Gomez-Barrena E., Cordero J., Martin-de-Hijas N.Z., Kinnari T.J., Fernandez-Roblas R. Evaluation of quantitative analysis of cultures from sonicated retrieved orthopedic implants in diagnosis of orthopedic infection. J Clin Microbiol 2008; 46 (2): 488-92.
- Costerton J.W. 2007. The Biofilm Primer. Springer, Hiedelberg. Pp 1-200, 67 figures, First in a 20 book series on biofilms.
- Сидорчук Р.І., Павлович К.В., Плегуша О.М. Динаміка змін інтегральних індексів неспецифічної резистентності та імунної реактивності при гнійно-деструктивних процесах нижніх кінцівок // Клінічна та експер. патологія. – 2011. – Ч. 1. – Т. Х, № 2 (36).