19 січня, 2022
Амбулаторне моніторування електрокардіограми
Продовження. Початок у № 5 (78), 2021
Редакція медичної газети «Здоров’я України», тематичного номера «Кардіологія. Ревматологія. Кардіохірургія» продовжує знайомити наших читачів із ґрунтовним і детальним підручником «Функціональна діагностика» за редакцією д. мед. н., професора О.Й. Жарінова, д. мед. н., професора Ю.А. Іваніва та к. мед. н., доцента В.О. Куця. Пропонуємо до вашої уваги розділ «Амбулаторне моніторування електрокардіограми» ІІ частини «Функціональні проби. Амбулаторне моніторування ЕКГ і артеріального тиску».
Показання для холтерівського моніторування ЕКГ
У настановах Американської асоціації серця / Американської колегії кардіологів (AHA/ACC) наведено такі основні показання для холтерівського моніторування ЕКГ (табл. 3) (Crawford et al., 1999):
- оцінка симптомів, які можуть бути пов’язані з порушеннями серцевого ритму та провідності;
- стратифікація ризику в пацієнтів зі структурною хворобою серця без симптомів аритмії;
- визначення ефективності лікування аритмій серця;
- оцінка функції імплантованих пристроїв;
- діагностика та аналіз ефективності лікування ішемії міокарда.
Найпоширеніше показання для ХМ ЕКГ – наявність симптомів, які часто виникають при аритміях. Такими симптомами є відчуття серцебиття, запаморочення, синкопальні стани, а також періодичне виникнення дискомфорту в грудній клітці, задухи, раптової слабкості. Метод ХМ ЕКГ може мати вирішальне значення в діагностиці порушень автоматизму, збудливості й провідності серця. Він дає змогу визначити загальну кількість надшлуночкових і шлуночкових екстрасистол та оцінити їх розподіл за певними періодами доби.
Залежно від розподілу частоти виникнення аритмії протягом доби, виділяють денний, нічний (>70% аритмій у певний відрізок часу) і змішаний циркадні типи. У хворих з екстрасистолією змішаний циркадний тип аритмії є високочутливим (100%), хоча й низькоспецифічним (18%) критерієм парасистолії (Макаров та співавт., 1998). У випадках, коли на звичайній ЕКГ фіксуються лише поодинокі екстрасистоли, під час ХМ ЕКГ нерідко виявляють епізоди групових екстрасистол та/або алоритмії, короткі епізоди шлуночкової тахікардії та ранні екстрасистоли типу «R на Т». Уточнення градації порушень серцевого ритму принципово важливе для визначення тактики ведення хворих.
ХМ ЕКГ дозволяє встановити джерело та ймовірний механізм виникнення пароксизмальної тахікардії, кількість епізодів аритмії, тривалість кожного епізоду, динаміку ЧСС протягом пароксизму, а також розподіл аритмічних подій за добу, їх взаємозв’язок зі змінами сегмента ST та клінічними симптомами. Тривалий запис ЕКГ нерідко дозволяє також з’ясувати електрофізіологічні механізми аритмії, в багатьох випадках – відрізнити автоматичні та реципрокні тахікардії. Метод ХМ ЕКГ дає змогу уточнити морфологію шлуночкових порушень ритму і, зокрема, диференціювати епізоди мономорфної шлуночкової тахікардії від тахікардії типу «пірует».
Реєстрація ЕКГ протягом доби є також важливим елементом обстеження осіб із пароксизмальною формою ФП. Згідно з європейськими рекомендаціями, обов’язковим критерієм діагностики ФП є наявність епізодів із відповідними змінами ЕКГ тривалістю ≥30 с (Kirchhof et al., 2016). При проведенні ХМ ЕКГ можна встановити кількість та тривалість епізодів аритмії, частоту шлуночкових скорочень під час виникнення пароксизму. Кількість надшлуночкових екстрасистол у пацієнтів із пароксизмальною формою ФП – один із провісників виникнення нових пароксизмів та критерій ефективності антиаритмічної терапії при їх подоланні.
Методом ХМ ЕКГ можна виявити також епізоди погіршення АВ-провідності при брадисистолічному варіанті ФП із паузами між сусідніми шлуночковими скороченнями тривалістю ≥2,0‑2,5 с. Інколи спостерігають минущий синдром Фредеріка, із тривалими та приблизно однаковими інтервалами RR при АВ-вузловому або ідіовентрикулярному ритмі на тлі ФП.
При брадиаритміях (брадикардія, АВ-блокади) основною метою ХМ ЕКГ є виявлення періодів найвиразнішого зниження ЧСС і пауз, а також супутніх порушень ритму серця. При ХМ у здорових осіб завжди реєструють паузи за рахунок синусової аритмії. Пауза може закінчуватися появою вислизаючих комплексів/ритмів або міграції водія ритму. Максимальна тривалість спонтанних пауз у здорових дорослих не повинна бути ˃2000 мс або більшою за два попередні інтервали RR (Макаров, 2003). Останній критерій є основним при диференціальній діагностиці з СА-блокадою ІІ ступеня 2-го типу.
ХМ – це оптимальний метод діагностики всього симптомокомплексу порушень ритму при синдромі слабкості синусового вузла. Основними його ознаками при ХМ у дорослих є (Moss, Stern, 1997):
- постійна, стійка синусова брадикардія із ЧСС <50/хв та/або відсутність зростання ЧСС понад 90/хв під час фізичних навантажень;
- паузи ритму > 3с в активний період доби внаслідок СА-блокади / зупинки синусового вузла;
- постійні або інтермітивні симптомні періоди вислизаючих ритмів;
- синдром брадитахікардії.
Під час ХМ ЕКГ нерідко виявляють порушення АВ-провідності.
В обстежуваних молодого віку без структурного захворювання серця періодично може виникати АВ-блокада ІІ ступеня 1-го типу, переважно у пасивний період доби. Частою знахідкою в осіб похилого віку є АВ-блокада І ступеня. ХМ ЕКГ дозволяє об’єктивно оцінити динаміку порушень провідності серця в пасивний період доби у пацієнтів з АВ-блокадою І або ІІ ступеня 1-го типу. АВ-блокада ІІ ступеня 2-го типу та субтотальна АВ-блокада завжди розглядаються як ознаки патології, що потребують терапевтичного втручання. Клінічно значущим є виявлення епізодів АВ-блокади ІІ ступеня 2-го типу і повної АВ-блокади. У таких випадках слід звертати увагу на кількість і тривалість пауз між шлуночковими скороченнями.
Так, паузи ритму тривалістю понад 2,5‑3 с вважаються загрозливими щодо виникнення нападів Морганьї – Адамса – Стокса.
Найвиразніші брадиаритмії та паузи ритму при ХМ реєструються вночі, частіше у другу її половину (Pieper, Hammill, 1995). Водночас більше клінічне значення, ймовірно, мають симптомні брадиаритмії, які раптово виникають в активний період доби (Макаров та співавт., 2014).
Основними ЕКГ-критеріями прогностично несприятливого перебігу повної АВ-блокади і ризику виникнення синкопе або раптової смерті внаслідок нападів Морганьї – Адамса – Стокса є реєстрація при ХМ ЕКГ пауз ритму тривалістю понад 3 с у денний час і подовження вище від норми тривалості інтервалу QT (синкопе і раптова смерть у хворих із повною АВ-блокадою часто виникають за появи пірует-тахікардії).
При 2‑3-канальному ХМ можливості діагностики внутрішньошлуночкових порушень провідності обмежені, базуються на розширенні та деформації шлуночкового комплексу. Діагноз виставляють за даними ЕКГ у 12 відведеннях або 12-канального ХМ ЕКГ. При транзиторних змінах морфології комплексу QRS, які можуть бути зумовлені блокадою внутрішньошлуночкового проведения імпульсів, здійснюється диференціальна діагностика з ідіовентрикулярним ритмом (відсутність передсердного зубця Р перед комплексом QRS) та передчасним збудженням шлуночків (укорочений інтервал РQ та дельта-хвиля). Взагалі усі виявлені під час ХМ ЕКГ аритмії та порушення провідності повинні бути оцінені й підтверджені візуально лікарем, який знає особливості оцінки аритмій при моніторингу ЕКГ (Макаров та співавт., 2014).
ХМ ЕКГ – зручний кількісний метод оцінки ефективності антиаритмічної терапії та діагностики аритмогенної дії застосованих препаратів. Для хворих із шлуночковими аритміями розроблені такі критерії ефективності антиаритмічного лікування (Graboys et al., 1982):
- Зменшення загальної кількості екстрасистол за добу більш ніж на 50‑75%.
- Зменшення кількості парних і ранніх екстрасистол на 90% і більше.
- Повне усунення епізодів шлуночкової тахікардії.
- При поліморфній шлуночковій екстрасистолії – зменшення кількості морфологічних типів екстрасистол до 1‑2.
Про парадоксальну аритмогенну дію антиаритмічного препарату свідчать: збільшення загальної кількості екстрасистол у 3‑4рази; збільшення кількості парних шлуночкових екстрасистол і епізодів нестійкої шлуночкової тахікардії протягом доби у 10 разів; поява раніше не документованої стійкої шлуночкової тахікардії (Velebit et al., 1982).
Оцінюючи адекватність лікування антиаритмічним препаратом, окрім перерахованих критеріїв, треба також враховувати особливості його впливу на синусовий ритм, провідність та частоту ішемічних епізодів.
Амбулаторне моніторування ЕКГ – інформативний засіб оцінки роботи імплантованих пристроїв: електрокардіостимуляторів та кардіовертерів-дефібриляторів. Результати дослідження можуть мати вирішальне значення при визначенні потреби в перепрограмуванні або навіть заміні пристрою. Водночас більшість сучасних двокамерних електрокардіостимуляторів здатні розпізнавати та фіксувати всі тахіаритмії, надавати інформацію про відсоток спонтанних і стимульованих комплексів, самостійно оцінювати якість функціонування імплантованого пристрою.
Стратифікація ризику раптової серцевої смерті
Останнім часом ХМ ЕКГ стало одним із найважливіших методів оцінки ризику (РСС) та виникнення життєво небезпечних шлуночкових аритмій, зокрема, після перенесеного інфаркту міокарда, в осіб із СН та гіпертрофічною кардіоміопатією. Можливості стратифікації ризику РСС на підставі даних ХМ ЕКГ не обмежуються уточненням кількості, градації та морфології шлуночкових аритмій.
Результати ХМ ЕКГ забезпечують різноманітну інформацію про інші параметри, що характеризують субстрат, пускові (тригерні) та модулювальні фактори – компоненти патогенезу життєво небезпечних аритмій серця:
- Минуще збільшення тривалості корегованого інтервалу QT, на тлі якого зростає тривалість «уразливого» періоду серцевого циклу і схильність до виникнення пароксизмів пірует-тахікардії. У нормі цей показник становить ˂0,43 с у чоловіків, ˂0,44 с у дітей до 15 років і ˂0,45 с у жінок (Zipes et al., 2006; Bayes de Luna, 2011).
- Зміни середньої ЧСС за добу і циркадного індексу ЧСС – співвідношення між середньою ЧСС в активний і пасивний періоди доби, який у нормі становить 1,22‑1,45 (Дабровскі та співавт., 2000). Зростання цього показника понад 1,45 свідчить про надмірну активацію симпатоадреналової системи, а зниження ˂1,22 – про недостатню активність блукаючого нерва і «захист» серця від впливу катехоламінів. Своєю чергою це може зумовлювати зниження порогу виникнення життєво небезпечних аритмій серця. Крім того, в пацієнтів зі структурною хворобою серця хронічна синусова тахікардія асоційована зі збільшенням імовірності РСС. Водночас тригерами життєво небезпечної аритмії серця можуть бути епізодичне нетривале підвищення ЧСС і шлуночкова екстрасистолія.
- Зниження стандартного показника варіабельності серцевого ритму – стандартного відхилення інтервалів RR протягом доби (SDNN) – нижче за 40‑50 мс, що свідчить про дисбаланс вегетативної регуляції серцевого ритму і є потужним предиктором виникнення РСС в осіб із післяінфарктним кардіосклерозом та/або СН і збереженим синусовим ритмом.
- Наявність епізодів депресії сегмента ST, характерних для ішемії міокарда. Можливість встановлення зв’язку порушень ритму з ішемією міокарда – унікальна особливість ХМ ЕКГ. Найчастіше ішемічну депресію сегмента ST реєструють після пароксизмів тахіаритмій. Значно рідше ішемію індукують брадиаритмії або алоритмії (бігемінія чи тригемінія). З іншого боку, ішемія міокарда є частою причиною виникнення шлуночкової екстрасистолії, надшлуночкових і шлуночкових тахіаритмій, РСС.
Програмне забезпечення деяких холтерівських систем передбачає можливість аналізу турбулентності ЧСС – ще одного можливого предиктора виникнення життєво небезпечних аритмій серця та РСС. Під турбулентністю ЧСС розуміють короткі коливання тривалості синусових циклів у відповідь на шлуночкову ектопію. В нормі після ізольованого шлуночкового ектопічного комплексу ЧСС дещо зростає, а потім повертається до вихідних показників.
Фізіологічне значення турбулентності ЧСС полягає у непрямому відображенні активності барорефлексу. Втім показники турбулентності ЧСС є недостатньо чутливими предикторами раптової смерті після перенесених коронарних подій.
Загалом ХМ ЕКГ – інформативний метод стратифікації ризику життєво небезпечних аритмій серця. Водночас інтерпретація результатів ХМ ЕКГ та ступінь агресивності превентивної терапії сильно залежать від наявності структурної хвороби серця. На думку експертів АСС та АНА, коли не виявлено порушень серцевого ритму і немає симптомів імовірної аритмії, підстав для виконання ХМ ЕКГ із метою сратифікації ризику немає (Crawford et al., 1999).
Втім у пацієнтів із післяінфарктним кардіосклерозом і систолічною дисфункцією ЛШ, хронічною СН і гіпертрофічною кардіоміопатією, за наявності порушень серцевого ритму, додаткова інформація, отримана за допомогою ХМ ЕКГ, може мати суттєве значення при виборі стратегії та тактики ведення хворих.
Можливості діагностики ІХС
Традиційно діагностика хронічних форм ІХС базується на оцінці характеру больового синдрому, чинників ризику, а також змін ЕКГ під час фізичного навантаження. ХМ ЕКГ дає змогу зареєструвати минущі зміни сегмента ST і зубця T, оцінити їх зв’язок із часом виникнення больових відчуттів, періодами фізичного або психоемоційного навантаження. Очевидні переваги ХМ ЕКГ полягають у можливості реєстрації неінвазивним методом епізодів ішемії, які виникають під час звичайної діяльності пацієнта, зокрема безбольової ішемії міокарда. Водночас метод ХМ ЕКГ характеризується обмеженою інформативністю в діагностиці атеросклерозу вінцевих артерій та ішемії міокарда порівняно з даними навантажувальних проб, сцинтиграфії міокарда й ангіографії вінцевих артерій.
Крім епізодів больової ішемії міокарда, в пацієнтів з ІХС нерідко виникають епізоди депресії сегмента ST, які не асоційовані з больовими відчуттями. З огляду на це, завданнями ХМ ЕКГ є, з одного боку, оцінка ЕКГ під час епізодів болю, а з другого – пошук безбольової ішемії міокарда та визначення загальної тривалості («тягаря») ішемії протягом періоду моніторування.
Проте є низка застережень щодо застосування ХМ ЕКГ у діагностиці ішемії міокарда. Передусім, зміни сегмента ST та зубця T часто неспецифічні. Вони можуть бути пов’язані з такими факторами, як:
- гіпервентиляція;
- зміна положення тіла;
- тахіаритмія;
- гіпертрофія або дисфункція ЛШ;
- синдром передчасного збудження шлуночків;
- артеріальна гіпертензія;
- порушення провідності;
- активація симпатичного відділу ВНС;
- електролітні порушення;
- приймання антиаритмічних, психотропних засобів, дигоксину тощо.
За наявності повної блокади лівої ніжки пучка Гіса, синдрому передчасного збудження шлуночків, післяінфарктного кардіосклерозу, аневризми ЛШ, виразної гіпертрофії ЛШ ідентифікація ЕКГ-ознак ішемії міокарда неможлива або має суттєві обмеження. Крім того, аналіз кінцевої частини шлуночкового комплексу ускладнюється через часті зміни положення тіла та ЧСС. За даними різних авторів, чутливість і специфічність ХМ ЕКГ у діагностиці ІХС становлять 7,9‑81,0 і 61,0‑100% відповідно. Значні розбіжності результатів зумовлені залученням у дослідження невеликих за обсягом і неоднорідних груп пацієнтів, а також застосуванням різних критеріїв оцінки змін сегмента ST та зубця T.
У рекомендаціях AHA/ACC з амбулаторної ЕКГ жодна клінічна ситуація не розглядається як безперечне (клас І) показання для ХМ ЕКГ із метою діагностики ІХС (Crawford et al., 1999). Підстави для застосування ХМ ЕКГ досить переконливі (клас ІІа) при підозрі на варіантну стенокардію типу Принцметала. Метод ХМ ЕКГ також можна застосовувати для передопераційного обстеження пацієнтів із хворобами периферичних судин, без клінічних ознак ІХС.
Ознаки ішемії міокарда при ХМ ЕКГ виявляють у 10‑40% хворих, яких обстежують перед великими хірургічними втручаннями на судинах. Виявлення ішемії має незалежне значення для прогнозування післяопераційних серцевих ускладнень і погіршення прогнозу при довготривалому спостереженні. Втім, сучасний алгоритм стратифікації ризику або передопераційного обстеження спочатку передбачає здійснення навантажувального тесту окремо або з одночасною візуалізацією серця і лише у разі неможливості виконання навантаження – ХМ ЕКГ.
ХМ ЕКГ може в певних випадках забезпечити додаткову діагностичну інформацію у хворих із нападами болю у грудній клітці, які не можуть виконати навантажувальну пробу, а також з діагностованою раніше ІХС і атиповим больовим синдромом (клас ІІb). Без сумніву, результати ХМ ЕКГ можуть бути також корисними для діагностики ішемії в пацієнтів із порушеннями ритму серця. Крім того, інколи ХМ ЕКГ дозволяє виявити ішемію в тих випадках, коли ангінозні напади з’являються лише в особливих життєвих ситуаціях (наприклад, під час статевого акту) і не відтворюються при навантажувальних пробах.
Наразі немає підстав рекомендувати ХМ ЕКГ зі скринінговою метою для виявлення безсимптомної ішемії міокарда в пацієнтів без діагностованих раніше ІХС або захворювання периферичних судин. Типові для ішемії зміни сегмента ST під час ХМ ЕКГ не характерні для осіб із негативним результатом навантажувальної проби. Навпаки, за наявності ознак ішемії під час проби з навантаженням приблизно в 25‑30% пацієнтів ішемія виявляється також методом ХМ ЕКГ.
З огляду на це, першим кроком діагностичного пошуку в пацієнтів, в яких немає протипоказань, повинна бути саме проба із фізичним навантаженням, а не ХМ ЕКГ. Наголосимо, що більша чутливість навантажувальної проби частково пов’язана з можливістю реєстрації ЕКГ у 12 відведеннях, на відміну від 2 або 3 каналів при ХМ ЕКГ.
Критерії діагностики ішемії міокарда
Типові для ішемії міокарда зміни сегмента ST під час ХМ ЕКГ характеризуються формулою «1×1×1» (Cohn, Kannel, 1987):
- амплітуда депресії сегмента ST – не менш ніж 1 мм (на відстані 60 мс від точки J);
- тривалість депресії сегмента ST – не менш ніж 1 хв;
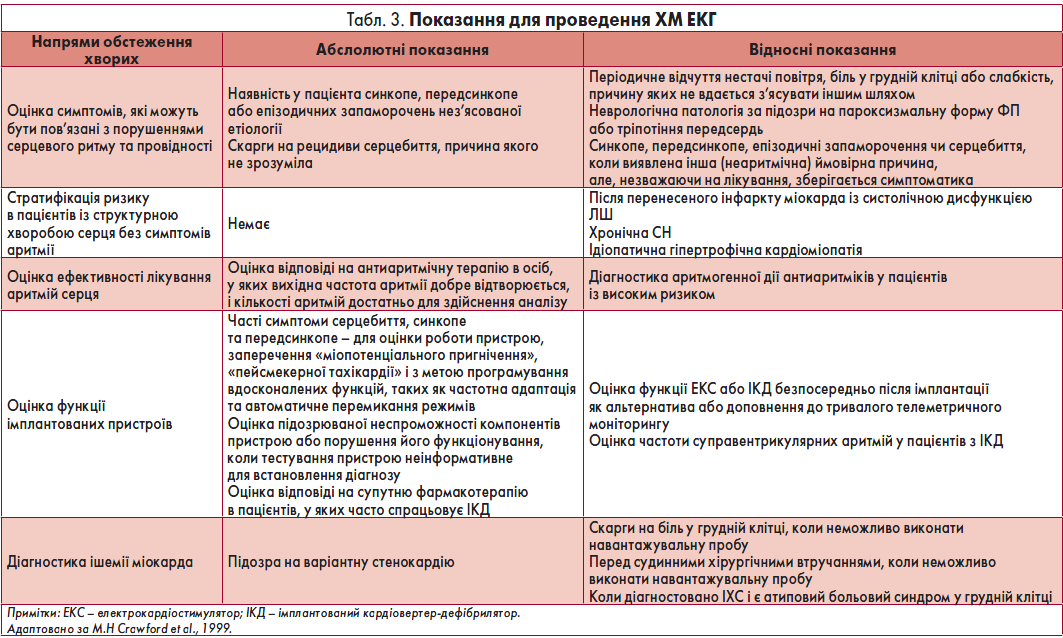
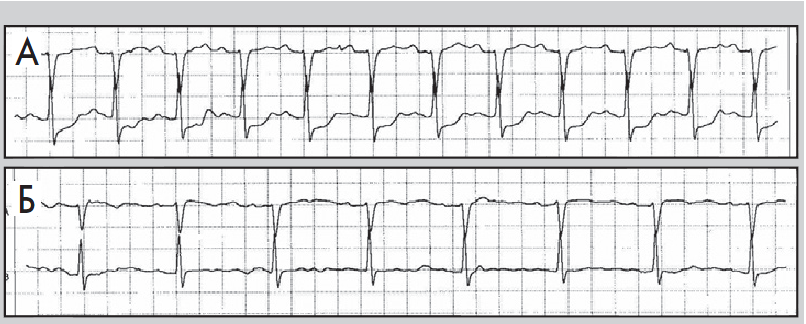
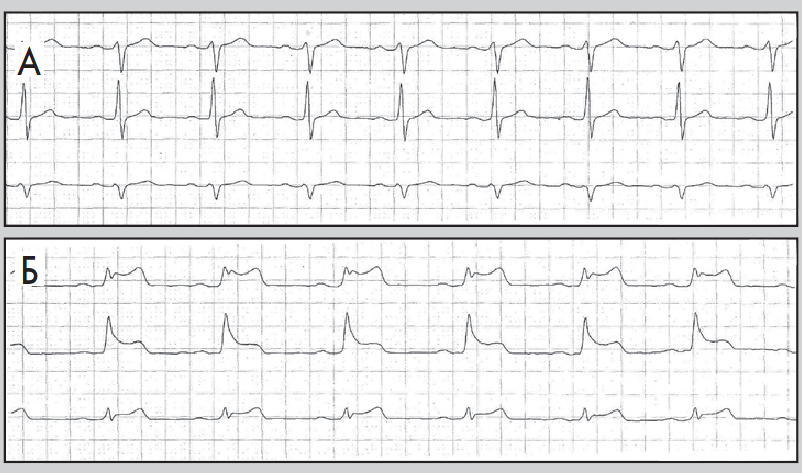
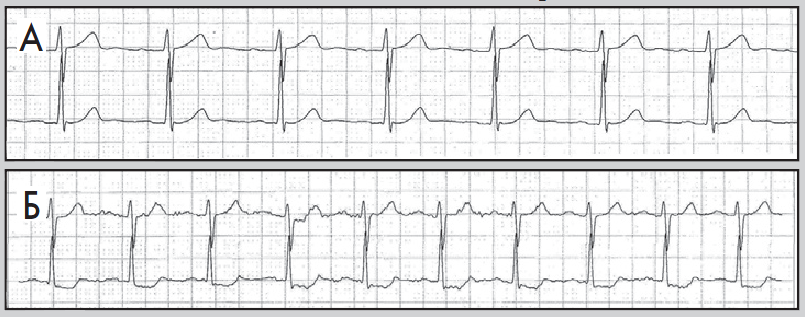
- тривалість періоду між послідовними епізодами депресії сегмента ST – не менш ніж 1 хв (рис. 8, 9).
Рис. 8. Фрагменти ЕКГ до (А) і під час (Б) ангінозного нападу; горизонтальна депресія сегмента ST, амплітуда – 2 мм
Рис. 9. Епізоди ХМ ЕКГ до (А) і під час (Б) ішемії міокарда; косонизхідна депресія сегмента ST, амплітуда – понад 1 мм
Якщо хоча б однієї з двох перших ознак немає, або характер змін сегмента ST нетиповий для ішемії, зміни ЕКГ розцінюють як сумнівні.
Аналіз результатів ХМ ЕКГ допомагає визначати патофізіологічні механізми ішемії міокарда. Ішемія, зумовлена недостатнім резервом коронарного кровопостачання, характеризується залежністю від тахікардії. Вона майже завжди виникає при зростанні ЧСС до певного рівня, тобто при досягненні «ішемічного порогу», і припиняється після відповідного зниження ЧСС. Такі епізоди ішемії збігаються з періодами підвищення фізичної та емоційної активності. Щоправда, «ішемічний поріг» може відрізнятися в різні періоди доби, причому найнебезпечнішими з огляду на це зазвичай є ранкові години.
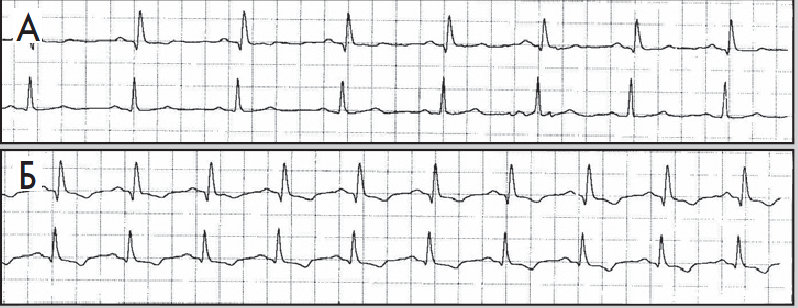
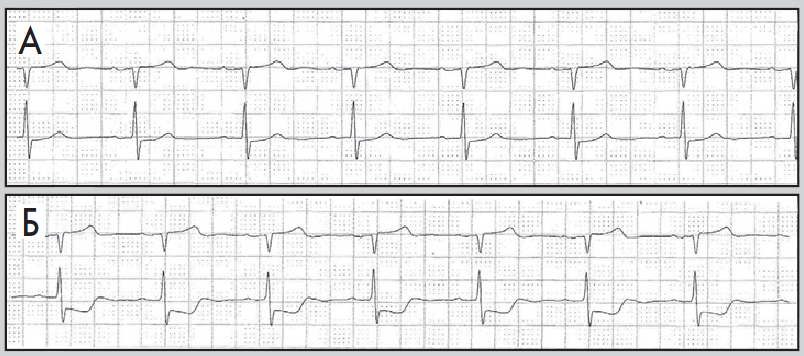
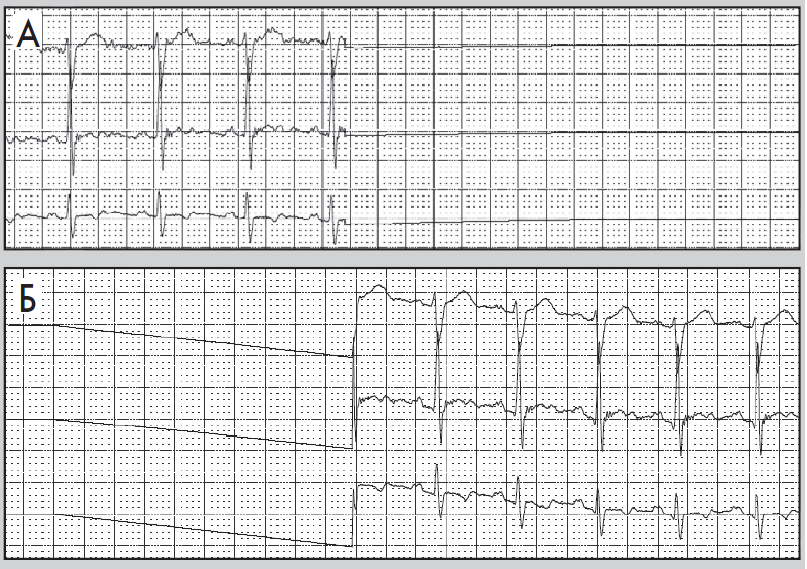
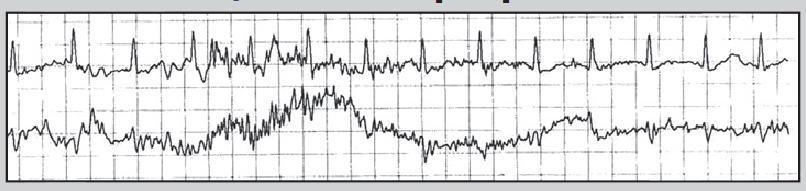
Нерідко в денні або вечірні години пацієнт краще переносить фізичні навантаження, та ішемія виникає при вищих показниках ЧСС. Цей феномен пояснюють поступовим запуском механізму «адаптації до ішемії». Водночас ішемія вазоспастичного походження (зокрема, варіантна стенокардія) виникає без зв’язку з тахікардією та фізичними навантаженнями, переважно у нічні години (рис. 10). Для трансмуральної ішемії, спричиненої ураженням магістральної вінцевої артерії, характерна елевація сегмента ST або фазові зміни, коли спочатку виникає депресія, а потім – підйом сегмента ST (рис. 11).
Рис. 10. Фрагменти ХМ ЕКГ до (А) і під час (Б) епізоду ішемії міокарда; ішемія не пов’язана зі зростанням ЧСС (67/хв у обох епізодах)
Рис. 11. Фрагменти ХМ ЕКГ до (А) і під час (Б) трансмуральної ішемії міокарда:
елевація сегмента ST, амплітуда – до 3 мм
Такі ішемічні епізоди можуть тривати до 20‑30 хв. Загальна тривалість епізодів ішемії більш ніж 60 хв/добу асоційована зі значним зростанням імовірності гострого інфаркту міокарда, смерті та є корисним додатковим критерієм при оцінці потреби в реваскуляризації вінцевих артерій.
Безсимптомна ішемія міокарда
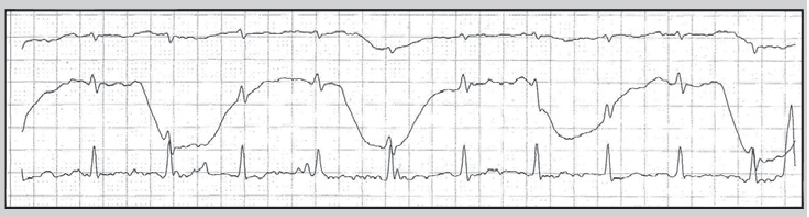
Під безсимптомною («німою») ішемією міокарда розуміють безсимптомні типові зміни сегмента ST у пацієнтів із діагностованою ІХС (рис. 12). У клінічній практиці важливо розрізняти такі категорії осіб із безсимптомними змінами сегмента ST:
- Пацієнти, в яких зміни сегмента ST є випадковою знахідкою.
- Хворі на безсимптомну ішемію після перенесеного інфаркту міокарда.
- Особи з безсимптомною ішемією на тлі раніше діагностованої ІХС, але без перенесеного інфаркту міокарда.
Рис. 12. Фрагменти ХМ ЕКГ у пацієнта, який раніше переніс інфаркт міокарда: А – немає змін сегмента ST, Б – безсимптомна депресія сегмента ST
Кількість і тривалість безбольових епізодів депресії сегмента ST може у 3‑4 рази перебільшувати такі епізодів стенокардії. Епізоди безбольової ішемії міокарда найчастіше притаманні хворим, схильним до вазоспазму.
Об’єктивним критерієм тяжкості перебігу ІХС і можливим провісником ризику розвитку інфаркту міокарда є загальний тягар ішемії, під яким розуміють сумарну тривалість епізодів симптомної та безсимптомної ішемії міокарда протягом доби. Так, у хворих на стабільну стенокардію I функціонального класу (ФК) на цей показник може припадати менш ніж 1%, II ФК – 1‑4%, III ФК – 5‑10%, IV ФК – більш ніж 10% від загальної тривалості доби.
Особливе значення ХМ ЕКГ має для діагностики безсимптомної ішемії міокарда в пацієнтів із цукровим діабетом. При поєднанні цукрового діабету та ІХС значно частіше реєструються епізоди безсимптомної ішемії, що, ймовірно, зумовлено пошкодженням внутрішньоміокардіальних нервових закінчень унаслідок діабетичної невропатії.
Артефакти
Під час аналізу даних ХМ ЕКГ майже завжди можна виявити епізоди спотворення ЕКГ-сигналу – артефакти. Причини виникнення артефактів різноманітні й зумовлені низкою чинників:
- зареєстровані сигнали не є відображенням біоелектричної активності серця обстежуваного;
- паузи спричинені деформацією або періодичним зникненням сигналу ЕКГ (рис. 13);
- постійна деформація сигналів ЕКГ унаслідок змін технічних параметрів реєструвального пристрою.
Рис. 13. Пауза, спричинена перериванням сигналу ЕКГ
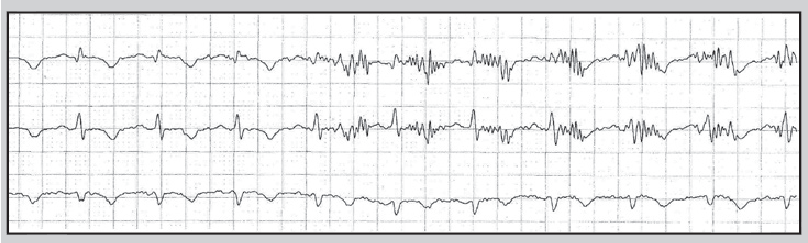
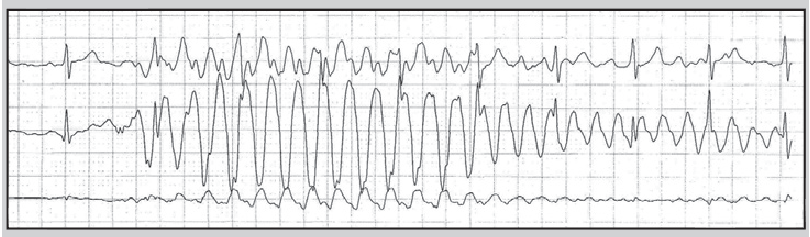
Найчастіша причина спотворення запису ЕКГ – порушення контакту електрода з тілом пацієнта (відклеювання від тіла або висихання електропровідного гелю). Значні спотворення сигналу ЕКГ інколи спостерігають при надмірній фізичній активності обстежуваного (рис. 14), унаслідок механічного впливу на електроди (рис. 15), при використанні побутових електроприладів (рис. 16) або перебуванні хворого в умовах потужного електромагнітного поля (рис. 17).
Рис. 14. Артефакт, що виник під часприсідання обстежуваного
Рис. 15. Артефакт, що виник унаслідок механічної дії на електроди при фізичній активності обстежуваного
Рис. 16. Артефакт, що виник під час гоління пацієнта електробритвою
Рис. 17. Артефакт, що, ймовірно, виник через перебування обстежуваного в умовах електромагнітного поля
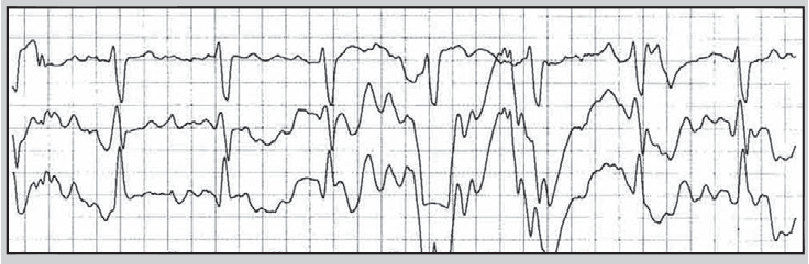
Порушення контакту можливе в місцях з’єднання проводу з електродом або реєстратором. У цьому разі на ЕКГ з’являються сигнали, які імітують шлуночкові екстрасистоли, порушення процесів реполяризації, паузи тощо. Деякі артефакти настільки нагадують справжні порушення ритму (рис. 18), що для їх диференціації потрібно уважно переглядати всі канали, в яких проводили моніторування, та порівнювати сумнівний епізод із попередніми, якщо такі були.
Рис. 18. Артефакт, що імітує шлуночкову тахікардію типу «пірует»: на першому каналі на тлі значного коливання ізолінії регулярно реєструються зубці S, на другому – зубці R
Для зменшення імовірності виникнення артефактів слід ретельно дотримуватися методики встановлення реєстратора. Потрібно використовувати рекомендовані виробником матеріали, ознайомлювати хворого із процедурою, метою та основними умовами проведення обстеження.
Формування висновку
У висновку ХМ ЕКГ потрібно вказати умови обстеження (стаціонарні чи амбулаторні), використані відведення. Слід зазначити характеристики синусового ритму, кількісну та якісну оцінку виявлених порушень ритму. Комп’ютерна програма обробки ЕКГ зазвичай автоматично підраховує кількість зареєстрованих за добу комплексів QRS, епізодів тахікардії/брадикардії, найбільшої та найменшої ЧСС, точний час їх реєстрації, загальну кількість надшлуночкових і шлуночкових екстрасистол та їх частку на 1000 серцевих скорочень, кількісну/якісну оцінку епізодів шлуночкових аритмій. Подібно характеризують порушення процесів реполяризації, вказують епізоди найбільшої елевації та/або депресії сегмента ST.
При аналізі результатів ХМ ЕКГ потрібно уточнити зв’язок усіх аритмічних та ішемічних подій із суб’єктивною симптоматикою. Розширений протокол може додатково містити погодинну оцінку порушень ритму та процесів реполяризації, аналіз варіабельності ритму серця, інтервалу QT, пізніх потенціалів шлуночків, оцінку роботи імплантованого електрокардіостимулятора або кардіовертера-дефібрилятора, деякі інші параметри. У висновок обов’язково потрібно внести графіки динаміки ЧСС за добу (добовий тренд ЧСС), відхилень сегмента ST, інтервалів PQ та QT, змін тривалості сегмента QT за добу.
Після основного висновку, кількісної та якісної характеристик виявлених порушень, графіків і таблиць повинні бути наведені приклади, які б ілюстрували всі описані порушення серцевого ритму та реполяризації. Тривалість кожного обраного епізоду найчастіше становить 7‑10 с, але може бути за потреби збільшена або зменшена дослідником. Все добове обстеження можна видрукувати у вигляді 30-хвилинних інтервалів на окремих аркушах.
Елементи висновку при здійсненні ХМ ЕКГ
Базовий ритм
- Синусовий ритм, ФП або інший
- Ритм ідентичний протягом усього часу дослідження або змінюється з часом
- Особливості змін ритму (вдень, уночі, на тлі брадикардії або тахікардії)
- Циркадний профіль ритму та його особливості
- ЧСС: максимальна і мінімальна, у зв’язку з фізичною активністю пацієнта
Суправентрикулярні екстрасистоли
1. Кіл ькісна оцінка:
- спорадичні
- рідкісні (1‑4/год)
- із помірною частотою (4‑40/год)
- часті (40‑400/год)
- дуже часті (˃400/год)
2. Якісна оцінка:
- ізольовані
- парні
- інтерпольовані
- бі-, три-, квадригемінія
- блоковані
3. Походження:
- передсердні
- вузлові
- із внутрішьошлуночковою аберацією
Шлуночкові екстрасистоли
1. Кількісна оцінка:
- спорадичні
- рідкісні (1‑4/год)
- із помірною частотою (4‑40/год)
- часті (40‑400/год)
- дуже часті (˃400/год)
2. Якісна оцінка:
- ізольовані
- парні
- інтерпольовані
- бі-, три-, квадригемінія
- блоковані
3. Морфологія:
- мономорфні
- поліморфні
Суправентрикулярні тахікардії
- Кількість епізодів
- Тривалість епізодів
- ЧСС під час тахікардії
- Наявність або відсутність синусового ритму після припинення тахікардії та тривалість його збереження (с)
- Особливості початку тахікардії
- Варіанти тахікардії:
- передсердна
- з АВ-блокадою
- АВ-вузлова
- АВ-реципрокна
- наявність аберації
- невідомий субстрат
Шлуночкові тахікардії
- Кількість епізодів
- Тривалість епізодів (стійка чи нестійка)
- ЧСС під час тахікардії
- Особливості початку тахікардії
- Варіанти тахікардії:
- мономорфна
- поліморфна
- типу «пірует»
Паузи
- Тривалість (мс)
- Походження
- Кількість
Блокади
- Рівень
- Ступінь і тип
- Особливості
- Блокади ніжок (фаза 3 або 4)
Передчасне збудження шлуночків
Є/немає
Сегмент ST
- Оцінка змін
- Специфічність для ішемії
- Кількість епізодів
- Тривалість епізодів
Симптоми
- Зміни, відзначені в щоденнику пацієнта
- Чи є ЕКГ-субстрат у моменти виникнення симптомів?
Реакція ЧСС на фізичне навантаження
Наслідки для змін ЧСС
Технічна оцінка якості запису
Загальні коментарі
Примітка: Адаптовано за J. Adamec, R. Adamec, 2008.
Моніторування подій
Типи пристроїв для амбулаторного моніторування ЕКГ
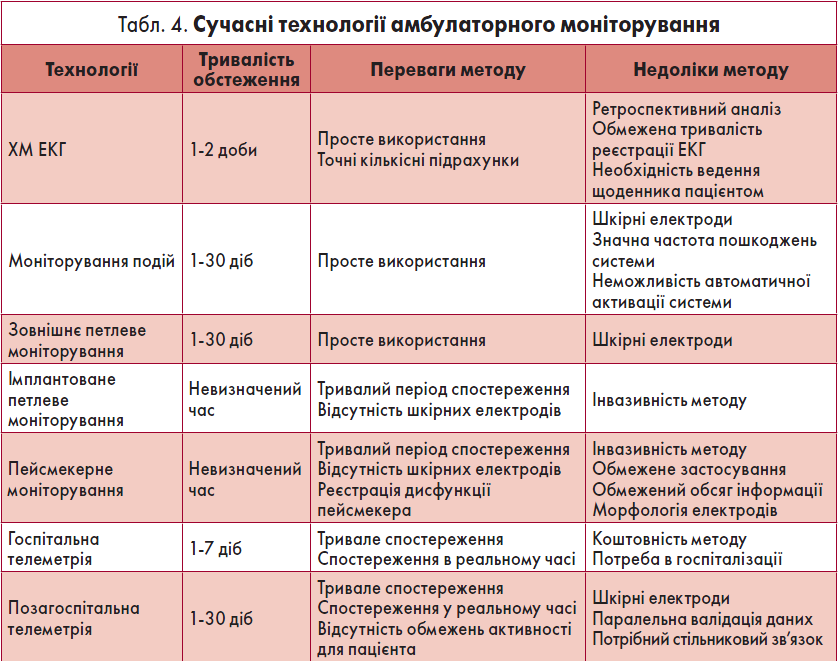
Певне обмеження ХМ ЕКГ полягає в короткому періоді обстеження, що пов’язано із труднощами виявлення нечастих аритмій та порушень провідності. Саме це зумовило появу протягом останнього часу нових технологій оцінки електричної активності серця, які ґрунтуються на принципі ХМ ЕКГ (табл. 4). Кожний із вказаних методів має свої переваги та недоліки.
Розрізняють кілька типів реєстраторів для переривчастого моніторування ЕКГ. Реєстратори подій записують короткий епізод ЕКГ після активації пристрою, у разі виникнення клінічних симптомів. Ці реєстратори прикріплюються й активуються пацієнтом самостійно. Приклад такого пристрою – монітор розміром банківської картки, який прикладається до грудної стінки в момент появи аритмії.
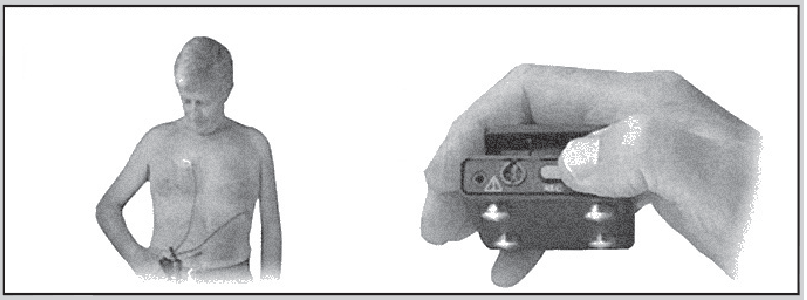
Існують також реєстратори подій, які постійно під’єднані та завжди готові до запису ЕКГ, але починають реєструвати ЕКГ лише після активації. Найпоширеніший тип такого реєстратора – монітор розміром пейджера, який прикріплюється двома електродами до грудної стінки (наприклад, негативний електрод – у правій підключичній області, позитивний – у позиції V5) і носиться пацієнтом на поясі (рис. 19).
Рис. 19. Реєстратор подій для переривчастого моніторування ЕКГ: А – позиції електродів, Б – активація пристрою
Порівняно з усіма іншими технологіями для амбулаторного моніторування ЕКГ вказані пристрої характеризуються найменшою вартістю.
Інша форма реєстратора подій – пристрій типу «годинник», який активується при прикладанні до нього пальців протилежної руки. Після реєстрації кількох епізодів дані зберігаються в пам’яті приладу. Далі ця інформація надсилається лікареві за допомогою телефону або факсу.
Описані пристрої дозволяють зареєструвати ЕКГ лише після активації, тобто після початку події, тому їх ще називають реєстраторами типу «після події» (post-event). Досконаліші реєстратори типу «перед подією» (pre-event) дозволяють записати ЕКГ не тільки після, але й до активації приладу. Це вдається зробити завдяки безперервному отриманню сигналу ЕКГ із постійним збереженням у пам’яті пристрою петлі, тобто останніх кількох секунд або хвилин.
У разі активації маркера пацієнтом або автоматичної активації пристрою петля пам’яті дозволяє «запам’ятати» ЕКГ протягом запрограмованого періоду до і після моменту початку події. Після закінчення реєстрації ЕКГ отримані дані передають лікареві за допомогою телефона або інтернету. Дослідження може тривати протягом кількох тижнів, що дозволяє виявити нечасті порушення серцевого ритму та оцінити ймовірний зв’язок з аритмією клінічних симптомів, які рідко виникають.
Отже, петлеві монітори – різновид «моніторування подій». Це єдина технологія, здатна встановити зміни ЕКГ не лише після, але й безпосередньо перед виникненням нечастих клінічних симптомів аритмії (Жарінов та співавт., 2010).
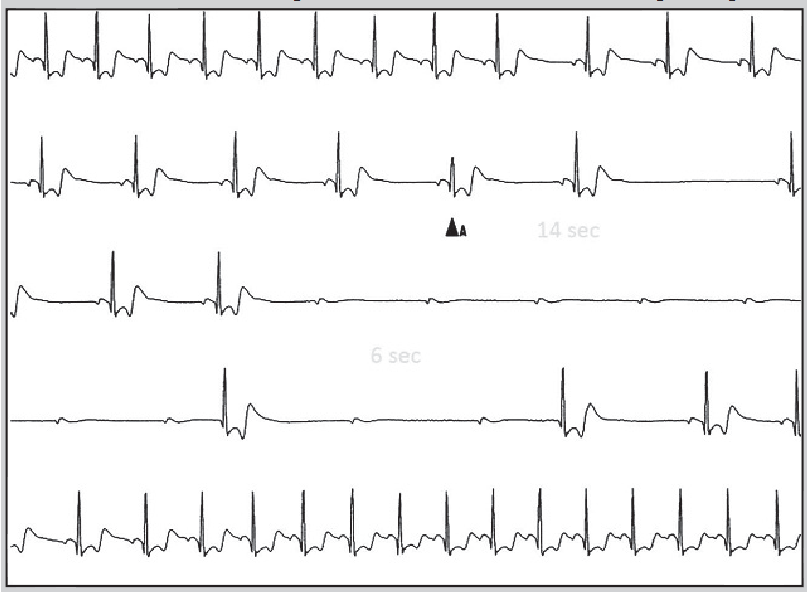
Для тривалішого моніторування ЕКГ використовують також імплантовані реєстратори подій, які встановлюють під шкіру справа або зліва від груднини. Вони забезпечують можливість реєстрації ЕКГ протягом запрограмованого періоду до і після активації пристрою пацієнтом або автоматичної активації у разі нечастого виникнення тяжких симптомів (синкопе), нападів тахі- та брадиаритмії (рис. 20). Після цього здійснюють телеметричну трансляцію зареєстрованої ЕКГ у пристрій-приймач для аналізу.
Рис. 20. ЕКГ, зареєстрована імплантованим реєстратором: прогресувальна синусова брадикардія, повна атріовентрикулярна блокада з дисфункцією водіїв ритму ІІ і ІІІ порядків
Примітка: Адаптовано за P. Alboni et al., 2013.
Можливість моніторування подій забезпечують також деякі двокамерні кардіостимулятори та імплантовані кардіовертери-дефібрилятори. Вони здатні розпізнавати порушення серцевого ритму, аналізувати кількість, частоту і тривалість розпізнаних аритмій. Серед наявних технологій для амбулаторного моніторування ЕКГ імплантовані реєстратори мають найбільшу вартість. Окрім того, існують певні обмеження точності та чутливості застосованих алгоритмів аналізу ЕКГ.
Показання для моніторування подій
Технології ЕКГ-моніторування подій мають певні переваги та обмеження, які повинні визначати перспективу їх клінічного застосування. Основний плюс даного методу порівняно із ХМ ЕКГ полягає в необмеженому збільшенні тривалості реєстрації ЕКГ. Залежно від потреби обстеження може тривати протягом тижнів або місяців. Значна перевага моніторування подій – висока специфічність дослідження, яка досягається при самостійній активації пристрою у разі виникнення симптомів.
Водночас певним обмеженням петлевих реєстраторів є потенційний дискомфорт при багатоденному прикладанні липких електродів до шкіри. Порівняно із ХМ ЕКГ моніторування подій – менш чутливий метод діагностики аритмій серця. Воно пов’язане з необхідністю активації пацієнтом і тому не дозволяє зареєструвати безсимптомні аритмії, а також аритмії, асоційовані з раптовою втратою свідомості. Щоправда, виявлення безсимптомних аритмій в осіб без будь-яких інших порушень серцевого ритму практично не впливає на оцінку ризику і тактику ведення хворих.
Слід зважати також на можливі перепони для якісної реєстрації ЕКГ:
- обмежені можливості або небажання деяких пацієнтів оволодіти правильними навичками роботи з «реєстраторами подій»;
- виникнення артефактів з огляду на підвищений тонус скелетних м’язів під час реєстрації ЕКГ;
- паркінсонізм або м’язовий тремор іншого походження.
Загалом ХМ ЕКГ може бути ключовим методом діагностики аритмій і порушень провідності серця в частини пацієнтів, дозволяє також уточнювати обставини виникнення, кількість та градацію аритмій серця, здійснювати стратифікацію ризику. Моніторування подій нерідко є основою для виявлення причини клінічних симптомів, встановлення діагнозу і подальшого вибору оптимальної тактики лікування. Потенційними показаннями для моніторування подій є напади серцебиття, синкопе, спостереження за перебігом раніше документованих аритмій, контроль ефективності антиаритмічної терапії. Визнані клінічні показання для моніторування подій – верифікація причини серцебиття і синкопальних станів.
Згідно з даними ретроспективного порівняння результатів різних досліджень, пристрої для моніторування подій (зокрема петлевий) із подальшою передачею отриманих даних за допомогою телефону дозволяють встановити діагноз у 66‑83% пацієнтів, ХМ ЕКГ – у 33‑35% осіб із нечастими нападами серцебиття.
Отже, у відповідних клінічних ситуаціях пристрої для моніторування подій характеризуються значно вигіднішим співвідношенням вартості та інформативності обстеження, ніж ХМ ЕКГ. Оптимальна тривалість моніторування подій для встановлення причини нападів серцебиття – 2‑4 тижні.
Інтерпретація даних амбулаторного моніторування ЕКГ обов’язково потребує порівняння часу виникнення порушень ритму або провідності серця із клінічними симптомами. Загалом можливі такі варіанти співвідношення та причинно-наслідкового зв’язку між аритміями та симптомами (Crawford et al., 1999):
- Симптоми з’являються одночасно з документованими епізодами аритмій, які є їх імовірною причиною.
- Суб’єктивні вияви не супроводжуються виникненням аритмій.
- Діагностовані аритмії не супроводжуються клінічними симптомами.
- Порушень ритму та клінічних симптомів протягом періоду моніторування ЕКГ немає.
Перший і другий варіанти співвідношення характеризуються високою діагностичною цінністю, оскільки дозволяють позитивно або негативно відповісти на запитання щодо зв’язку симптомів із порушеннями серцевого ритму. Також вони можуть бути підставою для прийняття клінічних рішень. При третьому варіанті важко визначити, чи аритмія має відношення до симптомів, які раніше спостерігалися в пацієнта. Не виключено, наприклад, що вони були викликані подібною аритмією, але більшою за градацією або тривалістю. Четвертий, варіант свідчить про недостатню тривалість здійсненого обстеження. Зазвичай у цьому випадку методом вибору є саме моніторування подій або методи, пов’язані зі спробами відтворення порушень серцевого ритму (електрофізіологічне дослідження).
Порівняно із нападами серцебиття значно складніше встановити причину синкопальних і передсинкопальних станів, хоча б з огляду на нижчу частоту їх виникнення. Про високу ймовірність аритмічної причини синкопальних станів свідчить виявлення:
- синусової брадикардії або ектопічних ритмів із ЧСС ˂30/хв у пасивний період доби;
- синусових пауз тривалістю >2 с;
- брадиаритмічного варіанта ФП із періодами асистолії тривалістю >2 с;
- АВ-блокади ІІ ступеня типу Мобітц ІІ;
- субтотальної та/або повної АВ-блокади;
- пароксизмів надшлуночкової тахіаритмії з ЧСС ˃150/хв;
- епізодів стійкої або нестійкої шлуночкової тахікардії.
Наголосимо, що ймовірність аритмічної причини синкопе значно більша в осіб зі структурною хворобою серця.
Загалом у разі неможливості встановлення причини синкопе на підставі анамнезу або фізикального дослідження слід передусім оцінити ймовірність стійкої шлуночкової тахіаритмії. Якщо анамнез дозволяє виключити нейрокардіогенне синкопе, а ризик шлуночкової тахіаритмії високий (про що свідчить тяжка фонова хвороба серця), методом вибору є електрофізіологічне обстеження. Пацієнтам із частими епізодами синкопе або передсинкопе (принаймні один на місяць) і низькою ймовірністю стійкої шлуночкової тахікардії або нейрокардіогенного синкопе показане зовнішнє петлеве моніторування ЕКГ. При рідкісних нападах синкопе або передсинкопе доцільно здійснювати триваліше петлеве моніторування ЕКГ за допомогою імплантованого пристрою.
Моніторування подій – зручний та економічно вигідний інструмент контролю за роботою постійних електрокардіостимуляторів, який дозволяє уникнути зайвих візитів пацієнта до клініки. Привабливою сферою застосування цього методу є також обстеження дітей і підлітків із підозрою на аритмії серця. Завдяки запису ЕКГ в амбулаторних умовах полегшується контроль ефективності та безпеки антиаритмічної терапії, передусім у пацієнтів із ФП і тріпотінням передсердь, а також екстрасистолією. Регулярна одноканальна реєстрація ЕКГ цілком достатня для своєчасного виявлення небажаних змін ЧСС, тривалості інтервалу PQ, комплексу QRS або інтервалу QT, які можуть передувати виникненню тяжких виявів аритмогенної дії та піддаються корекції.
Очевидно, такий контроль в амбулаторних умовах можливий за умови відсутності тяжкої структурної хвороби серця або СН. Однак поки що в терапевтичних стандартах цьому аспекту амбулаторного моніторування ЕКГ приділяється недостатньо уваги.
Використання моніторування подій суттєво доповнює наявні алгоритми обстеження пацієнтів із порушеннями серцевого ритму та провідності. Воно забезпечує можливість реєстрації ЕКГ і встановлення діагнозу в ситуаціях, коли застосувати інші методи дослідження неможливо, а багаторазове холтерівське моніторування ЕКГ виявляється неінформативним для підтвердження або заперечення «аритмічної» причини клінічних симптомів. З іншого боку, моніторування подій має чітко визначений спектр клінічних показань і не повинно застосовуватися без підстав.
Вибір оптимальної методики моніторування ЕКГ
Вибір оптимального способу моніторування ЕКГ має базуватися на особливостях клінічної ситуації. Безперервне (холтерівське) моніторування ЕКГ незамінне в тому разі, якщо потрібно здійснити кількісну оцінку вже діагностованих порушень серцевого ритму, ЧСС у різні періоди доби, виявити безсимптомні аритмії та порушення провідності серця, або в яких симптоми виникають щодня або майже щодня.
Крім того, безперервне (холтерівське або імплантоване моніторування ЕКГ з автоматичною активацією пристрою) показане пацієнтам, в яких спостерігаються епізоди повної втрати свідомості, що не здатні самостійно прикріпити або активувати реєстратор подій. У разі виникнення клінічних виявів щотижня, щомісяця або із ще більшою періодичністю безперервне моніторування ЕКГ не має сенсу.
Значно інформативнішим у цьому випадку є моніторування подій з активацією пристрою пацієнтом і можливістю подальшої передачі сигналу ЕКГ. Петлеве моніторування здійснюють тоді, коли тривалість симптомів незначна, і з огляду на це проблематично встигнути здійснити запис звичайної ЕКГ після появи симптомів. Пристрої для петлевого моніторування найдоцільніше використовувати за нечастих, відносно нетяжких, але стійких симптомів, які можуть бути зумовлені аритмією (The Task Force, 2013).
Важливим чинником вибору оптимального методу моніторування ЕКГ є співвідношення вартості та діагностичної інформативності обстеження. Якщо мета дослідження полягає в оцінці змін ЕКГ і частоти серцевого ритму на тлі нечастих симптомів, найбільш вигідно застосувати реєстратори подій, які прикріплюються й активуються самим пацієнтом. Водночас якщо надто мала тривалість або тяжкість симптомів обмежує використання цих пристроїв, доцільно застосувати петлевий монітор.
За діагностики причини нападів серцебиття і синкопальних станів обидва методи характеризуються кращим співвідношенням вартості та інформативності, ніж холтерівське моніторування ЕКГ. Імплантовані реєстратори подій мають найбільшу вартість, але незамінні у випадках, коли синкопальні епізоди виникають дуже рідко (один раз на кілька місяців), тож застосування інших типів пристроїв не має сенсу.
Технології амбулаторного фрагментарного моніторування ЕКГ вигідні для всіх учасників процесу надання допомоги пацієнтам з аритміями:
- Для лікарів вони забезпечують зручний та інформативний засіб діагностики порушень серцевого ритму.
- Для пацієнтів – можливість амбулаторного встановлення причини нечастих клінічних симптомів та передачі інформації для лікаря безпосередньо з дому.
- Для системи охорони здоров’я – шлях до економії загальних витрат на надання медичної допомоги.
Зменшення витрат забезпечується завдяки уникненню багатьох госпіталізацій, швидшому встановленню клінічного діагнозу, а також доступності нових неінвазивних технологій. З огляду на забезпечення постійного контакту з лікарем, моніторування подій і петлеве моніторування ЕКГ є зручними допоміжними засобами психологічної реабілітації осіб з порушеннями серцевого ритму. Застосування нових технологій виглядає особливо привабливим за умов впровадження страхової медицини.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 6 (79) 2021 р.