27 жовтня, 2022
Захист нейроваскулярного юніту – нова терапевтична ціль при черепно‑мозковій травмі
Автор: А. Г. Сірко, д.м.н., професор, завідувач Центру церебральної нейрохірургії КП «Дніпропетровська обласна клінічна лікарня ім. І.І. Мечникова» ДОР
 Черепно-мозкова травма (ЧМТ) є однією з найпоширеніших форм нейрохірургічної та неврологічної патології у всьому світі [1]. Сучасні дані свідчать про те, що сьогодні в усьому світі спостерігається зростання частоти травматизму; Україна – не виняток.
Черепно-мозкова травма (ЧМТ) є однією з найпоширеніших форм нейрохірургічної та неврологічної патології у всьому світі [1]. Сучасні дані свідчать про те, що сьогодні в усьому світі спостерігається зростання частоти травматизму; Україна – не виняток.
ЧМТ в Україні та світі: сучасний стан проблеми
ЧМТ є важливою медико-соціальною проблемою. Щороку майже в 10 млн потерпілих в усьому світі з’являється тяжка ЧМТ, яка супроводжується госпіталізацією, тривалою інвалідністю або смертю [2-4]. Частота ЧМТ у країнах Європейського Союзу (ЄС) становить ≈235 випадків на 100 тис. населення на рік [5, 6]. Смертність від ЧМТ у країнах ЄС – 15 випадків на 100 тис. населення на рік [7-9]. Майже в 5,3 млн потерпілих у США та в 6,2 млн у країнах ЄС спостерігають пов’язані із ЧМТ інвалідність, фізичні розлади, хворобу чи обмеження в соціальній сфері [2, 3].
В Україні щороку майже у 100 тис. потерпілих відзначали ЧМТ (Лехан В. М., Гук А. П., 2010). Частота внутрішньочерепних травм становила 19,6 на 10 тис. населення на рік. За 1 рік в Україні через ЧМТ помирало >11 000 хворих, тобто смертність становила 24 випадки на 100 тис. населення на рік (Шлапак І. П. і співавт., 2005); 55% помирали на догоспітальному етапі, а 41% – на госпітальному, що перевищує госпітальну летальність у розвинених країнах у >1,5 раза [10, 11].
Україна донедавна посідала 5-те місце в Європі за показниками смертності через дорожньо-транспортні пригоди (ДТП). За оцінкою Світового банку, втрати економіки України через ДТП щороку перевищували 5 млрд доларів США.
Останніми місяцями актуальність питання лікування та реабілітації постраждалих із ЧМТ і черепно-мозковими пораненнями (ЧМП) значно зросла, що пов’язано з початком повномасштабної війни на території України.
У структурі вогнепальних поранень голови переважають ушкодження м’яких тканин (49-55%). Під час локального збройного конфлікту на сході України (АТО 2014-2017 рр.) поранення м’яких тканин голови діагностовані в 53% [12, 13].
Непроникні поранення голови під час Другої світової війни становили 17% у структурі вогнепальних ЧМП, війни в Афганістані – 10%, збройного конфлікту в Чечні та на Північному Кавказі – 18%, під час локального збройного конфлікту на сході України в ході АТО (2014-2017 рр.) – 23% [13, 14].
Проникні ЧМП з’являються частіше, ніж непроникні, але рідше за вогнепальні ушкодження м’яких тканин голови. Під час Другої світової війни проникні ЧМП відзначені у 28% поранених, війни в Афганістані – у 40%, збройного конфлікту на Північному Кавказі – у 30%, АТО 2014-2017 рр. – у 41% [13, 14]. Під час війни в Афганістані ізольовані ЧМП діагностовано в 69% спостережень, поєднані – у 20%, множинні – в 11%. У збройних конфліктах на Північному Кавказі спостерігали чітку тенденцію до зменшення частоти ізольованих ЧМП і збільшення поєднаних та множинних: так, поєднані ЧМП у 1994-1998 рр. відзначали у 22% поранених, у 1999-2002 рр. – у 35%, множинні – відповідно в 13 і 16% [14, 15].
Найпоширенішими за умов сучасних локальних війн і збройних конфліктів є множинні рани, спричинені фрагментами вибухового пристрою, які зумовлюють ушкодження декількох анатомічних зон. Умови ведення бойових дій, особливості вогнепальної зброї, яка застосовується на сході України, докорінно відрізняються від раніше відомих збройних конфліктів [12].
Отже, ЧМТ супроводжується високою летальністю й інвалідизацією хворих, тяжкими наслідками зі стійкою тимчасовою втратою працездатності. Саме ЧМТ є однією з найрозповсюдженіших причин захворюваності та летальних наслідків серед молодих соціально активних осіб. Відповідно до даних різних джерел, інвалідами стають 19,0% потерпілих, а зниження працездатності спостерігається в 47,0-51% потерпілих. Окрім того, ЧМТ спричиняє значні економічні витрати для родини, суспільства та держави загалом.
Первинні та вторинні фактори ушкодження головного мозку. Роль системи нейромоніторингу в лікуванні ЧМТ
Окрім механічного ушкодження головного мозку (ГМ), що з’явилося безпосередньо після ЧМТ (первинні ушкодження), за даними ДУ «Інститут нейрохірургії ім. акад. А. П. Ромоданова НАМН України», існує високий ризик вторинних ушкоджень, які часто недооцінюють; вони додатково збільшують смертність при ЧМТ на 20-25% [15, 16]. Водночас вторинні ушкодження ГМ є потенційно оборотними, а первинні (несумісні з життям) відзначають лише у 39-45% потерпілих, які померли [16, 17]. Отже, майже 50% летальних наслідків можна запобігти.
Наразі немає ефективних методів лікування, здатних зменшити первинні ушкодження ГМ. Однак певні лікувальні заходи можуть мінімізувати вторинні ушкодження ГМ, спричинені впливом внутрішньочерепної гіпертензії (ВЧГ), гіпертермії, гіпоксії та ішемії ГМ.
Запровадження загальноприйнятого за кордоном критерію тяжкої ЧМТ (кращий бал за ШКГ після стабілізації ≤8 балів) дозволило стандартизувати визначення тяжкої ЧМТ. Одним із важливих досягнень у лікуванні тяжкої ЧМТ є введення клінічних протоколів лікування.
Доведено, що такі протоколи, засновані на принципах доказової медицини, забезпечили покращення неврологічних результатів. Етапи лікування, проведені згідно з протоколом, відрізняються багатьма ключовими моментами (як-от тип і послідовність оперативного втручання), проте загальною є концепція інтенсифікації лікування до досягнення мети (наприклад, певний рівень внутрішньочерепного тиску (ВЧТ) або церебрального перфузійного тиску (ЦПТ), насичення тканини мозку киснем (ptiO2), показників мікродіалізу). На основі аналізу змін ВЧТ, ЦПТ, кровообігу головного мозку (КГМ) та оксигенації ГМ можлива оцінка ефективності профілактики й корекції факторів вторинного ушкодження ГМ. На думку дослідників, основою цієї оцінки мають бути комп’ютерні системи реєстрації та аналізу зазначених параметрів. В Україні вже давно є нагальна потреба запровадження систем нейрофізіологічного моніторингу в потерпілих при ЧМТ.
На сьогодні клінічні центри, де рутинно проводиться нейромоніторинг (моніторинг ВЧТ, ЦПТ, оксигенації ГМ) при тяжкій ЧМТ, зазвичай є винятком, а не правилом.
Наявність ВЧГ у більшості хворих визначає тяжкість перебігу та прогноз. Застосування системи нейрофізіологічного моніторингу дозволяє проводити персоніфіковане лікування ЧМТ, коли використання тих чи інших терапевтичних засобів у режимі реального часу залежить від індивідуальних показників ВЧТ, ЦПТ, оксигенації ГМ і тканинного мікродіалізу (індивідуалізація лікування).
Сучасні рекомендації щодо лікування тяжкої ЧМТ у дорослих складаються з високоякісних звітів про докази, але вони більше не супроводжуються протоколами управління, оскільки для цього потрібен експертний висновок, щоб подолати розрив між опублікованими доказами та доглядом за пацієнтами. У 2020 р. консенсусна група зі 42 досвідчених і активно практикуючих лідерів думок щодо тяжкої ЧМТ із 6 континентів зібралася разом, щоб створити сучасний протокол ЧМТ для дорослих пацієнтів із встановленими моніторами ВЧТ і кисню в мозку [18].
Попередньо створивши протокол для лікування пацієнтів лише з моніторингом ВЧТ, розробники звернули увагу на пацієнтів, які мали монітор кисню в мозку на додаток до монітора ВЧТ. Протоколи управління були розроблені за допомогою консенсусного підходу, заснованого на методі Delphi, та завершені на особистій зустрічі. Результатом такого підходу було створення 3 окремих протоколів лікування, кожен з яких складався з 3 рівнів, відповідно до яких вищі рівні передбачають лікування з вищим ризиком. Один протокол стосується лікування підвищення ВЧТ, коли оксигенація ГМ є нормальною; другий стосується лікування гіпоксії мозку з нормальним ВЧТ; у третьому розглядається ситуація, коли наявні як внутрішньочерепна гіпертензія, так і гіпоксія ГМ. Комісія порушувала питання щодо переливання крові й управління штучною вентиляцією легень під час розробки різних алгоритмів. Автори дійшли висновку, що протоколи призначені для допомоги клініцистам у веденні пацієнтів як із монітором ВЧТ, так і з монітором кисню в мозку, але вони не відповідають ні стандарту догляду, ні заміні продуманого індивідуального управління. Ці протоколи слід використовувати в поєднанні з рекомендаціями щодо основного догляду та лікування, нещодавно опублікованими спільно з Seattle International Brain Injury Consensus Conference [19].
Як і запобігання ВЧГ, визначення показань до виконання оперативного втручання, його строків, обсягу та методу має вирішальне значення. На основі аналізу результатів багатоцентрових проспективних рандомізованих досліджень Американською асоціацією нейрохірургів створені й оприлюднені рекомендації з хірургічного лікування ЧМТ, однак багато питань залишаються невирішеними та потребують подальшого вивчення.
Незважаючи на значний інтерес наукового світу до проблеми ЧМТ, механізми, які лежать в основі розвитку нейродегенеративних процесів за ЧМТ, залишаються нез’ясованими. За останні два десятиліття молекулярні механізми загибелі нейронів після ЧМТ були розібрані багатьма групами. Ці механізми містять складні комбінації некрозу, апоптозу, некроптозу, а також автофагії [20, 21]. Розуміння таких шляхів надасть змогу застосовувати патогенетично обґрунтовану схему лікування пацієнтів із ЧМТ.
Первинні та вторинні ураження ГМ при ЧМТ. Перебіг патологічних процесів на клітинному рівні
Було встановлено, що перебіг ЧМТ і прогноз її наслідків залежать від вираженості первинних та вторинних уражень ГМ [22-25]. Первинні ураження є безпосереднім наслідком церебральної катастрофи. В момент травми нейрони, гліальні клітини, кровоносні судини зазнають впливу сил зсуву внаслідок обертального прискорення, стискання й розтягування, спричинених прискоренням і гальмуванням, а також контактом із кістковими виступами основи черепа. Залежно від агресивності ушкоджувального чинника з’являється той чи інший об’єм первинного ураження речовини ГМ. До первинних травматичних ушкоджень ГМ належать дифузне аксональне ушкодження, вогнища забою та розміжчення ГМ, певні первинні внутрішньочерепні крововиливи, розриви стовбура мозку тощо.
Первинне ушкодження зумовлює виникнення вторинних патологічних процесів: порушення КГМ, обміну речовин, іонного гомеостазу, запалення, вивільнення ексайтотоксичних амінокислот, вільних радикалів (ВР), кровотечі, набряку ГМ, що спричиняють вторинну травму мозку. При ЧМТ численні первинні та вторинні ушкодження нерідко збігаються в часі. Однак навіть якщо внаслідок ЧМТ нібито виникає лише один тип ушкодження, протягом хвилин, годин і діб запускаються численні клітинні та молекулярні процеси, які є проміжною ланкою в ушкодженні клітин [26-29].
Вторинні ушкодження погіршують стан травмованого ГМ і нерідко мають негативний вплив на результати лікування ЧМТ [30]. Протягом останніх 30 років проведені численні дослідження, присвячені вивченню низки вторинних ушкоджень, які є наслідком первинної механічної травми ГМ.
Основною збуджувальною амінокислотою в тканині ГМ є глутамат [31]. Стимуляція глутаматом рецепторів постсинаптичних лігандзалежних іонних каналів NMDA, AMPA (альфа-аміно‑3-гідрокси‑5-метил‑4-ізоксазол-пропіонат) і каїнат зазвичай є короткочасною, але якщо вона триває, нейрони гинуть. Це явище отримало назву ексайтотоксичності. Рівень глутамату в потерпілих із ЧМТ визначали за допомогою мікродіалізу [32-34]. Відзначено зв’язок між високим рівнем глутамату, підвищенням ВЧТ, ішемічним ушкодженням тканини ГМ (гіпотензія, гіпоксемія) та несприятливими наслідками ЧМТ [32, 35].
ЧМТ спричиняє вироблення надлишку ВР. Вивчалися реактивні форми кисню та азоту при ЧМТ [36-38]. Ексайтотоксичність, спричинена надмірною стимуляцією глутаматом, зумовлює підвищення внутрішньоклітинного вмісту Ca2+, внаслідок чого активуються ензими, що формують ВР: ксантин-оксидаза, синтаза оксиду азоту та фосфоліпаза [39, 40]. Ексайтотоксичність зумовлює збільшення вмісту Ca2+ в мітохондріях, що спричиняє структурні зміни їх внутрішньої мембрани з руйнуванням ланцюга переносу електронів, унаслідок чого збільшується утворення реактивних форм кисню [41, 42]. Ацидоз посилює формування ВР, оскільки за низького pH з трансферину та феритину вивільняється залізо, яке, своєю чергою, активує продукцію ВР [43].
ВР спричиняють перекисне окислення ліпідів [44]. Подальші конформаційні зміни мембран зумовлюють втрату їхньої функціональної цілісності. Існує припущення, що ВР ушкоджують ендотеліальні клітини гематоенцефалічного бар’єра (ГЕБ); крім того, було виявлено, що поглиначі ВР знижують проникність ГЕБ і зменшують набряк ГМ. ВР здатні окислювати білки та ДНК, а клітини під впливом H2O2 зазнають апоптозу чи некрозу залежно від його концентрації [45].
Уже через 2,5 год після ЧМТ у пенумбрі кори ГМ виявляють компоненти комплементу [46]. Впродовж декількох годин після травми в ГМ виробляються прозапальні цитокіни: інтерлейкін-1 (IL-1), інтерлейкін-6 (IL-6) та фактор некрозу пухлини-α (ФНП-α) [47, 48]. ФНП-α спричиняє порушення проникності ГЕБ, а цитокіни насамперед зумовлюють запальну реакцію, діючи як хемоатрактанти для лейкоцитів. Значну кількість нейтрофілів у судинній системі кори ушкодженого ГМ виявляють уже через 2 год після ЧМТ; максимальна їх кількість у паренхімі мозку накопичується через 24-48 год, при цьому через 24 год після ЧМТ в ушкодженій ділянці ГМ виявляють макрофаги [49]. Реакція одноядерних клітин на ушкодження відзначається на 2-гу добу після травми та досягає максимуму через 5-6 діб [50]. Лейкоцити спричиняють вивільнення ензимів, ВР і медіаторів, що змінюють церебральну вазореактивність. Накопичення поліморфоядерних лейкоцитів пов’язане з прогресуванням набряку ГМ після ЧМТ [51].
Набряк ГМ – патологічне накопичення рідини в його паренхімі; він буває вазогенним і цитотоксичним [52-54]. Інші різновиди набряку ГМ – осмотичний, інтерстиційний (гідростатичний), гіперемічний – на сьогодні належать більше до етіології, ніж до фізичного розташування [55-57]. За результатами останніх досліджень, основним типом набряку ГМ при ЧМТ є клітинний [58]. ЧМТ спричиняє каскад подій: механічну деформацію, вивільнення нейромедіаторів, мітохондріальну дисфункцію [59-63], деполяризацію мембран, що зумовлює порушення іонних градієнтів [64, 65]. При ЧМТ порушується функція іонних каналів унаслідок деполяризації, яка виникає одночасно з механічним ушкодженням, тимчасово збільшується вміст позаклітинного K+. Такі порушення іонного гомеостазу супроводжуються перерозподілом іонів Na+. За рухом іонів Na+ і Ca2+ пасивно слідують іони Cl– (підтримання електронейтральності), а за ними (осмотично) – вода. Тривалі іонні порушення спричиняють цитотоксичний набряк ГМ, що є первинним фактором підвищення ВЧТ [66-68].
Нещодавнє відкриття аквапоринів (AQP) було сприйняте з ентузіазмом, адже вони забезпечують механізм руху значного обсягу води через клітинну мембрану [69]. Виявлення в різних органах і тканинах сімейства AQP (водопровідного каналу на основі білка, що має 11 підтипів) було епохальним відкриттям [70-74], при цьому більшість публікацій присвячені AQP4 – одному з перших підтипів білка, виділеного з мембран астроцитів синаптичних нервових закінчень, розташованих поряд із кровоносними судинами [75]. AQP4 виявляють навколо судин будь-якого діаметра в білій, сірій речовині та у всіх відділах ГМ (передньому, проміжному, середньому, а акож у стовбурі мозку) [76, 77]. За даними G.P. Nicchia та співавт., AQP4 відповідає за швидкий транспорт води в культивованих астрогліальних клітинах і, ймовірно, є первинним чинником набряку ГМ, спричиненого ішемією [78]. За даними G.T. Manley та співавт., на 35% зменшилася вираженість набряку ГМ (її визначали за відсотком збільшення в розмірах ушкодженої півкулі) внаслідок перекриття середньої мозкової артерії у мишей з недостатнім умістом AQP4 [79]. Отже, AQP4 може відігравати ключову роль у модулюванні транспорту води в тканині ГМ, а пригнічення його активності може забезпечити нові терапевтичні можливості для зменшення вираженості набряку ГМ за різної патології. G.T. Manley та співавт. зазначають, що інактивація AQP4 в нокаутних мишей зменшує вираженість набряку ГМ, спричиненого гострою водною інтоксикацією та порушенням КГМ за ішемічним типом. Це окреслює нові напрями лікування набряку ГМ, особливо за можливості фармакологічної модуляції AQP4. В експерименті було продемонстровано можливість модулювати активність AQP4 за допомогою фармакологічних засобів, але для використання цих результатів у клінічній практиці необхідні подальші дослідження [80-82].
Процеси зменшення вираженості вазогенного набряку ГМ краще вивчено, ніж клітинного. В інтерстиції відбувається як масове переміщення рідини, так і її дифузія [83, 84].
За вазогенного набряку ГМ вивчалися 3 можливі механізми регуляції кліренсу позаклітинної рідини:
1) її масове переміщення до спинномозкової рідини (СМР) за наявності градієнтів тиску [85-88];
2) поглинання білкових компонентів набрякової рідини гліальними клітинами [89, 90];
3) трансендотеліальний везикулярний транспорт води у зворотному напрямку – з крові [91].
Було показано, що кліренс білкової рідини підтримується здебільшого за рахунок СМР [92, 93]. Ці дані збігаються з результатами досліджень H.J. Reulen і співавт., які продемонстрували рух набрякової рідини в напрямку шлуночка ГМ [94]. За даними інших дослідників [94, 95], під час інфузії рідини до паренхіми ГМ, коли набряк був зумовлений ефектом тиску, рідина рухалася до коркового шару 3 шляхами: позаклітинним простором нейропілю та збільшеними перикапілярним і периваскулярним просторами. Рідина може бути видалена у СМР у субарахноїдальному просторі шляхом дренування вздовж периваскулярних каналів; у цьому процесі не брали участі ні астроцити, ні нейрони, що суперечить даним інших авторів, згідно з якими поглинання білка клітинами є основним механізмом підтримання кліренсу за наявності вазогенного набряку ГМ [96, 97].
Крім різноманітних механізмів ушкодження, на результати лікування ЧМТ впливають такі чинники, як множинність ушкоджень (політравма), вік, стать потерпілих, вживання алкоголю / наркотиків, наявність супутніх патологій тощо [98-104]. Гірші наслідки ЧМТ можуть бути зумовлені певними генетичними особливостями, зокрема поліморфізмом алелів аполіпопротеїну Е (ApoE), що бере участь у процесах ушкодження та відновлення тканини ГМ, впливає на процеси нейродегенерації, накопичення в корі ГМ білка бета-амілоїду [105-107]. У потерпілих з алеломорфом ε4 ApoE ймовірність несприятливих результатів лікування через 6 міс після ЧМТ є удвічі вищою, ніж за його відсутності [108-110].
M.A. Schreiber у дослідженнях з використанням регресійного аналізу показав негативний вплив на результати лікування ЧМТ поєднання низького рівня свідомості (за ШКГ) і похилого віку потерпілих, що можна пояснити наявністю супутньої патології та швидким виснаженням компенсаторних механізмів; молодий вік пацієнтів, початковий високий рівень свідомості (13 балів за ШКГ) виявилися сприятливими прогностичними чинниками [111]. Результати лікування ЧМТ у молодих жінок також були кращими, що пояснюється високим умістом у їхній крові естрогенів, які є нейропротекторними гормонами. В молодих потерпілих чоловічої статі нейропротекторну властивість має тестостерон, рівень якого з віком зменшується [112].
Нейропротекція чи цитозахист мозку?
Проведені дослідження стали основою для програм, спрямованих на розробку нейропротекторних лікарських засобів для надання невідкладної допомоги за ЧМТ. Були проведені численні дослідження ранніх стадій – понад 20 клінічних випробувань ІІ і ІІІ фази за участю потерпілих з помірно тяжкою та/або тяжкою ЧМТ [113, 114]. Вивчені антагоністи глутамату, Ca2+ і брадикініну, стероїдні гормони, поглиначі ВР тощо. Однак достовірних відмінностей ефективності при застосуванні цих засобів і плацебо під час клінічних випробувань не виявлено.
Ймовірні причини зазначених невдач пов’язані з недостатнім вивченням механізмів вторинного ушкодження ГМ (наприклад, відмінностей тривалості «терапевтичного вікна» в людей та експериментальних тварин); недостатнім доклінічним випробуванням препаратів на різних моделях ЧМТ, біологічних видах, експериментальних тваринах різного віку, статі; відсутністю всебічного дослідження фармакокінетики запропонованих лікарських засобів; різнорідністю потерпілих та недосконалістю шкали оцінки функціонального стану, відсутністю біомаркерів для визначення тяжкості травми й одужання [115-118 ]. Значні надії покладають на комбіноване застосування лікарських засобів, монотерапія якими виявилася неефективною.
Вирішення проблеми надання медичної допомоги, а також захисту мозку в разі ЧМТ є одним з актуальних завдань нейрохірургії та неврології. Хоча в провідних клініках світу накопичений колосальний досвід лікування пацієнтів із ЧМТ, дотепер відсутні стандартизовані протоколи лікування. Надання медичної допомоги пацієнтам цієї групи також ускладнюється тим, що через відсутність специфічного лікування ЧМТ клініцисти часто обирають варіант ведення «за показаннями», залежно від клінічного перебігу травми. Ці факти значно ускладнюють менеджмент пацієнтів із ЧМТ, що, відповідно, впливає на показники їхньої летальності й інвалідизації, які все ще лишаються високими і не показують стійкої тенденції до суттєвого зниження.
Сучасний підхід до менеджменту пацієнтів із ЧМТ базується на сучасній концепції нейроваскулярного юніту (НВЮ), яка містить стратегії захисту нервової тканини та мікроциркуляторної ланки. Створення концепції НВЮ дозволило подивитися на проблему гострого ушкодження мозку з іншого боку; класична стратегія нейропротекції виявилася застарілою, оскільки вона не враховує усіх типів клітин ГМ, які зазнають ушкодження чи смерті за ЧМТ [119]. У 2019 р. було опубліковано звіт Консорціуму STAIR X, згідно з яким «нейропротекція» є неправильним підходом, оскільки не враховує всі типи клітин мозку, чутливі до пошкодження або смерті, тому рекомендовано змінити термін «нейропротекція» на «цитозахист мозку», щоб точніше описати намічену мету захисту всіх компонентів НВЮ. Також рекомендовано віддавати перевагу цитопротекторним підходам, які впливають на численні мішені ішемічного каскаду [120].
Концепція НВЮ
Останніми роками розуміння ролі інших клітин у патобіології кровоносних судин ГМ значно розширилося; сьогодні відомо, що існує тісний анатомо-функціональний зв’язок капілярів мозку, ендотеліоцитів із нейронами, гліальними клітинами та перицитами [121]. Такий єдиний взаємопов’язаний анатомо-функціональний комплекс має назву НВЮ – функціональна одиниця, представлена нервовою тканиною та мікроциркуляторною ланкою (рис. 1). Створення цієї концепції підкреслило унікальний взаємозв’язок між нервовими клітинами та судинною системою мозку.
Рис. 1. Схематична ілюстрація НВЮ [10]
Хоча життєво важливе значення церебральних судин для здоров’я мозку вже давно було зрозумілим, деякі нейробіологи продовжували вважати, що клітини та судини мозку належать до різних систем. Така дихотомія зумовила проблеми з розумінням функціонування центральної нервової системи (ЦНС). Зокрема, дослідники чітко розділяли нейродегенеративні (наприклад, хвороба Альцгеймера) та цереброваскулярні захворювання (наприклад, інсульт), тому ці стани вважалися взаємовиключними. Концепція НВЮ поставила під сумнів ці припущення та підкреслила симбіотичний зв’язок між клітинами мозку й церебральними кровоносними судинами, акцентуючи увагу на їхній структурі. НВЮ спочатку було введено як концептуальну основу для цереброваскулярних захворювань (зокрема, ішемічного інсульту). Сьогодні ж НВЮ належить ключова роль у розвитку багатьох інших захворювань ЦНС, у т. ч. ЧМТ, гостре порушення мозкового кровотоку, нейродегенеративні процеси [122].
Як концептуальна одиниця НВЮ підкреслює важливість передачі сигналів «клітина-клітина» між усіма компонентами. Отже, порушення передачі сигналів і порушення зв’язків між компонентами лежить в основі дисфункції ГМ за ЧМТ [123]. Нервовий компонент (зокрема, нейрони) має вирішальне значення для когнітивної функції пацієнтів і зазнає впливу різних патологічних чинників, як-от гіпоксія та окислювальний стрес. Судинний компонент утворює ГЕБ, який є частиною НВЮ і важливою багатоклітинною структурою, що відокремлює мозок від системи кровообігу. Складна взаємодія між компонентами НВЮ вимагає, щоб кожен клітинний компонент функціонував злагоджено та скоординовано з метою забезпечення гомеостазу ЦНС. Кожен із компонентів НВЮ має спеціальні функції, які є критичними для загальної функції НВЮ. Нейрони в НВЮ забезпечують сигнали та контролюють місцевий кровообіг безпосередньо, наприклад, через оксид азоту, а також опосередковано за допомогою клітин глії.
Як відомо, оксид азоту є сигнальною молекулою, яка бере участь у регуляції мозкового кровотоку за рахунок зміни тонусу церебральних судин.
Гліальні компоненти НВЮ
Гліальні клітини ГМ, представлені астроцитами (астроглія), олігодендроцитами та мікроглією, виконують різні функції для підтримки гомеостазу ЦНС. Зокрема, астроцити забезпечують регуляцію церебрального кровообігу й утворюють функціональний бар’єр – т. зв. пограничну гліальну мембрану, котра відокремлює нейрони від кровоносних судин, мозкових оболонок, периваскулярних просторів [124, 125]. На додаток до структурної підтримки нейронів астроцити також сприяють нормальному функціонуванню нейронів (регулюють нейромедіатор глутамату, вивільнюють нейротрофічні фактори та гліомедіатори тощо). Крім того, астроцитами також контролюються концентрація позаклітинних іонів і глімфатична система.
Мікроглія – імунокомпетентні клітини ЦНС, які забезпечують функцію розпізнавання та фагоцитування патогенів, мертвих клітин, тобто саме мікроглія утворює першу лінію захисту ЦНС, а також забезпечує «очищення», опосередковане фагоцитозом. І навпаки, мікроглія бере участь у секреції нейротоксинів, як-от індуцибельна NO‑синтаза (іNOS) та прозапальні цитокіни, які негативно впливають на ЦНС [126].
Іншим типом гліальних клітин мозку є олігодендроцити, що забезпечують синтез мієліну, з якого утворюється мієлінова оболонка нервових волокон, відповідальна за значне прискорення передачі нервового імпульсу [127]. Загалом усі гліальні клітини (з огляду на їхню мультифункціональну роль у ЦНС) можуть впливати на результати лікування пацієнтів із розладами ЦНС.
Мікросудинні компоненти НВЮ
Мікросудинними компонентами НВЮ є перицити, ендотеліальні клітини та гладком’язові клітини судин. Перицити розташовані в центрі між ендотеліальними клітинами, астроцитами та нейронами, отже, вони беруть участь у передачі сигналу, а також зв’язку між сусідніми клітинами, за рахунок яких регулюють проникність ГЕБ, ангіогенез, метаболізм, кліренс, нейрозапалення, гемодинамічну відповідь й активність стовбурових клітин. Функція перицитів підтверджує їхню життєво важливу роль у ЦНС як у нормі, так і за патологічних станів [128].
Як і перицити, ендотеліальні клітини – фізіологічно важливі, адже беруть участь у підтримці судинного гомеостазу, регуляції церебральної вазоконстрикції та вазодилатації, ангіогенезі, секреції факторів антикоагуляції. Ендотеліальні клітини також мають життєво важливу роль у контролі метаболізму в ЦНС, регуляції транспорту іонів і поживних речовин. Ендотеліальні клітини пов’язані щільними контактами, що значно обмежує параклітинну дифузію речовин із крові до ЦНС. Ці ендотеліальні клітини разом із перицитами, базальною мембраною та «ніжками» астроцитів утворюють ГЕБ [129]. Цілісність ГЕБ має вирішальне значення для гомеостазу й імунопротекції усією ЦНС, при цьому серед усіх мікросудинних компонентів НВЮ саме ендотеліальні клітини є основним компонентом ГЕБ, тоді як перицити насамперед забезпечують підтримку цілісності ГЕБ.
Позаклітинний матрикс
Позаклітинний матрикс функціонує як якір для ендотелію через клітинно-матриксні взаємодії між ламініном (або іншими матриксними білками) та інтегрином. За допомогою цих взаємодій можна стимулювати численні внутрішньоклітинні сигнальні шляхи. Вважається, що саме щільні контакти є ключовою перешкодою для параклітинної дифузії, тому з огляду на участь матриксних білків у регуляції експресії ендотеліальних щільних контактів білки базальної мембрани, ймовірно, також відповідають за підтримку дифузії. Позаклітинний матрикс разом зі щільними контактами є основоположним для проникності ГЕБ, отже, деградація цих білків може значно посилити його дисфункцію. Крім того, матричні металопротеїнази (зокрема, ММР‑9) здатні руйнувати позаклітинний матрикс і щільні контакти, що підвищує проникність ГЕБ, а також спричиняє вазогенний набряк [130, 131].
Дисфункція НВЮ в патофізіології ЧМТ
Хоча на сьогодні відомі численні причини травми, ЧМТ послідовно пов’язана як із первинними, так і з вторинними механізмами ушкодження [132]. Так, у разі ЧМТ механічна сила безпосередньо зумовлює миттєве ушкодження, що містить ушкодження нейронів і судинні порушення; згодом спостерігається вторинне ушкодження, опосередковане такими патофізіологічними процесами, як окислювальний стрес, синдром системної запальної відповіді (SIRS), нейрозапалення, дисфункція ГЕБ і апоптоз [133-135]. Усі ці первинні та вторинні патологічні процеси сприяють структурним та/або метаболічним аномаліям НВЮ, що спричиняє тривалий неврологічний дефіцит.
Ішемічний каскад
Загибель нейронів, а також втрата асоціативних зв’язків у гострому періоді ЧМТ обумовлені складними механізмами, серед яких ішемічний каскад, що супроводжується окислювальним стресом, має одну із провідних ролей; його розвиток зумовлює прогресувальну нейропатологію і сприяє насамперед вторинному ушкодженню.
Окислювальний стрес разом із виснаженням енергії спричиняє дисфункцію іонних каналів, отже, й деполяризацію нейронів, агрегацію нейромедіаторів (наприклад, глутамату), що ще більше посилює деполяризацію нейронів, підвищення рівня токсичного кальцію [136]. Окислювальний стрес супроводжується підвищеними рівнями токсичних активних форм кисню (АФК), таких як пероксиди і ВР. У результаті дії активних форм кисню такі важливі компоненти клітини, як білки, ліпіди і ДНК, окислюються, порушується мітохондріальний ланцюг транспорту, індукуючи в такий спосіб ще більшу продукцію ROS і RNS, що спричиняє хибне коло [137].
Окислювальний стрес і подальший каскад патологічних біохімічних реакцій індукують апоптоз, некроз клітин, відтерміновану нейродегенерацію після ЧМТ [138].
Крім того, ішемічний каскад супроводжується порушенням функціонування мембранних електролітних каналів, підвищенням проникності клітинних мембран і ГЕБ, унаслідок чого в нейрони з екстрацелюлярного простору проникає вода. Це призводить до формування набряку мозку.
Окислювальний стрес, підвищені рівні токсичних білків можуть негативно впливати на астроцити, стимулюючи останніх секретувати прозапальні фактори, як-от ІЛ-6, моноцитарний хемоатрактантний білок-1 (MCP-1) та MMP-9, що зумовлює розвиток SIRS, нейрозапалення, вплив на ГЕБ [139]. Загальновідомо, що саме ішемічний каскад – ключова причина порушення функції ендотелію та НВЮ, що за несприятливих умов може призвести до загибелі окремих елементів або структурної одиниці (НВЮ) в цілому.
SIRS
Однією з ключових загроз ЧМТ легкої та середньої тяжкості є ризик SIRS, який може розвиватися в гострому періоді травми та є одним із клінічних проявів генералізованої запальної реакції організму і причиною ендотоксикозу [140]. Цей синдром розвивається внаслідок викиду низки біологічно активних речовин, які з вогнища пошкодження потрапляють у загальний кровоток.
Відомо, що SIRS є однією з основних причин розвитку синдрому поліорганної недостатності, а також інтрацеребральних гнійно-запальних ускладнень (гнійний менінгіт, менінгоенцефаліт, вентрикуліт, абсцес ГМ) [141]. SIRS може впливати на цереброваскулярну функцію шляхом зсуву в роботі клітин НВЮ від нейроваскулярної регуляції до нейрозапальної реакції.
Зазвичай для оцінки тяжкості SIRS використовують шкалу R. Bone, критеріями є: тахікардія (частота скорочень серця – >90 за 1 хв, тахіпное (частота дихання >20 за 1 хв), гіпо- або гіпертермія (температура тіла <36 °C або >38 °C), лейкоцитоз або лейкопенія (вміст лейкоцитів >12×109 в 1 л або <4×109 в 1 л), наявність у лейкоцитарній формулі незрілих форм лейкоцитів (>10% їх загальної кількості).
Зважаючи на зв’язок SIRS із подальшими гнійно-запальними ускладненнями, доцільно розпочати впливати на цей процес у ранній період травми.
Нейрозапалення
Нейрозапалення – ознака різних патологічних станів у ЦНС. Після первинної травми змінене мікросередовище та вивільнені з ушкоджених клітин внутрішньоклітинні компоненти спричиняють активацію, рекрутинг гліальних клітин, після чого і мікроглія, і астроцити реагують на стимули протягом подальших 24 год та досягають свого піку на ≈3-7-й день після ЧМТ. На додаток до сигналів «небезпеки», які виділяють ушкоджені клітини, мітохондріальний стрес, ексайтотоксичність глутамату й ушкодження судин також належать до тригерів нейрозапалення [142].
За мірою прогресування запальної реакції гліальні клітини-попередники утворюють навколо ушкодженої тканини гліальний рубець, який ізолює ушкоджені ділянки та пригнічує поширення запалення. Крім того, гліальний рубець експресує інгібіторні компоненти для регенерації аксона та діє як фізичний і хімічний бар’єр, що робить його основною перешкодою для регенерації аксона й відновлення зв’язків нейронів, тобто саме гліальний рубець, ймовірно, пов’язаний з довгостроковими наслідками в пацієнтів після ЧМТ.
Дисфункція ГЕБ
ГЕБ функціонує як ключовий гомеостатичний вузол між ЦНС та іншими основними системами організму. З огляду на те що ураження ГЕБ є однією із ключових ознак ЧМТ, його дисфункція може свідчити про тяжкість травми, а також про тривалість відновлення після ЧМТ. Порушення цілісності ГЕБ може бути наслідком первинної травми чи з’явитися вторинно внаслідок таких патологічних процесів, як запалення, метаболічні порушення та астроцитарна дисфункція. Внаслідок ЧМТ активуються декілька прозапальних шляхів (зокрема, IL‑1β/NF‑κB та JAK/STAT1), які індукують активацію MMP і подальшу деградацію позаклітинного матриксу, а також щільних контактів. Сама собою підвищена активація NF‑κB як фактора транскрипції також індукує транскрипцію прозапальних генів і ферментів, у т. ч. ICAM‑1 та іNOS. Продемонстровано, що перший збільшує проникність ГЕБ за рахунок полегшення трансендотеліальної міграції лейкоцитів, тоді як другий має ексайтотоксичний і нейротоксичний ефекти, а також активує MMP через іNOS. Крім того, нейрозапалення та виснаження запасів енергії самі собою зумовлюють порушення іонного транспорту, мітохондріальну дисфункцію, що ще більше посилюють дисфункцію ГЕБ.
Отже, ішемічний каскад та ризик SIRS у гострому періоді ЧМТ, нейрозапалення та дисфункція ГЕБ у проміжному періоді ЧМТ – провідні механізми дисфункції НВЮ за ЧМТ. З огляду на те що розвиток цих трьох станів пов’язаний зі скоординованою реакцією всіх компонентів НВЮ, вплив на нього має бути ключовою метою лікування.
Дисфункція НВЮ як нова терапевтична ціль
Патофізіологія вищезазначених реакцій підтверджує, що дисфункція НВЮ внаслідок ЧМТ, імовірно, сприятиме розвитку нейродегенеративних процесів [143]. Так, за результатами попередніх досліджень, повідомлено про підвищений ризик розвитку нейродегенеративних захворювань, таких як хвороба Альцгеймера, та посттравматичних станів, зокрема постравматичної епілепсії, енцефалопатії та ін., серед осіб, які мали ЧМТ у минулому [144]. Аналогічні дані також існують щодо хвороби Паркінсона [145, 146].
Гіпотеза дисфункції НВЮ випливає з такого:
- НВЮ містить нейрони, нейрогліальні / судинні клітини, позаклітинний матрикс і судинну мережу ГМ, що відіграють важливу роль у гомеостазі ЦНС;
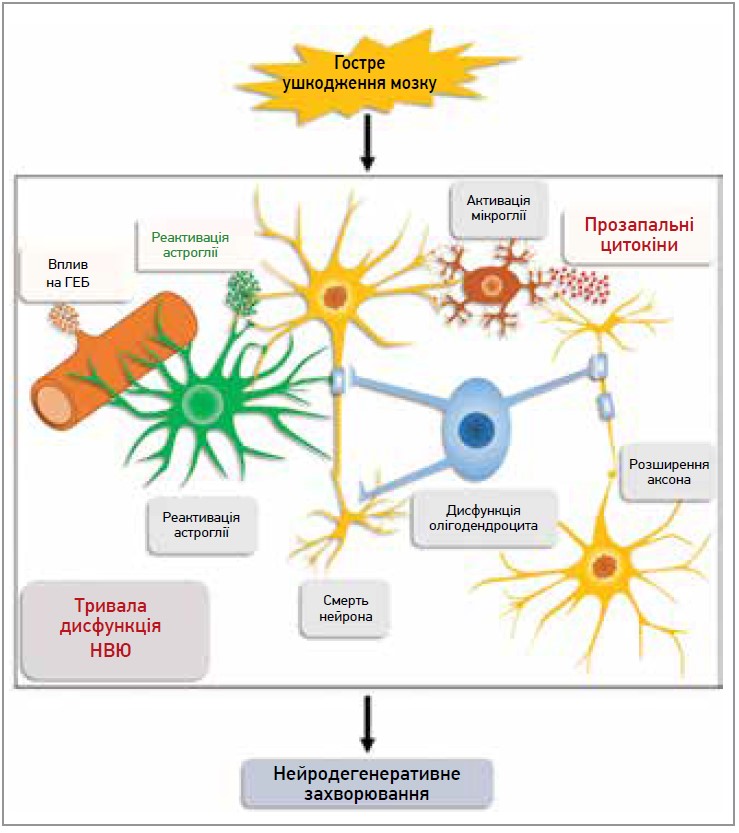
- усі первинні та вторинні патологічні процеси під час ЧМТ сприяють тривалій дисфункції НВЮ, в т. ч. смерті нейронів, нейрогліальній дисфункції та порушенню ГЕБ (рис. 2);
- пацієнти із ЧМТ мають підвищений ризик розвитку нейродегенеративних захворювань та інших патологічних порушень (зниження когнітивних функцій, якості життя, посттравматична енцефалопатія) в основі епідеміології та взаємних патологічних процесів;
- дисфункція НВЮ також бере участь у патофізіології нейродегенеративних захворювань [147].
Рис. 2. Дисфункція НВЮ за ЧМТ
Висновки
1. Таким чином, лікування пацієнтів із ЧМТ є складною та багатогранною проблемою і потребує адекватної корекції багатьох патофізіологічних порушень. Насамперед слід враховувати, що після первинного механічного ушкодження ГМ (ушкодження нейронів і судинні порушення) спостерігається вторинне ушкодження, опосередковане такими патофізіологічними процесами, як окислювальний стрес, синдром системної запальної відповіді (SIRS), нейрозапалення, дисфункція ГЕБ й апоптоз нейронів, на тлі яких розвиваються ВЧГ, гіпертермія, гіпоксія та ішемія ГМ. Попередні терапевтичні стратегії (ведення за показаннями, а також нейропротекція) не дали очікуваного результату та майже не вплинули на зниження показників летальності й інвалідизації, що вимагало пошуку нових підходів до лікування ЧМТ.
Сьогодні менеджмент пацієнтів із ЧМТ базується на сучасній концепції НВЮ, котра включає стратегії захисту нервової тканини та мікроциркуляторної ланки, які утворюють єдиний структурно-функціональний елемент тканини ГМ. Кожен із компонентів НВЮ має спеціальні функції, що є критичними для загального функціонування НВЮ. Так, нейрони в НВЮ забезпечують сигнальну функцію, беруть участь у контролі місцевого кровообігу; гліальні компоненти НВЮ здійснюють структурну підтримку нейронів, сприяють нормальному функціонуванню нейронів, регулюють церебральний кровоток; позаклітинний матрикс регулює проникність ГЕБ.
Саме тому цитопротекція має містити захист не лише нейронів, а й астроцитів, олігодендроцитів, мікроглії та мікросудинних компонентів. Так, сучасна концепція свідчить про необхідність захисту не нейронів, а саме НВЮ, яка складає єдиний структурно-функціональний елемент тканини ГМ, подібно до того, як у нирках слід розглядати як єдине ціле нефрон з його канальцями та пов’язаними з ним мікросудинами. Очевидно, що реалізація такого підходу на практиці означатиме необхідність підбору не одного чи двох препаратів, а цілої схеми цитопротекторного лікування.
2. Теоретично ідеальний цитопротектор має бути антагоністом одночасно декількох ушкоджувальних чинників. У більшості робіт, які публікувалися останніми роками, містяться рекомендації, що уточнюють окремі точки застосування протекторної терапії, основними напрямами котрої є блокування ішемічного каскаду шляхом зменшення інтенсивності вільнорадикального й перекисного окиснення ліпідів, гальмування вивільнення медіаторів (глутамат, аспартат), що мають ексайтотоксичну дію, зменшення набряку мозку, терапевтичні втручання для пом’якшення нейрозапалення, зменшення ризику виникнення SIRS та пом’якшення його проявів і наслідків, стимуляція системи нейротрансмітерів і нейромодуляторів та вплив на пришвидшення передачі нервового імпульсу, покращення перфузії ГМ, корекція енергетичного обміну шляхом зниження ушкоджувальної дії гіпоксії та зменшення енергетичної потреби нейронів, стимуляція репаративних процесів.
3. Однак сучасні дані (як на експериментальних моделях, так і на пацієнтах) чітко демонструють, що фокусування на нейронах є недостатньою терапевтичною стратегією. Чиста нейропротекція (навіть якщо вона ефективна) може не зумовити покращення результатів [148], тому раціональна протекторна терапія в разі ЧМТ передбачає урахування всього НВЮ та вплив на різні етапи каскаду патологічних реакцій, у т. ч. на ішемічний каскад та SIRS у гострому періоді, нейрозапалення та дисфункцію ГЕБ у проміжному періоді, з метою захисту всіх компонентів НВЮ.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 11 (528), 2022 р.



![Рис. 1. Схематична ілюстрація НВЮ [10]](/multimedia/userfiles/images/2022/ZU_11_2022/ZU_11_2022_Uria_Pharm_pic_1.jpg)