23 січня, 2023
Сучасні підходи до лікування дегенеративно-дистрофічних захворювань суглобів
За матеріалами конференції
Дегенеративно-дистрофічні захворювання суглобів характеризуються прогресуючим порушенням метаболізму суглобового хряща, кісткової структури епіфізів із подальшим залученням інших елементів суглоба. Ці хронічні процеси супроводжуються розвитком деформації суглобів, больовим синдромом, втратою функціональної активності, розвитком вторинного запального процесу та зниженням якості життя хворих. На засіданні круглого столу у рамках науково-практичної конференції «V зимова школа із травматології», яка відбулася наприкінці минулого року в онлайн-режимі, були представлені останні настанови, результати досліджень та рекомендації із ведення пацієнтів даного профілю, зокрема з остеоартритом.
Ключові слова: остеоартрит, деформуючий артроз, гонартроз, неденатурований колаген ІІ типу, нестероїдні протизапальні препарати.
 Доповідь «Консервативне та хірургічне лікування гонартрозу. Де межа?» представив член-кореспондент НАМН, заслужений лікар України, керівник відділу мікрохірургії та реконструктивно-відновлювальної хірургії верхньої кінцівки ДУ «Інститут травматології та ортопедії НАМН України», доктор медичних наук, професор Сергій Семенович Страфун.
Доповідь «Консервативне та хірургічне лікування гонартрозу. Де межа?» представив член-кореспондент НАМН, заслужений лікар України, керівник відділу мікрохірургії та реконструктивно-відновлювальної хірургії верхньої кінцівки ДУ «Інститут травматології та ортопедії НАМН України», доктор медичних наук, професор Сергій Семенович Страфун.
Актуальність вищезазначеної теми зумовлена кількома причинами. По-перше, деформуючий остеоартроз (ДОА), що здебільшого вражає колінний суглоб, є одним із найпоширеніших захворювань суглобового апарату й сучасною проблемою цивілізації. По-друге, в останні десятиліття відбувався бурхливий розвиток регенеративних медичних технологій. Поряд із цим значно зросли сучасні можливості артроскопії. Усе це сприяло певним змінам у підходах до лікування остеоартрозу колінного суглоба.
На сьогодні провідні ревматологічні та травматологічні/ортопедичні організації виділяють три основні підходи до лікування ДОА: нефармакологічний, медикаментозний і хірургічний.
Медикаментозна терапія включає препарати як локального впливу (мазі, гелі на основі НПЗП; ін’єкції глюкокортикостероїдів та гіалуронової кислоти [ГК]), так і системного (препарати швидкої й повільної дії). Останні, у свою чергу, розділяються на дві основні групи:
- симптоматичні (SMOADs): парацетамол, НПЗП, анальгетики, опіати;
- симптоматичні препарати сповільненої дії (SYSADOA) і патогенетичні або хворобомодифікуючі препарати для тривалої терапії остеоартриту (DMOADs): глюкозаміну сульфат, хондроїтину сульфат, неомилювані сполуки олії авокадо та сої, хрящовий неденатурований колаген II типу (UC ІІ®).
Основним компонентом медикаментозного лікування з метою швидкого та якісного знеболення є НПЗП, ефект яких спрямований на усунення запалення (настає протягом 1-2 тиж) і полегшення стану та функціональної активності суглоба.
Проте слід враховувати негативні наслідки прийому НПЗП із боку основних систем організму, зокрема шлунково-кишкового тракту, серцево-судинної системи та системи кровотворення.
Вкрай важливим є те, що окрім системних проявів застосування традиційних НПЗП безпосередньо може прискорювати прогресування остеоартрозу, що було показано при тривалому прийомі диклофенаку. Так, пацієнти, які приймали диклофенак >180 днів, мали у 2,4 раза збільшений ризик погіршення перебігу коксартрозу й у 3,2 раза – гонартрозу порівняно із групою пацієнтів, які приймали цей препарат коротким курсом (30 днів) (Reijman M. et al., 2005). Тривале застосування НПЗП при остеоартрозі пов’язують із дегенерацією суглобового хряща через повне пригнічення синтезу простагландину E2.
Автор доповіді зауважив, що традиційні НПЗП здатні також пригнічувати синтез глікозаміногліканів та колагену суглобового хряща при остеоартрозі. Тому постає питання використання інших НПЗП, а саме високоселективних інгібіторів циклооксигенази 2-го типу (ЦОГ-2), які дозволяли б мінімізувати вплив на шлунково-кишковий тракт і серцево-судинну систему й при цьому зберігали б фізіологічний рівень простагландину Е2, необхідний для відновлення хряща. Одним із найсучасніших представників високоселективних інгібіторів ЦОГ-2 є еторикоксиб (оригінальний препарат – Аркоксія®), який забезпечує тривале знеболення при хорошій переносимості. Важливим є хондропротекторний потенціал еторикоксибу, який реалізується завдяки наступним ефектам:
- зниження рівня прозапальних цитокінів IL-1β, TNF-α;
- зменшення гіперпродукції простагландину Е2 та збереження його фізіологічного рівня;
- зменшення рівня мікроРНК miR-214;
- збільшення експресії трансформуючого фактора росту в остеоартрозних хондроцитах.
Еторикоксиб швидко досягає пікової концентрації у плазмі та спинномозковій рідині, що забезпечує швидке настання знеболювального ефекту, який зберігається до 24 годин. Важливим є те, що еторикоксиб виявляє подвійну аналгезивну дію за рахунок пригнічення центрального й периферичного механізмів болю (Nielsen A. et al., 2016).
Підходи до ведення остеоартрозу включають консервативне й хірургічне лікування.
Лікування І стадії ДОА колінного суглоба за Келгреном – Лоуренсом передбачає наступні варіанти:
- консервативне лікування: нефармакологічне (модифікація способу життя, раннє виявлення провокуючих факторів та їх корекція, зниження маси тіла (за необхідності), ЛФК, використання індивідуальних устілок) і медикаментозне (парацетамол, НПЗП, фізіотерапевтичне лікування, SYSADOA та DMOADs);
- інтервенційна ортопедія: внутрішньосуглобове та параартикулярне введення препаратів (глюкокортикостероїдів, ГК, збагаченої тромбоцитами плазми (PRP);
- хірургічне лікування: артроскопія колінного суглоба при травматичному розриві менісків, ушкодженні суглобового хряща, наявності вільних або невільних кістково-хрящових тіл у порожнині колінного суглоба.
Доповідач зазначив, що при І стадії гонартрозу основу лікування складає консервативна терапія. Натомість у хворих із ІІ-ІІІ стадією захворювання можливості консервативної терапії вже звужуються, поступаючись інтервенційній ортопедії та хірургічному лікуванню.
Консервативна тактика включає вищезазначені нефармакологічні та медикаментозні засоби. Інтервенційні методики передбачають проведення внутрішньосуглобових і параартикулярних ін’єкцій глюкокортикостероїдів, ГК, а також введення PRP, концентрованого аспірату кісткового мозку (BMAC) та стромально-васкулярної фракції (SVF).
Хірургічне лікування на даній стадії захворювання включає:
- артроскопічний дебрідмент/лаваж колінного суглоба з використанням клітинних технологій (PRP, BMAC, SVF);
- артроскопію колінного суглоба з відновленням за допомогою шва ушкодженої частини менісків;
- відновлення суглобового хряща синтетичним матриксом;
- корекційні вальгизуючі/варизуючі остеотомії;
- трансплантацію ало/аутологічного суглобового хряща.
До регенеративних технологій у лікуванні локальних дефектів суглобового хряща відносять тунелізацію, остеохондропластику та аутохондропластику на фібриновому згортку.
У клінічній практиці часто можна спостерігати, коли тотальна меніскектомія призводить до прогресування остеоартрозу. Тому в більшості випадків при дегенеративних змінах проводять парціальну меніскектомію. Основними показаннями до цієї процедури є:
- ушкодження в «білій» зоні;
- масивні ушкодження менісків та інших структур колінного суглоба;
- часткова або повна блокада (обмеження рухливості) колінного суглоба;
- повторні розриви після зшивання;
- повний розрив (відрив) меніска;
- застарілий розрив із деградацією ушкодженої ділянки;
- дегенеративний розрив у пацієнтів похилого віку.
Відновлення менісків проводять за таких показань:
- периферійні ушкодження у «червоній» зоні;
- вертикальні й поздовжні розриви довжиною 1-4 см;
- відновлення менісків поєднані з відновленням передньої хрестоподібної зв’язки.
Метааналіз 11 досліджень показав, що застосування додаткових біологічних аугментів (фібриновий згорток) дозволяє знизити ризик невдачі при зшиванні меніска із 25,7 до 9,9% (Zaffagnini S. et al., 2021). У хворих із ІV стадією гонартрозу використовуються всі вищеперелічені методики консервативного та інтервенційного лікування. Хірургічне лікування передбачає ендопротезування колінного суглоба. За неможливості його проведення виконується артродез суглоба.
Далі професор С.С. Страфун приділив увагу особливостям застосування регенеративних технологій залежно від стадії ДОА колінного суглоба за Келгреном – Лоуренсом.
Так, при І стадії застосовується введення PRP внутрішньосуглобово, за потреби додатково із ГК, або параартикулярно у больові точки.
У хворих із ІІ стадією арсенал регенеративних технологій уже більш широкий, але на початковому етапі застосовується PRP (у поєднанні з ГК за необхідності), аналогічно як у хворих із І стадією. За неефективності такої терапії застосовують BMAC, або SVF жирової тканини, або їх поєднання. За наявності ушкоджень менісків і зв’язок проводять клітинну терапію разом із відновленням структур та дебрідментом.
При веденні ІІІ стадії ДОА застосовують усі попередні етапи лікування. Особливо зарекомендував себе метод введення BMAC у субхондральні зони суглоба, де при даній стадії захворювання зміни є більш вираженими.
Менеджмент ІV стадії включає застосування всіх можливих варіантів лікування остеоартрозу у якості паліативної допомоги за неможливості проведення ендопротезування.
Доповідач наголосив, що сьогодні клітинні технології не дозволяють виростити новий хрящ, але навіть у тяжких випадках захворювання дають змогу досягнути клінічного покращення, зниження рівня больового синдрому та потреби у знеболювальних препаратах.
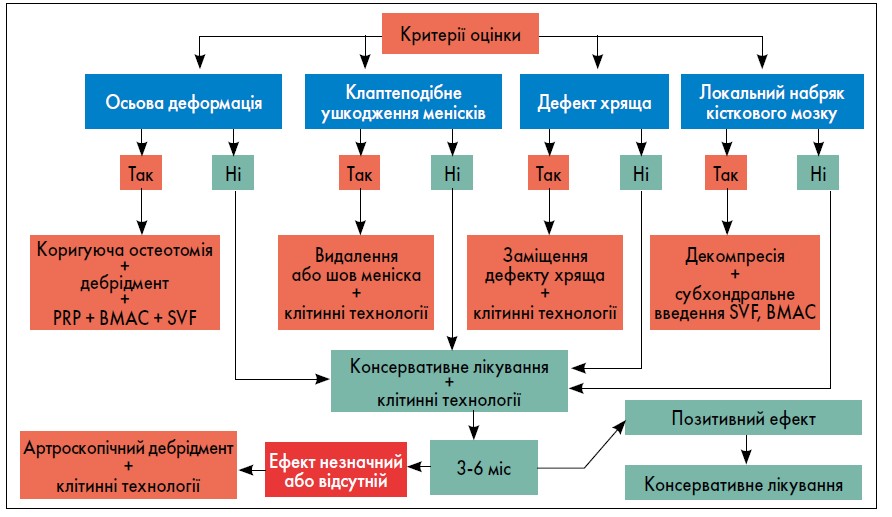
Відповідаючи на питання, де ж саме проходить межа консервативного й хірургічного лікування хворих на гонартроз, професор С.С. Страфун зазначив, що вона визначається наявністю або відсутністю певних симптомів. Як правило, у практиці лікарів ортопедів-травматологів переважають хворі із ІІ-ІІІ стадією ДОА колінного суглоба за Келгреном – Лоуренсом, і подальша тактика ведення таких пацієнтів залежатиме від конкретних патологічних змін за результатами рентгенографії (у положенні стоячи) і МРТ (рисунок). Разом із тим важливою є інтраопераційна оцінка стану ушкодженого суглоба, оскільки МРТ-картина не завжди повною мірою відображає наявні патологічні зміни.
Рис. Менеджмент ДОА колінного суглоба ІІ-ІІІ стадії за Келгреном – Лоуренсом
Особливості застосування симптоматичних препаратів повільної дії для лікування остеоартриту (Symptomatic SlowActing Drug in Osteoarthritis – SYSADOA) у доповіді «SYSADOA як базисна терапія остеоартриту – міф чи реальність?» представив віце-президент Асоціації ревматологів України, завідувач кафедри внутрішньої медицини № 3 Національного медичного університету імені О.О. Богомольця, доктор медичних наук, професор Олег Борисович Яременко.
 Відомо, що понад 10% населення хворіє на остеоартрит, тоді як поширеність хронічних запальних захворювань суглобів (ревматоїдний артрит, анкілозивний спондиліт, псоріатичний артрит) становить лише 1,0-1,5%. Тому питання підвищення ефективності та безпеки лікування остеоартриту з медико-соціальної точки зору залишається досить актуальним. Починаючи з 2012 року, беззаперечно стабільні позиції в менеджменті цього захворювання посідають нестероїдні протизапальні препарати (НПЗП). Рекомендації 2019 року Американського коледжу ревматологів (American College of Rheumatology – ACR) включають призначення НПЗП при збереженні виражених симптомів періодично або на постійній основі. Проте побічні ефекти НПЗП змушують постійно шукати їм якісну альтернативу.
Відомо, що понад 10% населення хворіє на остеоартрит, тоді як поширеність хронічних запальних захворювань суглобів (ревматоїдний артрит, анкілозивний спондиліт, псоріатичний артрит) становить лише 1,0-1,5%. Тому питання підвищення ефективності та безпеки лікування остеоартриту з медико-соціальної точки зору залишається досить актуальним. Починаючи з 2012 року, беззаперечно стабільні позиції в менеджменті цього захворювання посідають нестероїдні протизапальні препарати (НПЗП). Рекомендації 2019 року Американського коледжу ревматологів (American College of Rheumatology – ACR) включають призначення НПЗП при збереженні виражених симптомів періодично або на постійній основі. Проте побічні ефекти НПЗП змушують постійно шукати їм якісну альтернативу.
Останній Кокранівський огляд (2019 р.) щодо використання парацетамолу у пацієнтів із остеоартритом кульшового або колінного суглоба засвідчив, що середні терапевтичні дози препарату за ефективністю не перевищують плацебо, а вищі дози (24 г на добу) викликають значні ураження печінки. Були зроблені висновки, що парацетамол не має клінічно значущих переваг порівняно з плацебо, забезпечує лише мінімальне зменшення вираженості больового синдрому та незначне покращення функціональної активності пацієнта. Тому настанови з лікування остеоартриту, які передбачають застосування парацетамолу як анальгетика першої лінії, потребують перегляду (Leopoidno A.O. et al., 2019).
Спікер звернув увагу на те, що існують певні обмеження застосування НПЗП: навіть короткочасний прийом може призвести до побічних ефектів, особливо з боку шлунково-кишкового тракту, що зустрічаються приблизно у 25% випадків, а у 5% хворих можуть розвинутися серйозні ускладнення (кровотечі, токсичні ураження печінки й нирок). Особливо високий ризик спостерігається у літніх пацієнтів.
Серед симптоматичних препаратів сповільненої дії для лікування остеоартриту (SYSADOA) найбільш вивченими є глюкозамін та хондроїтину сульфат. Ще у 2014 році Європейське товариство клінічних і економічних аспектів остеоартрозу та остеопорозу (The European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis – ESCEO) відзначало, що лікування остеоартриту за допомогою глюкозаміну сульфату та хондроїтину сульфату може стримувати структурні зміни суглобів і, за необхідності, виступати альтернативою парацетамолу при тривалому застосуванні. Проте подальші дослідження не підтвердили це твердження.
Кокранівський огляд та результати рандомізованого подвійного сліпого клінічного дослідження (Kwoh, 2014) засвідчили, що прийом глюкозаміну гідрохлориду в дозі 1500 мг/добу протягом 6 міс не продемонстрував переваг порівняно з плацебо, зокрема стосовно структурномодифікуючого впливу, покращення морфологічних характеристик суглобового хряща (за даними магнітно-резонансної томографії), впливу на зниження екскреції маркера деструкції хряща (СТХ-ІІ). Дослідження ефективності застосування комбінації хондроїтину сульфату (1200 мг) та глюкозаміну сульфату (1500 мг) протягом 6 міс також не показало переваг порівняно з плацебо щодо зменшення болю і функціональних порушень у пацієнтів із гонартрозом (Roman-Blas J.A., 2017).
Метааналіз рандомізованих контрольованих досліджень ефективності глюкозаміну та хондроїтину при остеоартриті колінного та кульшового суглобів, який включав понад 7 тис. пацієнтів, довів, що ці SYSADOA не показали достовірної різниці загального ефекту щодо зменшення болю, поліпшення функції та зменшення скутості в суглобах порівняно з плацебо (Zhu X. et al., 2018).
Згідно з настановами 2018 року Європейської протиревматичної ліги (The European Alliance of Associations for Rheumatology – EULAR) із лікування остеоартриту суглобів кистей, хондроїтину сульфат може використовуватися для полегшення болю та покращення функціонування (сила рекомендацій – А), проте це стосується лише ураження суглобів однієї анатомічної ділянки – кистей. Доказових даних щодо доцільності застосування хондроїтину сульфату при інших локалізаціях остеоартриту не існує; перевага віддається корекції факторів ризику, допоміжним пристосуванням для ходьби, прийому НПЗП та внутрішньосуглобовим ін’єкціям глюкокортикоїдів.
Відсутність препаратів зі структурно-модифікуючою дією, низька клінічна ефективність та побічні ефекти симптоматичного лікування зумовлюють актуальність пошуку нових ефективних і безпечних засобів для лікування остеоартриту. До перспективних напрямків менеджменту цього захворювання відносять методи тканинної інженерії, препарати рослинного походження й препарати колагену та його дериватів.
Професор О.Б. Яременко наголосив, що наслідком перебігу остеоартриту є не лише зниження синтезу глікозаміногліканів і протеогліканів, а й негативні зміни кількісних та якісних характеристик колагену. Це має важливе значення, адже 50-70% сухого залишку суглобового хряща складає колаген, який підтримує міцність хряща, протидіє силам його стиснення/розтягнення. Наразі для лікування остеоартриту використовують повністю чи частково денатуровані форми колагену (гідролізати) і неденатурований колаген II типу (UC-ІІ®). Гідролізати колагену являють собою лише «будівельний матеріал», тобто джерело амінокислот і пептидів для синтезу колагену. Водночас неденатурований колаген реалізує свою дію через каскад імуноопосередкованих реакцій і продемонстрував ефективність у низці контрольованих експериментальних і клінічних досліджень. Наприклад, покращання якості шкіри (зменшення глибини та кількості зморщок) й еластичності сполучної тканини засвідчили вчені у клінічному випробуванні S. Sibilla et al. (2015). Засоби на основі колагену для перорального застосування вже після 4 тижнів прийому індукують вироблення власного колагену, а також синтез глікозаміногліканів, що пояснює збільшення гідратації шкіри, щільності колагенових волокон та зниження їх фрагментації (Asserin J. et al., 2015).
Неденатурований колаген ІІ типу (нативний колаген) ініціює каскад імунних реакцій, активуючи процес відновлення хрящової тканини суглобів. На цьому механізмі заснована дія нативного колагену, який представлений на фармацевтичному ринку України засобом Меркана®, що має у своєму складі запатентований неденатурований колаген II типу (UC-ІІ®). При пероральному прийомі UC-ІІ® із порожнини кишечника захоплюється дендритними клітинами, розташованими у пеєрових бляшках тонкого кишечника, оскільки нативний колаген не всмоктується у кров. Дендритна клітина встановлює, що цей антиген є безпечним для організму (оральна толерантність), і перетворює неспеціалізовані лімфоцити на «навчені», або специфічні, Т-регулятори. Ці клітини дозрівають у лімфатичних вузлах кишечника, потрапляють у системний кровотік і мають здатність продукувати синтез двох типів медіаторів: інтерлейкіну‑10 (ІЛ‑10) як головного протизапального цитокіну і трансформуючого фактора росту β, який є стимулятором регенеративних процесів у суглобовому хрящі (Li T.F. et al., 2005).
Якщо заглибитись у патогенетичні механізми дії неденатурованого колагену, то Т-регулятори із системного кровотоку потрапляють у капіляри синовіальної мембрани, а безпосередньо цитокіни методом дифузії переходять у синовіальну рідину, де проявляють такі ефекти (Li T.F. et al., 2005):
- ІЛ‑10 пригнічує синтез ІЛ‑1 та фактора некрозу пухлини α (TNFα) синовіоцитів, що сповільнює виділення агресивних ферментів (колагенази, гіалуронідази та ін.), здатних руйнувати хрящ;
- трансформуючий фактор росту β стимулює синтез хондроцитами компонентів матриксу хряща (колаген, хондроїтин, гіалуронова кислота).
Отже, препарат Меркана® проявляє одразу два ефекти – протизапальну дію та відновлення хряща, що забезпечує сповільнення прогресування захворювання й покращення функції суглобів.
Багатоцентрове дослідження з оцінки безпечності та ефективності застосування неденатурованого колагену ІІ типу в лікуванні остеоартриту (Mehra A. et al., 2019) засвідчило, що застосування UC-ІІ® сприяло зменшенню болю й скутості в суглобах, покращенню функціональної здатності суглобів на 40% за шкалою WOMAC та на 52% – за візуально-аналоговою шкалою порівняно з початковим станом. Протягом 3 міс дослідження не було зафіксовано небажаних наслідків, які б призвели до відміни препарату.
Подвійне сліпе рандомізоване дослідження з порівняння ефективності застосування UC-ІІ® та комплексу глюкозаміну гідрохлориду й хондроїтину сульфату (Lugo J.P. et al., 2016) показало, що через 6 міс лікування у групі прийому UC-ІІ® на 25% знизився больовий синдром і на 19,7% покращилася функція суглобів порівняно з комбінацією глюкозаміну з хондроїтином. Пацієнти, які приймали препарат UC-ІІ®, досягли зниження потреби у прийомі знеболювальних препаратів на 61%, що дозволило мінімізувати ризики розвитку побічних ефектів від застосування НПЗП.
Дані систематичного огляду, присвяченого вивченню ролі похідних колагену у відновленні суглобового хряща при остеоартриті (Honvo G. et al., 2020), дають переконливі підстави припускати, що використання препаратів колагену як додаткової терапії може бути доцільним у пацієнтів з остеоартритом.
Вітчизняне дослідження з вивчення ефективності й переносимості препарату Меркана® (UC-ІІ®) у хворих на остеоартрит ІІ-ІІІ рентгенологічної стадії за Келгреном – Лоуренсом (Яременко О.Б., Федьков Д.Л., 2021) додатково до традиційних критеріїв оцінки болю й функціональної активності суглобів включало визначення динаміки рівня С-телопептиду колагену ІІ типу у сечі (uCTXII) – маркера деструкції хряща та показників товщини хряща колінного суглоба за даними ультразвукового дослідження (УЗД). Уже через 1 міс прийому Меркана® спостерігалося достовірне зменшення болю та інших клінічних проявів остеоартриту (за даними опитувальника WOMAC), що досягло 33% через 6 міс. За час проведення дослідження побічних ефектів не спостерігалось, всі 30 включених у випробування пацієнтів завершили його успішно. Після 3 міс прийому Меркана® достовірна динаміка зниження рівня маркера деструкції хряща uCTX-II становила 5,6%, що вказувало на позитивні зміни метаболізму хряща. Підтвердженням цього може бути збільшення сумарного значення товщини суглобового хряща за даними УЗД після 6 міс лікування: на 17,6% у лівому коліні й на 5,6% – у правому. Ці дані демонструють ефективність і безпечність лікування хворих на остеоартрит препаратом неденатурованого колагену без негативного системного впливу.
Від редакції
Підвищення ефективності та безпеки лікування дегенеративно-дистрофічних захворювань суглобів залишається актуальною проблемою. Разом із тим продовжується пошук нових засобів фармакотерапії, відбувається бурхливий розвиток регенеративних технологій і зростають сучасні можливості артроскопії. Так, поряд із традиційною протизапальною терапією в арсеналі лікарів з’явився сучасний хондропротектор для тривалого лікування остеоартриту на основі неденатурованого колагену ІІ типу (UC-ІІ®) - Меркана®. Оптимальним НПЗП при остеоартрозі можна вважати сучасний селективний інгібітор ЦОГ-2 еторикоксиб, представлений в Україні оригінальним препаратом Аркоксія®, оскільки він демонструє високу знеболювальну активність при хорошій переносимості й позитивному впливі на суглобовий хрящ.
Підготувала Катерина Пашинська
Тематичний номер «Хірургія. Ортопедія. Травматологія. Інтенсивна терапія» № 5 (52), 2022 р.