13 травня, 2024
Іксазоміб + леналідомід + дексаметазон у рутинній клінічній практиці: ефективність при рецидивній/рефрактерній множинній мієломі
За результатами дослідження INSIGHT-RMG
Інгібітори протеасом є класом препаратів, що використовується для лікування множинної мієломи (ММ) – злоякісного новоутворення, яке розвивається з плазматичних клітин кісткового мозку. Іксазоміб, перший пероральний інгібітор протеасом, схвалений для терапії ММ у комбінації з леналідомідом і дексаметазоном у дорослих пацієнтів, які отримали щонайменше одну попередню лінію терапії.
Дослідження INSIGHT-RMG, проведене в умовах рутинної клінічної практики, продемонструвало: ефективність і профіль безпеки комбінації іксазомібу, леналідоміду та дексаметазону у раніше лікованих пацієнтів з ММ були зіставними з такими в клінічному дослідженні ІІІ фази TOURMALINE-MM1, на основі якого було надано схвалення цій комбінації препаратів. Ці дані мають важливе значення, оскільки вони вказують на те, що пацієнти з ММ у клінічній практиці можуть отримати подібну користь від даної терапії, як і учасники клінічних досліджень, незважаючи на потенційно гірший загальний стан здоров’я.
Результати лікування ММ у рутинній клінічній практиці часто відрізняються від даних, отриманих у клінічних дослідженнях, причому у пацієнтів з повсякденної практики спостерігаються гірші віддалені результати [1, 2]. Ця розбіжність може бути зумовлена відмінностями в характеристиках пацієнтів і строгими критеріями відбору для участі в клінічних дослідженнях. Зокрема, значна частка пацієнтів (40%) у реєстрах та за даними сучасних досліджень не відповідає стандартним критеріям включення до рандомізованих досліджень [3]. Аналогічно аналіз понад 3000 пацієнтів, які увійшли до глобального проспективного дослідження INSIGHT-MM (NCT02761187), показав, що 39% пацієнтів з ММ, які лікуються в рутинній клінічній практиці, не підпадають під критерії участі в дослідженнях [4]. Крім того, ретроспективний аналіз електронних медичних карток у США продемонстрував: від 47,9 до 72,3% пацієнтів з повсякденної практики з рецидивуючою/рефрактерною (р/р) ММ не відповідають критеріям прийнятності для участі в клінічних дослідженнях [5]. Таким чином, дослідження за даними спостережень можуть надати важливу інформацію про ефективність і безпеку нових методів лікування в рутинній клінічній практиці, оскільки вони мають менш строгі критерії включення і, отже, охоплюють більш різноманітну популяцію пацієнтів, які часто недостатньо представлені в клінічних дослідженнях (наприклад, літніх та ослаблених пацієнтів, пацієнтів із супутніми та/або прогресуючими захворюваннями, а також представників певних етнічних меншин чи рас) [3, 6, 7].
Відмінності в результатах між реальними умовами та умовами клінічних досліджень можуть також виникати через варіації тривалості терапії. Фактори, які можуть обмежувати тривалість лікування в рутинній практиці, включають вплив лікувального закладу, оскільки академічні та громадські центри мають різний рівень досвіду у застосуванні нових схем лікування та керуванні побічними ефектами, а також відмінності у перевагах пацієнта/лікаря щодо підходів «від лікування до прогресування». Крім того, більший тягар супутньої патології може вплинути на переносимість, зручність і практичність терапії в реальних умовах, що може призвести до передчасного припинення лікування. Тому результати досліджень за даними спостережень здатні краще інформувати про справжню терапевтичну користь, яка може бути досягнута, і допомогти у прийнятті рішень щодо лікування в повсякденній практиці [8].
Іксазоміб схвалений у понад 70 країнах у комбінації з леналідомідом і дексаметазоном для лікування пацієнтів з ММ, які отримали принаймні одну попередню лінію терапії [10]. Схвалення ґрунтувалося на результатах дослідження III фази TOURMALINE-MM1. У ньому порівнювали іксазоміб + леналідомід + дексаметазон (IRd) та плацебо + леналідомід + дексаметазон (плацебо-Rd) у дорослих з р/рММ, котрі попередньо отримали від одного до трьох курсів лікування [11]. Дослідження продемонструвало значно довшу виживаність без прогресування (ВБП) та покращення частоти відповіді при застосуванні IRd порівняно з плацебо-Rd (медіана ВБП 20,6 проти 14,7 місяця; відношення ризиків 0,74; 95% довірчий інтервал (ДІ) 0,587-0,939; р=0,01). Також значно покращилася частота відповіді (загальна частота відповіді (ЗЧВ) 78 проти 72%; частота дуже хорошої часткової або кращої відповіді (≥ДХЧВ) 48 проти 39%) при обмеженій додатковій токсичності в групі IRd [11].
Нові дані сучасних досліджень пацієнтів з ММ, які отримували іксазоміб, свідчать про те, що результати в рутинній практиці можуть бути в цілому порівнянними з тими, що спостерігалися в дослідженні TOURMALINE-MM1. Однак глобальних даних за тривалий час у великій, різноманітній і неселективній популяції пацієнтів недостатньо. Тому було проведено об’єднаний аналіз дослідження INSIGHT-MM та Чеського реєстру моноклональних гаммапатій (RMG), щоб оцінити ефективність та безпеку IRd у пацієнтів з р/рММ у рутинній клінічній практиці.
Методи
Дизайн дослідження та популяція пацієнтів
Це був об’єднаний аналіз даних пацієнтів з р/рММ, які отримували IRd у проспективному дослідженні INSIGHT-MM, та RMG [17, 18]. Проаналізовані дані дослідження INSIGHT-MM з 1 липня 2016 по вересень 2019 року для і Чеського RMG з 1 травня 2007 по 5 лютого 2020 року. Для цього аналізу були відібрані дорослі пацієнти з р/рММ, у яких застосували ≥1 попередню лінію терапії та які отримували IRd.
Збір даних і кінцеві точки
Були зібрані індивідуальні дані пацієнтів з р/рММ (демографічні показники, характеристики захворювання, історія лікування, його ефективність і безпека), які отримали IRd. Ефективність оцінювалася за найкращою відповіддю на терапію, тривалістю терапії (DOT), часом до наступного лікування (TTNT), ВБП і загальною виживаністю (ЗВ). Відповідь і ВБП визначали на основі критеріїв Міжнародної робочої групи з мієломи за оцінкою лікуючого лікаря або місцевого дослідника [19]. Безпеку оцінювали шляхом реєстрації випадків зниження дози та відміни іксазомібу або леналідоміду, а також причин цих подій протягом періоду дослідження.
Статистичний аналіз
Кінцеві точки часу до події для DOT, ВБП і ЗВ оцінювали за допомогою методології Каплана – Меєра. TTNT визначали за допомогою методу кумулятивної частоти (конкуруючого ризику). Аналіз був переважно описовим і статистичні порівняння між групами не проводилися. Початкові характеристики пацієнтів і результати були проаналізовані для всіх пацієнтів та за лініями терапії IRd. Також виконано аналіз ВБП для пацієнтів, які отримували IRd у другій лінії порівняно з більше ніж другою лінією, та для пацієнтів, котрі застосовували IRd у другій і третій лініях порівняно з більш ніж третьою лінією. Аналіз проводився за допомогою програми SASR v9.4.
Результати
Популяція пацієнтів
На момент відсікання даних до аналізу було включено 263 пацієнти з 13 країн, які застосовували IRd, з них 132 пацієнти з INSIGHT-MM і 131 пацієнт із Чеського RMG. Пацієнти отримували в середньому дві попередні лінії лікування (діапазон від 1 до 9). Загалом 44% (n=115) пацієнтів призначали IRd у другій лінії, 35% (n=93) у третій, 11% (n=29) у четвертій і 10% (n=26) у більше ніж четвертій лінії.
Початкові характеристики пацієнтів і характеристики захворювання наведені в таблиці. Середній вік пацієнтів на початку терапії IRd становив 68 років (діапазон від 40 до 87 років), 15% пацієнтів – понад 75 років; 56% учасників були чоловіками. На початку терапії IRd найпоширенішим типом М-протеїну був імуноглобулін G (69%), а 21% пацієнтів мали екстрамедулярне захворювання. Медіана часу від встановлення первинного діагнозу до початку лікування IRd становила 35,8 (діапазон 3,0-387,4) міс.
|
Таблиця. Демографічні дані пацієнтів і характеристики захворювання загалом та за лініями терапії IRd |
|||||
|
Характеристика |
Всі (n=263) |
Друга лінія (n=115) |
Третя лінія (n=93) |
Четверта лінія (n=29) |
Більше ніж четверта лінія (n=26) |
|
Чоловіки, n (%) |
146 (56) |
59 (51) |
48 (52) |
23 (79) |
16 (62) |
|
Середній вік на початку терапії IRd, років (діапазон) |
68 (4087) |
70 (4184) |
67 (4087) |
67 (4579) |
67 (5281) |
|
Вік на початку лікування IRd, років, n (%) |
|||||
|
<50 |
18 (7) |
9 (8) |
7 (8) |
2 (7) |
0 |
|
5065 |
90 (34) |
32 (28) |
35 (38) |
11 (38) |
12 (46) |
|
6675 |
115 (44) |
52 (45) |
36 (39) |
15 (52) |
12 (46) |
|
>75 |
40 (15) |
22 (19) |
15 (16) |
1 (3) |
2 (8) |
|
Стадія за ISS на момент встановлення діагнозу, n (%) |
n=216 |
n=105 |
n=65 |
n=21 |
n=25 |
|
І |
73 (34) |
32 (30) |
24 (37) |
6 (29) |
11 (44) |
|
ІІ |
67 (31) |
40 (38) |
19 (29) |
3 (14) |
5 (20) |
|
ІІІ |
76 (35) |
33 (31) |
22 (34) |
12 (57) |
9 (36) |
|
Медіана часу від встановлення первинного діагнозу, |
n=260 35,8 (3,0387,4) |
n=115 28,3 (3,0196,6) |
n=90 43,4 (5,2234,8) |
n=29 53,7 (8,6387,4) |
n=26 83,8 (26,9378,8) |
|
Заклад для терапії IRd, n (%)† |
|||||
|
Академічний/університетський |
225 (86) |
102 (89) |
79 (85) |
23 (79) |
21 (81) |
|
Громадська лікарня/клініка |
38 (14) |
13 (11) |
14 (15) |
6 (21) |
5 (19) |
|
Пацієнти, які отримували IRd у клінічному дослідженні, n (%) |
n=134 5 (4) |
n=72 3 (4) |
n=35 2 (6) |
n=10 0 (0) |
n=17 0 (0) |
|
Стан за ECOG на початку року, бали, при застосуванні IRd, n (%) |
n=216 |
n=105 |
n=71 |
n=21 |
n=19 |
|
0 |
63 (29) |
24 (23) |
26 (37) |
9 (43) |
4 (21) |
|
1 |
123 (57) |
60 (57) |
39 (55) |
11 (52) |
13 (68) |
|
2 |
27 (13) |
18 (17) |
6 (8) |
1 (5) |
2 (11) |
|
3 |
3 (1) |
3 (3) |
0 |
0 |
0 |
|
Тип Мпротеїну на початку терапії IRd, n (%) |
n=218 |
n=101 |
n=68 |
n=23 |
n=26 |
|
IgG |
150 (69) |
62 (61) |
49 (72) |
17 (74) |
22 (85) |
|
IgA |
43 (20) |
26 (26) |
12 (18) |
3 (13) |
2 (8) |
|
Легкі ланцюги |
19 (9) |
11 (11) |
4 (6) |
2 (9) |
2 (8) |
|
Інший |
6 (3) |
2 (2) |
3 (4) |
1 (4) |
0 |
|
Цитогенетичні особливості до/на початку терапії IRd, n (%)* |
|||||
|
Цитогенетичні аномалії високого ризику |
19 (7) |
11 (10) |
4 (4) |
1 (3) |
3 (12) |
|
Цитогенетичні аномалії стандартного ризику |
63 (24) |
32 (28) |
20 (22) |
6 (21) |
5 (19) |
|
Дані недоступні |
181 (69) |
72 (63) |
69 (74) |
22 (76) |
18 (69) |
|
Тип рецидиву, n (%)§ |
|||||
|
Клінічний рецидив |
154 (59) |
77 (67) |
48 (52) |
11 (38) |
18 (69) |
|
Біохімічний рецидив |
109 (41) |
38 (33) |
45 (48) |
18 (62) |
8 (31) |
|
Екстрамедулярне захворювання на початку терапії IRd, n (%)‡ |
n=212 45 (21) |
n=94 18 (19) |
n=72 18 (25) |
n=23 0 |
n=23 9 (39) |
|
Лікування, отримане в будьякій попередній лінії до IRd, n (%) |
|||||
|
Бортезоміб |
238 (90) |
100 (87) |
86 (92) |
27 (93) |
25 (96) |
|
Трансплантація стовбурових клітин |
145 (55) |
47 (41) |
56 (60) |
20 (69) |
22 (85) |
|
Алогенна трансплантація стовбурових клітин |
2 (<1) |
0 (0) |
1 (1) |
0 (0) |
1 (4) |
|
Талідомід |
121 (46) |
25 (22) |
57 (61) |
20 (69) |
19 (73) |
|
Леналідомід |
71 (27) |
14 (12) |
21 (23) |
17 (59) |
19 (73) |
|
Карфілзоміб |
24 (9) |
6 (5) |
8 (9) |
3 (10) |
7 (27) |
|
Даратумумаб |
22 (8) |
4 (3) |
5 (5) |
5 (17) |
8 (31) |
|
Помалідомід |
5 (2) |
0 (0) |
0 (0) |
0 (0) |
5 (19) |
|
Рефрактерність до попередньої терапії, n (%)# |
|||||
|
PI |
27 (10) |
8 (7) |
9 (10) |
3 (10) |
7 (27) |
|
Леналідомід |
19 (7) |
2 (2) |
5 (5) |
6 (21) |
6 (23) |
|
CRAB – гіперкальціємія, ниркова недостатність, анемія, ураження кісток; ECOG – Східна кооперативна онкологічна група; ISS – Міжнародна система стадіювання; PI – інгібітор протеасом. †71% пацієнтів з INSIGHTMM і 100% пацієнтів з RMG отримували лікування в академічних/університетських закладах; 29% пацієнтів з INSIGHTMM і 0% пацієнтів з RMG отримували лікування в громадських лікарнях/клініках. *Цитогенетичні аномалії високого ризику були встановлені за допомогою флуоресцентної гібридизації in situ і визначені як del(17p), t(4;14), t(14;16), виявлені в будьякий час до лікування IRd. Для INSIGHTMM цитогенетичні результати оцінювали при рецидиві, тоді як для RMG їх можна було оцінювати в будьякий час. §Клінічний рецидив реєструвався для пацієнтів з критеріями CRAB, екстрамедулярним захворюванням або з обома параметрами на момент початку терапії IRd; біохімічний рецидив реєструвався для пацієнтів без цих параметрів. ‡Екстрамедулярне захворювання вважалося будьяким з варіантів: екстрамедулярне утворення, не пов’язане з кістками, кісткове екстрамедулярне пухлинне утворення або обидва. #Рефрактерність визначалася як прогресування під час або протягом 60 днів після припинення режиму, що містить РІ (бортезоміб або карфілзоміб) чи леналідомід. |
|||||
Відповідь на лікування IRd та результати
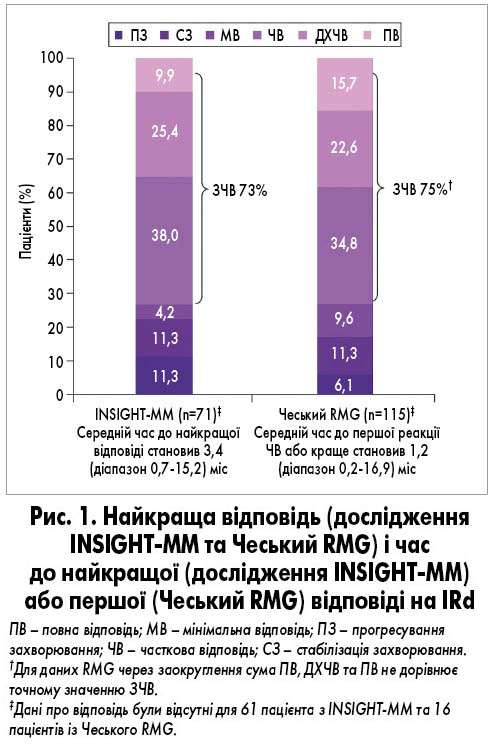 Для всіх пацієнтів комбінований показник ЗЧВ становив 73%, включаючи 37% пацієнтів, які досягли ≥ДХЧВ (рис. 1). Середня тривалість спостереження для всіх пацієнтів досягла 14,8 міс. Медіана DOT дорівнювала 11,8 міс (рис. 2А) і була довшою у пацієнтів, які отримували IRd у другій або третій лінії, ніж у четвертій або більше лінії терапії. Серед усіх пацієнтів медіана TTNT становила 33,0 міс (рис. 2Б) і була довшою у пацієнтів, які отримували IRd у раніших лініях терапії порівняно з пізнішими. Загальна медіана ВБП становила 21,2 міс (рис. 2В). Медіана ВБП була значно довшою у пацієнтів, які отримували IRd у другій лінії порівняно з більше ніж другою лінією, а також у другій і третій лініях порівняно з більше ніж третьою лінією. Медіана ЗВ для всіх пацієнтів і для тих, хто отримував IRd у другій, третій і четвертій лініях, не була досягнута; медіана ЗВ у більше ніж четвертій лінії становила 9,8 міс (рис. 2Г).
Для всіх пацієнтів комбінований показник ЗЧВ становив 73%, включаючи 37% пацієнтів, які досягли ≥ДХЧВ (рис. 1). Середня тривалість спостереження для всіх пацієнтів досягла 14,8 міс. Медіана DOT дорівнювала 11,8 міс (рис. 2А) і була довшою у пацієнтів, які отримували IRd у другій або третій лінії, ніж у четвертій або більше лінії терапії. Серед усіх пацієнтів медіана TTNT становила 33,0 міс (рис. 2Б) і була довшою у пацієнтів, які отримували IRd у раніших лініях терапії порівняно з пізнішими. Загальна медіана ВБП становила 21,2 міс (рис. 2В). Медіана ВБП була значно довшою у пацієнтів, які отримували IRd у другій лінії порівняно з більше ніж другою лінією, а також у другій і третій лініях порівняно з більше ніж третьою лінією. Медіана ЗВ для всіх пацієнтів і для тих, хто отримував IRd у другій, третій і четвертій лініях, не була досягнута; медіана ЗВ у більше ніж четвертій лінії становила 9,8 міс (рис. 2Г).
Подальше лікування
Дев’яносто один пацієнт мав повні записи про подальше лікування одразу після терапії IRd. Серед цих пацієнтів 26% згодом отримували даратумумаб, 24% – помалідомід, 20% – бортезоміб, 19% – леналідомід, 14% – карфілзоміб, 9% – талідомід, 3% – трансплантацію стовбурових клітин і 12% – інші види терапії.
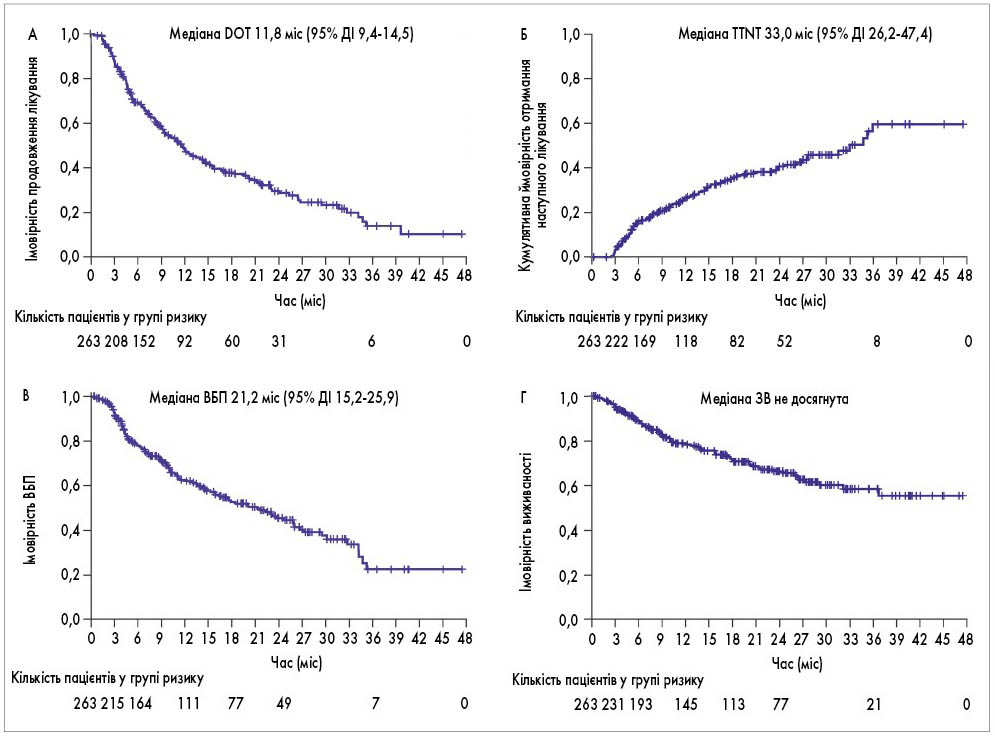 Рис. 2. Кінцеві точки часу до події при застосуванні IRd для загальної популяції пацієнтів (n=263). A – DOT; Б – TTNT; В – ВБП та Г – ЗВ
Рис. 2. Кінцеві точки часу до події при застосуванні IRd для загальної популяції пацієнтів (n=263). A – DOT; Б – TTNT; В – ВБП та Г – ЗВ
DOT, ВБП і ЗВ аналізували за допомогою методології Каплана – Меєра, TTNT визначали за допомогою аналізу кумулятивної частоти.
Безпека
Зниження дози іксазомібу та леналідоміду потребували відповідно 17 та 36% пацієнтів, які отримували лікування IRd; 10% пацієнтів було необхідне зниження дози іксазомібу через задокументовані небажані явища (НЯ), а 23% – зниження дози леналідоміду через задокументовані НЯ. Про відміну іксазомібу та леналідоміду повідомлялося у 50% пацієнтів; 32% потребували відміни іксазомібу через задокументовані НЯ, а 30% – припинення прийому леналідоміду через задокументовані НЯ.
Висновки
Об’єднаний аналіз даних дослідження INSIGHT-MM та Чеського RMG показав, що ефективність схеми IRd у рутинній клінічній практиці може бути порівнянною з отриманою в реєстраційному клінічному дослідженні III фази TOURMALINE-MM1. Незважаючи на те що пацієнти в повсякденній практиці мали несприятливіші характеристики захворювання та анамнез лікування порівняно з учасниками клінічного дослідження, ЗЧВ і ВБП були подібними в обох популяціях.
Отримані дані також свідчать про те, що найбільшу користь від застосування IRd пацієнти здобувають у раніших (другій або третій) лініях терапії порівняно з тими, хто лікується за цією схемою на пізніших етапах. Профіль безпеки IRd в рутинній практиці відповідав такому в клінічному дослідженні, при цьому не було виявлено нових повідомлень щодо безпеки. Схема добре переносилася пацієнтами, в тому числі особами старшого віку та з супутніми захворюваннями.
Список літератури знаходиться в редакції.
За матеріалами Hajek R., Minarik J., Straub J. et al. Ixazomib-lenalidomide-dexamethasone in routine clinical practice: effectiveness in relapsed/refractory multiple myeloma. Future Oncol. 2021 Jul; 17(19): 2499-2512.
DOI: 10.2217/fon-2020-1225.
Підготувала Анна Сочнєва
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 2 (88) 2024 р.



