10 червня, 2024
Ехокардіографія (частина 3)
Частина 1 Частина 2 Частина 3
У таблиці 1 представлено основні доплерівські характеристики потоків крові через клапани серця.
|
Таблиця 1. Характеристика нормальних потоків через клапани серця і магістральні судини |
|||||
|
Місце визначення швидкості потоку |
Нормальна швидкість потоку, м/с |
Графіка потоку |
Рекомендовані підходи для проведення вимірювань |
Чинники, які впливають на величину швидкості та графіку потоку |
|
|
Діти |
Дорослі |
||||
|
Мітральний клапан, діастола |
1,0 (0,8-1,3) |
0,9 (0,6-1,3) |
М-подібна |
Верхівкове чотирикамерне зображення. Верхівкове зображення по довгій осі лівого шлуночка |
Діастолічні властивості лівого шлуночка. Вік досліджуваного: з віком перша хвиля (Е) стає нижчою, а друга хвиля (А) — вищою. ЧСС: за тахікардії наростає хвиля А |
|
Тристулковий клапан, діастола |
0,6 (0,5-0,8) |
0,5 (0,3-0,7) |
М-подібна |
Верхівкове чотирикамерне зображення |
Діастолічні властивості правого шлуночка. Вік досліджуваного. ЧСС. Фаза дихання: на вдиху потік прискорюється |
|
Вихідний відділ правого шлуночка та легенева артерія, систола |
0,9 (0,7-1,1) |
0,8 (0,6-0,9) |
Параболічна |
Парастернальний підхід, коротка вісь, рівень аортального клапана |
Положення пробного об’єму в просвіті легеневої артерії: чим ближче до центру, тим вища швидкість |
|
Вихідний відділ лівого шлуночка, систола |
1,0 (0,7-1,2) |
0,9 (0,7-1,1) |
Параболічна Можлива реєстрація низькоамплітудних діастолічних потоків, які доходять сюди з мітрального отвору |
Верхівкове п’ятикамерне зображення |
|
|
Аортальний клапан 1 висхіднии відділ грудної аорти, систола |
1,5 (1,2-1,8) |
1,4 (0,81 - 1,7) |
Параболічна |
Супрастернальний підхід Права надключична ямка Правий парастернальний підхід з першого-другого міжребер’я Верхівкове зображення по довгій осі лівого шлуночка |
У висхідній аорті вища швидкість реєструється при розміщенні пробного об’єму ближче до зовнішнього вигину. Із віком людини швидкість стає меншою (внаслідок більшого діаметра висхідного відділу аорти в старших осіб) |
Кольорова доплерівська ехокардіографія
Методика кольорової доплерівської ехокардіографії за фізичним принципом не відрізняється від доплерівського дослідження імпульсною хвилею. Основна відмінність – спосіб зображення на екрані отриманої інформації. При кольоровому доплерівському дослідженні автоматично визначають напрямок і швидкість потоку крові у великій кількості точок у межах заданого оператором сектора, і кожну із цих точок забарвлюють у певний колір залежно від того, в якому напрямку і з якою швидкістю тут відбувається рух еритроцитів. Якщо точки розміщено достатньо щільно, а оцінювання відбувається в реальному часі з достатньо високою частотою оновлення кадрів, то можна отримати зображення у вигляді рухливої кольорової хмарки, яке сприймається як рух потоків через серце (Флакскампф, 2013). «Хмарка» постійно і ритмічно змінює кольорову гаму, залежно від фази серцевого циклу і, відповідно, від напрямку, у якому йде потік крові.
Рух крові в напрямку до датчика переважно подають у жовто-червоній гамі кольорів, у протилежному напрямку – в блакитно-синій. Причому беруть до уваги лише два основні напрямки: до датчика і від нього. Якщо ж напрямок потоку є косим щодо осі скенування, то до уваги беруть ту складову частину вектора швидкості, яка паралельна до лінії променя, що скенує. Що більша швидкість потоку, то світлішим відтінком кольору (червоного чи синього) вона відображається. Відсутність потоку, тобто нульова швидкість, позначається чорним кольором. Тому в разі, коли напрямок потоку, незважаючи на його швидкість, буде перпендикулярним до осі скенування, він відображатиметься на екрані також чорним кольором.
На екрані, у верхньому лівому кутку зазвичай представлено шкалу кольору, що інформує, якому напрямку певна кольорова гама відповідає.
Якщо швидкість і напрямок потоку в певній точці змінюються дуже швидко, як це трапляється за турбулентного характеру потоку, то для позначення цього можуть використовувати зелений колір. Тому переважно зеленим кольором будуть забарвлені струмені регургітації або потоки крові, які проходять через стенозовані клапани.
Кольорова доплерівська ехокардіографія має такий самий недолік, що й імпульсний доплер: якщо вимірювана швидкість перевищує обмеження Найквіста, то відображення спотворюється (aliasing). Якщо точки, швидкість у яких наближається до обмеження Найквіста, забарвлювалися у світло-жовтий колір (верхня межа червоної шкали), то точки, швидкість у яких перевищує це обмеження, уже будуть забарвлені у світло-блакитний колір (протилежний край кольорової шкали). Швидкість, яка буде ще вищою, позначатиметься темнішим відтінком синього.
Тобто ламінарний потік, швидкість якого по краях є нижчою, а по центру –високою, може бути представлено кольоровою плямою, рожевою по краях, ближче до центра – жовтою, а в самому центрі – блакитною. Перехід від жовтого кольору до блакитного в такому разі відбувається через найсвітліші відтінки і білий колір (Feigenbaum et al., 2010).
Більшість апаратів, на яких виконували кольорове доплерівське дослідження, дають можливість «розтягати» або «стискати» кольорову шкалу. Тобто її можна змінювати в такий спосіб, що одну і ту саму швидкість вдається позначати різним відтінком. Коли виникає потреба досліджувати потік із низькою швидкістю, кольорову шкалу бажано «стиснути». Ба більше, вужчому діапазону швидкостей відповідатиме більша кількість градацій кольору.
В одній і тій самій судині рух крові може бути позначено різним кольором не лише тоді, коли швидкість потоку перевищує обмеження Найквіста, а й тоді, коли змінюється напрямок потоку щодо датчика.
Отже, безперервний потік може бути подано одночасно двома кольоровими гамами – червоною і синьою. Якщо перехід кольору відбувається через біле, це вказує на те, що позначена кольором швидкість перевищувала обмеження Найквіста та/або її величина вийшла за межі кольорової шкали. Якщо ж перехід кольору відбувається через чорне, то це свідчить про зміну напрямку потоку щодо датчика.
Різновидом кольорової доплерографії є енергетичний доплерівський метод. Його принцип полягає в тому, що аналіз відбитого рухомими еритроцитами ехосигналу проводять, щоб оцінити інтенсивність потоку, а не його швидкість або напрямок. Інформація подається на екран монітора у вигляді золотисто-оранжевого кольору, який накладається на двовимірне чорно-біле зображення органа, виявляючи судинне русло.
Цей спосіб доплерівського аналізу кровотоку знайшов широке застосування там, де потрібно оцінити кровонаповнення органів та ступінь їх перфузії (наприклад, нирковий трансплантат).
В ангіології енергетичний доплерівський метод дає цінну інформацію в таких ситуаціях:
• Тромбоз глибоких вен гомілки.
• Диференціація оклюзії внутрішньої сонної артерії від стенозу зі слабким кровотоком.
• Виявлення ходу хребцевих артерій.
• Зображення судин зі звивистим ходом.
• Чіткіше контурування бляшок, які звужують просвіт судин.
• Транскраніальне зображення судин головного мозку.
• Прохідність судин портальної системи.
• Тромбоз нижньої порожнистої вени.
Тканинна доплерографія міокарда
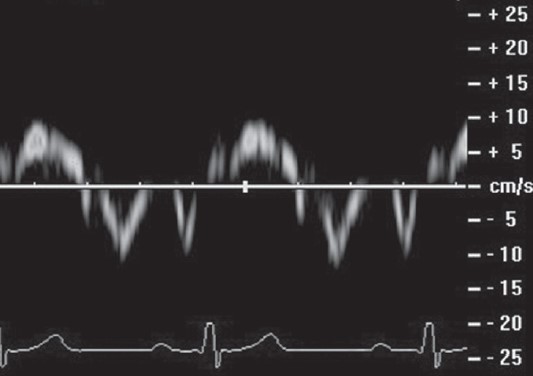
Міокард є набагато потужнішим рефлектором ультразвукових хвиль, ніж кров, однак як систолічна, так і діастолічна швидкості його руху значно менші (<25 см/с). Для їх реєстрації необхідно так налагодити приймаючий пристрій сканера, щоб не відфільтровувати потужні сигнали з малим доплерівським зсувом частоти, як це зазвичай є у випадку доплерографічної індикації потоків крові.
Щоб зареєструвати швидкість руху міокарда, зазвичай застосовують датчик 2,5‑4 МГц, апарат перемикають у режим тканинної імпульсно-хвильової доплерографії (ТІД, Tissue Doppler Imaging – TDI), а контрольний об’єм встановлюють на стінці серця під контролем двовимірного зображення з парастернального або верхівкового доступу саме в тій ділянці, локальну кінетику якої необхідно вивчити.
Щоб оцінити глобальну поздовжню систолічну і діастолічну функцію лівого шлуночка, проводять ТІД мітрального кільця з верхівкового доступу. Оцінювання локальної поздовжньої кінетики міокарда важливе тому, що поздовжнє скорочення має суттєве значення для викиду крові, а в різних шарах міокарда і різних сегментах циркуляторне і поздовжнє скорочення/ розслаблення відбуваються неодночасно і з неоднаковим внеском у сумарний результат. Патологічні стани можуть насамперед чинити вплив на поздовжню кінетику міокарда. Так, при субендокардіальній ішемії завдяки орієнтації міокардіальних волокон у цьому шарі серцевої стінки спочатку погіршується поздовжня скоротливість. Процеси старіння так само супроводжуються тим, що насамперед знижується поздовжня скоротлива здатність, а діастолочне розслаблення стає дуже неоднорідним.
Криву запису міокардіальних швидкостей при ТІД представлено трьома компонентами, а саме: зубець систолічного руху (Sm; «m» означає «міокардіальний», щоб не плутати тканинні доплерівські показники з тими, які притаманні потоку крові), зубець ранньодіастолічного руху (Em) і зубець пізньодіастолічного руху (Am) (рис. 1). Систолічний компонент переважно має куполоподібну форму, але в окремих осіб може бути представлений двома зубцями, які відображають окремо ізоволюмічне скорочення і систолічний викид. Амплітуда Sm вища в базальних сегментах лівого шлуночка, ніж у середніх або верхівкових, крім того, у бічних і нижніх стінках цей показник більший, ніж у передній і перегородковій. Значення амплітуди Sm у нормі – понад 9 см/с. Діастолічні складові міокардіального руху дуже нагадують за своїм виглядом і часовими характеристиками криву доплерівського трансмітрального потоку (Поташев, 2012).
Рис. 1. Тканинна імпульсно-хвильова доплерографія міокарда базального сегмента бічної стінки ЛШ
У здорових осіб без анамнестичних вказівок на патологію серця та з нормальними глобальними показниками систолічної й діастолічної функції (фракція викиду понад 50% і трансмітральне співвідношення Е/А > 1) у більшості сегментів стінки лівого шлуночка при запису ТІД переважає діастолічний зубець Em, а співвідношення Em/Am також більше, ніж 1 (табл. 2).
|
Таблиця 2. Величини міокардіальних швидкостей у нормі для базальних сегментів лівого шлуночка, визначені за методом ТІД |
||||
|
Сегменти ЛШ |
Em, см/с |
Am, см/с |
Em/Am |
Sm, см/с |
|
Перегородка |
11,5 ± 2,6 |
9,5 ± 2,4 |
1,0 ± 0,7 |
9,9 ± 1,7 |
|
Бічна стінка |
13,3 ± 3,3 |
11,3 ± 2,9 |
1,5 ± 0,6 |
10,6 ± 2,3 |
|
Передня стінка |
11,7 ± 3,4 |
10,3 ± 2,9 |
1,2 ± 0,7 |
9,2 ± 1,8 |
|
Задня стінка |
14,3 ± 3,6 |
11,6 ± 2,6 |
1,3 ± 0,7 |
10,4 ± 2,5 |
Для ТІД кінетики мітрального кільця в нормі характерні такі особливості:
- Найвищу амплітуду має швидкість раннього діастолічного руху.
- Систолічні швидкості руху практично не вирізняються за своїми значеннями в різних сегментах кільця і залишаються майже постійними в різних вікових групах.
- Величини діастолічних швидкостей кільця у фазах швидкого (Em) і передсердного (Am) наповнення статистично значуще змінюються з віком.
- Відношення Em/Am із віком стає меншим від одиниці так само, як і відношення E/A трансмітрального діастолічного кровотоку.
Зменшення амплітуди зубця Em нижче за значення норми є чітким показником розладів розслаблення лівого шлуночка й аномальної діастолічної функції. Цей показник не залежить від умов переднавантаження (передусім від наповнення лівого шлуночка), а тому є точнішим, ніж профіль трансмітрального кровотоку. Зниження швидкості систолічного зміщення мітрального кільця Sm менше 5,5 см/с – чутливий і специфічний маркер значних розладів скоротливої здатності міокарда (Іванів та співавт., 2003).
Хоча традиційну двовимірну ехокардіографію вважають надійним методом аналізу руху стінки шлуночка й регіональної функції міокарда, однак візуальне оцінювання руху стінки надто суб’єктивне і тому дуже залежить від оператора. Тому ТІД відкрила раніше недоступні можливості кількісного оцінювання локальної функції міокарда, пропонуючи параметри його систоло-діастолічної активності в довільно вибраній зоні інтересу і практично нівелюючи суб’єктивний чинник у характеристиці сегментарних розладів скоротливості й процесів розслаблення (Носенко та співавт., 2007).
На підставі цієї методики розвинулися способи, що характеризують деформацію міокарда протягом серцевого циклу через вивчення напруження (strain) і швидкості зміни напруження (strain rate) і відображають еластичні сили міокарда, на які не впливають загальний рух і зміщення серця в грудній клітці. Напруження (strain) може бути визначене як деформація кожного сегмента стінки лівого шлуночка протягом серцевого циклу. Інтегруючи величини напруження за час серцевого циклу, отримують швидкість зміни напруження (strain rate), тобто відсоткову зміну вздовж довгої осі показників скорочення і розслаблення, що відповідає наростанню компресії (під час систоли) і декомпресії (під час діастоли) міокарда. Цю ТІД-методику вивчення швидкості зміни напруження застосовують для виявлення локальної й короткотривалої ішемії, інотропного резерву лівого шлуночка й оцінювання життєздатності міокарда при виконанні стрес-ехокардіографії.
Тривимірна ехокардіографія
Розроблення спеціальних ехокардіографічних датчиків і методів аналізу отриманої інформації стали передумовою значних успіхів у розвитку тривимірної ехокардіографії та зробили цей спосіб візуалізації серця потужним діагностичним інструментом у кардіологічній практиці. Він дає можливість отримувати просторові зображення серця в реальному часі. За його допомогою виконують точні та надійні вимірювання розміру камер і їх функції, зокрема кількісний аналіз механічної десинхронізації лівого шлуночка з метою відбору пацієнтів для серцевої ресинхронізаційної терапії у випадках широкої блокади лівої ніжки пучка Гіса.
Крім того, тривимірна ехокардіографія дає можливість по-новому подивитися на клапани серця за різних патологічних станів, а також значно розширити уявлення про анатомічні особливості за вроджених вад серця, що поліпшує доопераційну діагностику, оптимізує планування хірургічного втручання, а також дає можливість оцінити результат операції або черезкатетерної процедури ще на операційному столі (Feigenbaum et al., 2010).
За багатьох хвороб серця велике значення має достовірний кількісний аналіз об’єму і маси шлуночків. Коли для цієї мети застосовують двовимірну ехокардіографію, то стикаються з багатьма труднощами, зумовленими насамперед особливостями будови камери або локальними розладами скоротливої здатності. Водночас тривимірна методика цих проблем не має, що доведено порівнянням із результатами МРТ-дослідження: точність і відтворюваність визначення розмірів камер серця, маси міокарда і фракції викиду шлуночків набагато краща при застосуванні тривимірної ехокардіографії, ніж двовимірної (Логвінов та співавт., 2010).
Це особливо важливо у разі дослідження правого шлуночка з його складною геометричною будовою. Для чіткішого контурування ендокарда і ліпшої якості тривимірних зображень часто застосовують ультразвукові контрастні речовини, які вводять внутрішньовенно. Крім того, тривимірну ехокардіографію в реальному часі застосовують для кількісного оцінювання об’єму лівого передсердя, що має значення в діагностиці діастолічної дисфункції лівого шлуночка.
Особливе місце тривимірна ехокардіографія посідає в діагностиці вроджених вад серця, коли з метою оптимального планування різного типу лікувальних втручань необхідне чітке розуміння взаємного розміщення різних структур серця і магістральних судин. Під контролем цього методу виконують такі катетерні маніпуляції, як закриття дефектів перегородок оклюдерами, балонну вальвулопластику за мітрального стенозу або усунення мітральної недостатності за допомогою накладання кліпси. У таких випадках застосовують черезстравохідні датчики, які мають здатність працювати в режимі тривимірного зображення (Otto, 2013).
Попри значний прогрес у розвитку 3D-технологій в ехокардіографії, цей метод залишається доповненням до двовимірного зображення, хоча за своєю інформативністю може конкурувати із магнітно-резонансною томографією серця (Lancellotti and Cosyns, 2016).
Послідовність стандартного ехокардіографічного обстеження
Повне трансторакальне ехокардіографічне обстеження передбачає двовимірне дослідження, доплерографічне дослідження та дослідження у М-режимі.
Зазвичай ехокардіографічне обстеження починають із двовимірного зображення, яке забезпечує орієнтацію у просторі та систему координат для інших методик (Шиллер и Осипов, 2005; Флакскампф, 2013). Традиційним початковим підходом є парастернальний доступ. Дослідження починають, розташовуючи датчик у третьому міжреберному проміжку зліва від груднини. Для оптимізації зображення (розширення міжреберних проміжків) пацієнта просять зайняти ліву декубітальну позицію, датчик зміщують на 1‑2 ребра вище і нижче залежно від конституції пацієнта. Датчик зміщують і обертають навколо осі до моменту отримання оптимального зображення проєкції довгої осі лівого шлуночка. Коректним вважають парастернальне зображення довгої осі лівого шлуночка, на якому добре видно базальні й середні сегменти лівого шлуночка, правий шлуночок, обидві стулки мітрального клапана, аортальний клапан, початковий сегмент висхідної аорти та ліве передсердя. Площина скенування має бути паралельною до довгої осі лівого шлуночка і пересікати центр лівого шлуночка (Шиллер и Осипов, 2005; Feigenbaum et al., 2010)].
За двовимірним зображенням довгої осі лівого шлуночка аналізують скоротливість лівого шлуночка на рівні базальних і середніх сегментів міжшлуночкової перегородки та задньої стінки лівого шлуночка, морфологію та рух стулок мітрального й аортального клапанів (Feigenbaum et al., 2010). Додаткові дані про морфологію та рух стулок клапанів отримують за одновимірного скенування.
Завдяки парастернальних перерізів по довгій осі лівого шлуночка отримують одновимірні зображення на різних рівнях: на рівні передньої стулки мітрального клапана, кінчиків стулок мітрального клапана, на рівні стінок лівого шлуночка дистальніше від стулок мітрального клапана та на рівні стулок аортального клапана (Шиллер и Осипов, 2005]. За допомогою одновимірного зображення на рівні стінок лівого шлуночка дистальніше від стулок мітрального клапана отримують кінцево-діастолічні розміри та визначають товщину стінок лівого і правого шлуночків. За отриманими вимірами оцінюють систолічну функцію лівого шлуночка за формулою L. Teicholtz за умови правильної конусоподібної геометрії лівого шлуночка та без сегментарних розладів скоротливості лівого шлуночка (Шиллер та Осипов, 2005; Feigenbaum et al., 2010).
На одновимірному зображенні на рівні аортального клапана оцінюють діаметр кільця аортального клапана, відкриття стулок аортального клапана, діаметр лівого передсердя. Необхідною умовою точності вимірів у М-режимі є перпендикулярне розташування лінії скенування щодо структур, які оцінюють (стінки і порожнина шлуночків, стулки клапана) (Feigenbaum et al., 2010). На цьому перерізі виконують кольорову доплерографію потоків через мітральний та аортальний клапани, оцінюють наявність або відсутність регургітації на мітральному та аортальному клапанах.
За медіального нахилу датчика парастернального перерізу по довгій осі лівого шлуночка отримують зображення вхідного тракту правого шлуночка. Завдяки такому перерізу оцінюють правий шлуночок та праве передсердя, септальну та передню стулки тристулкового клапана. У правому передсерді можна візуалізувати євстахіїв клапан. Цей переріз можна використати для доплерографії потоку через тристулковий клапан (Шиллер та Осипов, 2005; Feigenbaum et al., 2010).
Нахиляючи датчик із парастернального перерізу по довгій осі лівого шлуночка латерально під гострим кутом до грудної клітки, отримують зображення вихідного тракту правого шлуночка і клапана легеневої артерії. На цьому перерізі виконують доплерографію потоку через клапан легеневої артерії (Feigenbaum et al., 2010).
Наступний етап ехокардіографічного обстеження – ротація датчика під кутом 90° до проєкції довгої осі лівого шлуночка й отримання низки зрізів по короткій осі. Першим, проксимальним є зображення на рівні великих судин. За таким перерізом аналізують морфологію і відкриття стулок аортального клапана та клапана легеневої артерії, оцінюють вихідний тракт правого шлуночка, праве і ліве передсердя. За допомогою доплерографії при такому перерізі отримують і аналізують графік потоку крові через клапан легеневої артерії. Цей переріз можна використати для оцінювання потоку регургітації через тристулковий клапан.
Нахиляючи датчик дистальніше вздовж довгої осі лівого шлуночка, отримують зображення на рівні мітрального клапана. За таким перерізом аналізують скоротливість базальних сегментів лівого шлуночка, морфологію та рух стулок мітрального клапана.
Наступним є зріз по короткій осі лівого шлуночка на рівні папілярних м’язів. На цьому перерізі оцінюють скоротливість середніх сегментів лівого шлуночка. Нахиляючи датчик ближче до верхівки (дистальніше), отримують зріз по короткій осі верхівки лівого шлуночка та оцінюють скоротливість верхівкових сегментів. У кожному зі зрізів короткої осі можна застосовувати М-режим для більш об’єктивної оцінки сегментарної скоротливості.
Після аналізу парастернальних зображень по короткій осі переходять до верхівкового доступу. Першим отримують чотирикамерне верхівкове зображення. На такому перерізі оцінюють сегментарну скоротливість лівого шлуночка (перегородка, верхівка та бічна стінка), морфологію та рух мітрального і тристулкового клапанів, морфологію обох передсердь. Виконують імпульсно-хвильову та кольорову доплерографію потоків через мітральний і тристулковий клапан, оцінюють діастолічне наповнення шлуночків та функцію клапанів. За допомогою безперервно-хвильової доплерографії на цьому перерізі оцінюють систолічний градієнт тиску на тристулковому клапані для визначення тиску в правому шлуночку і легеневій артерії. У разі стенозу мітрального чи тристулкового клапана на цьому перерізі застосовують постійно-хвильову доплерографію для оцінювання діастолічного градієнта тиску і визначення площі отвору (Otto, 2010).
За чотирикамерного зображення обертають датчик за годинниковою стрілкою на 30° та отримують п’ятикамерне верхівкове зображення з аортою. За допомогою такого перерізу оцінюють сегментарну скоротливість лівого шлуночка (передньо-септальна стінка, верхівка та задня стінка лівого шлуночка), структуру і функцію мітрального й аортального клапанів. Виконують доплерографію потоків через мітральний та аортальний клапани. Цей переріз є основним для виявлення й оцінювання аортального стенозу і субаортальної обструкції витоку з лівого шлуночка (Otto, 2010). Обертаючи датчик ще на 30° за годинниковою стрілкою, отримують двокамерне зображення (лівий шлуночок і ліве передсердя). Аналізують скоротливість передньої та нижньої стінки лівого шлуночка, продовжують аналізувати рух і морфологію стулок мітрального клапана. Функцію мітрального клапана оцінюють доплерографічно. Сумарну скоротливість лівого шлуночка визначають за правилом Сімпсона із чотири- та двокамерних верхівкових зображень (Feigenbaum et al., 2010; Otto, 2010).
Функцію мітрального клапана оцінюють доплерографічно на всіх верхівкових перерізах, оскільки струмінь зворотного потоку через клапан може бути ексцентричним, то його можна виявити не на кожному перерізі.
Після оцінювання всіх верхівкових зображень переходять до субкостального доступу. Отримавши чотирикамерне зображення, оцінюють стан міжпередсердної перегородки, структуру і функцію лівого і правого шлуночків.
Датчик повертають на 90° і нахиляють праворуч, щоб отримати зображення правого передсердя і місця впадіння нижньої порожнистої вени. За допомогою цього зображення виконують запис змін діаметра нижньої порожнистої вени в М-режимі при диханні. За дихальними змінами діаметра нижньої порожнистої вени оцінюють тиск у правому передсерді (Feigenbaum et al., 2010).
Закінчують обстеження супрастернальним доступом. Візуалізують поперечний відділ дуги аорти, частково висхідний і низхідний відділи, визначають діаметр різних ділянок грудної аорти. Виконують доплерографію потоку у висхідній та низхідній аорті.
Ехокардіографічне обстеження камер серця
Лівий шлуночок. Оцінювання розмірів. Оцінювання систолічної функції. Ішемічна хвороба серця.
Первинна патологія міокарда
Лівий шлуночок. Оцінювання розмірів
Для оцінювання структури і функції ЛШ використовують максимальну кількість проєкцій: парастернальні проєкції довгої осі ЛШ та короткої осі ЛШ на рівні мітрального клапана, папілярних м’язів та верхівки, верхівкові проєкції (послідовно чотрири-, п’яти- і двокамерну проєкції). Геометрична форма ЛШ серця в нормі наближена до правильного еліпса, в разі патології (ІХС, кардіоміопатія) шлуночок часто набуває сферичної форми. Лінійні розміри камери ЛШ слід вимірювати в парастернальній проєкції довгої осі.
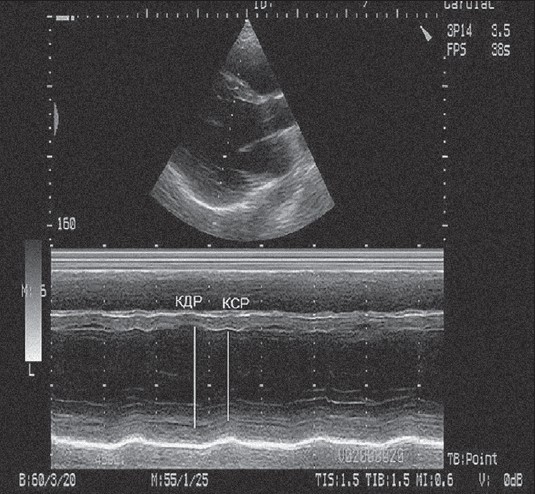
До стандартного ехокардіографічного протоколу входить визначення кінцеводіастолічного (КДР) та кінцево-систолічного (КСР) розміру (діаметра) ЛШ та товщини стінок ЛШ у діастолу. Розміри визначають на рівні хорд мітрального клапана, відразу за кінчиками стулок мітрального клапана (Feigenbaum et al., 2010; Коваленко та співавт., 2011). Ці показники можна отримати при застосуванні дво- або одновимірної ехокардіографії. КДР визначають у кінці діастоли, це максимальний розмір ЛШ; КСР визначають у час максимального систолічного потовщення стінок ЛШ (рис. 2).
Рис. 2. Визначення кінцеводіастолічного та кінцевосистолічного розмірів лівого шлуночка в М-режимі
При використанні М-режиму для коректного вимірювання розмірів лінія скенування має бути розташована строго перпендикулярно до стінок ЛШ; при відхиленні від кута 90° можливе завищення значень отриманих вимірів.
У нормі товщина стінок ЛШ у діастолі не перевищує 11 мм, КДР ЛШ – 55 мм (Коваленко та співавт., 2011).
Оцінювання гіпертрофії стінок лівого шлуночка
У пацієнтів з артеріальною гіпертензією суттєве значення для вибору тактики лікування та контролю його ефективності має оцінювання гіпертрофії стінок ЛШ. У відповідь на тривале підвищення артеріального тиску ЛШ зазнає геометричних змін, які класифікують як концентричну гіпертрофію, концентричне ремоделювання або ексцентричну гіпертрофію.
За перших двох типів ремоделювання потовщення стінок превалює над дилатацією порожнини ЛШ, за третього – збільшення маси ЛШ відбувається через дилатацію ЛШ. Для того щоб розрізнити типи ремоделювання ЛШ, застосовують показники індексу маси міокарда лівого шлуночка (ІММЛШ) та відносної товщини стінки лівого шлуночка (ВТСЛШ).
Для визначення маси міокарда лівого шлуночка (ММЛШ) вимірюють КДР ЛШ, товщину міжшлуночкової перегородки (ТМШП) та задньої стінки лівого шлуночка (ТЗСЛШ) у діастолі. У нормі товщина стінок ЛШ у діастолі не перевищує 11 мм.
ММЛШ обчислюють за формулою ASE-cube:
ММЛШ = 0,8 х {1,04 [(КДР + ТЗСЛШ + ТМШП)3 – КДР3]} + 0,6 г,
ІММЛШ обчислюють за формулою:
ІММЛШ = ММЛШ / ППТ,
де ППТ – площа поверхні тіла.
ВТСЛШ визначають за формулою:
ВТСЛШ = 2 х ТЗСЛШ/КДРЛШ.
У нормі ІММЛШ становить менше 95 г/м2 для жінок і менше 115 г/м2 для чоловіків (Радченко, 2010; Коваленко та співавт., 2011).
За артеріальної гіпертензії виділяють такі типи геометрії ЛШ:
•Нормальна геометрія ЛШ – з нормальною ВТСЛШ (<0,45) і нормальною ММЛШ.
•Концентричне ремоделювання – з нормальною ММЛШ і збільшеною ВТСЛШ (>0,45).
•Концентрична гіпертрофія – зі збільшеною ММЛШ і збільшеною ВТСЛШ (>0,45).
•Ексцентрична гіпертрофія – зі збільшеною ММЛШ і нормальною ВТСЛШ (<0,45) (Коваленко та співавт., 2011).
Оцінювання систолічної функції
Критерієм оцінювання систолічної функції ЛШ є фракція викиду – співвідношення ударного об’єму ЛШ до кінцеводіастолічного об’єму, виражене у відсотках. Нині існує багато способів оцінювання скоротливості ЛШ.
Метод L. Teicholtz, який передбачає використання одновимірного режиму (розділ 23), придатний лише для камери серця з правильною геометричною формою еліпса та без сегментарних розладів скоротливості (рис. 2).
У разі змін геометрії ЛШ (сферичній формі, наявності аневризми) та/або порушеннях регіонарної скоротливості ЛШ застосовують волюметричні методи, менш залежні від форми ЛШ, найбільш універсальним з яких є метод Сімпсона.
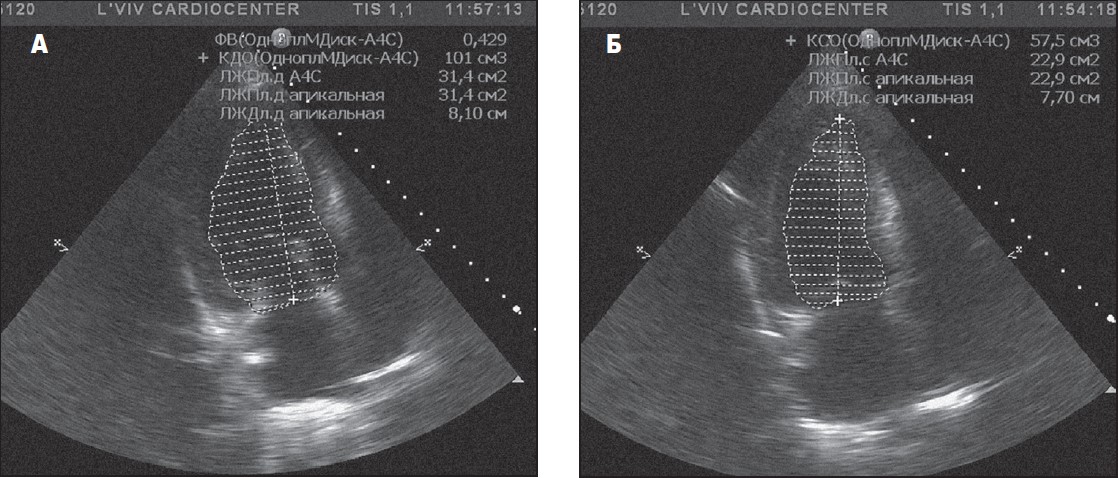
В основі методу Сімпсона є поділ камери ЛШ на 20 дисків за довжиною шлуночка та визначення діастолічного і систолічного об’ємів у двох взаємно перпендикулярних проєкціях (чотирикамерній проєкції з верхівки та двокамерній проєкції).
Для цього в кожній із названих проєкцій за діастоли та систоли ретельно окреслюють ендокардіальний контур ЛШ, отримуючи кінцево-діастолічний та кінцево-систолічний об’єми (рис. 3) (Коваленко та співавт., 2011).
Рис. 3. Визначення об’ємів лівого шлуночка методом Сімпсона: А — діастолічний об’єм, Б — систолічний об’єм
Фракцію викиду ЛШ обчислюють за формулою:
ФВЛШ = (КДО ЛШ – КСО ЛШ) / КДО ЛШ,
де ФВЛШ – фракція викиду ЛШ, КДО – кінцево-діастолічний об’єм, КСО – кінцево-систолічний об’єм.
Результат подають у відсотках. У нормі фракція викиду ЛШ становить 55% і більше.
Сегментарна скоротливість лівого шлуночка
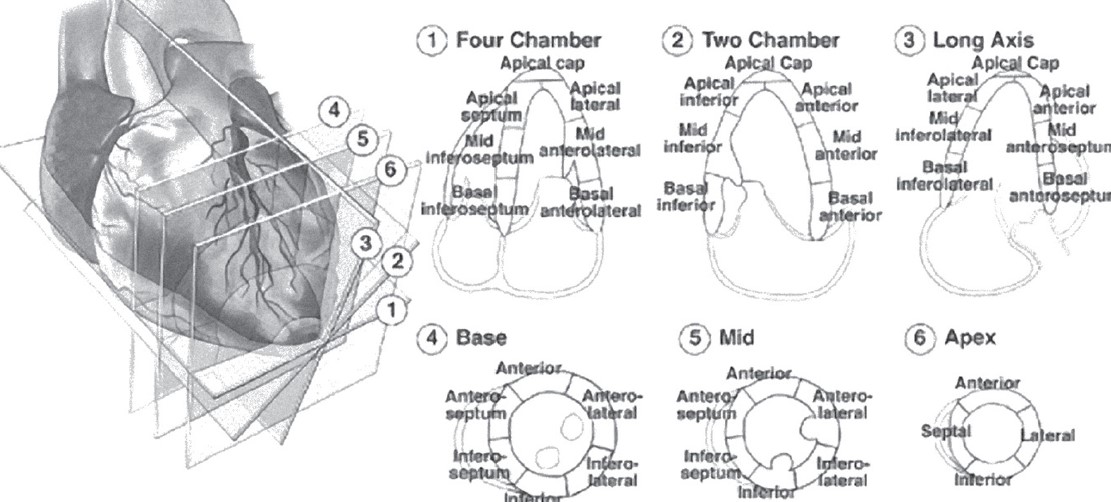
Щоб оцінити локальну скоротливість ЛШ, міокард ЛШ поділяють на 16 сегментів згідно з форматом, прийнятим Американським товариством фахівців з ехокардіографії (ASE) (рис. 4).
Рис. 4. Поділ лівого шлуночка на сегменти згідно з рекомендаціями Українського товариства кардіологів. Адаптовано за рекомендаціями Американського товариства фахівців з ехокардіографії (ASE, 1989). Верхівкові проєкції та парастернальні проєкції короткої осі лівого шлуночка
ЛШ поділяють на базальну, середню і верхівкову третини. Базальна і середня третини містять по шість сегментів, а верхівка містить чотири сегменти (Cerqueira et al., 2002; Lang et al., 2015).
Усі 16 сегментів можливо візуалізувати та оцінити рухомість кожного як із трьох коротких, так і з усіх поздовжніх перерізів. Достовірність оцінки сегментарної скоротливості зростає, якщо кожен сегмент оцінювати з різних проєкцій. Верхівкову третину ЛШ у більшості хворих не вдається візуалізувати із парастернального перерізу по довгій осі, а тому її оцінюють лише з верхівкових дво-, п’яти- та чотирикамерних зображень.
У нормі стінки ЛШ симетрично скорочуються, при скороченні стінка ЛШ потовщується. Нормальну скоротливість міокарда характеризують терміном нормокінезія, цей термін передбачає достатнє систолічне потовщення стінок серця і нормальну амплітуду руху стінки. Обидві складові терміну нормокінезії обов’язкові, оскільки нормальний рух стінки без достатнього систолічного потовщення може бути пасивним, зумовленим тим, що сусідні до ішемізованого сегменти «тягнуть» уражений сегмент за собою. Акінезія означає повну відсутність руху сегмента та/або систолічного потовщення. Гіпокінезія – знижена амплітуда руху стінки та/або систолічного потовщення. Дискінезія – сегмент під час систоли випинає в бік, протилежний руху сегментів, які скорочуються нормально. Аневризма – стоншення стінки ЛШ та відсутність скоротливості (Feigenbaum et al., 2010).
Крім того, вирізняють тардокінез – асинхронність руху сегмента (відставання) в часі при збереженій амплітуді руху і потовщення. Тардокінезія може бути ознакою ішемії.
Для кількісного оцінювання сегментарної скоротливості запровадили критерій індексу локальної скоротливості ЛШ. Для його визначення рухливість кожного сегмента оцінюють у балах за шкалою скоротливості: за нормокінезії – 1 бал, гіпокінезії – 2 бали, акінезії – 3 бали, дискінезії – 4 бали, аневризми – 5 балів. Індекс скоротливості стінки ЛШ обчислюють, поділивши суму балів усіх сегментів на їх кількість (Коваленко та співавт., 2011; Lang et al., 2015). Отже, нормокінетичний ЛШ має індекс скоротливості, що дорівнює одиниці.
Діастолічна функція
Первинна діастолічна дисфункція ЛШ відповідальна приблизно за 30% випадків серцевої недостатності. Нерідко її не розпізнають, бо насамперед звертають увагу на систолічну функцію, або фракцію викиду, хоча стан хворих з ізольованою діастолічною дисфункцією не є легшим, ніж тих, у кого серцева недостатність зумовлена ослабленням скоротливої здатності, і прогноз у них не ліпший (Коваленко та співавт., 2013].
У період діастоли послідовно змінюються тиск та об’єм ЛШ. Виділяють чотири фази діастоли: ізоволюмічне розслаблення, раннє діастолічне наповнення, діастаз, пізнє наповнення внаслідок передсердного скорочення. Нормальна діастолічна функція забезпечує належне наповнення шлуночків як у стані спокою, так і під час навантаження, без аномального підвищення діастолічного тиску. Своєю чергою, відповідне наповнення шлуночків забезпечує нормальний ударний об’єм згідно з механізмом Франка – Старлінга (Feigenbaum et al., 2010].
Наповнення ЛШ охоплює низку гемодинамічних подій, першою з яких є розслаблення міокарда – активний енергетично залежний процес, що зумовлює швидке зниження тиску в ЛШ після закінчення його скорочення і під час ранньої діастоли. Коли тиск у ЛШ стає нижчим, ніж у лівому передсерді (ЛП), відкривається мітральний клапан і починається раннє діастолічне наповнення. У нормальних умовах основним визначальним фактором рушійної сили раннього діастолічного наповнення є еластична віддача (засмоктування) внаслідок активного розслаблення ЛШ.
Діастолічний тиск у ЛШ продовжує падати під час ранньої діастоли, незважаючи на надходження крові з ЛП, завдяки міокардіальному розслабленню. У певний момент цей тиск може перевищити тиск у ЛП, і ця втрата позитивної рушійної сили зумовлює сповільнення мітрального потоку. Зазвичай майже 80% наповнення ЛШ відбувається під час ранньої діастолічної фази.
Позитивний трансмітральний градієнт тиску і потік виникають знову наприкінці діастолічної фази завдяки скороченню передсердя, що зумовлює до 20% наповнення ЛШ у нормі (Флакскампф, 2013).
Частка заповнення ЛШ під час ранньої або пізньої діастолічних фаз залежить від еластичної віддачі (засмоктування), ступеня міокардіального розслаблення, податливості (compliance) камери і тиску в ЛП. Стан цих показників є результатом взаємодії між патологічними станами серця, діастолічних особливостей самої стінки шлуночків, зовнішніх чинників та величини об’єму крові.
Тобто діагностичні методи оцінювання діастолічної функції мусили б визначати прямо чи посередньо діастолічні тиски, ступінь міокардіального розслаблення, частку шлуночкового наповнення під час різних фаз діастоли та податливість шлуночка.
До широкого запровадження ехокардіографії діастолу ЛШ оцінювали лише на підставі даних катетеризації серця та вентрикулографії: тиск у ЛП, кінцеводіастолічний тиск у ЛШ, часова константа розслаблення, dP/dt, взаємозв’язок (петля) тиску та об’єму, графіка кривої діастолічного тиску. Однак розвиток методик ехокардіографічного оцінювання діастолічної функції призвів до майже повного витіснення інвазивних способів (Lancellotti and Cosyns, 2016).
Насамперед уявлення про діастолічні процеси дає доплерівський аналіз трансмітрального потоку. Його профіль безпосередньо залежить від перепаду тиску між передсердям і шлуночком.
Швидкість трансмітрального потоку зменшується в напрямку від мітрального отвору до верхівки ЛШ, і ступінь цього зниження швидкості не залежить від віку. Характер трансмітрального потоку добре корелює як з інвазивними показниками, так і з прогнозом (Коваленко та співавт., 2013).
Однак є суттєві обмеження для його широкого клінічного використання. Найсуттєвіше з них – псевдонормалізація трансмітрального потоку за виразних розладів діастолічного наповнення. Феномен псевдонормалізації полягає в тому, що в разі підвищення тиску наповнення ЛШ виникає «перехідний етап» від порушеного розслаблення до рестриктивного типу. А на цьому етапі крива трансмітрального потоку набуває такого вигляду, як у здорових осіб. Тому, щоб відрізнити нормальний тип потоку від псевдонормального, почали визначати характер кровотоку в легеневих венах. Доповнюють уявлення про діастолу нові методики – оцінювання поширення потоку в ЛШ, доплерівська характеристика міокардіальних швидкостей, а також прості проби зі зміною стану серцевого наповнення (Lancellotti and Cosyns, 2016].
У клінічній практиці використовують такі параметри трансмітрального потоку для оцінювання діастолічної функції: час ізоволюмічного розслаблення (IVRT), час сповільнення раннього діастолічного потоку (DTE), швидкості раннього (Е) і пізнього (А) діастолічного потоків, їх співвідношення (Е/А). IVRT визначають як період від закриття аортального клапана до початку трансмітрального потоку. Щоб його виміряти, отримують верхівкове п’ятикамерне зображення і скеровують безперервний (CW) доплерівський промінь у такий спосіб, аби одночасно зареєструвати діастолічний мітральний і систолічний аортальний потоки. IVRT вимірюють від сигналу (клацання), зумовленого закриттям аортального клапана, і початком трансмітрального потоку (Іванів та співавт., 2003).
Інші показники визначають за записом трансмітрального кровотоку, отриманого за допомогою імпульсно-хвильового доплерівського методу (PW Doppler).
Виділяють такі основні типи трансмітрального кровотоку:
1) нормальний;
2) порушене розслаблення (розлади релаксації);
3) псевдонормалізація;
4) опір наповненню (рестриктивні розлади) (табл. 3) (Feigenbaum et al., 2010).
|
Таблиця 3. Ехокардіографічні показники діастолічної функції в нормі та при різних типах діастолічних розладів |
|||||
|
Показник |
Нормальний тип |
Порушене розслаблення (І тип) |
Псевдонормальний тип (II тип) |
Рестрикція наповненню (III тип) |
|
|
Характер розладів діастолічної функції |
|
Нормальна діастолічна функція |
Нормальні тиск наповнення і податливість ЛШ |
Розслаблення ЛШ і податливість його знижені, а тиск наповнення підвищений |
Глибокі розлади податливості ЛШ і значно підвищений тиск наповнення ЛШ |
|
Трансмітральний потік |
E/A |
1-2 |
<1 |
1-2 |
>2 |
|
IVRT |
<100 мс |
>100 мс |
60-100 мс |
<60 мс |
|
|
DTE |
<220 мс |
>220 мс |
150-200 мс |
<150 мс |
|
|
Потік у легеневих венах |
|
Низькі швидкості АС і S; |
S>D за значної хвилі зворотного потоку АС |
S/D<1, збільшена швидкість АС |
Значно зменшена хвиля S; висока АС — рідко |
|
Швидкість поширення потоку в ЛШ (М-колір) |
>550 мм/с |
<450 мм/с |
<450 мм/с |
<450 мм/с |
|
|
Тканинна доплерографія мітрального кільця |
е’>8 см/с |
е’<8 см/с |
е’<8 см/с |
е’<8 см/с |
|
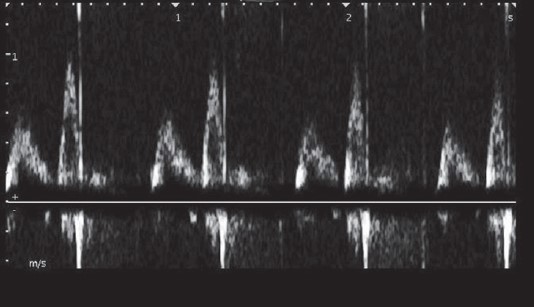
Трансмітральний кровотік, характерний для порушеного розслаблення, виникає найчастіше за гострої ішемії, старіння, гіпертрофії, міокардитів, дилатаційної кардіоміопатії, аортального стенозу, гіпотиреозу (рис. 5).
Рис. 5. Доплерографія трансмітрального потоку, характерна для І типу діастолічних розладів. Хвиля Е має значно меншу амплітуду, ніж А
Зміни умов навантаження на шлуночок (дегідратація або зміна положення тіла на вертикальне) можуть початково нормальний характер кровотоку змінити на тип порушеного розслаблення (Флакскампф, 2013).
Якщо у хворого з порушеним розслабленням підвищується переднавантаження, тоді зростає тиск у ЛП на момент відкриття мітрального клапана, а це виявляється підвищенням хвилі Е, що вже характеризує тип рестриктивного наповнення (Feigenbaum et al., 2010).
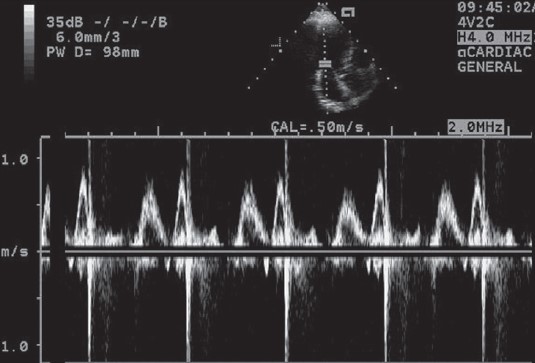
Під час переходу від типу порушеного розслаблення до типу рестриктивного наповнення трансмітральний потік може мати нормальний вигляд – це так звана псевдонормалізація трансмітрального потоку (рис. 6).
Рис. 6. Псевдонормалізація трансмітрального потоку (ІІ тип діастолічної дисфункції) у пацієнтки зі значною гіпертрофією ЛШ внаслідок тривалої артеріальної гіпертензії. Амплітуда хвиль Е і А мало відрізняється
Один зі способів переконатися, чи «нормальний» характер трансмітрального потоку насправді таким і є, – це оцінити потік у легеневих венах.
У нормі систолічна хвиля швидкості потоку в легеневих венах (S) дещо вища, ніж діастолічна (D), із дуже невеликою швидкістю зворотного потоку внаслідок передсердного скорочення (позначають буквою «а» або «AC»).
Якщо порушене розслаблення поєднується з підвищеним тиском наповнення ЛШ, то систолічна хвиля потоку в легеневих венах стає меншою порівняно з діастолічною, а швидкість хвилі передсердного скорочення перевищуватиме 0,23 м/с (Іванів та співавт., 2003).
Найважливішим обмеженням у використанні потоку в легеневих венах для оцінювання діастолічної функції ЛШ є труднощі отримання задовільного для інтерпретації сигналу.
Зазвичай на верхівковому чотирикамерному зображенні контрольний об’єм імпульсно-хвильового доплера ставлять у гирло правої верхньої легеневої вени, відступивши вглибину на 0,5 см. Записують сигналу наприкінці видиху.
Повний аналіз потоків у легеневих венах включно з прямими систолічним і діастолічним потоками і зворотним потоком передсердного скорочення вдається провести не більш ніж у 70% випадків (Otto, 2013).
Зміна стану серцевого наповнення
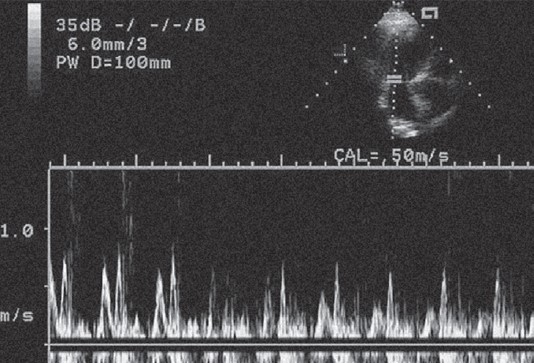
Прості функціональні проби допомагають повніше характеризувати трансмітральний кровотік. В осіб із псевдонормалізацією потоку поєднуються первинні розлади розслаблення із підвищенням тиску лівошлуночкового наповнення. Тому проба Вальсальви, яка короткочасно зменшує переднавантаження (приплив крові у ЛП), може викрити діастолічну дисфункцію, перевівши псевдонормальний потік у той, який характерний для аномального розслаблення (рис. 7).
Рис. 7. Вплив проби Вальсальви на характер трансмітрального кровотоку тієї ж пацієнтки що рис. 6. У перших двох комплексах амплітуда хвиль Е і А однакова. Із початком проби Вальсальви внаслідок зменшення об’єму крові, який надходить у ЛШ, амплітуда хвилі Е чітко стає меншою, що видно із 6-го комлексу і далі
Якщо співвідношення E/A при пробі Вальсальви зменшується порівняно з вихідним на 40% чи більше, або збільшується тривалість трансмітральної хвилі А, то це переконливо свідчить про підвищений кінцево-діастолічний тиск у ЛШ. Вважають, що проба Вальсальви дещо чутливіша для викриття прихованої діастолічної дисфункції, ніж аналіз кровотоку в легеневих венах (Коваленко та співавт., 2013).
Поширення кольорового потоку
Для практичного застосування потрібен такий неінвазивний метод оцінювання діастолічної функції, який би не залежав від умов навантаження (Feigenbaum et al., 2010).
Один із таких методів – визначення швидкості поширення потоку (ШРП, або flow propagation velocity – Vp) у порожнині ЛШ під час ранньої діастоли, що вдається оцінити кількісно з використанням кольорового М-способу. Ця величина корелює з інвазивним еталонним показником діастолічної функції – часовою константою розслаблення (t – тау). У шлуночку з нормальним розслабленням (низька t) є швидке поширення потоку в порожнині, а в шлуночку зі сповільненим розслабленням (висока τ) – сповільнене.
Щоб визначити ШРП, виконують кольорову доплерографію наповнення ЛШ у М-режимі з верхівкового чотирикамерного зображення. Сектор кольорового картування розміщують максимально паралельно до потоку наповнення. Кольорову шкалу зменшують приблизно до 70% від максимальної ранньодіастолічної швидкості, досягаючи ефекту спотвореного відображення швидкості (aliasing). При цьому в центрі забарвленого червоним кольором потоку наповнення з’являється світло-блакитна смуга aliasing. Тоді промінь одновимірного скенування пускають паралельно до потоку ранньодіастолічного наповнення через цю смугу і реєструють кольоровий графік (Color M-mode).
Визначають найближчу до мітрального кільця точку переходу кольору (із червоного в блакитний) і від неї вздовж переднього краю блакитного кольору проводять дотичну лінію. Кут нахилу цієї лінії, виміряний як співвідношення відстань/час (у м/с), і називають швидкістю поширення потоку раннього діастолічного наповнення ЛШ (early diastolic LV flow propagation velocity).
Про діастолічну дисфункцію свідчить величина ШРП менша ніж 55 см/с для молодих осіб, а для осіб віком понад 45 років – менша ніж 45 см/с.
Щоб оцінити ризик виникнення застійної серцевої недостатності, використовують співвідношення трансмітральної ранньодіастолічної швидкості Е і ШРП (E/Vp).
Якщо ця величина перевищує 1,5, то це вказує на високу ймовірність розвитку лівошлуночкової недостатності й смертності, незалежно від інших показників, включно з фракцією викиду (Otto, 2013).
Продовження у наст. номерах
Тематичний номер «Кардіологія. Ревматологія. Кардіохірургія» № 2 (93) 2024 р.