21 листопада, 2023
Оцінка впливу лівообертального аргініну гідрохлориду на органи-мішені в пацієнтів з артеріальною гіпертензією в поєднанні зі стандартною терапією: фокус на диджиталізацію ЕКГ
 Більшість пацієнтів зі стабільною стенокардією (СтСт) мають різні супутні захворювання, як-от артеріальна гіпертензія (АГ), дисліпідемія, цукровий діабет, серцева недостатність зі зниженою чи збереженою фракцією викиду [1]. Це підтверджує дослідження CLARIFY (The prospeCtive observational LongitudinAl RegIstry oF patients with stable coronary arterY disease), в якому 70 і 75% пацієнтів із СтСт мали в анамнезі АГ та дисліпідемію відповідно, а 30% страждали на цукровий діабет [2]. Оскільки АГ формує другу за чисельністю групу кардіологічних хворих [3], оптимізація лікування пацієнтів із СтСт у поєднанні з АГ є актуальною.
Більшість пацієнтів зі стабільною стенокардією (СтСт) мають різні супутні захворювання, як-от артеріальна гіпертензія (АГ), дисліпідемія, цукровий діабет, серцева недостатність зі зниженою чи збереженою фракцією викиду [1]. Це підтверджує дослідження CLARIFY (The prospeCtive observational LongitudinAl RegIstry oF patients with stable coronary arterY disease), в якому 70 і 75% пацієнтів із СтСт мали в анамнезі АГ та дисліпідемію відповідно, а 30% страждали на цукровий діабет [2]. Оскільки АГ формує другу за чисельністю групу кардіологічних хворих [3], оптимізація лікування пацієнтів із СтСт у поєднанні з АГ є актуальною.
Поряд із традиційною антиангінальною й антигіпертензивною терапією СтСт у поєднанні з АГ чільне місце посідає кардіоцитопротекторна терапія – лікування, що шляхом безпосереднього впливу на кардіоміоцит сприяє його виживанню в умовах ішемії (гіпоксії), усуває порушення метаболізму та функцій мембран кардіоміоцитів завдяки взаємодії з певними рецепторними ділянками мембрани, ферментами або фрагментами іонних каналів [4]. L-аргінін (активна речовина препарату Тівортін®, «Юрія-Фарм») – перспективний кардіоцитопротектор у лікуванні СтСт у поєднанні з АГ. Варто зазначити, що перевагу слід віддавати препаратам, які мають у своєму складі саме лівообертальний ізомер аргініну. L-аргінін має ангіопротекторну, антиоксидантну, антигіпоксичну та мембраностабілізувальну дії, а також сприяє зниженню артеріального тиску (АТ) [5].
Мета роботи
Встановити ефективність кардіоцитопротекторної терапії (Тівортіну) в пацієнтів у разі поєднання СтСт й АГ за цифрової обробки стандартної електрокардіограми (ЕКГ) з диджиталізацією її показників на базі власного медичного програмного забезпечення «Смарт-ЕКГ» (свідоцтво реєстрації авторського права № 73687 від 05.09.2017).
Об’єкт і методи дослідження
Обстеження проводили на базі обласного клінічного кардіологічного центру м. Чернівці. Для оцінки ефективності застосування Тівортіну обстежили 45 пацієнтів зі СтСт у поєднанні з АГ, яких розподілили на дві групи: І група включала 15 пацієнтів, які отримували оптимальну медикаментозну терапію (ОМТ) згідно з уніфікованими протоколами надання допомоги Міністерства охорони здоров’я України (β-адреноблокатори, інгібітори ангіотензинперетворювального ферменту, блокатори рецепторів ангіотензину, антитромбоцитарні засоби, статини та ін.); ІІ група включала 30 пацієнтів, які отримували ОМТ і Тівортін. Тривалість терапії становила 10 днів.
Клінічний огляд включав вимірювання частоти серцевих скорочень (ЧСС), систолічного (САТ) і діастолічного АТ (ДАТ). Із метою аналізу якості життя використовували шкалу EQ‑5D‑5L із візуальною аналоговою шкалою реєстрації поточного стану здоров’я EQ-VAS. За диджиталізації ЕКГ і використання програмного забезпечення «Смарт-ЕКГ» оцінювали показники варіабельності серцевого ритму – ВСР (SDNN – стандартне відхилення N-N-інтервалів; RMSSD – квадратний корінь із суми квадратів різниці величин послідовних пар N-N-інтервалів; pNN50% – частка NN50 загальної кількості послідовних пар N-N-інтервалів, що розрізняються більш ніж на 50 мс, отриманих за період запису) та зміни першої похідної зубця Т з обрахунком показника відношення максимальних швидкостей (ВМШ) диференційованого зубця Т (співвідношення змін різниці потенціалів на другому коліні зубця Т до максимальної швидкості на першому коліні зубця Т).
Статистична обробка результатів включала застосування парного t-критерію Стьюдента при аналізі двох залежних вибірок і нормальному розподілі, тоді як за ненормального розподілу застосовували t-критерій Вілкоксона; при аналізі двох незалежних вибірок і нормальному розподілі застосовували 2-вибірковий t-критерій Стьюдента, тоді як за ненормального розподілу – U-критерій Вілкоксона. Результати представлено у вигляді зміни відсоткового приросту (∆%) показників у процесі спостереження. Різниця вважалася статистично значущою за рівня р<0,05.
Результати
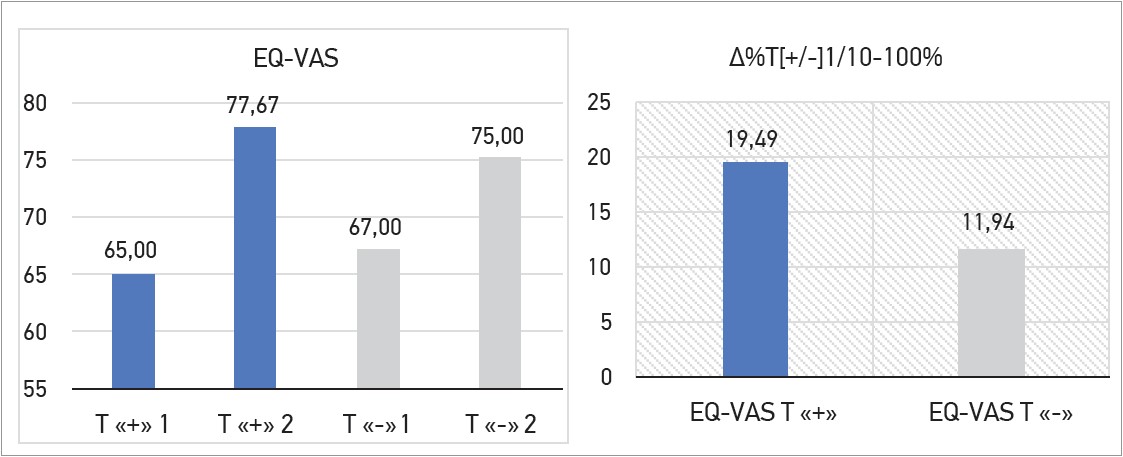
Якість життя за опитувальником EQ‑5D‑5L за візуальною аналоговою шкалою EQ-VAS переважала в пацієнтів за прийому ОМТ і додавання Тівортіну порівняно з пацієнтами, які отримували лише ОМТ (∆ +19,49% проти ∆ +11,94% при р<0,05). Дані представлено на рисунку 1.
Рис. 1. Якість життя за візуальною шкалою EQ-VAS і відсотковий приріст (∆%) її показників між 1-м і 10-м днями спостереження
Примітки: Т «+» 1 – якість життя пацієнтів на 1-й день прийому ОМТ і Тівортіну; Т «+» 2 – якість життя пацієнтів на 10-й день прийому ОМТ і Тівортіну; Т «-» 1 – якість життя пацієнтів на 1-й день прийому ОМТ;
Т «-» 1 – якість життя пацієнтів на 10-й день прийому ОМТ; EQ-VAS «+» – відсотковий приріст (∆%) за прийому ОМТ і Тівортіну; EQ-VAS «-» – відсотковий приріст (∆%) за прийому ОМТ.
Під час обрахунку відсоткового приросту (∆%) показники І чи ІІ груп на 1-й день лікування вважали за 100%, а показники І чи ІІ груп на 10-й день лікування – за ×%. Результат описували з відрахуванням 100%.
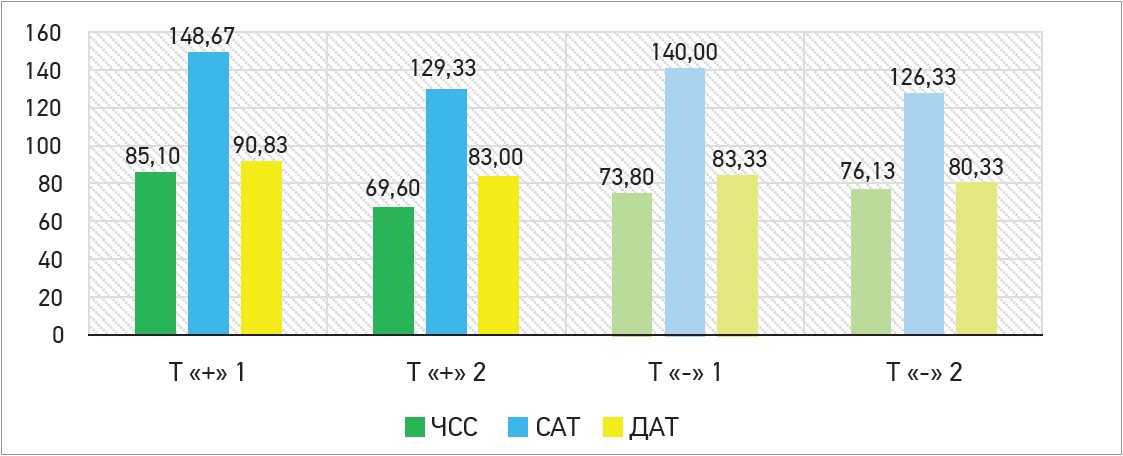
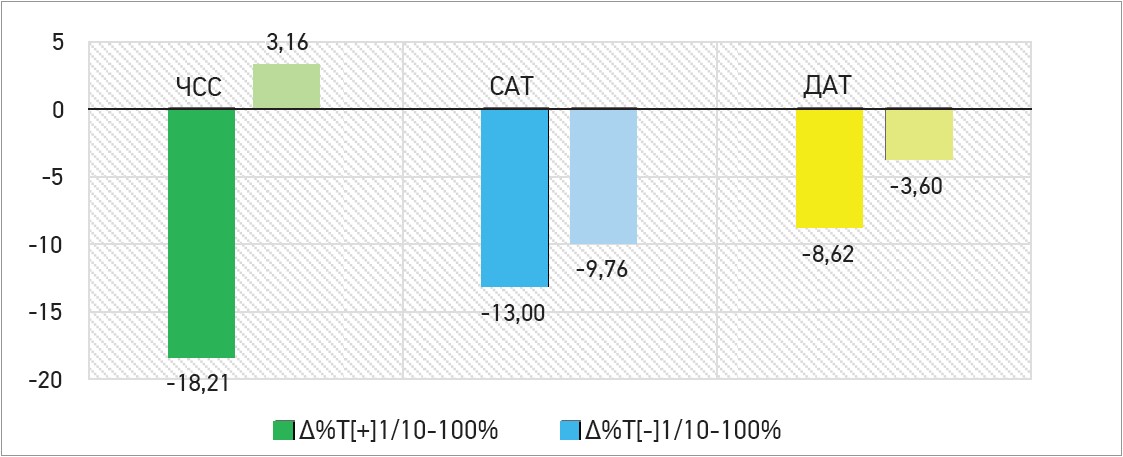
Зниження ЧСС, САТ і ДАТ переважало в групі Тівортіну порівняно з групою на ОМТ, що у відсотковому співвідношенні становило ∆ -18,21% проти ∆ +3,16%, ∆ -13,0% проти ∆ -9,76% та ∆ -8,62% проти ∆ -3,6% відповідно (в усіх випадках p<0,05). Дані представлено на рисунках 2 та 3.
Рис. 2. Зміни гемодинамічних показників (ЧСС, САТ і ДАТ) між 1-м і 10-м днями спостереження
Примітки: Т «+» 1 – гемодинамічні показники на 1-й день прийому ОМТ і Тівортіну; Т «+» 2 – гемодинамічні показники на 10-й день прийому ОМТ і Тівортіну; Т «-» 1 – гемодинамічні показники на 1-й день прийому ОМТ;
Т «-» 1 – гемодинамічні показники на 10-й день прийому ОМТ.
Рис. 3. Оцінка відсоткового приросту (∆%) гемодинамічних показників (ЧСС, САТ і ДАТ) між 1-м і 10-м днями спостереження
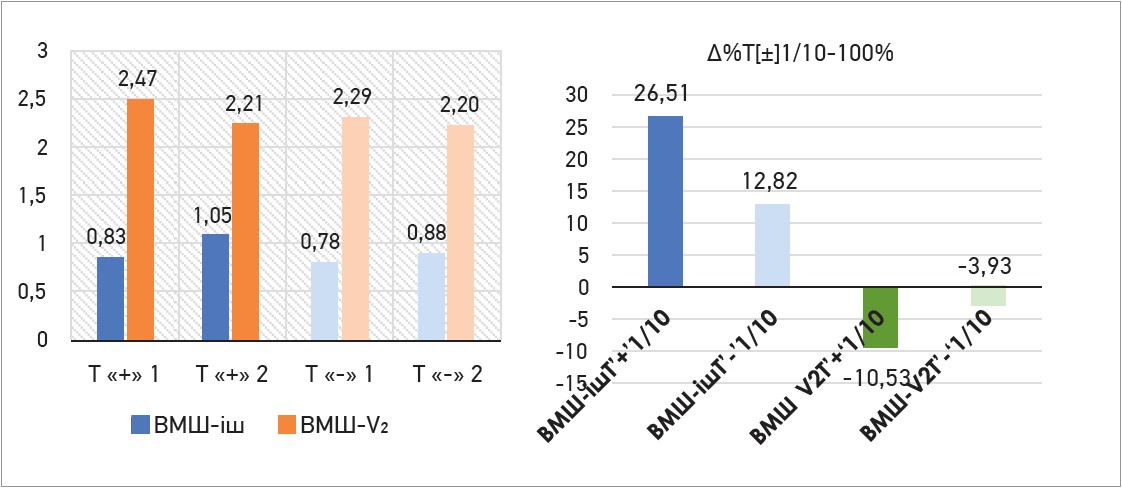
Збільшення ВМШ у зоні ішемії було вираженішим за додаткового прийому Тівортіну порівняно з пацієнтами, що отримували лише ОМТ (∆ +26,51% проти ∆ +12,82% при р<0,05). Зменшення ВМШ у відведенні V2 (маркерне відведення оцінки за гіпертрофії лівого шлуночка) теж було значніше в пацієнтів, які приймали ОМТ і Тівортін, порівняно з пацієнтами, що приймали лише ОМТ (∆ -10,53% проти ∆ -3,93% при р<0,05). Дані представлено на рисунку 4.
Рис. 4. ВМШ у зоні ішемії, у відведенні V2 та відсотковий приріст (∆%) цих показників між 1-м і 10-м днями спостереження
Примітки: Т «+» 1 – ВМШ у зоні ішемії та V2 на 1-й день прийому ОМТ і Тівортіну; Т «+» 2 – ВМШ у зоні ішемії та V2 на 10-й день прийому ОМТ і Тівортіну; Т «-» 1 – ВМШ у зоні ішемії та V2 на 1-й день прийому ОМТ; Т «-» 1 – ВМШ у зоні ішемії та V2 на 10-й день прийому ОМТ; ВМШ-ішТ – ВМШ у зоні ішемії; ВМШ-V2 – ВМШ у відведенні V2; ВМШ-ішТ «+» 1/10 або ВМШ-V2 «+» 1/10 – відсотковий приріст (∆%) за прийому ОМТ і Тівортіну; ВМШ-ішТ «-» 1/10 або ВМШ-V2 «-» 1/10 – відсотковий приріст (∆%) за прийому ОМТ.
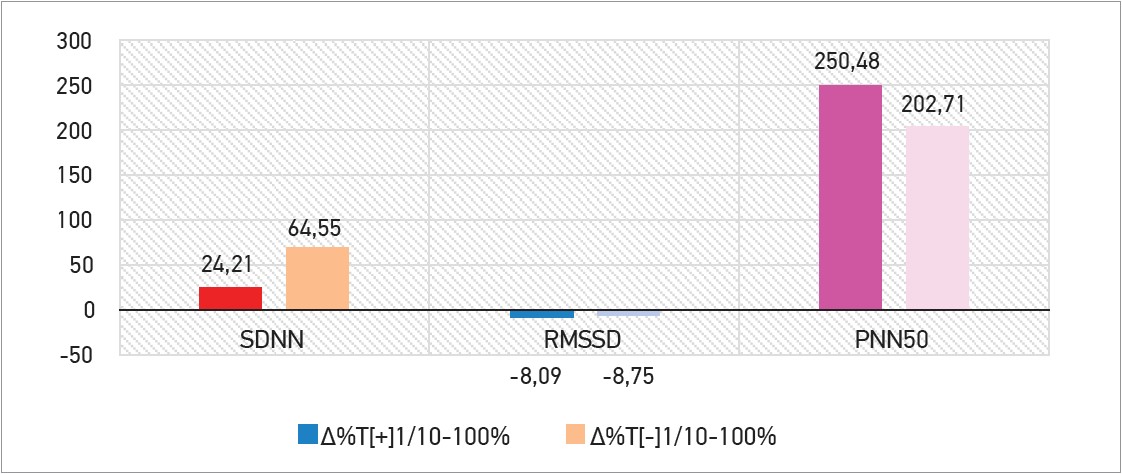
В обох групах спостерігали підвищення SDNN (∆ +24,21% проти ∆ +64,55% при р<0,05), невелике зниження RMSSD (∆ -8,09% проти ∆ -8,75% при р<0,05) та виражене підвищення pNN50 (∆ +250,48% проти ∆ +202,71% при р<0,05). Дані представлено на рисунках 5 і 6.
Рис. 5. Зміни показників ВСР між 1-м і 10-м днями спостереження
Примітки: Т «+» 1 – показники ВСР на 1-й день прийому ОМТ і Тівортіну; Т «+» 2 – показники ВСР на 10-й день прийому ОМТ і Тівортіну; Т «-» 1 – показники ВСР на 1-й день прийому ОМТ; Т «-» 1 – показники ВСР на 10-й день прийому ОМТ.
Рис. 6. Оцінка відсоткового приросту (∆%) показників ВСР між 1-м і 10-м днями спостереження
Обговорення
Ендотеліальна дисфункція (ЕД) спричинена дисбалансом між факторами, які сприяють розслабленню ендотелію (оксид азоту (NO), простациклін) і його скороченню (тромбоксан А2, ендотелін‑1) [6]. ЕД також є невід’ємною складовою АГ та може слугувати додатковим чинником ризику АГ. Одним із найбільш значущих механізмів ЕД є порушення метаболізму L-аргінін – NO, спричинене зменшенням його синтезу клітинами ендотелію або активацією його деградації за окиснювального стресу [7]. L-аргінін активує захист судин, підвищує NO (оскільки є його фізіологічним донатором), відновлює ендотелій судин і чинить органопротекторну дію на органи-мішені при АГ, знижує синтез ендотеліну‑1, сповільнює розвиток атеросклеротичної бляшки, поліпшує ендотелійзалежну вазодилатацію та підвищує час виконання навантаження до появи депресії сегмента ST [8]. Нормалізація синтезу NO позитивно впливає на ЕД, перешкоджає розвитку синдрому раннього старіння судин (early vascular aging, EVA-синдром), тому забезпечує комплексний захист органів-мішеней, що уражаються при АГ [9]. У рандомізованому клінічному дослідженні CTRI/2019/03/018026 відзначили, що додавання L-аргініну до стандартної антигіпертензивної терапії в дозі 3 г/день протягом 2 тиж у пацієнтів з АГ сприяло значному зниженню АТ [5]. Подібні результати отримано й у нашому дослідженні, що свідчить про позитивний антигіпертензивний ефект Тівортіну в пацієнтів із СтСт у поєднанні з АГ.
Показник ВМШ диференційованого зубця Т змінюється внаслідок первинних змін зубця Т зі збільшенням реполяризації в пошкодженій зоні (зниження ВМШ) і вторинних змін зубця Т, що є наслідком порушення деполяризації при гіпертрофії лівого шлуночка (збільшення ВМШ). Результати нашого дослідження вказують на позитивний вплив Тівортіну на значення показника ВМШ у зоні ішемії, оскільки реєстрували його збільшення, що свідчить про відновлення ішемізованого міокарда. За прийому Тівортіну також відзначили зниження ВМШ у маркерному відведенні гіпертрофії V2, що свідчить про нормалізацію процесів деполяризації гіпертрофованого міокарда.
Прийом Тівортіну сприяв підвищенню SDNN, що вказує на зниження ризику несприятливих подій у разі СтСт [10], активації парасимпатичного контуру та механізмів саморегуляції.
Отримані в ході нашого дослідження результати доводять доцільність застосування кардіоцитопротекторної терапії в пацієнтів із СтСт у поєднанні з АГ. Диджиталізація ЕКГ – новий діагностичний інструмент оцінки ефективності лікування.
Висновки
- Дисліпідемія, окиснювальний стрес та ЕД зумовлюють пошук нових підходів до лікування СтСт у поєднанні з АГ, а отже, кардіоцитопротекція є перспективним терапевтичним напрямом.
- Додавання до стандартної схеми лікування Тівортіну в пацієнтів із СтСт у поєднанні з АГ є ефективним, оскільки препарат сприяє нормалізації гемодинамічних показників (зниженню ЧСС, САТ, ДАТ), підвищенню якості життя, зростанню ВМШ у зоні ішемії та зниженню ВМШ у зоні гіпертрофії (позитивні терапевтичні ефекти) за даними диференційованої ЕКГ, підвищенню активації механізмів саморегуляції та парасимпатичних впливів нервової системи.
Література
1. Manolis A.J., Kallistratos M.S., Poulimenos L.E. (2019). Angina and hypertension. European heart journal supplements : journal of the European Society of Cardiology, 21: 15–16.
https://doi.org/10.1093/eurheartj/suz041.
2. Tendera M., Fox K., Ferrari R., Ford I., Greenlaw N., Abergel H., Macarie C., Tardif J. C., Vardas P., Zamorano J., Gabriel Steg P., CLARIFY Registry Investigators (2014). Inadequate heart rate control despite widespread use of beta-blockers in outpatients with stable CAD: findings from the international prospective CLARIFY registry. International journal of cardiology, 176(1): 119–124. https://doi.org/10.1016/j.ijcard.2014.06.052.
3. Лутай М.І., Пархоменко О.М., Лисенко А.Ф. (2018). Український пацієнт зі стабільною ІХС: результати 5-річного реєстру CLARIFY. Медична газета «Здоров’я України 21 сторіччя», (15-16): 436-437.
4. Ferrari R., Nesta F., Boraso A. (1999). Increased heart is detrimentali the myocardial metabolic theory. Eur. Heart J.
5. Dr. Vandana S.P., Dr. Sanjay S.V. (2023). Effect of add on L-arginine on Mean arterial pressure in hypertensive patients on antihypertensive treatment. Pravara Med Rev, 15 (01):
5-10. DOI: 10.36848/PMR/2022/99100.51015.
6. Das D., Shruthi N. R., Banerjee A., Jothimani G., Duttaroy A. K., Pathak S. (2023). Endothelial dysfunction, platelet hyperactivity, hypertension, and the metabolic syndrome: molecular insights and combating strategies. Front Nutr., 10: 1221438. https://doi.org/10.3389/fnut.2023.1221438.
7. Fedoniuk, L. Y. (2019). Роль дисфункції ендотелію у формуванні вад клапанів серця. Здобутки клінічної і експериментальної медицини, (3): 40–47. https://doi.org/10.11603/1811-2471.2019.v.i3.10507.
8. Тащук В.К. (2020). Оцінка ефективності кардіоцитопротекції в лікуванні хворих на гострий інфаркт міокарда та стабільну стенокардію шляхом цифрової обробки ЕКГ (дигіталізації) з подальшою її експертною оцінкою. Буковинський медичний вісник, 1 (93): 142-151. https://doi.org/10.24061/2413-0737.XXIV.1.93.2020.19.
9. Распутіна Л.В. (2022). EVA-синдром – раннє старіння судин при артеріальній гіпертензії. Медична газета «Здоров’я України 21 сторіччя», № 5-6: 522-523. https://health-ua.com/article/70191-EVAsindrom--rann-starnnya-sudin-pri-arteralnj-gpertenz.
10. Castro-de la Torre T. C., Amador-Licona N., Bernal-Ruíz E. (2017). Correlación de la variabilidad de la frecuencia cardiaca con SYNTAX II en angina crónica [Correlation of heart rate variability with SYNTAX II on chronic angina]. Revista medica del Instituto Mexicano del Seguro Social, 55 (1): 107–111.
Медична газета «Здоров’я України 21 сторіччя» № 19 (555), 2023 р