3 грудня, 2023
Ведення пацієнтів із хронічною ішемічною хворобою серця
Ішемічна хвороба серця (ІХС) виникає внаслідок абсолютного або відносного порушення кровопостачання міокарда через ураження коронарних артерій (КА) серця. Постійна нестача кровопостачання у тій чи іншій ділянці серця спричиняє розвиток хронічної ІХС, що може призвести до раптової аритмії, оклюзії КА, інфаркту міокарда (ІМ) та навіть летальних випадків. Тож діагностика, адекватне лікування та належний догляд таких пацієнтів є дуже важливими. Американська асоціація серця (AHA, 2023) разом з Американською колегією кардіологів (ACC, 2023) у співпраці з провідними медичними спільнотами* розробили настанову щодо ведення хворих на хронічну ІХС, яка об’єднує вже наявні рекомендації та останні наукові докази. Мета документа – надати чіткі рекомендації щодо діагностики й терапії, спрямованої на зменшення симптомів і ризику майбутніх серцево-судинних (СС) подій, поліпшення якості життя, а також подальшого спостереження пацієнтів із хронічною ІХС. Пропонуємо до вашої уваги ключові положення цієї настанови, опублікованої у виданні J Am Coll Cardiol (2023; 82 (9): 833‑955).
Діагностика та оцінка ризику
Діагностичне обстеження
У пацієнтів із хронічною ІХС, перш ніж розпочати обстеження, необхідно оптимізувати терапію. Пацієнтам із хронічною ІХС та погіршенням симптомів або функціональних можливостей, попри оптимальне лікування, рекомендовано виконати позитронно-емісійну томографію (ПЕТ) / перфузійну однофотонно-емісійну комп’ютерну томографію (КТ) міокарда з навантаженням, магнітно-резонансну томографію (МРТ) серця або стрес-ехокардіографію для виявлення ішемії міокарда та її ступеня, оцінки ризику серйозних СС-подій (MACE) і прийняття терапевтичних рішень (клас рекомендації 1, рівень доказовості B-NR) (Knott et al., 2020; Arai et al., 2020).
Встановлення тяжкості ішемії у хворих на хронічну ІХС може бути корисним для клінічного рішення щодо виконання інвазивної коронарографії (ІКА), а також інтенсифікації профілактичної та протиішемічної терапії. Доцільність візуалізаційних методів обстеження слід розглянути в пацієнтів, які скаржаться на новий або стійкий біль у грудях. ІКА може виявитися доцільною для коригування лікування з метою зменшення симптомів стенокардії (клас рекомендації 1, рівень доказовості B-R) (Spertus et al., 2020).
В осіб із хронічною ІХС і частою стенокардією або тяжкою ішемією, спричиненою стресом, IКA або коронарна КТ-ангіографія є варіантом вибору (Maron et al., 2020). Крім того, виконують тестування на біговій доріжці з фізичним навантаженням, щоб визначити, чи відповідають в пацієнтів симптоми таким, як за стенокардії, оцінити тяжкість симптомів, функціональні можливості й вибрати тактику терапії (клас рекомендації 2а, рівень доказовості B-NR) (Ho et al., 2007; Jaureguizar et al., 2016).
Для пацієнтів із хронічною ІХС, яким виконують ПЕТ-візуалізацію перфузії міокарда або МРТ із навантаженням, може бути корисним визначення резерву міокардіального кровотоку для підвищення точності діагностики та поліпшення стратифікації ризику (клас рекомендації 2а, рівень доказовості B-NR) (Patel et al., 2020; Bom et al., 2020).
Для хворих на хронічну ІХС зі зміною симптомів чи функціональних можливостей (що зберігаються, попри оптимальну терапію), яким раніше виконували коронарну реваскуляризацію, коронарна КТ-ангіографія є доцільною для оцінювання прохідності шунта або стента (≥3 мм) (клас рекомендації 2а, рівень доказовості B-NR) (Andreini et al., 2019).
Стратифікація ризику для оцінювання прогнозу
У пацієнтів із хронічною ІХС для стратифікації ризику слід залучати всю доступну інформацію, зокрема результати неінвазивних, інвазивних чи обох діагностичних СС-обстежень, або ж валідовану класифікацію для оцінювання щорічного ризику смерті від серцево-судинних захворювань (ССЗ) або нефатального ІМ: низького (<1%), проміжного (1‑3%) і високого (>3%) (клас рекомендації 1, рівень доказовості B-NR) (Heitner et al., 2019).
Окрім того, для зниження частоти MACE рекомендовано оптимізувати терапію в цієї категорії хворих (клас рекомендації 1, рівень доказовості А) (Frye et al., 2009).
У пацієнтів із хронічною ІХС та нещодавно зниженою систолічною функцією лівого шлуночка (ЛШ), клінічними ознаками серцевої недостатності (СН) або обома станами для оцінювання анатомії коронарних артерій та розгляду питання щодо виконання потенційної реваскуляризації доцільно використовувати внутрішню сонну артерію (ВСА) (клас рекомендації 1, рівень доказовості А) (Lopes et al., 2020).
Для пацієнтів із хронічною ІХС без систолічної дисфункції ЛШ, СН, стабільного болю за грудниною, рефрактерного до лікування, та/або результатів неінвазивного тестування, що свідчать про ймовірність значного (>50%) ураження лівої головної КА, дослідження ВСА для стратифікації ризику не рекомендовані (клас рекомендації 3: немає переваг, рівень доказовості А) (Reynolds et al., 2021; Weintraub et al., 2019).
Аспекти терапії
Загальний підхід до вибору лікування
Кінцевими цілями лікування пацієнтів із хронічною ІХС є подовження виживаності та поліпшення якості життя. Для цього терапія має бути спрямована на зниження частоти кардіальної смерті, нефатальних ішемічних подій, сповільнення прогресування атеросклерозу, а також симптомів і функціональних обмежень хронічної ІХС, зважаючи на побажання хворого, потенційні ускладнення на тлі застосування процедур / ліків і витрат для системи охорони здоров’я (Bayati et al., 2018).
Для оптимізації лікування для кожного пацієнта слід брати до уваги низку чинників:
1. Насамперед необхідно оцінити ризики для пацієнта (як ішемічних подій, так і ускладнень, пов’язаних із потенційними варіантами лікування).
2. Важливим є ретельне оцінювання симптомів хронічної ІХС, функціональних обмежень і якості життя хворих.
3. Слід також враховувати соціальні детермінанти здоров’я (зокрема, соціальне середовище, у якому живуть пацієнти, що може позначатися на стані їхнього здоров’я).
4. Хворі мають бути поінформовані щодо тактики лікування, щоб брати активну участь у спільному прийнятті відповідних рішень.
5. Мультидисциплінарний командний підхід може допомогти пацієнтам і клініцистам краще орієнтуватися в терапевтичному процесі (van der Heide et al., 2013).
Пацієнтам із хронічною ІХС рекомендовано клінічне обстеження щонайменше раз на рік для встановлення симптомів, змін функціонального стану, дотримання здорового способу життя і фармакологічних аспектів, а також моніторингу ускладнень хронічної ІХС та відповідного лікування (клас рекомендації 1, рівень доказовості C‑LD) (Waldeyer et al., 2022).
В осіб із хронічною ІХС застосування валідованих показників стану здоров’я, про які повідомляють хворі, може бути доцільним для оцінювання симптомів, функціонального стану та якості життя (клас рекомендації 2b, рівень доказовості B-NR) (Saxon et al., 2020; Arnold et al., 2016).
Під час ведення пацієнтів із хронічною ІХС рекомендовано використовувати мультидисциплінарний, командний підхід для сприяння модифікації чинників ризику розвитку атеросклеротичних ССЗ (АССЗ), поліпшення результатів терапії та використання медичних послуг (клас рекомендації 1, рівень доказовості А) (Chen et al., 2019). Хворі на хронічну ІХС мають регулярно отримувати індивідуальну інформацію щодо лікування симптомів, коригування способу життя, чинників ризику розвитку ускладнень і прихильності до терапії, щоб поліпшити наявні знання та сприяти зміні їхньої поведінки (клас рекомендації 1, рівень доказовості C‑LD) (Ghisi et al., 2014). Пацієнтів з хронічною ІХС слід залучати до прийняття спільного разом із клініцистами, особливо без чітко визначеної стратегії діагностики чи лікування (клас рекомендації 1, рівень доказовості C‑LD) (Provance et al., 2019; Jansen et al., 2019).
Пацієнти з хронічною ІХС мають пройти рутинне оцінювання соціальних детермінант здоров’я для прийняття відповідних рішень щодо лікування та надання рекомендацій із модифікації способу життя (клас рекомендації 1, рівень доказовості B-R) (Lindley et al., 2021).
Терапія на основі рекомендацій
Контроль рівня ліпідів
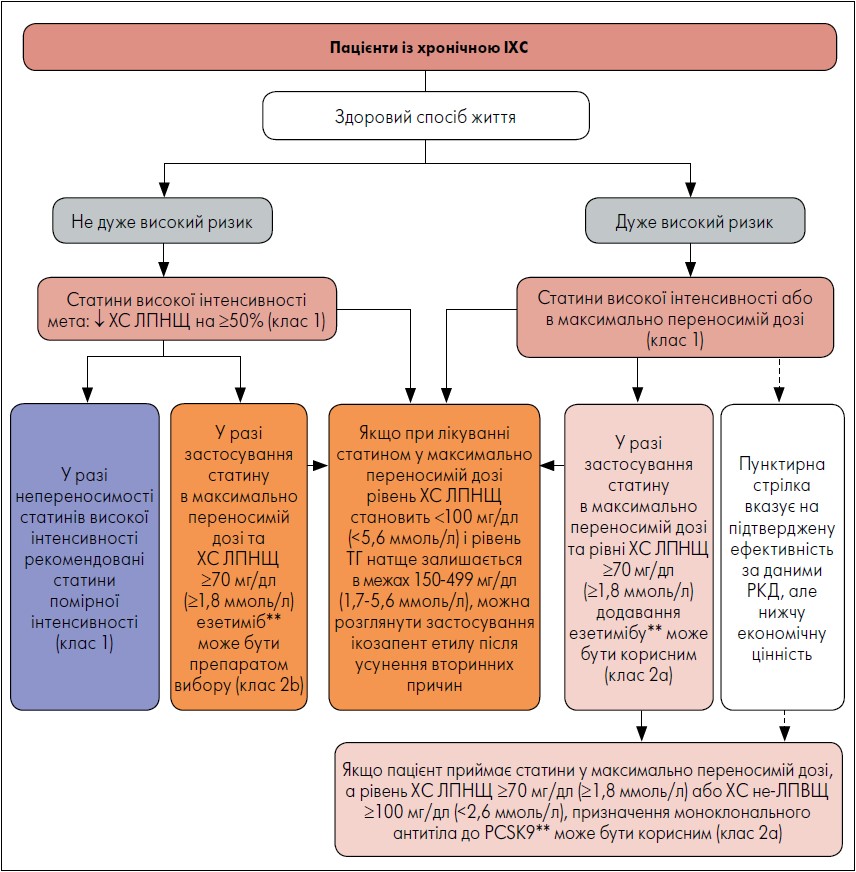
За даними рандомізованих контрольованих досліджень (РКД), встановлено ефективність і безпеку високоінтенсивної статинотерапії як початкового підходу до зниження рівня холестерину (ХС) ліпопротеїнів низької щільності (ЛПНЩ) на ≥50% і СС-захворюваності та смертності (рис. 1). Таке лікування сприяє зменшенню ймовірності виникнення MACE (клас рекомендації 1, рівень доказовості А) (LaRosa et al., 2005).
Рис. 1. Контроль рівня ліпідів у пацієнтів із хронічною ІХС*
Примітки: Дуже високий ризик передбачає серію тяжких АССЗ або одне тяжке АССЗ та декілька подій високого ризику
в анамнезі.
* У дужках зазначено клас рекомендації. ** Тільки якщо езетиміб і моноклональні тіла до PCSK9 вважаються неефективними
або не переносяться, для подальшого зниження рівня ХС ЛПНЩ слід розглянути застосування бемпедоєвої кислоти або
інклісірану (замість моноклонального тіла до PCSK9). Нині вивчають вплив бемпедоєвої кислоти та інклісірану на MACE.
Адаптовано за S.M. Grundy et al., 2019.
Результати багатьох РКД свідчать, що терапія статинами помірної інтенсивності також зменшує ризик СС-подій і летальність серед пацієнтів зі встановленими АССЗ, зокрема віком >75 років. Хворим, які погано переносять лікування статинами високої інтенсивності або воно протипоказане, слід призначити препарати помірної інтенсивності, щоб досягти зменшення ХС ЛПНЩ на 30‑49% для зниження ризику MACE (клас рекомендації 1, рівень доказовості А) (Baigent et al., 2010). Крім того, у пацієнтів із хронічною ІХС слід оцінювати дотримання модифікації способу життя та вплив гіполіпідемічних засобів завдяки визначенню рівня ліпідів натще через 4‑12 тижнів після початку приймання статинів або коригування дози, а потім що 3‑12 місяців залежно від потреби встановити відповідь або прихильність до терапії (клас рекомендації 1, рівень доказовості А) (Jia et al., 2020; Rana et al., 2021). Передбачають, що в пацієнтів із хронічною ІХС застосування генериків у межах максимально переносимої статинотерапії дасть змогу значно заощадити кошти (економічна цінність: висока, рівень доказовості B-NR) (Kazi et al., 2016).
У пацієнтів із хронічною ІХС і рівнем ХС ЛПНЩ ≥70 мг/дл (≥1,8 ммоль/л), яких вважають групою дуже високого ризику та які отримують статини в максимально переносимій дозі, додавання езетимібу може бути корисним для подальшого зниження ризику MACE (клас рекомендації 2а, рівень доказовості B-R) (Bach et al., 2019; Bonaca et al., 2018).
Зокрема, у дослідженні IMPROVE-IT застосування езетимібу на додаток до статинів помірної інтенсивності в пацієнтів із хронічною ІХС сприяло значному зменшенню ймовірності розвитку АССЗ за середнього періоду спостереження 6 років (Cannon et al., 2015).
Для осіб із хронічною ІХС та ХС ЛПНЩ ≥70 мг/дл (≥1,8 ммоль/л), які не належать до групи високого ризику та отримують статинотерапію в максимально переносимій дозі, додавання езетимібу для зниження ризику MACE є ймовірно доцільним (клас рекомендації 2b, рівень доказовості B-R) (Bohula et al., 2017; Virani et al., 2017).
За прогнозами додавання генеричного езетимібу до максимально переносимої статинотерапії у хворих на хронічну ІХС матиме високу економічну цінність у США (економічна цінність: висока, рівень доказовості B-NR) (Kazi et al., 2019).
Крім того, ефективність езетимібу оцінювали в РКД, присвячених вивченню моноклональних антитіл до пропротеїнової конвертази субтилізин / кексинового типу 9 (PCSK9). У жодному з них не визначали, яка стратегія є дієвішою: додавання до лікування спершу езетимібу чи моноклонального антитіла до PCSK9. Однак, зважаючи на загальну доступність езетимібу, пероральне застосування раз на добу та доведену довготривалу безпеку й переносимість, для досягнення бажаного рівня ХС ЛПНЩ слід спочатку додавати езетиміб, а потім моноклональне антитіло до PCSK9 (Schwartz et al., 2018; Talasaz et al., 2021).
Слід зауважити, що в пацієнтів із хронічною ІХС групи дуже високого ризику з рівнем ХС ЛПНЩ ≥70 мг/дл (≥1,8 ммоль/л) або ХС ліпопротеїнів невисокої щільності (не-ЛПВЩ) ≥100 мг/дл (≥2,6 ммоль/л), приймання моноклонального антитіла до PCSK9 на тлі застосування статинів у максимально переносимій дозі й езетимібу може бути корисним для зниження ризику MACE (клас рекомендації 2а, рівень доказовості А) (Jukema et al., 2019; Roe et al., 2019).
Зокрема, це було підтверджено в дослідженні FOURIER, у якому вивчали ефективність еволокумабу в осіб зі встановленим АССЗ і ХС ЛПНЩ ≥70 мг/дл (≥1,8 ммоль/л) або ХС не-ЛПВЩ ≥100 мг/дл (≥2,6 ммоль/л), що отримували статини в максимально переносимій дозі з/без езетимібу. У разі застосування еволокумабу фіксували зменшення кількості СС-подій на 15%, причому більшу користь мали пацієнтів із додатковими чинниками високого ризику (Schwartz et al., 2018).
Подібні результати отримали у дослідженні ODYSSEY OUTCOMES, де вивчали вплив застосування алірокумабу в пацієнтів із гострим коронарним синдромом (ГКС), які також приймали статини в максимально переносимій дозі з/без езетимібу. Застосування алірокумабу сприяло зниженню частоти СС-подій на 15%, при цьому ліпший ефект спостерігали в пацієнтів із додатковими чинниками високого ризику (Murphy et al., 2019).
В осіб із хронічною ІХС групи дуже високого ризику прогнозовану економічну цінність застосування моноклональних антитіл до PCSK9 у США не встановлено (економічна цінність: не визначено, рівень доказовості B-NR) (Bhatt et al., 2020; Fonarow et al., 2019).
Слід зауважити, що в пацієнтів із хронічною ІХС та ХС ЛПНЩ <100 мг/дл (<5,6 ммоль/л) і стійким рівнем тригліцеридів (ТГ) натще 150‑499 мг/дл (1,7‑5,6 ммоль/л) після лікування вторинних причин, які отримують статинотерапію в максимально переносимій дозі, можна розглянути призначення ікозапент етилу для зниження ризику MACE та смерті від ССЗ (клас рекомендації 2b, рівень доказовості B-R).
У дослідженні REDUCE-IT у пацієнтів із підтвердженим АССЗ або цукровим діабетом (ЦД) і додатковими чинниками ризику, ТГ 150‑499 мг/дл (1,7‑5,6 ммоль/л) і ХС ЛПНЩ <100 мг/дл (<5,6 ммоль/л), які на тлі статинотерапії отримували мінеральну олію як плацебо або ікозапент етил, останній знижував відносний ризик MACE на 25% і частоту СС-смерті – на 20% (Bhatt et al., 2019).
Бемпедоєва кислота знижує рівень ХС ЛПНЩ на 15‑25% залежно від типу й дози фонової статинотерапії та має меншу кількість побічних ефектів із боку м’язової системи (Goldberg et al., 2019). Вона також доступна як комбінований препарат з езетимібом, що знижує вміст ХС ЛПНЩ на ~35%. Попри те, що бемпедоєву кислоту можна поєднувати зі статинами, слід уникати її застосування разом із >20 мг/добу симвастатину чи 40 мг/добу правастатину через зростання рівнів обох препаратів у сироватці крові вдвічі. Інклісіран знижує рівень ХС ЛПНЩ приблизно на 50% і загалом добре переноситься, але може спричинювати алергічні реакції у місці ін’єкції (Ray et al., 2020).
Тобто у пацієнтів із хронічною ІХС та ХС ЛПНЩ ≥70 мг/дл (≥1,8 ммоль/л), які приймають статини в максимально переносимій дозі, та в яких езетиміб і моноклональне антитіло до PCSK9 вважаються недостатньо ефективними або не переносяться, для зниження рівня ХС ЛПНЩ можна розглянути додавання бемпедоєвої кислоти або інклісірану (замість моноклонального антитіла до PCSK9) (клас рекомендації 2b, рівень доказовості B-R) (Goldberg et al., 2019; Ray et al., 2020). Вплив бемпедоєвої кислоти та інклісірану на MACE нині ще досліджується, тож лікування нестатинами із доведеною ефективністю, як-от езетиміб і моноклональне антитіло до PCSK9, є пріоритетним.
У хворих на хронічну ІХС, які отримують статинотерапію, додавання ніацину, фенофібрату або дієтичних добавок, що містять жирні кислоти омега‑3, не сприятиме зниженню СС-ризику (клас рекомендації 3: немає переваг, рівень доказовості B-R) (Kalstad et al., 2021).
Моніторинг артеріального тиску
Артеріальна гіпертензія (АГ) є підтвердженим чинником СС-ризику і поширеним супутнім захворюванням серед осіб із хронічною ІХС (Goldberger et al., 2021). Дослідники фіксували високу ймовірність захворюваності й летальних випадків у хворих на хронічну ІХС та АГ порівняно з особами з артеріальним тиском (АТ), який перебуває у межах вікової норми. Лікування АГ за допомогою модифікації способу життя та медикаментозної терапії допомагає контролювати АГ та знизити ризик розвитку MACE (Carrick et al., 2018; Fihn et al., 2014).
Відповідно до рекомендацій, у дорослих пацієнтів із хронічною ІХС та підвищеним АТ 120‑129/<80 мм рт. ст. рекомендованою стратегією першої лінії для зниження АТ є нефармакологічна терапія (клас рекомендації 1, рівень доказовості А). У хворих на ІХС та АГ цільовий АТ має бути <130/<80 мм рт. ст. для зменшення випадків ССЗ та смерті від усіх причин (клас рекомендації 1, рівень доказовості B-R) (Bohm et al., 2019; Sobieraj et al., 2019).
На додаток до немедикаментозних методів лікування в осіб із хронічною ІХС та АГ за систолічного АТ ≥130 мм рт. ст. та/або діастолічного АТ ≥80 мм рт. ст. як терапія першої лінії (згідно з вагомими показаннями) рекомендовані інгібітори ангіотензинперетворювального ферменту (іАПФ), блокатори рецепторів ангіотензину ІІ типу (БРА) чи β-блокатори (як-от нещодавно перенесений ІМ або стенокардія). Застосування додаткових антигіпертензивних препаратів, наприклад дигідропіридинових блокаторів кальцієвих каналів (БКК), тіазидних діуретиків тривалої дії та/або антагоністів мінералокортикоїдних рецепторів, є доцільним за потреби оптимізувати контроль АТ (клас рекомендації 1, рівень доказовості B-R) (Law et al., 2009; Poole-Wilson et al., 2004).
Застосування іНЗКТГ‑2 та арГПП‑1
Комплексні стратегії зниження СС-ризику є ефективними для пацієнтів із хронічною ІХС та ЦД 2-го типу (Gaede et al., 2008). Проте частота СС-подій залишається високою навіть серед хворих на ЦД, які отримують якісне лікування, а ІХС є основною причиною захворюваності та смерті (Rana et al., 2021).
Два класи цукрознижувальних препаратів – інгібітори натрійзалежного котранспортера глюкози 2-го типу (іНЗКТГ‑2) та агоністи рецепторів глюкагоноподібного пептиду‑1 (арГПП‑1) – мають потужні переваги для СС-системи незалежно від їх впливу на глікемічний контроль (Neal et al., 2017; Wiviott et al., 2018). Пацієнтам із хронічною ІХС та ЦД 2-го типу рекомендоване лікування іНЗКТГ‑2 або арГПП‑1 для зниження ризику MACE (клас рекомендації 1, рівень доказовості А) (McGuire et al., 2021). За прогнозами, додавання арГПП‑1 до терапії у таких хворих матиме високу економічну цінність порівняно зі стандартною терапією у США (економічна цінність: висока, рівень доказовості B-NR) (Gerstein et al., 2019).
Своєю чергою, дослідники передбачають середню економічну цінність додавання іНЗКТГ‑2 до лікування пацієнтів зазначеної категорії порівняно з рутинною терапією у США (економічна цінність: середня, рівень доказовості B-NR) (Yoshida et al., 2020).
Пацієнтам із хронічною ІХС та СН із фракцією викиду (ФВ) ЛШ ≤40% рекомендоване застосування іНЗКТГ‑2 для зниження ризику СС-смерті та госпіталізації з приводу СН, а також для поліпшення якості життя хворих незалежно від наявності ЦД (клас рекомендації 1, рівень доказовості А) (Kosiborod et al., 2020; Butler et al., 2021).
Додавання іНЗКТГ‑2 до оптимальної терапії у таких пацієнтів, незалежно від наявності ЦД, за прогнозами матиме середню економічну цінність у США (економічна цінність: середня, рівень доказовості B-NR) (Parizo et al., 2021).
Зокрема, у хворих на хронічну ІХС та СН із ФВ ЛШ >40% застосування іНЗКТГ‑2 може бути корисним для зменшення кількості госпіталізації через СН і підвищення якості життя пацієнтів незалежно від наявності ЦД (клас рекомендації 2а, рівень доказовості B-R) (Solomon et al., 2022).
Передбачають невизначену економічну цінність додавання іНЗКТГ‑2 до оптимальної терапії, незалежно від наявності ЦД, в осіб із хронічною ІХС та СН із ФВ ЛШ >40%, у США (економічна цінність: не визначено, рівень доказовості B-NR) (Zheng et al., 2022).
Особливості харчування
Зміна харчової поведінки разом з оптимізацією терапії на основі рекомендацій у пацієнтів із хронічною ІХС є важливими для зниження ризику гострих СС-подій, зокрема АССЗ, а також результатів, пов’язаних із СН, інсультом та СС-смертю (Rees et al., 2019).
Як відомо, здорове харчування поліпшує контроль чинників СС-ризику в таких хворих і чинить позитивний вплив на патофізіологічні механізми, що спричиняють розвиток гострих ССЗ (Knuuti et al., 2020).
Пацієнтам із хронічною ІХС для зниження ризику розвитку СС-ускладнень рекомендоване спеціальне харчування, основою якого є овочі, фрукти, бобові, горіхи, цільнозернові продукти і нежирний білок (клас рекомендації 1, рівень доказовості B-R) (Sawicki et al., 2016).
Крім того, пацієнти з хронічною ІХС мають зменшити кількість калорій, отримуваних із насичених жирів, та замінити їх на моно- й поліненасичені жири, складні вуглеводи і харчову клітковину (клас рекомендації 2а, рівень доказовості B-NR) (Hooper et al., 2006).
Для зменшення ймовірності СС-подій такі хворі мають мінімізувати споживання натрію (оптимально 1500 мг/добу), рафінованих вуглеводів, обробленого м’яса та солодких напоїв (клас рекомендації 2а, рівень доказовості B-NR) (Sacks et al., 2001). Пацієнтам із хронічною ІХС варто уникати вживання транс-жирів, оскільки вони пов’язані з підвищеним рівнем захворюваності та смертності (клас рекомендації 3: завдає шкоди, рівень доказовості B-NR) (Guasch-Ferre et al., 2015; Kiage et al., 2013).
Слід зауважити, що для осіб із хронічною ІХС приймання безрецептурних або дієтичних добавок, зокрема омега‑3 жирних кислот, вітамінів C, D, E, бета-каротину і кальцію, не є корисним для зниження ризику гострих СС-подій (клас рекомендації 3: немає переваг, рівень доказовості B-NR) (Myung et al., 2021).
Нормалізація фізичної активності
Регулярна фізична активність пов’язана з поліпшенням клінічних результатів в осіб із ССЗ, зокрема їхніх функціональних можливостей і якості життя, а також зниженням показників захворюваності та смертності (Fan et al., 2021; Nieste et al., 2021). Механізми користі фізичної активності та вправ полягають в антиатеросклеротичному, антиаритмічному, антитромботичному, антиішемічному й антидепресивному ефектах (Franklin et al., 2020).
Пацієнтам із хронічною ІХС, які не мають протипоказань, для поліпшення функціональних можливостей та якості життя, а також для зниження частоти госпіталізації і рівня смертності рекомендований режим фізичних вправ, що передбачає 150 або 75 хв/тиждень аеробних навантажень помірної чи високої інтенсивності відповідно (клас рекомендації 1, рівень доказовості А) (Dibben et al., 2018).
Крім того, для поліпшення м’язової сили, функціональних можливостей і контролю чинників СС-ризику в таких хворих доцільними є силові навантаження два дні на тиждень (клас рекомендації 1, рівень доказовості B-R) (Marzolini et al., 2012). Особам із хронічною ІХС та низьким рівнем звичайної фізичної активності для підвищення функціональних можливостей і зниження СС-ризику слід уникати інтенсивних тренувань, але й не вести малорухомий спосіб життя (клас рекомендації 2а, рівень доказовості B-NR) (Geidl et al., 2020; Hall et al., 2020).
Контроль ваги
В осіб із надмірною вагою та ожирінням хронічна ІХС може виникати у більш ранньому віці, а середня тривалість життя є коротшою (Powell-Wiley et al., 2021).
Ожиріння прискорює розвиток атеросклерозу та спричиняє порушення функцій серця через шкідливий вплив на міокард і СС-систему, а також розвиток супутніх захворювань, асоційованих з ожирінням, як-от АГ, дисліпідемія та ЦД 2-го типу (McGill et al., 2002).
Пацієнтам із хронічною ІХС під час звичайного клінічного спостереження рекомендовано визначати індекс маси тіла (ІМТ) із/без урахування окружності талії (клас рекомендації 1, рівень доказовості С-ЕО) (Khan et al., 2018).
Хворі на хронічну ІХС, які мають надмірну вагу або ожиріння, мають отримати консультації щодо дієти, способу життя та цілей схуднення (клас рекомендації 1, рівень доказовості B-NR) (LeBlanc et al., 2018).
Зокрема, якщо такі пацієнти для зниження ваги потребують призначення фармакологічної терапії, арГПП‑1 можуть бути корисним на додаток до консультацій дієтолога та фізичної активності, при цьому перевагу слід віддавати семаглутиду порівняно з ліраглутидом (клас рекомендації 2а, рівень доказовості B-R) (Wilding et al., 2021; Rubino et al., 2022).
В осіб із хронічною ІХС і тяжким ожирінням, яким не вдалося досягти цільового зменшення маси тіла за допомогою корекції способу життя та медикаментозного лікування та які мають прийнятний хірургічний ризик, доцільно розглянути можливість виконання баріатричної процедури для зниження ваги і СС-ризику (клас рекомендації 2а, рівень доказовості B-NR) (Doumouras et al., 2021).
Приймання симпатоміметиків для зниження ваги в пацієнтів із хронічною ІХС є потенційно шкідливим (клас рекомендації 3: завдає шкоди, рівень доказовості B-R) (James et al., 2010).
Відмова від куріння
Куріння є основною причиною розвитку ССЗ та СС-подій в осіб із хронічною ІХС. Тютюновий дим чинить негативний вплив на функцію ендотелію, призводить до атеросклерозу та має протромботичну дію (Duncan et al., 2019; Roy et al., 2017). Пацієнтам із хронічною ІХС, які курять, слід під час кожного візиту до лікаря рекомендувати позбутися цієї згубної звички (клас рекомендації 1, рівень доказовості А) (Stead et al., 2013).
Для осіб із хронічною ІХС, які регулярно курять тютюн, для його припинення рекомендовано застосовувати поведінкові втручання у поєднанні з фармакотерапією, що полягає в призначенні бупропіону, варенікліну або комбінованої нікотинзамісної терапії тривалої та короткої дії (клас рекомендації 1, рівень доказовості А) (Hartmann-Boyce et al., 2021). Також у таких хворих для відмови від куріння можна розглянути призначення варенікліну порівняно з бупропіоном або нікотинзамісною терапією (клас рекомендації 2b, рівень доказовості B-R) (Suissa et al., 2017).
Окрім того, у пацієнтів із хронічною ІХС, які регулярно курять тютюн, короткочасне використання електронних сигарет із нікотином, ймовірно, допоможе кинути курити, але ризик тривалого застосування та невідома довгострокова безпека можуть переважати користь (клас рекомендації 2b, рівень доказовості B-R) (Hajek et al., 2019). Хворі на хронічну ІХС мають уникати пасивного куріння, щоб зменшити ймовірність розвитку СС-ускладнень (клас рекомендації 3: завдає шкоди, рівень доказовості B-NR) (Panagiotakos et al., 2007).
Обмеження вживання алкоголю і психоактивних речовин
Психоактивні речовини та вживання алкоголю можуть мати негативний вплив на СС-систему і призводити до розвитку залежності й медикаментозної взаємодії під час лікування (Lichtenstein et al., 2021). Пацієнти із хронічною ІХС мають отримувати регулярні консультації щодо вживання психоактивних речовин, щоб знизити частоту розвитку АССЗ (клас рекомендації 1, рівень доказовості C‑LD) (DeFilippis et al., 2020; Costanzo et al., 2011). У таких хворих обмеження споживання алкоголю сприяє зменшенню смертності від ССЗ та інших причин (клас рекомендації 2а, рівень доказовості B-NR) (Biddinger et al., 2022).
Особам із хронічною ІХС не слід рекомендувати вживання алкоголю для захисту СС-системи (клас рекомендації 3: немає переваг, рівень доказовості B-NR) (Mukamal et al., 2005).
Психічне здоров’я
Психічне здоров’я чинить суттєвий вплив на функціонування СС-системи та загальне благополуччя осіб із хронічною ІХС (Levine et al., 2021). Для пацієнтів із хронічною ІХС є доцільним скринінг психічного здоров’я для можливого додаткового оцінювання їхнього стану та призначення відповідного лікування (клас рекомендації 2а, рівень доказовості B-R) (Kim et al., 2021).
Лікування психічних розладів за допомогою медикаментозної / немедикаментозної терапії або обох методів є розумним підходом для поліпшення СС-наслідків у цій популяції хворих (клас рекомендації 2а, рівень доказовості B-R) (Vaccarino et al., 2020; Smolderen et al., 2017).
Сексуальне здоров’я та активність
Сексуальне здоров’я чинить значний вплив на якість життя осіб із хронічною ІХС (Levine et al., 2012). Підхід до відновлення статевої активності в пацієнтів із хронічною ІХС має бути індивідуалізованим на основі її типу, а також переносимості фізичних навантажень та післяопераційного відновлення (клас рекомендації 2а, рівень доказовості B-NR) (Dahabreh et al., 2011). Для таких хворих можуть бути корисними кардіореабілітація та регулярні фізичні вправи з метою зниження ризику СС-ускладнень під час сексуальної активності (клас рекомендації 2а, рівень доказовості B-NR) (Muller et al., 1996).
Пацієнтам із хронічною ІХС не слід одночасно застосовувати інгібітори фосфодіестерази типу 5 та препарати класу нітратів через імовірність розвитку тяжкої гіпотензії (клас рекомендації 3: завдає шкоди, рівень доказовості B-NR) (Corona et al., 2008).
Фармакотерапія для запобігання розвитку СС-подій і зменшення симптомів
Антитромбоцитарна терапія
Підтверджено переваги застосування ацетилсаліцилової кислоти (АСК) у межах вторинної профілактики АССЗ для зниження MACE (Baigent et al., 2009). Пацієнтам із хронічною ІХС, якщо немає показань до пероральних антикоагулянтів для зниження частоти атеросклеротичних подій, рекомендовано призначати АСК у низькій дозі (75‑100 мг) (клас рекомендації 1, рівень доказовості А) (Antithrombotic Trialists’ Collaboration, 2002).
У дослідженні ADAPTABLE (n=15 076) не спостерігали суттєвих відмінностей у результатах щодо смерті від будь-якої причини, госпіталізації з приводу ІМ або інсульту залежно від дозування АСК, але 41,6% осіб, які приймали високу дозу 325 мг/добу, перейшли на нижчу – 81 мг/добу (Jones et al., 2021). Крім того, як альтернативу АСК у низьких дозах у разі їх непереносимості можна застосовувати клопідогрель (Watanabe et al., 2019).
У дослідженні HOST-Exam вивчали, який антитромбоцитарний засіб – АСК чи клопідогрель – ефективніший у хворих на хронічну ІХС після черезшкірного коронарного втручання (ЧКВ). Пацієнтів за переносимості антитромбоцитарної терапії протягом 6‑18 міс. і без ішемічних ускладнень чи великої кровотечі рандомізували для приймання 75 мг/добу клопідогрелю або 100 мг/добу АСК на період 24 міс. За отриманими результатами, клопідогрель мав переваги порівняно з АСК як за тромботичних подій, так і кровотеч (Koo et al., 2021).
Необхідні подальші клінічні дослідження для надання рекомендацій щодо тривалого застосування клопідогрелю порівняно з АСК у вигляді монотерапії за хронічної ІХС.
Приймання подвійної антитромбоцитарної терапії (ПАТТ) можна розглянути у хворих із високим ризиком тромбозів і низьким – кровотечі. Оптимальну тривалість застосування ПАТТ вивчали за результатами метааналізу РКД (n=31 666), у якому коротша терапія (6 міс.) була пов’язана з нижчою загальною смертністю, схожими даними щодо ІМ та тромбозу стента, але меншою кількістю великих кровотеч порівняно з довшою (рік) (Palmerini et al., 2015).
Відповідно до рекомендацій, пацієнтам із хронічною ІХС, яким виконали ЧКВ, рекомендовано ПАТТ АСК + клопідогрель упродовж 6 міс. після ЧКВ із монотерапією далі антиагрегантом для зменшення кількості MACE та випадків кровотечі (клас рекомендації 1, рівень доказовості А) (Colombo et al., 2014; Schulz-Schьpke et al., 2015).
У систематичному огляді й метааналізі проспективних РКД, присвячених вторинній профілактиці в пацієнтів із хронічною ІХС групи ризику (n=33 435), із яких 20 203 отримували ПАТТ, а 13 232 – АСК, близько половини мали в анамнезі ІМ. Іншими супутніми станами також були ЦД, хронічна хвороба нирок (ХХН) і раніше виконане ЧКВ. На тлі ПАТT протягом >1 року фіксували зниження на 1,09% частоти MACE та абсолютного ризику, але збільшення на 0,8% абсолютного ризику великої кровотечі без великої внутрішньомозкової або фатальної кровотечі (Udell et al., 2016).
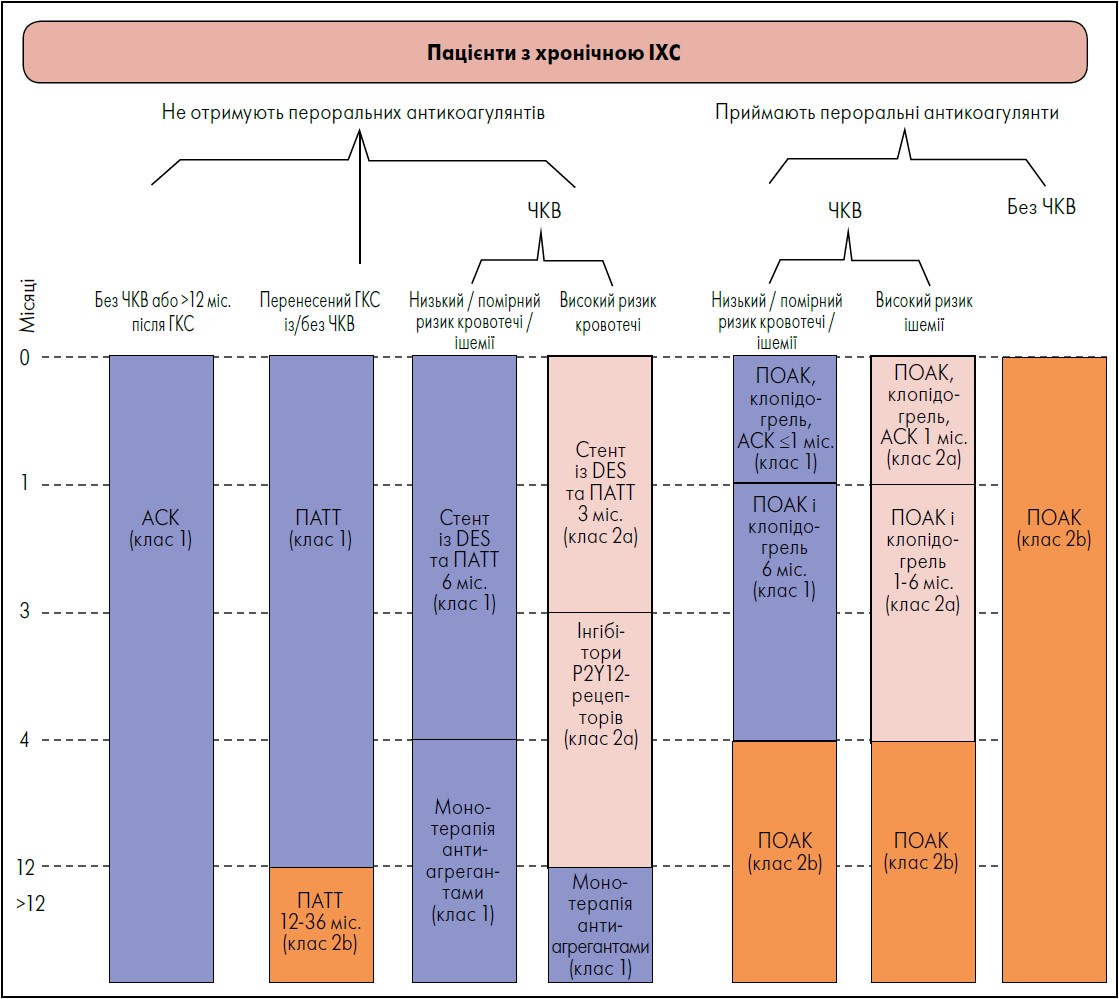
На рисунку 2 представлено загальні рекомендації щодо тривалості антитромбоцитарної терапії в осіб із хронічною ІХС.
Рис. 2. Тривалість антитромбоцитарної терапії*
Примітки: АСК – ацетилсаліцилова кислота; ПОАК – пероральні антикоагулянти; ПАТТ – подвійна антитромбоцитарна терапія.
Адаптовано за S.S. Virani et al., 2023.
За даними клінічних досліджень (SMART CHOICE, STOP-DAPT2, TWILIGHT і GLOBAL LEADERS), у 35‑62% пацієнтів зі стабільною ІХС на тлі ПАТT протягом 1‑3 міс. із монотерапією надалі інгібітором P2Y12-рецепторів підтверджено зниження частоти кровотечі без посилення ішемічних ускладнень (Watanabe et al., 2019; Mehran et al., 2019; Hahn et al., 2019). За результатами метааналізу, припинення приймання АСК через 1‑3 міс. і продовження застосування інгібітора P2Y12-рецепторів (переважно прасугрелу або тикагрелору) знижує ризик великої кровотечі на 40% без підвищення ймовірності MACE у пацієнтів із хронічною ІХС (O’Donoghue et al., 2020).
Власне, в окремої групи хворих на хронічну ІХС, яким виконали ЧКВ і встановили стент із медикаментозним покриттям (DES), а також пройшли курс ПАТТ тривалістю 1‑3 міс., для зниження ризику кровотечі є доцільною монотерапія інгібітором P2Y12-рецепторів упродовж щонайменше року (клас рекомендації 2а, рівень доказовості А) (Feres et al., 2012).
У дослідженні PEGASUS-TIMI 54 взяли участь 21 162 пацієнти, які перенесли ІМ за 1‑3 роки до того, як почали застосовувати тикагрелор (90 або 60 мг двічі на добу) порівняно з плацебо на тлі терапії АСК у низьких дозах (Pirlet et al., 2017). Лікування тикагрелором (60 мг) знижувало ризик СС-смерті, ІМ або інсульту на 16%, але збільшувало ймовірність великої кровотечі через 33 міс. спостереження (Bonaca et al., 2015).
Систематичний огляд 11 РКД присвячений частоті летальних випадків, великих крововиливів, ІМ, тромбозів стента та MACE у 33 051 хворого на хронічну ІХС на тлі короткого та тривалого курсу ПАТТ після стентування із DES і вторинної профілактики з приводу ІМ. У пацієнтів, яким встановили стент із DES, за подовженої ПАТT спостерігали зменшення кількості випадків тромбозу стента та ІМ, але збільшення – великих кровотеч (Bittl, 2016). Згідно з рекомендаціями, в осіб із хронічною ІХС, які перенесли ІМ та мають низький ризик кровотечі, для зниження частоти MACE може бути корисним продовження ПАТТ понад 12 міс. на період до 3 років (клас рекомендації 2b, рівень доказовості А) (Udell et al., 2016).
Пацієнтам із хронічною ІХС та перенесеним ІМ без інсульту, транзиторної ішемічної атаки (ТІА) або внутрішньомозкового крововиливу (ВМК) в анамнезі для зменшення ризику MACE до терапії АСК можна додавати ворапаксар (клас рекомендації 2b, рівень доказовості B-R) (Scirica et al., 2012; Bohula et al., 2015).
Застосування цього препарату вивчали в рандомізованому дослідженні TRAP 2P TIMI 50 за участю 26 449 пацієнтів з ІМ, ішемічним інсультом або захворюванням периферичних артерій в анамнезі. Учасники щодня отримували 2,5 мг ворапаксару або плацебо на тлі лікування АСК. За середнього періоду спостереження 3 роки у тих, хто отримував ворапаксар, фіксували нижчу частоту ішемічних подій і летальних випадків від ССЗ, але більшу частоту великих кровотеч і ВМК (Morrow et al., 2012).
За даними систематичного огляду та метааналізу обсерваційних досліджень і РКД (n=20 315), у яких переважали пацієнти зі стабільною ІХС, порівнювали ПАТТ та монотерапію антиагрегантами після невідкладного або планового аортокоронарного шунтування (АКШ). Випадків оклюзії трансплантата підшкірної вени було менше серед тих, хто отримував ПАТТ (Cardoso et al., 2018).
Отже, у хворих на хронічну ІХС застосування ПАТТ після АКШ може бути ефективним для зниження частоти оклюзії трансплантата підшкірної вени (клас рекомендації 2b, рівень доказовості B-R).
Своєю чергою, у пацієнтів із хронічною ІХС без нещодавнього ГКС або показань до ПАТТ, пов’язаних із ЧКВ, додавання клопідогрелю до АСК не є корисним для зниження частоти MACE (клас рекомендації 3: немає переваг, рівень доказовості А) (Bhatt et al., 2006).
Крім того, пацієнтам із хронічною ІХС і перенесеним інсультом, ТІА або ВМК ворапаксар не слід додавати до ПАТТ через підвищений ризик великої кровотечі та ВМК (клас рекомендації 3: завдає шкоди, рівень доказовості А) (Morrow et al., 2012).
Прасугрел не варто застосовувати пацієнтам із хронічною ІХС та інсультом, ТІА чи ВМК в анамнезі через імовірність розвитку великої або фатальної кровотечі (клас рекомендації 3: завдає шкоди, рівень доказовості B-R) (Wiviott et al., 2007). Хворим на хронічну ІХС не рекомендовано призначати хронічні нестероїдні протизапальні препарати через збільшення частоти ССС-ускладнень і кровотеч (клас рекомендації 3: завдає шкоди, рівень доказовості B-R) (Bhala et al., 2013).
Антитромбоцитарна та антикоагулянтна терапія
Дані систематичного огляду і мережевого метааналізу чотирьох РКД за участю 39‑72% осіб зі стабільною ІХС засвідчили, що застосування комбінації пероральних антикоагулянтів (ПОАК), що не є антагоністами вітаміну К, з інгібітором P2Y12-рецепторів асоціювалося з меншою кількістю кровотеч порівняно з агоністами вітаміну К (АВК) і ПАТТ. Припинення застосування АСК порівняно з продовженням сприяло меншій кількості кровотеч, зокрема ВМК, без відмінностей щодо MACE.
Відповідно до рекомендацій, пацієнтам із хронічною ІХС, які перенесли планове ЧКВ і потребують пероральної антикоагулянтної терапії, рекомендовано застосовувати ПАТТ протягом 1‑4 тижнів із прийманням надалі лише клопідогрелю впродовж 6 міс. на додаток до ПОАК (клас рекомендації 1, рівень доказовості B-R) (Lopes et al., 2020).
Хворим на хронічну ІХС після ЧКВ, яким необхідно призначити пероральні антикоагулянти, доцільно продовжувати приймання АСК разом із клопідогрелем упродовж місяця за наявності високого тромботичного ризику і низької ймовірності кровотеч (клас рекомендації 2а, рівень доказовості B-R) (Lopes et al., 2020).
У пацієнтів із хронічною ІХС, які потребують використання пероральних антикоагулянтів і мають низький ризик розвитку атеротромботичного інсульту через рік після ЧКВ, для зменшення ймовірності кровотечі можна розглянути питання про припинення застосування АСК із продовженням приймання лише ПОАК (клас рекомендації 2b, B-R) (Yasuda et al., 2019). Для осіб із хронічною ІХС, яким необхідно призначити пероральні антикоагулянти, можна розглянути монотерапію ПОАК, якщо немає гострих показань для супутньої антитромбоцитарної терапії (клас рекомендації 2b, рівень доказовості C‑LD) (Potpara et al., 2020; Kumbhani et al., 2021).
Своєю чергою, у хворих на хронічну ІХС без показань щодо застосування ПОАК або ПАТT, але зі значною імовірністю повторних ішемічних подій і низьким / помірним ризиком кровотечі, додавання ривароксабану (2,5 мг двічі на добу) до АСК (81 мг/добу) є розумним вибором для тривалого зниження ризику MACE (клас рекомендації 2а, рівень доказовості B-R) (Bhatt et al., 2020; Steffel et al., 2020).
Застосування ПОАК (апіксабану по 5 або 2,5 мг двічі на добу в пацієнтів із двома із трьох критеріїв високого ризику кровотечі, ривароксабану (15 мг/добу), едоксабану (60 мг/добу або 30 мг) у разі кліренсу креатиніну 15‑50 мл/хв, ваги <60 кг або одночасного приймання специфічних потужних інгібіторів Р-глікопротеїну, а також дабігатрану (110 чи 150 мг двічі на добу) та інгібітора P2Y12-рецепторів без АСК може бути найсприятливішим варіантом лікування та антитромботичною терапією для більшості пацієнтів із ФП, які перенесли ЧКВ (Lopes et al., 2019).
У рандомізованому дослідженні AUGUSTUS за участю осіб із ФП, не спричиненою порушенням роботи серцевого клапана, із ризиком тромбозу через нещодавню коронарну подію (як-от серцевий напад або процедура відкриття судин серця), вивчали ефект застосування АСК у низьких дозах (порівняно з плацебо) та апіксабану (порівняно з АВК) на ризик тромбозу стента. За результатами, при застосуванні АСК спостерігали зростання кількості випадків кровотечі вдвічі. Частота тромбозу стента виявилася нижчою в разі застосування АСК порівняно з плацебо та апіксабану проти АВК. У пацієнтів після ЧКВ із високим ризиком тромбозу стента та прийнятним ризиком кровотечі слід розглянути можливість призначення терапії АСК курсом до 30 днів (Lopes et al., 2020).
За даними випробування REDUAL PCI, подвійна терапія дабігатран + інгібітор P2Y12-рецепторів тикагрелор чи клопідогрель у пацієнтів із ГКС після ЧКВ була пов’язана зі зниженням ризику кровотечі порівняно із потрійним лікуванням варфарин + клопідогрель або тикагрелор і АСК незалежно від процедурних чи клінічних чинників ризику (Angiolillo et al., 2021; Alexander et al., 2020).
У багатоцентровому відкритому дослідженні AFIRE2236 пацієнтів із ФП, які перенесли ЧКВ або АКШ понад рік тому або мали хронічну ІХС, рандомізували на групи для отримання ривароксабану або ривароксабан + антиагрегант (70,2% – АСК, 26,8% – інгібітор P2Y12-рецепторів). Первинною кінцевою точкою було поєднання інсульту, системної емболії, ІМ, нестабільної стенокардії, що потребувала реваскуляризації, або смерті з будь-якої причини, а кінцевою точкою безпеки – велика кровотеча. Ривароксабан не поступався комбінованій терапії за ефективністю та переважав за безпекою в осіб із ФП і хронічною ІХС (Lemesle et al., 2017).
До того ж у дослідженні COMPASS порівнювали ефективність і безпеку ривароксабану із/без АСК у низьких дозах щодо зменшення частоти СС-подій у хворих на стабільне АССЗ (Bhatt et al., 2020).
Первинним результатом була СС-смерть, інсульт або ІМ. Дослідження припинили достроково через переконливі переваги ривароксабану й АСК порівняно з монотерапією АСК. Зокрема, оцінювання пацієнтів із високим ризиком (наявність багатосудинної ІХС та принаймні однієї з таких ознак, як ЦД, рецидив ІМ, захворювання периферичних артерій, СН або ХХН) продемонструвала користь комбінованої терапії зі значним зниженням частоти ішемічних подій і смерті від усіх причин. Проте поєднання ривароксабану й АСК асоціювалося з вищим ризиком розвитку великої кровотечі порівняно з монотерапією АСК (Steffel et al., 2020; Eikelboom et al., 2017).
Подвійна антитромбоцитарна терапія та інгібітори протонної помпи
У кількох дослідженнях оцінювали ефективність і безпеку інгібіторів протонної помпи (ІПП) у межах ПАТТ. Метааналіз РКД (n=6930) засвідчив, що застосування ІПП пов’язане зі зниженим ризиком шлунково-кишкової кровотечі в пацієнтів із хронічною ІХС, які отримували ПАТТ після ЧКВ (Guo et al., 2021).
Отже, в осіб із хронічною ІХС, які приймають ПАТТ, використання ІПП може бути ефективним щодо зменшення ймовірності гастроінтестинальної кровотечі (клас рекомендації 2а, рівень доказовості B-R).
Лікування бета-блокаторами
Клінічні ефекти β-блокаторів – зменшення потреби міокарда в кисні, поліпшення ішемічного порогу і запобігання дезадаптивному ремоделюванню ЛШ (Dargie et al., 2001). За даними РКД, пацієнтам із хронічною ІХС і ФВ ЛШ ≤40% із/без перенесеного ІМ для зниження ризику майбутніх MACE, зокрема СС-смерті, рекомендоване застосування β-блокаторів (клас рекомендації 1, рівень доказовості А) (Joo et al., 2021; Poole-Wilson et al., 2003).
Власне, β-блокатори були в центрі уваги багатьох досліджень, у яких вивчали їхню ефективність в осіб із СН та систолічною дисфункцією ЛШ (Domanski et al., 2003; Flather et al., 2005). Так, у низці РКД за участю пацієнтів із систолічною дисфункцією ЛШ спостерігали клінічну користь застосування бісопрололу, карведилолу та метопрололу сукцинату щодо зменшення летальних випадків через ССЗ і MACE (Packer et al., 2002). Відповідно до рекомендацій, в осіб із хронічною ІХС і ФВ ЛШ <50% слід віддавати перевагу метопрололу сукцинату пролонгованої дії, карведилолу або бісопрололу з титруванням до цільових доз порівняно з іншими β-блокаторами (клас рекомендації 1, рівень доказовості А) (Dargie et al., 2001).
У хворих на хронічну ІХС, які розпочали терапію β-блокаторами з приводу ІМ, або за поточної ФВ ЛШ ≤50%, стенокардії, аритмії або неконтрольованої АГ, можливо, доцільно переглянути показання для тривалої (>1 рік) терапії β-блокаторами для зниження частоти MACE (клас рекомендації 2b, рівень доказовості B-NR) (Holt et al., 2021; Park et al., 2021). У пацієнтів із хронічною ІХС без перенесеного ІМ або при ФВ ЛШ ≤50% застосування β-блокаторів є неефективним щодо зменшення MACE без інших основних показань до призначення цих препаратів (клас рекомендації 3: немає переваг, рівень доказовості B-NR) (Dahl Aarvik et al., 2019).
Застосування блокаторів РААС
У хворих зі значною ймовірністю хронічної ІХС зі структурними аномаліями (ФВ ЛШ ≤40%), супутніми захворюваннями (наприклад, ЦД, ХХН, УГ) або і тим, і іншим, спостерігають підвищений ризик розвитку симптоматичної СН і повторних СС-подій. Окрім зниження АТ, блокатори ренін-ангіотензин-альдостеронової системи (РААС) знижують частоту MACE в осіб із високим ризиком хронічної ІХС (Nissen et al., 2004). За даними РКД, застосування блокаторів РААС полегшувало симптоми, зменшувало кількість госпіталізації та/або подовжувало виживаність у пацієнтів із високим ризиком хронічної ІХС (Flather et al., 2000).
Тож пацієнтам із хронічною ІХС, які також мають АГ, ЦД, ФВ ЛШ ≤40% або ХХН, для зменшення кількості СС-подій у разі непереносимості іАПФ рекомендовано застосовувати іАПФ або БРА (клас рекомендації 1, рівень доказовості А) (Kоber et al., 1995).
Крім того, в осіб із хронічною ІХС без АГ, ЦД або ХХН і ФВ ЛШ >40% можна розглянути призначення іАПФ чи БРА для зниження частоти СС-ускладнень (клас рекомендації 2b, рівень доказовості B-R) (Bosch et al., 2021; Bangalore et al., 2017).
Приймання колхіцину
Запалення є ключовим компонентом у розвитку атеросклерозу. Приймання певних протизапальних засобів може сприяти поліпшенню СС-результатів. У пацієнтів із хронічною ІХС доцільно розглянути додавання колхіцину в межах вторинної профілактики, щоб знизити частоту рецидивів АССЗ (клас рекомендації 2b, рівень доказовості B-R) (Nidorf et al., 2020).
Полегшення симптомів стенокардії
Медикаментозна антиангінальна терапія в пацієнтів із хронічною ІХС має два загальні механізми дії: зменшення потреби міокарда в кисні або збільшення артеріального кровопостачання міокарда.
Основною метою такого лікування є максимальне полегшення симптомів без загострення супутніх захворювань та взаємодії з іншими препаратами, при цьому важливою є хороша переносимість (Ohman, 2016).
Пацієнтам із хронічною ІХС та стенокардією для зменшення симптомів стенокардії або еквівалентних симптомів рекомендовано антиангінальну терапію β-блокаторами, БКК або нітратами тривалої дії (клас рекомендації 1, рівень доказовості B-R) (Heidenreich et al., 1999).
Хворим, у яких симптоми зберігаються, попри початкове лікування, для полегшення стенокардії або еквівалентних симптомів доцільно додатково призначати другий антиангінальний препарат іншого класу (як-от β-блокатори, БКК, нітрати тривалої дії) (клас рекомендації 1, рівень доказовості B-R) (Ferrari et al., 2019).
Зокрема, ранолазин слід призначати пацієнтам із хронічною ІХС, у яких симптоми залишаються, попри лікування β-блокаторами, БКК або нітратами тривалої дії (клас рекомендації 1, рівень доказовості B-R) (Chaitman et al., 2004; Stone et al., 2006). Нітрогліцерин сублінгвально або у вигляді спрею застосовують у хворих на хронічну ІХС для негайного короткочасного зменшення симптомів стенокардії або еквівалентних симптомів (клас рекомендації 1, рівень доказовості B-NR) (Ohman, 2016).
Своєю чергою, в осіб із хронічною ІХС і нормальною функцією ЛШ додавання івабрадину до стандартної антиангінальної терапії є потенційно шкідливим (клас рекомендації 3: завдає шкоди, рівень доказовості B-R) (Fox et al., 2014).
У пацієнтів із хронічною ІХС та рефрактерною стенокардією, якщо немає інших варіантів лікування для зменшення симптомів, можна розглянути застосування посиленої зовнішньої контрпульсації (клас рекомендації 2b, рівень доказовості B-R) (Arora et al., 1999).
Реваскуляризація
Мета втручання
Реваскуляризація сприяє ефективнішому зменшенню симптомів та поліпшенню якості життя пацієнтів із хронічною ІХС та стабільною стенокардією, ніж лише медикаментозне лікування (Maron et al., 2020; Navarese et al., 2021). Хворим на хронічну ІХС та стенокардію, що обмежує повсякденну діяльність, попри оптимальну терапію, а також зі значним стенозом КА для зменшення симптомів рекомендовано реваскуляризацію (клас рекомендації 1, рівень доказовості А) (Al-Lamee et al., 2019). В осіб із хронічною ІХС та значною оклюзією лівої головної КА або багатосудинним ураженням із тяжкою дисфункцією ЛШ (ФВ ЛШ ≤35%) для поліпшення виживаності на додаток до фармакотерапії слід виконати АКШ (клас рекомендації 1, рівень доказовості B-R) (Velazquez et al., 2016).
У хворих на хронічну ІХС, які страждають на багатосудинне захворювання з тяжкою дисфункцією ЛШ, застосування АКШ разом з оптимальним медикаментозним лікуванням має середню економічну цінність порівняно з лише фармакотерапією (економічна цінність: середня, рівень доказовості B-NR) (Chew et al., 2022).
У пацієнтів із хронічною ІХС та множинним ураженням коронарних судин, яким показане АКШ або ЧКВ, реваскуляризація на додаток до оптимальної терапії є доцільною для зниження ризику СС-подій, як-от спонтанний ІМ, незапланована термінова реваскуляризація або кардіальна смерть (клас рекомендації 2а, рівень доказовості B-R) (Chaitman et al., 2021; Laukkanen et al., 2021).
В окремої категорії хворих на хронічну ІХС зі значним стенозом стовбура лівої КА для поліпшення виживаності можна розглянути ЧКВ, що допоможе забезпечити реваскуляризацію, еквівалентну такій за АКШ (клас рекомендації 2а, рівень доказовості B-NR) (Bittl et al., 2013).
У пацієнтів із хронічною ІХС та стенокардією або еквівалентними симптомами, які не проходили обстеження з приводу ішемії та мають ангіографічно підтверджений проміжний коронарний стеноз, перед початком ЧКВ рекомендовано визначити фракційний резерв кровотоку (FFR) або виконати інші валідовані негіперемічні тести (наприклад, iFR) (клас рекомендації 1, рівень доказовості А) (Davies et al., 2017).
Зокрема, в осіб із хронічною ІХС, яким виконують коронарографію без попереднього навантажувального тестування, інвазивна оцінка FFR для ангіографічного визначення проміжних коронарних стенозів перед ЧКВ має високу економічну цінність (економічна цінність: висока, рівень доказовості B-NR) (Fearon et al., 2018).
Переваги черезшкірного коронарного втручання та аортокоронарного шунтування
Наявні значущі відмінності між тим, яким як АКШ та ЧКВ чинять вплив на відновлення кровотоку в ішемізованій зоні міокарда (Doenst et al., 2019). Пацієнтам із хронічною ІХС, які потребують виконання реваскуляризації через значне ураження стовбура лівої КА, пов’язане з тяжкою ІХС, для поліпшення виживаності рекомендовано АКШ на відміну від ЧКВ (клас рекомендації 1, рівень доказовості B-R) (Morice et al., 2014).
У хворих на хронічну ІХС, яким необхідно виконати реваскуляризацію з приводу багатосудинного ураження коронарних судин за тяжкої / дифузної ІХС, для поліпшення виживаності розумним вибором є АКШ замість ЧКВ (клас рекомендації 2а, рівень доказовості B-R) (Fearon et al., 2022; Thuijs et al., 2019).
Для осіб із хронічною ІХС, які є кандидатами для виконання реваскуляризації, але не хірургічного втручання, доцільно вибрати ЧКВ замість АКШ, щоб зменшити симптоми та ризик MACE (клас рекомендації 2а, рівень доказовості B-NR) (Ono et al., 2022).
Для пацієнтів із хронічною ІХС, ЦД та багатосудинним ураженням коронарних судин із залученням лівої передньої низхідної артерії для зниження смертності та частоти повторної реваскуляризації (в разі можливості виконання) рекомендовано АКШ порівняно із ЧКВ (клас рекомендації 1, рівень доказовості А) (Farkouh et al., 2019). У хворих на хронічну ІХС низького або помірного ступеня тяжкості та ЦД зі стенозом стовбура лівої КА із метою зменшення кількості MACE як альтернативу АКШ можна розглянути ЧКВ (клас рекомендації 2b, рівень доказовості B-R) (Milojevic et al., 2019).
Класи рекомендацій та рівні доказовості при оцінюванні клінічних стратегій, терапевтичних втручань і методів або діагностичних інструментів, що лежать в основі настанови*
Клас (сила) рекомендації
- клас 1 (сильна) – переваги >>> ризики
- клас 2а (помірна) – переваги >> ризики
- клас 2b (слабка) – переваги ≥ ризики
- клас 3 – переваг немає (помірна) – переваги = ризики
- клас 3 – завдає шкоди (сильна) – ризики > переваги
Рівень (якість) доказів
Рівень А
- докази високої якості з >1 РКД
- метааналіз високоякісних РКД
- ≥1 РКД, підкріплене даними якісних досліджень реєстрів
Рівень B-R (рандомізовані)
- докази помірної якості з ≥1 РКД
- метааналіз РКД помірної якості
Рівень B-NR (нерандомізовані)
- докази помірної якості з ≥1 добре спланованих, якісно виконаних нерандомізованих, обсерваційних досліджень або досліджень реєстрів
- метааналіз таких досліджень
Рівень C‑LD (обмежені дані)
- рандомізовані або нерандомізовані обсерваційні дослідження чи дослідження реєстрів з обмеженнями у дизайні або при проведенні
- метааналіз таких досліджень
- фізіологічні або механістичні дослідження за участю людей
Рівень C-EO (експертна думка)
- консенсусні експертні висновки на підставі клінічного досвіду
Примітка: РКД – рандомізовані контрольовані дослідження.
* Відповідно до методології ACC/AHA, для оцінювання значущості певних рекомендацій введено поняття їхньої «економічної цінності» у клінічній практиці. Економічну цінність рекомендацій визначали як «високу», «середню», «низьку», «невизначену» та «неоцінену».
Підготувала Олена Коробка
Оригінальний текст документа читайте на сайті www.jacc.org