30 жовтня, 2024
Хвороба Гоше. Клінічна настанова, заснована на доказах. Продовження
Ч. І. Ч. ІІ
Продовження клінічної настанови, що є клінічними рекомендаціями щодо надання медичної допомоги пацієнтам із Хворобою Гоше (ХГ) і ґрунтується на даних доказової медицини стосовно ефективності і безпеки медичних втручань, фармакотерапії та організаційних принципів її надання.
Guidelines for the treatment of Gaucher disease through the Life Saving Drugs Program, Department of Health and Aged Care, Australiа (2020)
Інфузії в домашніх умовах
Якщо пацієнт бажає, здійснення інфузій іміглюцерази, велаглюцерази і таліглюцерази прийнятне в домашніх умовах, пацієнт має одержати не менш ніж 3 інфузії під час перебування в госпіталі та бути клінічно стабільним за оцінкою лікуючого лікаря, що передбачає, що будь-яка реакція, асоційована з інфузією, добре контрольована.
Коментар робочої групи. На момент розробки цієї клінічної настанови в Україні ФЗТ в домашніх умовах не проводять, хоча, з огляду на пандемію COVID‑19 і військовий стан, такий підхід був би доцільним за умови дотримання всіх правил проведення внутрішньовенних інфузій та контролю медичними працівниками можливих побічних реакцій.
Intravenous enzyme replacement therapy (ERT) for Gaucher disease. UnitedHealthcare Oxford Clinical Policy (2022)
Для тривалої ФЗТ в дітей і дорослих із ХГ І типу показані іміглюцераза, велаглюцераза альфа і таліглюзераза альфа.
Hughes та співавт. (2015) опублікували результати довгострокового розширеного дослідження ІІІ фази лікування пацієнтів із ХГ І типу велаглюцеразою альфа. У дослідженні взяли участь 57 пацієнтів (25 із них із TKT032 trial і 32 – із HGT-GCB‑039 trial) віком від 3 до 62 років. Усі учасники перші три інфузії отримали в місці проведення клінічного випробовування. Наступні інфузії пацієнти отримували в альтернативних місцях лікування, за напрямом дослідника, у разі відсутності в них побічних реакцій.
Усі пацієнти отримували велаглюцеразу альфа кожен 2-й тиждень внутрішньовенно протягом 1,2-4,8 року в дозі 60 Од/кг (деякі пацієнти потребували зниження дози під час продовження випробування). Із 57 учасників 19 закінчили випробування. Інші пацієнти (34) припинили клінічне випробування за рішенням спонсора. Майже в усіх пацієнтів упродовж випробування спостерігали побічні реакції. У 16 з 57 пацієнтів побічні реакції, імовірно, були пов’язані з лікуванням. Із 56 пацієнтів із побічними реакціями тільки 1 пацієнт скаржився на високий тиск і головний біль, пов’язаний з інфузією. Шість учасників мали побічні реакції, асоційовані з інфузією. Було зареєстровано 19 серйозних побічних реакцій, у тому числі спонтанний аборт у першому триместрі (пацієнтка мала викидні в анамнезі та антифосфоліпідний синдром) та 1 смертельний випадок після судом. Жодних серйозних побічних реакцій не пов’язували з лікуванням. В 1 пацієнта були виявлені IgG-антитіла до велаглюцерази альфа.
Середнє збільшення концентрації гемоглобіну становило 2,75 г/дл (26%) у загальній групі велаглюцерази альфа, показник збільшення кількості тромбоцитів у середньому становив 120%. У 64% учасників спостерігали зменшення об’єму селезінки та у 27% – зменшення об’єму печінки. За результатами дослідження ефективності показників виявлено, що стан хворих поліпшився у перші 24 міс та в подальшому залишався стабільним. Автори дійшли висновку, що велаглюцераза альфа є безпечною і добре переноситься.
Проведено мультинаціональне дослідження фази ІІІ для оцінки ефективності та безпеки застосування різних доз велаглюцерази альфа в пацієнтів із ХГ, які отримували: внутрішньовенну інфузію велаглюцерази альфа в дозі 60 Од/кг (n=12) або 45 Од/кг (n=13) через тиждень протягом 12 міс [8]. Первинною кінцевою точкою була зміна концентрації гемоглобіну від базового рівня в разі застосування дози 60 Од/кг. Через 12 міс середня концентрація гемоглобіну збільшилася від початкового рівня (60 Од/кг: +23,3%; +2,43 г/дл; p<0,001; 45 Од/кг: +23,8%; +2,44 г/дл; р<0,001), як і середня кількість тромбоцитів (60 Од/кг: +65,9%; +50,9 × 109/л; р=0,002; 45 Од/кг: +66,4%; +40,9 × 109/л; р=0,01). Середній об’єм селезінки зменшився від початкового рівня (60 Од/кг: -50,4%, з 14,0 до 5,8 MN; р=0,003; 45 Од/кг: -39,9%, від 14,5 до 9,5 МN; р=0,009). Не було виявлено жодних серйозних побічних реакцій. На підставі цього дослідження доведено, що велаглюцераза альфа, як правило, добре переноситься та ефективна в дорослих і дітей із ХГ І типу. Усі вимірювані параметри клінічно значуще поліпшилися через 12 місяців.
Ефективність ФЗТ в дітей із ХГ І і ІІ типів визначали у тривалому когортному дослідженні, яке охоплювало проспективні і ретроспективні клінічні дані [16]. Дослідники оцінювали ефективність лікування за віком і генотипом, використовуючи узагальнені лінійні змішані моделі. У цьому дослідженні взяли участь діти (n=25) віком від 1,1 до 15,6 року з ХГ (14 дітей із ХГ І типу та 11 – із ХГ ІІІ типу), які відвідували спеціалізований лікувальний центр в Англії. Загалом 24 пацієнти отримували ФЗТ (середня тривалість лікування становила 5,57 року, діапазон – від 0 до 13,7 року). Діти, які отримували лікування, надавали дані до та під час лікування, а дитина, яка не отримувала лікування, надавала анамнестичні дані. Для відображення прогресування захворювання обрали такі клінічні показники, як кількість тромбоцитів, вміст гемоглобіну та відсутність/наявність болю в кістках. Дослідники виявили, що тривалість ФЗТ була пов’язана зі статистично значущим поліпшенням кількості тромбоцитів (р<0,001), рівня гемоглобіну (р<0,001) і наявністю болю в кістках (р=0,02). Вони зазначали, що величина впливу на гематологічні параметри була більшою в дітей із ХГ ІІІ типу проти дітей із ХГ І типу.
Зміна терапії з іміглюцерази на велаглюцеразу альфа
Pastores та співавт. (2014) провели мультицентрове відкрите випробування, яке оцінювало безпеку велаглюцерази альфа в пацієнтів із ХГ І типу (n=211); 6 пацієнтів раніше не отримували лікування, 205 – отримували іміглюцеразу. Неліковані учасники отримували внутрішньовенно велаглюцеразу альфа кожні 2 тиж в дозі 60 Од/кг; пацієнти, які раніше застосовували іміглюцеразу, отримували велаглюцеразу альфа в дозі 15-60 Од/кг [7]. Дані про безпеку оцінювали за допомогою фізичного огляду, моніторингу життєво важливих ознак, клінічно-лабораторної оцінки (гематологія та клінічна хімія), визначення антитіл до велаглюцерази альфа і моніторингу побічних ефектів.
Побічні реакції, які вважали пов’язаними з досліджуваним препаратом, спостерігали в 35 (17,1%) осіб із 205 пацієнтів групи іміглюцерази, і в 1 людини з 6 нелікованих осіб. Найпоширенішими побічними ефектами були головний біль, назофарингіт, нудота і втома. Побічні реакції, пов’язані з інфузією, зареєстрували у 28 (13,3%) з 211 пацієнтів, зазвичай – протягом перших трьох інфузій. Нейтралізуючі антитіла проти велаглюцерази альфа de novo з'явилися під час лікування в 1 (<1,0%) пацієнта, який раніше отримував ФЗТ, і не виявлялися в жодного з пацієнтів, які не отримували лікування. Дослідники дійшли висновку, що наведені дані підтверджують безпеку застосування велаглюцерази альфа в дозі 60 Од/кг кожні 2 тиж у пацієнтів із ХГ І типу, які раніше не отримували ФЗТ, і безпеку переходу від іміглюцерази до велаглюцерази альфа в тій самій дозі. Безпека велаглюцерази альфа спостерігається в широкому діапазоні вікових груп пацієнтів та узгоджується з даними попередніх контрольних випробувань.
У багатоцентровому відкритому дослідженні, яке тривало 12 міс, вивчали безпеку й ефективність велаглюцерази альфа в пацієнтів із ХГ І типу (n=40; вік ≥2 роки), які раніше отримували терапію іміглюцеразою та перебували в стабільному стані [9]. Пацієнтів було переведено на лікування велаглюцеразою альфа в дозі, що дорівнювала їх попередній дозі іміглюцерази. Велаглюцеразу альфа вводили протягом однієї години кожні 2 тижні. Як правило, лікування добре переносилося, побічні реакції були легкої або середньої тяжкості. Концентрація гемоглобіну, кількість тромбоцитів та об’єм селезінки і печінки залишалися стабільними протягом 12 місяців. На думку дослідників, дорослі й діти з ХГ І типу можуть бути успішно переведені з терапії іміглюцеразою на терапію велаглюцеразою альфа.
У недавньому документі описані ефекти переходу на велаглюцеразу альфа в групі дорослих пацієнтів із ХГ І типу, що раніше отримували знижену дозу іміглюцерази внаслідок її дефіциту [9]. Тридцять два пацієнти з двох великих європейських Гоше-центрів перейшли на лікування велаглюцеразою альфа після лікування зменшеною дозою іміглюцерази впродовж від 1 до 8,5 місяця. Динаміку важливих симптомів ХГ досліджували 4 рази: за рік до дефіциту, незадовго до дефіциту, перед переходом на велаглюцеразу альфа і після одного року застосування велаглюцерази альфа. Це такі симптоми, як концентрація гемоглобіну, кількість тромбоцитів, активність хітотріозидази у плазмі всіх пацієнтів та об’єм селезінки й печінки (а також фракція жиру кісткового мозку) у 10 хворих. Зменшення кількості тромбоцитів у результаті зменшення дози іміглюцерази було швидко відновлено при лікуванні велаглюцеразою альфа. Активність хітотріозидази загалом знизилася після зміни препарату. П’ятеро з 10 пацієнтів мали збільшений об’єм печінки щонайменше на 10% після 6 міс лікування велаглюцеразою альфа, що було зворотним у 3 пацієнтів. Більшість пацієнтів отримували інфузію вдома, при цьому жодних побічних реакцій не спостерігали. Велаглюцераза альфа є безпечною та ефективною альтернативою іміглюцерази.
Коментар робочої групи. У подвійному сліпому рандомізованому багатоцентровому дослідженні (Ari Zimran et al., 2015) безпеки та ефективності застосування двох різних доз препарату таліглюцераза альфа (30 Од/кг і 60 Од/кг) у пацієнтів дитячого віку було продемонстровано поліпшення в обох групах основних показників патологічних проявів ХГ, у тому числі органомегалії та гематологічних розладів, порівняно з вихідним рівнем після 12 міс лікування. Також спостерігали збільшення зросту, ваги та кісткового віку паралельно з поліпшенням пов’язаних із захворюванням біомаркерів – активністю хітотріозидази та CCL18.
Детальніше з дослідженням можна ознайомитися за посиланням: https://www.sciencedirect.com/science/article/pii/S1079979614001193?via%3Dih ub.
У дослідженні (Gregory M. Pastores et al., 2014) безпеки та ефективності переходу на таліглюцеразу альфа в дорослих і педіатричних пацієнтів із ХГ, які отримували іміглюцеразу принаймні впродовж останніх 2 років, жодних серйозних небажаних явищ виявлено не було, стан пацієнтів за основними параметрами захворювання залишався клінічно стабільним.
Детальніше з дослідженням можна ознайомитись за посиланням: https://www.sciencedirect.com/science/article/abs/pii/S1079979614000552
Guidelines for the treatment of Gaucher disease through the Life Saving Drugs Program, Department of Health and Aged Care, Australiа (2020)
Вибір лікування
Лікар-практик може пропонувати найбільш відповідні препарати для лікування пацієнта.
Усі пацієнти, які починають застосовувати лікарський засіб (ЛЗ) або перейшли на інший ЛЗ за державною програмою, мають продовжувати застосовувати той самий ЛЗ упродовж щонайменше 12 міс, поки не виникнуть клінічні ознаки тривалого клінічного погіршення або значних побічних реакцій.
Коментар робочої групи. Вважаємо, що іміглюцераза, велаглюцераза альфа і таліглюзераза альфа можна застосовувати для тривалої ФЗТ у дітей і дорослих із ХГ І типу. Заміна одного препарату на інший при проведенні ФЗТ є недоцільною в разі досягнення терапевтичних цілей за умови адекватного дозування та відсутності побічних реакцій.
Лікування гострого кісткового кризу
Кісткові кризи можуть спричиняти сильний біль, який триває протягом декількох тижнів та часто є стійким до інтенсивної терапії наркотичними препаратами. Діагноз встановлюють на основі даних МРТ [16] або сканування кісток із технецієм [41]. Застосування високих доз перорального преднізолону (1 г/м2) протягом 2 днів із подальшим зменшенням дози препарату допомагає полегшити біль протягом декількох годин [14]; така терапія не має довгострокових побічних ефектів [16]. Для лікування неспецифічного болю можна призначати нестероїдні протизапальні препарати. Під час гострого кризу рентгенограми зазвичай є неінформативними, але через декілька тижнів на них можуть спостерігатися періостальні реакції.
Коментар робочої групи. Через обмеженість ресурсного забезпечення сканування кісток із технецієм в Україні не проводять.
Лікування пацієнтів із нейропатичною формою захворювання
Мanagement of neuronopathic Gaucher disease: Revised recommendations. A. Vllodi, A. Tylki-Szymanska, E. H. Davies, E. Kolodny, B. Bembi, T.Collin-Histed, E. Mengel, A. Erikson, R. Schiffmann (2009)
Нейропатичні форми є найбільш рідкісними варіантами ХГ, згідно з оцінками їх частота становить <1 на 100 тис живих новонароджених. Нейропатичні форми, подібно до інших варіантів ХГ, є панетнічними, хоча особливо високу поширеність ураження нервової системи в пацієнтів із ХГ було задокументовано в Північній Швеції, у Польщі та серед арабської популяції Джаніну.
При веденні пацієнтів із нейропатичною ХГ (НХГ) виникають значні труднощі. Особливо неясною залишається роль ФЗТ. У 2001 р. Європейською робочою групою з вивчення хвороби Гоше (EWGGD) була сформована Спеціальна група з вивчення НХГ, метою якої була розробка рекомендації з ведення таких пацієнтів. Відповідні рекомендації були розроблені та опубліковані.
З часом стало зрозуміло, що потрібно переглянути дані, отримані в Європі та інших частинах світу, і в разі необхідності оновити рекомендації. Після літературного пошуку було виявлено три дослідження, проведені з 2001 року, у рамках яких вивчали ефект ФЗТ на прогресування неврологічних проявів захворювання. Спеціальний акцент був зроблений на ефективність ФЗТ у високих дозах щодо прогресування неврологічних проявів захворювання. Як правило, високою прийнято вважати дозу ≥120 Од/кг кожні 2 тижні. Goker-Alpan та співавт. провели дослідження (n=32), за результатами якого не було виявлено будь-якого ефекту ФЗТ на прогресування неврологічних проявів захворювання. Проте тільки 2 пацієнти отримували терапію в дозі 120 Од/кг на 2 тижні. Erikson та співавт. повідомили про результати застосування ФЗТ у 8 пацієнтів із Норботтена. Жоден із цих пацієнтів не отримував ФЗТ у високій дозі.
Davies та співавт. повідомили про результати спостереження за 55 пацієнтами. Більшість із них були з мутацією гена L444P. Усі вони отримували ФЗТ, але при цьому спостерігалася суттєва варіабельність у дозуванні ФЗТ, а також нерівномірний розподіл факторів ризику. Так, найстарші пацієнти отримували терапію в найнижчій дозі, а в декількох пацієнтів була проведена тотальна спленектомія. Водночас у наймолодших пацієнтів зазначалася висока частка гетерозиготності, вони отримували терапію у високих дозах, і в дуже малої кількості була проведена спленектомія. Така гетерогенність значною мірою утруднювала аналіз. Утім проведення деяких обстежень було можливим. Стан у пацієнтів старшого віку залишався відносно стабільним, незважаючи на традиційну дозу ФЗТ (60 Од/кг на 2 тиж). Як правило, у старших/дорослих пацієнтів захворювання було легким, чим можна пояснити цей «стабільний» статус. У молодших пацієнтів не було виявлено чіткого впливу ФЗТ у високих дозах на неврологічні наслідки захворювання. У будь-якому разі період спостереження в багатьох пацієнтів був занадто коротким, щоб робити належні висновки.
На підставі доступних даних висновок для цієї групи був таким: немає доказових даних, які б свідчили про те, що ФЗТ у високих дозах запобігає прогресуванню неврологічних проявів захворювання або сповільнює його. Отже, рекомендації стосовно дозування ФЗТ мають бути переглянуті.
Водночас це могло б стати гарною можливістю переглянути і, у разі необхідності, оновити інші рекомендації з ведення пацієнтів.
На панелі 3 подано рекомендації з лікування НХГ, розроблені Спеціальною групою на підставі таких доказових даних:
- При ХГ як ненейропатичної, так і нейропатичної форми ФЗТ продемонструвала відмінний профіль безпеки.
- Існують чіткі доказові дані про те, що в більшості пацієнтів ФЗТ сприяє полегшенню системних проявів захворювання (таких як порушення структури скелета, вісцеромегалія, відхилення від норми з боку системи крові) при ненейропатичній формі захворювання, а також при хронічній НХГ, поліпшуючи при цьому якість життя.
- Немає доказових даних, які свідчили б про те, що ФЗТ сприяє регресії, стабілізації або сповільненню прогресування неврологічних порушень.
- У пацієнтів зі встановленою гострою формою НХГ ефект ФЗТ на прогресування захворювання є незначним. Вона лише призводить до подовження болю та страждання.
- Є доказові дані, що при хронічній НХГ тотальна спленектомія асоціюється з поглибленням тяжкості захворювання та прогресуванням неврологічних порушень і уражень кісток і/або ризиком виникнення інфекції та можливим зниженням відповіді на ФЗТ. З огляду на це, тотальної спленектомії потрібно уникати, наскільки це можливо. Утім у поодиноких випадках вона може бути необхідною для поліпшення відповіді на терапію. У такому разі ми рекомендуємо часткову спленектомію замість тотальної [2].
Панель 3
Рекомендації щодо лікування
• Сьогодні лікуванням вибору є ФЗТ рекомбінантною людською глюкоцереброзидазою, націленою на макрофаги (препарат Церезим виробництва компанії «Джензайм Корпорейшн», м. Кембридж, штат Массачусетс, США).
• У дітей із хронічною формою НХГ ФЗТ має бути розпочата якнайшвидше після встановлення діагнозу в стартовій дозі 60 Од/кг кожні 2 тижні.
• Час від часу може виникати необхідність у підвищенні дози з метою контролю вісцеральних проявів хвороби, наприклад у разі прогресування гепатоспленомегалії, загострення захворювання легень або за наявності системних симптомів неясного генезу, таких як загальне нездужання або підвищена дратівливість, що супроводжуються значними змінами рівнів біомаркерів, зокрема хітотріозидази. Водночас доза не має бути нижче 60 Од/кг на 2 тижні.
• У дорослих пацієнтів доза 30-60 Од/кг на 2 тиж має бути достатньою, оскільки при застосуванні такої дози було продемонстровано стабільність стану внутрішніх органів.
• ФЗТ не може бути рекомендована в пацієнтів із гострою формою НХГ. Лікування таких дітей має бути як при тяжкому швидко прогресуючому неврологічному захворюванні в немовлят і дітей раннього віку. Крім того, відповідним чином мають лікуватися порушення, характерні для ураження стовбура головного мозку, зокрема тяжкий ларингоспазм, порушення функції ковтання і дихання. Ми усвідомлюємо, що це важливе питання, проте детального опису такого лікування в цій статті не передбачено. У разі «проміжної» форми лікування можна випробовувати, якщо немає чітких даних про те, що це є швидко прогресуюче неврологічне захворювання. Утім, щойно з’являються відповідні доказові дані, таке лікування потрібно припинити.
• Лікування дорослих пацієнтів також є критичним. У таких пацієнтів спостерігають тенденцію не лише до значного ураження внутрішніх органів, а й до виникнення проблем, асоційованих із хронічною прогресивною неврологічною дисфункцією. Проте і ця тема, хоч і є важливою, але в цій статті не розглядається.
• Спленектомія є протипоказаною, за винятком невідкладних станів, наприклад при розриві селезінки або тяжкій тромбоцитопенії, що потребує трансфузії тромбоцитарної маси або може призвести до загрозливої для життя внутрішньої кровотечі. У таких випадках потрібно розглянути можливість проведення часткової, а не тотальної, спленектомії. Усі такі пацієнти мають отримувати лікування, яке б вони отримували після тотальної спленектомії, наприклад уведення вакцини для профілактики пневмококової інфекції, профілактичне застосування пеніциліну. Спленектомія збільшеної, але функціонально неспроможної селезінки показана в рідкісних випадках, коли системне захворювання не відповідає на ФЗТ у високих дозах і коли всі інші можливі причини резистентності до ФЗТ виключені.
Цілі терапії та стабілізація в умовах лікування
The Belgian Working Group on Gaucher Diseas, Guidelines for diagnosis, treatment and monitoring of Gaucher’s disease (2016)
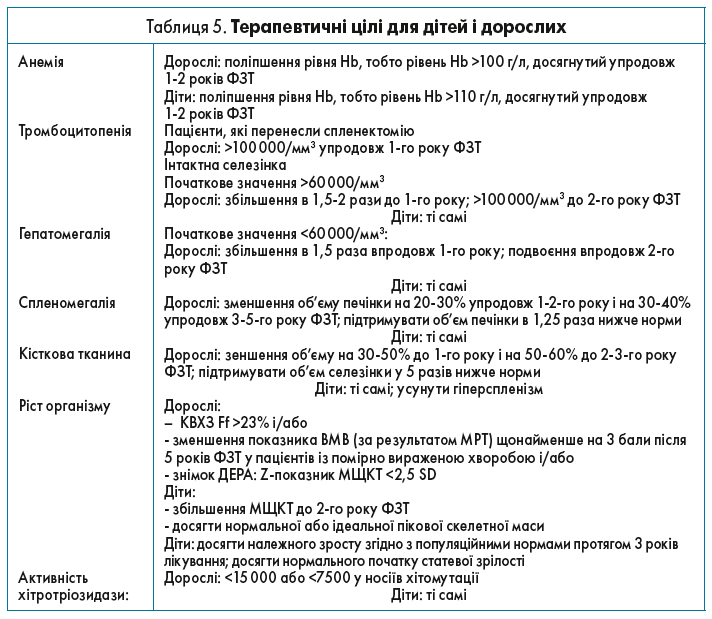
Лікування ХГ має чітко описані в кількох керівництвах терапевтичні цілі. Були розглянуті різні настанови, які стали основою терапевтичних цілей, описаних нижче (табл. 5, 6).
Моніторинг прогресування захворювання та ефективності лікування
Revised recommendations for the management of Gaucher disease in children. European Journal of Pediatrics (2013)
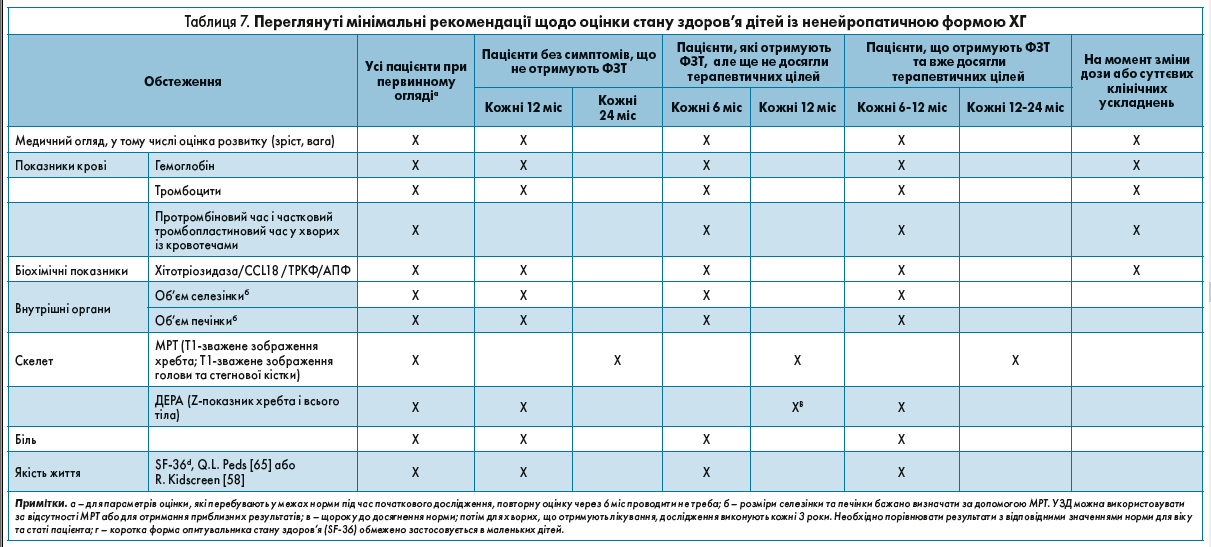
У таблиці 7 наведено рекомендовані початкові та контрольні методи дослідження пацієнтів, які отримують і які не отримують лікування.
Моніторинг дітей із симптомами захворювання
На момент встановлення діагнозу та в подальшому кожні 6 міс необхідно виконувати медичний огляд і досліджувати гематологічні показники хворого.
Після досягнення терапевтичних цілей кількість і частоту проведення лабораторних тестів можна зменшити, але медичний огляд і вивчення анамнезу треба продовжувати виконувати раз на пів року.
Дослідження внутрішніх органів
У дітей із симптомами захворювання кожні 12-24 міс, залежно від тяжкості органомегалії, необхідно виконувату об’ємну МРТ. Після досягнення нормальних/стабільних розмірів органів МРТ можна проводити рідше. Об’ємні показники представляють у вигляді множини нормальних розмірів, розрахованих для певної маси тіла. У дітей молодшого віку проведення МРТ зазвичай потребує виконання пероральної або внутрішньовенної седації. Ураховуючи дозу опромінення, КТ більше не застосовують для рутинного моніторингу стану здоров’я хворих. Через недостатню чутливість УЗД також не рекомендується до використання; виняток становить недоступність МРТ. Дані УЗД не треба враховувати під час прийняття рішень щодо зміни дози препарату, оскільки навіть досвідчений лікар-рентгенолог може лише приблизно оцінити розміри органа. Ручне вимірювання в сантиметрах відстані нижче реберної дуги також не дає точних результатів.
Оцінка стану кісток скелета
Патологія кісток може спричинити виражені клінічні прояви захворювання та призвести до довгострокової інвалідності хворого. Ступінь кісткової патології не завжди корелює зі збільшенням селезінки/печінки, анемією чи тромбоцитопенією. Таким чином, обстеження скелета є обов’язковим незалежно від залучення в патологічний процес інших систем організму. Діти та підлітки віком 10-20 років, які не отримують лікування, мають тяжче ураження кісток та меншу щільність кісткової тканини проти дітей молодшого віку, що відображає прогресуючий характер нелікованої в дитинстві хвороби. Хоча остеонекроз, остеопенію і/або кісткові кризи спостерігають не в усіх дітей, ці прояви хвороби можуть мати серйозні довгострокові наслідки, такі як компресія суглобів, переломи і хронічний біль. Спленектомія, яку широко застосовували до появи ФЗТ, має побічний ефект – погіршення кісткової патології через більше накопичення макрофагів, хемокінів і цитокінів.
Оцінка та моніторинг впливу скелетної патології мають бути комплексними, лікар мусить регулярно відстежувати можливі кісткові кризи і кістковий біль. Під час медичного огляду оцінюють зріст дитини, діапазон рухів у суглобах, сколіоз і кісткові деформації. МЩКТ потрібно вимірювати за допомогою ДЕРА всього тіла, поперекового відділу хребта і/або кульшових суглобів. У дітей МЩКТ має бути виражена у Z-показниках згідно з віком і статтю пацієнта, що потребує наявності відповідного програмного забезпечення для аналізу даних.
Загалом рентгенівські промені недостатньо чутливі для проведення моніторингу прогресування хвороби, зміни відображаються занадто пізно. До того ж при регулярному застосуванні пацієнт отримує надмірну дозу іонізуючого випромінювання.
МРТ є найбільш поширеним і прийнятним методом для відстеження патології кісткової тканини та кісткового мозку в пацієнтів із ХГ.
У дуже маленьких дітей дослідження можна проводити під седацією. МРТ хребта і стегнової кістки (золотий стандарт) надає інформацію про аномальне ремоделювання, інфільтрацію кісткового мозку, остеонекроз та остеосклероз. Щоб виявити відхилення від норми, інтерпретація МРТ дитячого віку потребує знань про перетворення гемопоетичного (червоного) кісткового мозку у стегновій кістці на жировий (жовтий). Інфільтрацію жовтого кісткового мозку клітинами Гоше можна спостерігати за допомогою методу візуалізації кількісного хімічного зсуву Діксона (Dixon-QCSI), спеціалізованої техніки МРТ; утім для дітей нормативні показники не визначені, а зазначена методика недоступна в більшості медичних закладів. Тяжкість патології кісткового мозку, встановлену на основі даних МРТ, виражають за допомогою напівкількісної бальної системи.
Швидкість росту хворих (зріст і вага), які отримують лікування, потрібно оцінювати кожні 6 місяців. У таких пацієнтів виконують початкову МРТ (на момент встановлення діагнозу), потім дослідження повторюють кожні 12 міс, а також щоразу при зміні дози препарату. ДЕРА у дітей, що проходять терапію, необхідно проводити під час початкового обстеження і далі кожні 12-24 міс – до нормалізації показників або за необхідності корегування дози; потім ДЕРА виконують кожні 3 роки (бажано в одному медичному центрі з використанням одного апарату).
Моніторинг стану здоров’я дітей з асимптомним перебігом ХГ
Як і у випадку з дітьми, що мають симптоми хвороби, моніторинг стану здоров’я асимптомних дітей, які були виявлені через наявність хвороби в рідних братів чи сестер, треба проводити кожні 6 місяців. Оскільки хворі сибси зазвичай мають схожий перебіг захворювання, додатковий контроль необхідно запроваджувати з огляду на вік пацієнта і тяжкість симптомів патології в старшого сибса (-ів).
У веденні хворих дітей, що їх було виявлено шляхом скринінгу певної спільноти, є певна дилема, особливо при невідомому генотипі або такому, що передбачає легший перебіг захворювання. У таких дітей симптоми ХГ можуть проявлятися в будь-якому віці або асимптомний стан зберігається протягом усього життя. У такому разі рекомендовано проводити медичне обстеження щонайменше 1 раз на рік. Частота моніторингу дітей, в яких виявили хворобу під час скринінгу новонароджених, залежить від генотипу: «тяжкий» генотип потребує відстеження кожні 6 міс; за наявності більш сприятливого генотипу, у тому числі N370S, оцінку стану потрібно виконувати щороку.
Коментар робочої групи. Рідні сибси пацієнтів зі встановленим діагнозом ХГ мають проходити медичне обстеження щонайменше 1 раз на рік, особливо при невстановленому генотипі, для виявлення перших клінічних проявів і своєчасного розгляду питання про необхідність лікування.
Оцінка стану внутрішніх органів і скелета
Для моніторингу органомегалії в дітей з асимптомним перебігом захворювання доцільно використовувати метод УЗД, але тільки до моменту, коли внаслідок клінічного погіршення розглядається необхідність призначення ФЗТ. МРТ кісток потрібно, за можливості, виконувати кожні 12-24 міс, іноді для зручності дослідження проводять під седацією. Частота ДЕРА – кожні 12 міс, особливо за відсутності МРТ (панель 4).
Панель 4
Протокол моніторингу ураження кісток у пацієнтів із ХГ
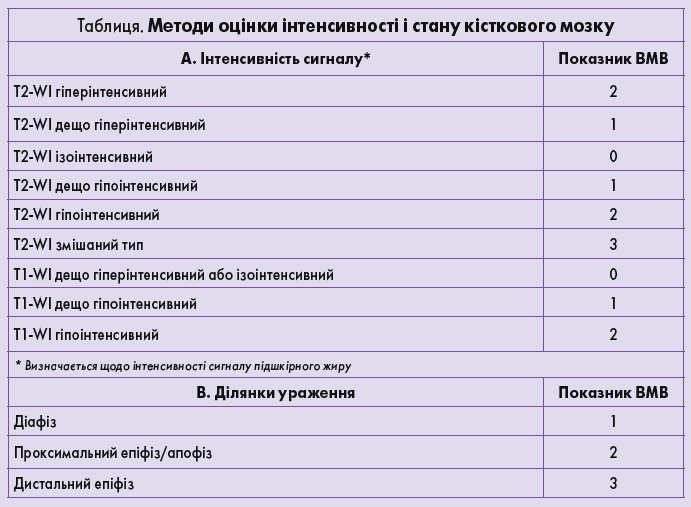
Показник кісткового мозку (показник BMB)
За даними д-ра F. Van Hoenacker, UZA, Антверпен, у співпраці з д-ром M. Maas, AMC, Амстердам.
Метод:
Напівкількісна методика дає змогу розрахувати показник інфільтрації кісткового мозку на підставі знімку МРТ хребта та стегнової кістки.
Перевагами цього підходу є:
Оцінка стану не лише периферичного, а й осьового скелета (своєчасне виявлення патології кісткового мозку). Цю методику можна легко виконувати в кожному центрі МРТ. Методика має належну варіабельність результатів в одного дослідника та в різних дослідників.
Протокол:
1) Сагітальна площина, TSE T1-WI поперекового відділу хребта, товщина зрізу 4 мм
2) Сагітальна площина, TSE T2-WI поперекового відділу хребта, товщина зрізу 4 мм
3) Корональна площина, T1-WI та T2-WI обох стегнових кісток (від голівки кістки до дистального краю), товщина зрізу 5 мм
4) Необов›язково: корональна площина, насичення сигналу від жиру, T2-WI або STIR (стегнової кістки)
Система оцінки:
Метод оцінки стану кісткового мозку (показник BMB) та інтерпретація результатів наведені в таблиці нижче. Показники поперекового відділу хребта та стегнової кістки складають разом і отримують загальну оцінку максимум 16 (стегнові кістки – 8, поперековий відділ хребта – 8).
Вищий показник BMB свідчить про тяжче ураження кісткового мозку.
Для контрольного аналізу S Vom Dahl, Lw Poll et al. обрали зменшення на 3 бали як хорошу відповідь із 95 відсотковими довірчими інтервалами
Моніторинг нейропатичної форми ХГ
Management of neuronopathic Gaucher disease: Revised recommendations. A. Vellodi, A. Tylki-Szymanska, E. H. Davies, E. Kolodny, B. Bembi, T.Collin-Histed, E. Mengel, A. Erikson, R. Schiffmann (2009).
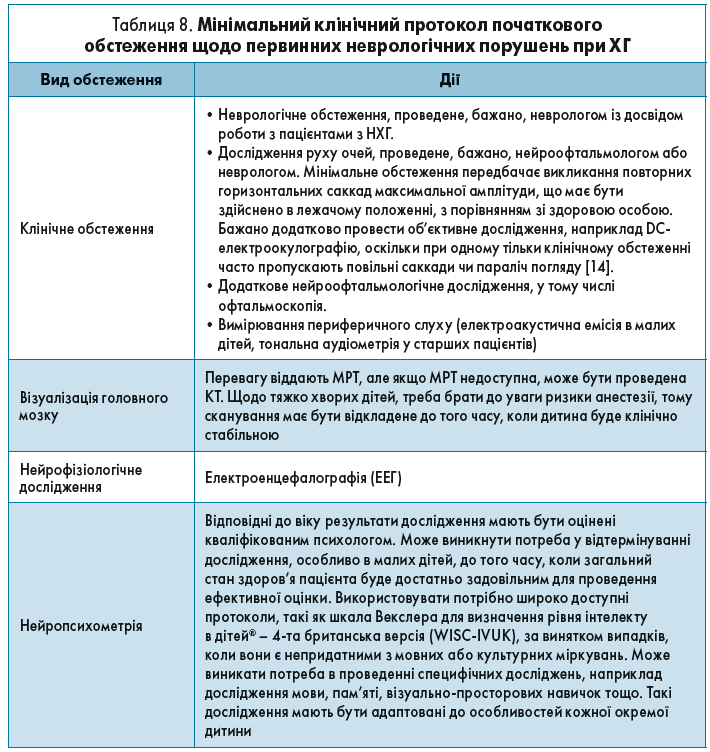
У таких пацієнтів має бути проведено повне початкове неврологічне обстеження на наявнять НХГ:
А. Усі пацієнти з уперше діагностованою ХГ.
Б. Особливу увагу потрібно приділити пацієнтам із ХГ, в яких є ≥1 фактор ризику розвитку НХГ із таких:
- Рідний брат або сестра пацієнта з підтвердженим діагнозом НХГ.
- Генотипи «високого ризику», у тому числі L444P/L444P, D409H/D409H або L444P/D409H. Генотипи мають бути підтверджені за допомогою прямого секвенування ДНК, особливо в разі підозри на наявність алельних генів L444P. При визначенні поліморфізму довжини рестрикційного фрагменту не можна відрізнити алельний ген L444P з транслокацією T→C від алельного гена L444R з транслокацією T→G [24]. На відміну від алельного гена L444P алельний ген L444R не асоційований із НХГ. Крім того, комплекс рекомбінантних алельних генів, у тому числі L444P, може бути виявлений тільки за допомогою секвенування.
- Розвиток тяжкої системної ХГ у віці ≤2 роки.
Відповідний неврологічний моніторинг має здійснюватися на регулярній основі в усіх вищезазначених групах, незалежно від того, чи було виявлено неврологічні порушення під час початкового обстеження, оскільки вони можуть виявлятися пізніше.
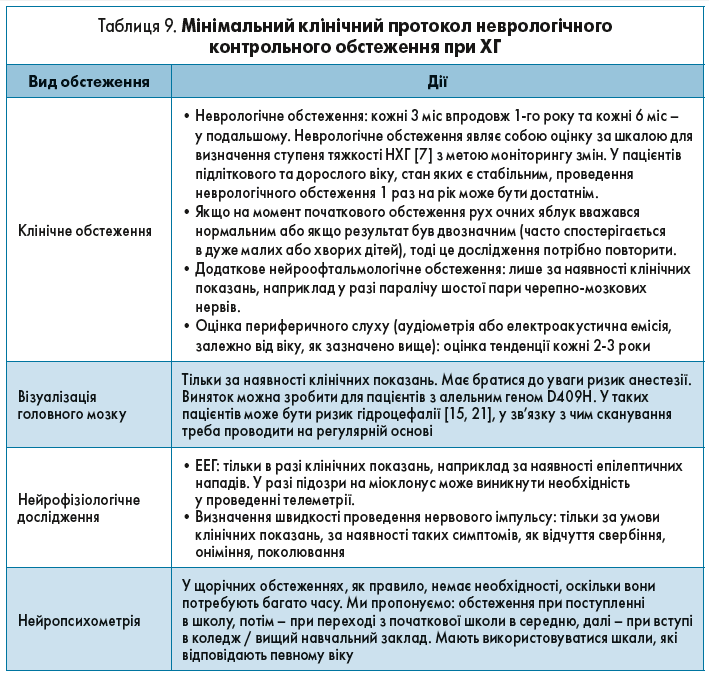
Оновлені Спеціальною групою рекомендовані протоколи початкового неврологічного обстеження та подальшого неврологічного моніторингу наведено в таблицях 8 і 9. Вони представлені у вигляді мінімальних клінічних протоколів, в яких містяться загальнодоступні, ефективні та економічні методики, аби лікарі мали можливість отримати найбільшу можливу кількість клінічно важливих даних. З огляду на попередній досвід, з метою ефективного моніторингу таких пацієнтів необхідне відповідне та ретельне обстеження згідно з алгоритмом.
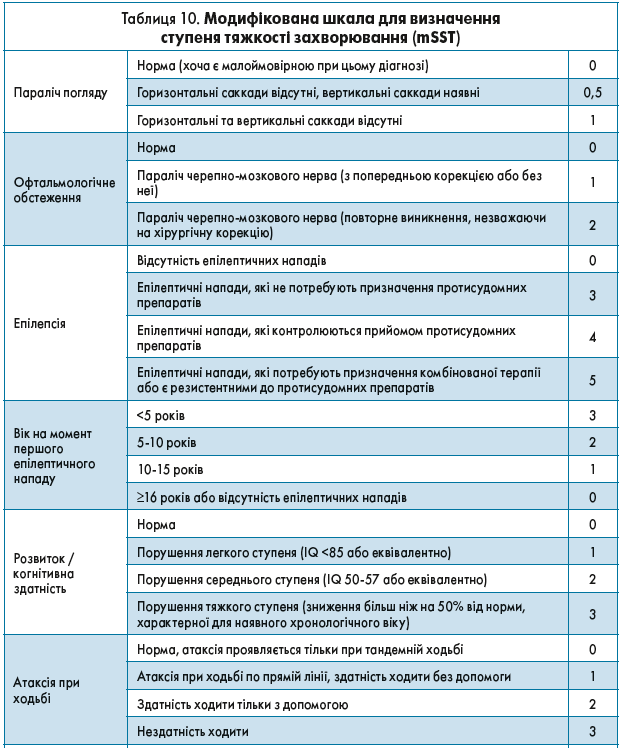
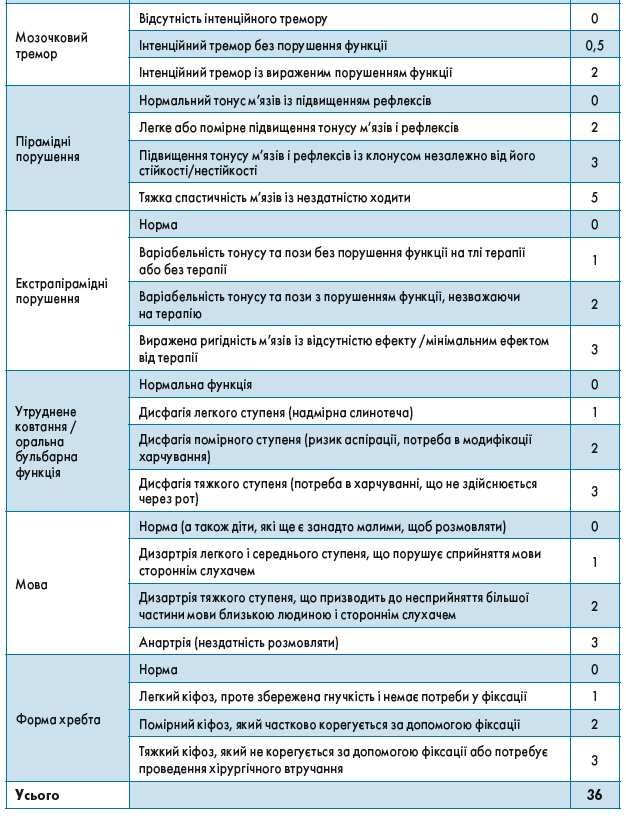
Затверджена модифікована шкала тяжкості захворювання, що дає змогу відстежувати клінічний перебіг патології [19], подана у таблиці 10.
Вагітність
Intravenous enzyme replacement therapy (ERT) for Gaucher disease. UnitedHealthcare Oxford Clinical Policy (2022)
Для оцінки перебігу вагітності в жінок із ХГ, які отримували велаглюцеразу альфа, з 2004 року були зібрані результати з 6 мультинаціональних клінічних центрів. Загалом, 25 вагітностей (середній термін вагітності – 2,7 міс, середній термін на ФЗТ – 31,2 міс) було зареєстровано у 21 жінки (середній вік 32,0 року). У першому триместрі стався аборт у двох жінок (уперше вагітних) та в однієї жінки, яка вже мала вагітності. Народжуваність становила 84% (середній вік гестації, 39,7 тиж). Середня вага в дітей при народженні становила 3234,4 г, за шкалою Апгар – понад 9 балів. У 18 пацієнток пологи були фізіологічними. У двох пацієнток проводився кесарів розтин через ендопротезування кульшових суглобів, в однієї – повторний кесарів розтин.
Дев’ять пацієнток отримали місцеву аналгезію/анестезію. Післяпологові ускладнення були рідкісними, спостерігався один випадок післяпологової (плацентарної) кровотечі. Середні показники вмісту гемоглобіну і тромбоцитів під час вагітності поліпшувалися (9,45 і 26,0% відповідно). Згідно з даними спостереження, зібраними протягом приблизно 8 років, було зроблено висновок, що велаглюцераза альфа безпечна для зачаття та вагітності з хорошими результатами в матерів і новонароджених.
Коментар робочої групи. Найбільші спостереження за вагітністю під час проведення ФЗТ, наведені щодо застосування іміглюцерази (416 вагітностей у 247 жінок), проводили в дослідженні Ari Zimran та співавт. (2009). Не було отримано доказів будь-якого несприятливого впливу іміглюцерази на плід або немовлят, яких годують груддю матері, що приймають альглюцеразу і/або іміглюцеразу.
Детальніше з дослідженням можна ознайомитися за посиланням: https://www.sciencedirect.com/science/article/abs/pii/S1079979609001053
В Україні, за даними клінічної бази пацієнтів із ХГ І типу, 5 жінок репродуктивного віку під час проведення ФЗТ препаратом іміглюцераза завагітніли та успішно завершили вагітність народженням 8 здорових дітей. Доза препарату становила від 30 до 60 Од/кг. Вагітність перебігала без ускладнень. Жодних побічних реакцій, пов’язаних із ФЗТ, у період вагітності та пологів не зафіксовано.
Дані фармакологічного нагляду показують, що іміглюцераза і велаглюцераза альфа безпечні для зачаття та вагітності, лікування препаратами добре переноситься вагітними і немає жодних доказів побічних ефектів, пов’язаних із вагітністю. Дійсно, ФЗТ може знадобитися, по-перше, для боротьби з хворобою, оскільки ХГ може загостритися під час вагітності, а по-друге, як профілактика тромбоцитопенії, яка може бути загрозливою під час вагітності або пологів і є протипоказанням для епідуральної анестезії. Дані щодо безпечного використання таліглюцерази альфа під час вагітності обмежені.
Альтернативні методи лікування
The Belgian Working Group on Gaucher Diseas, Guidelines for diagnosis, treatment and monitoring of Gaucher’s disease (2016)
Субстрат-редукційна терапія (пероральна)
Міглустат
Іміновий цукор W-бутилдезоксийориміцин, міглустат, інгібітор глюкоцереброзидсинтази, перший етап біологічного синтезу гліколіпідів, був попередником пероральних субстратних інгібіторів для лікування ХГ, що їх було вперше запропоновано Radin у 1976 році. Хоча клінічні випробування показали суттєвий вплив на основні показники захворювання, проблематичний профіль безпеки обмежив показання до застосування, коли Європейське агентство лікарських засобів (EMA – European medicines agency) схвалило міглустат (Завеска, «Актеліон Фармасьютікалз») для лікування пацієнтів із легкою та помірною ХГ, які не є підходящими кандидатами для ФЗТ (2002 р.), а FDA – для пацієнтів, у яких ФЗТ не є підходящим варіантом лікування (2003 р.). Утім, за відсутності інших методів, здатних впливати на неврологічні прояви, цей засіб для субстрат-редукційної терапії (СРТ) має здатність долати гематоенцефалічний бар’єр і розглядається як прототип терапевтичного ведення НХГ. Крім того, препарат застосовується перорально, що усуває багато незручностей внутрішньовенної ФЗТ. На жаль, у клінічному випробуванні міглустату при ГХ ІІІ типу не вдалося продемонструвати неврологічні переваги. Через низьку ефективність препарату в пацієнтів із ХГ І типу (у порівнянні з ФЗТ) в поєднанні з більшою частотою побічних ефектів (шлунково-кишкових, неврологічних) цей препарат більше не призначають у Бельгії. Компанія «Актеліон» просуває цей препарат для застосування в лікуванні іншої лізосомної хвороби накопичення – хвороби Німана-Піка типу С.
Коментар робочої групи. Станом на 01.07.2022 ЛЗ міглустат в Україні не зареєстровано.
Еліглустат, Церделга®
Нещодавно розпочались клінічні випробування СРТ фази ІІІ. Еліглустат («Джензайм Корп.») – це церамідний аналог субстрату (на відміну від фрагмента глюкози, як у міглустаті) з кращим профілем безпеки та вищою активністю, ніж у міглустату. Дворічні результати випробування фази ІІ показали значуще поліпшення ключових клінічних показників у 20 з 24 пацієнтів із ХГ І типу. Таке саме поліпшення було продемонстровано і в рандомізованому клінічному випробуванні фази ІІІ ENGAGE. Незважаючи на те що цей пероральний засіб для СРТ, імовірно, отримає реєстраційне посвідчення (очікується отримання задовільних даних із безпеки), він потребуватиме довгострокового досвіду застосування (довшого, ніж для ФЗТ) через складний метаболізм цитохрому Р450, що ускладнює використання деяких ліків. Важливо зазначити, що еліглустат не долає гематоенцефалічний бар’єр, отже, не має додаткових переваг у лікуванні ХГ ІІІ типу.
Інформація стосовно пероральної терапії еліглустатом (персональне спілкування з компанією «Джензайм/Санофі»)
Перед початком терапії ЛЗ еліглустат (Церделга®) пацієнти мають пройти генотипування щодо CYP2D6 для визначення стану метаболізму CYP2D6. Його буде виконувати лабораторія LabCorp (м. Мехелен, Бельгія), а фінансує цю послугу компанія «Джензайм/Санофі». На CYP2D6 базується визначення дози препарату.
Показання до застосування
Еліглустат призначений для довгострокової терапії дорослих пацієнтів із ХГ І типу (ХГ 1), які є повільними, середніми або швидкими (ПМ, СМ, ШМ) метаболізаторами CYP2D6.
Коментар робочої групи. Станом на 01.07.2022 ЛЗ еліглустат в Україні не зареєстровано.
Генна терапія
На етапі дослідження.
Терапія фармакологічними шаперонами
Терапія фармакологічними шаперонами (ФШ) – це нова стратегія збільшення залишкової активності глюкоцереброзидази шляхом стабілізації неправильно скомпонованих мутантних білків, запобігання розщеплення в протеосомах, пов’язаному з ендоплазматичним ретикулумом, та забезпечення міграції до лізосом. Цей підхід особливо корисний у пацієнтів із ХГ, оскільки навіть помірне збільшення залишкової активності глюкоцереброзидази має бути достатнім для пом’якшення фенотипу. Більше того, ці маленькі молекули мають бути здатні долати гематоенцефалічний бар’єр. Першим шапероном, що використовувався у клінічному дослідженні, був ізофагоміну тартрат («Амікус Терапевтікс»), але випробування фази ІІ не досягли кінцевих точок, і подальша розробка була припинена.
Другим шапероном є амброксолу гідрохлорид («ЕксСАР Корпорейшн»), 30 років тому розроблений як муколітичний засіб (Мукосолван, «Берінгер Інгельхайм») і доступний без рецепта в багатьох країнах. A. Zimran використовував амброксол за межами зареєстрованих показань у 12 осіб із помірно вираженою ХГ І типу у 2009 р., при цьому лише 2 пацієнти з найменшою масою тіла досягли позитивних результатів, що свідчить про необхідність застосування більших доз. Отже, перш ніж розглядати потенціал амброксолу в лікуванні легкої форми ХГ І типу, необхідно провести формальні клінічні випробування з використанням вищих доз. Шаперони можуть бути найкращим перспективним варіантом і в поєднанні з ФЗТ, і як метод підтримувального лікування. Сподіваємося, що серед цих малих молекул буде хоча б одна, яка пом’якшуватиме нейропатичні прояви.
Інші методи лікування
Ортопедична хірургія, у тому числі протезування, ад’ювантні препарати (біль, остеопороз), фізіотерапія, психотерапія, протиепілептичне лікування, трансплантація печінки, хірургічна операція на серці – заміна клапана, препарати для лікування легеневої гіпертензії, гематологія/онкологія, онкологія, акушерство, ендокринологія.
Цей перелік вказує на те, що ХГ – серйозне багатофакторне захворювання і пацієнтів, які страждають на ХГ, необхідно лікувати в тісній співпраці з довідковим центром, у штаті якого є багатопрофільна група.
Висновки
Хвороба Гоше зазвичай проявляється в дитинстві. Щоб запобігти розвитку серйозних, незворотних ускладнень захворювання, діти із симптомним та асимптомним перебігом потребують ретельного і регулярного моніторингу стану здоров’я. Пацієнтам із наявністю симптомів необхідно призначати ФЗТ.
У цих переглянутих рекомендаціях розширили групу дітей із ХГ, яких треба обстежувати через регулярні інтервали часу. Було охоплено і групу дітей із нейропатичною формою захворювання та з патологією, що перебуває в досимптомному періоді. На основі глибшого розуміння природного перебігу ХГ в дитячому віці та даних довготривалого спостереження за результатамив і наслідками ФЗТ розроблені рекомендації щодо проведення додаткової оцінки стану кісток (вимірювання МЩКТ через значну поширеність низької щільності кісток) і росту дітей. Також були наведені принципи корегування дози терапії.
Перегляд клінічної настанови заплановано на 2028 рік.
Матеріал подано у скороченому вигляді.
Текст адаптовано та уніфіковано відповідно до стандартів Тематичного випуску «Медичної газети «Здоров’я України».
Повний текст настанови за посиланням https://www.dec.gov.ua/wp-content/uploads/2023/02/2022_12_06_kn_hvoroba-goshe.pdf
Тематичний номер «Діабетологія. Тиреоїдологія. Метаболічні розлади» № 3 (67) 2024 р.