26 грудня, 2020
Целіакія та несприйняття глютену без целіакії: що нового у 2020 році?
 У 2020 р. з’явилися нові рекомендації Європейського товариства педіатрії, гастроентерології, гепатології та нутриціології (ESPGHAN) із діагностики целіакії у дітей. У 2019 р. представлені та опубліковані гайдлайни з целіакії та глютенозалежних захворювань від Європейського товариства з вивчення целіакії (ESsCD) та з целіакії від Американського коледжу гастроентерології (ACG), що відкрили потужні можливості в роботі з пацієнтами з цією патологією.
У 2020 р. з’явилися нові рекомендації Європейського товариства педіатрії, гастроентерології, гепатології та нутриціології (ESPGHAN) із діагностики целіакії у дітей. У 2019 р. представлені та опубліковані гайдлайни з целіакії та глютенозалежних захворювань від Європейського товариства з вивчення целіакії (ESsCD) та з целіакії від Американського коледжу гастроентерології (ACG), що відкрили потужні можливості в роботі з пацієнтами з цією патологією.
Метою створення рекомендацій ESsCD стала необхідність оновлення робочих міжнародних документів із менеджменту целіакії та інших розладів, пов’язаних із засвоєнням глютену, на основі включення нових критично та структуровано оцінених даних. Минулого року ми представляли основні положення з діагностики зазначеної патології (тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія», № 4 (54), 2019 р., с. 20-21). Подивимося, що саме пропонується у 2020 році.
Що відомо про целіакію в 2020 році?
- Целіакія залишається захворюванням, яке недостатньо діагностується через неоднорідність клінічних ознак та симптомів.
- Для діагностики целіакії використовуються різні підходи (анамнез, клінічне обстеження, серологія, генетичне тестування, гістопатологічні дослідження), але жоден з них не може вважатися достатнім для встановлення діагнозу.
Як відомо, саме ESPGHAN вперше у 2012 р. надало рекомендації, що дозволили проводити серологічну діагностику без необхідності гістопатологічних досліджень в окремих клінічних випадках.
Що нового?
1. Для первинного тестування хворих із підозрою на целіакію необхідно визначити рівні загального IgA та антитіл проти тканинної трансглутамінази (ТТГ) 2 IgA.
2. Уникнення біопсії задля діагностики целіакії є безпечним підходом у дітей із високими титрами антитіл ТТГ IgA у сироватці крові (у разі збільшення концентрації в 10 разів та більше від верхньої межі норми) та за наявності відповідно підвищених титрів антитіл до ендомізіуму (EMA-IgA) у другій пробі сироватки.
Діти з підвищеними титрами ТТГ IgA, але такими, що не досягають десятикратного збільшення від верхньої межі норми, потребують проведення ендоскопічного дослідження з біопсією для зменшення ризиків хибно-позитивного діагнозу.
Хворим із низьким рівнем загального IgA тести на основі IgG (DGP, EMA або TGA) потрібно виконувати на другому етапі. Тестування на EMA, DGP або AGA (IgG та IgA) як початковий скринінг у клінічній практиці не рекомендовано.
Пацієнти з позитивними титрами ТТГ IgA та EMA та незначними змінами у тонкій кишці або без них можуть розцінюватися як такі, що мають потенційну целіакію. Такі ж результати можуть бути отримані й через низьке споживання глютену перед біопсією, взяттям лабораторних проб та інші діагностичні помилки. Потенційна целіакія вимагає відповідних клінічних та лабораторних досліджень і подальшого спостереження (серологія + біопсія) для моніторингу динаміки перебігу захворювання.
3. У безсимптомних дітей целіакію можна діагностувати без проведення біопсії дванадцятипалої кишки, використовуючи ті самі критерії, що і для пацієнтів із симптомами.
4. Генетичне тестування на лейкоцитарний антиген людини (HLA) та наявність симптомів не є обов’язковими критеріями діагностики, що базується на серологічних тестах без проведення біопсії. Негативні результати тестування на HLA DQ2 та DQ8 свідчать про вкрай низьку вірогідність целіакії, тоді як позитивний результат не може підтвердити діагноз (ESPGHAN Guidelines for Diagnosing Coeliac Disease, 2020).
Медична лабораторія (МЛ) «Діла» є лідером лабораторної діагностики. Нашими фахівцями було розроблено алгоритм серологічної діагностики глютенозалежних захворювань за допомогою тестів другого покоління, що відповідає світовим та європейським тенденціям.
Непереносимість глютену без целіакії
Останнім часом питання споживання безглютенових продуктів стає все більш актуальним. Лише у США за 2016 р. на розвиток безглютенової промисловості було витрачено більше 15 млрд доларів [1]. За різними даними, частка населення з гіперчутливістю до глютену коливається і в середньому становить 10% [2]. 1% населення планети страждає на абсолютну непереносимість глютену (целіакію) [3]. Що необхідно знати про несприйняття глютену без целіакії (НГБЦ) і чим вона відрізняється від целіакії та синдрому подразненої кишки (СПК)?
НГБЦ – це один із вивчених на сьогоднішній день проявів різних видів несприйняття злакових (серед цих проявів – целіакія, алергія на пшеницю, СПК). За даними різних авторів, поширеність НГБЦ становить 0,6-10,6% [2, 5-7], що пов’язане з різними факторами, одним із найбільш вірогідних залишається відсутність специфічних біомаркерів для діагностики цієї патології. Відомі антитіла до гліадину (АГА), виявлення яких стало неоціненним внеском у вивчення целіакії, давно замінили інші специфічні біомаркери, які виявляються у людей, що мають НГБЦ (приблизно в 50% у неконтрольованих клінічних дослідженнях) [8-9], тому користь від використання АГА на сьогоднішній день залишається до кінця не з’ясованою.
Різноваріабельна поширеність НГБЦ також може пояснюватися певним перехрещуванням симптоматики НГБЦ та СПК. Так, результати опитування великої вибірки осіб (n=1002), проведеного у Великій Британії, показали, що більша частина респондентів з чутливістю до глютену мала симптоми, які відповідали Римським III критеріям СПК у порівнянні з тими, хто її не мав (20 проти 3,89%, р<0,0001) [6].
При цьому поширеність СПК є подібною до НГБЦ і складає приблизно 11% [10]. Крім того, обидва стани частіше спостерігаються переважно у молодих та середнього віку жінок [10].
Патофізіологія НГБЦ вивчена не до кінця. Існують різні гіпотези патогенезу цього стану, однією з яких є наявність не-IgE-опосередкованої гіперчутливості до пшениці [11]. У дослідженні Carroccio та співавт. [9] було встановлено, що більшість людей із гіперчутливістю до пшениці також має підвищену чутливість до коров’ячого молока [11].
Дослідження впливу НГБЦ на інтестинальну проникність є досить суперечливими. Наприклад, гістологічні дослідження біоптатів дванадцятипалої кишки ex vivo підтвердили збільшення кишкової проникності в осіб із НГБЦ [12]. Існують й протилежні відомості. Наприклад, дослідження in vivo із використанням розчинів лактози/манніту продемонстрували зниження кишкової проникності порівняно з контролем (р=0,03) [13].
Патофізіологія СПК також до кінця не вивчена, хоча маємо відомості щодо вісцеральної гіперчутливості, порушення перистальтики, впливу генетичних, психологічних факторів та порушеної бар’єрної функції слизової оболонки кишечнику [14]. Крім того, хворі з СПК можуть мати підвищену чутливість до злакових та глютену зокрема, хоча механізм цього зв’язку також до сьогоднішнього дня залишається незрозумілим. Продемонстровано, що глютен порушує бар’єрну функцію кишечнику у хворих із СПК.
У рандомізованому контрольованому дослідженні за участю 45 хворих із СПК з переважанням діареї порівнювали вплив безглютенової дієти (БГД) та глютенової (ГД) протягом 4 тижнів. Проникність кишкової стінки була вище на ГД серед носіїв генів HLA-DQ2/8. Також було встановлено нижчу експресію білків щільних з’єднань ентероцитів (ZO-1, оклюдин, клаудин-1) у групі ГД [15]. В іншому дослідженні, що проводилося для з’ясування впливу глютену на інтестинальну проникність у хворих із СПК, було встановлено зміни процесів фосфорилювання легкого ланцюга міозину, експресію клаудину-15 та 2, пов’язану з глютеном [16]. Отримані дані можуть потенційно пояснювати зміни кишкової проникності у хворих із СПК після глютенової провокації.
Використання конфокальної лазерної ендомікроскопії у 36 хворих із СПК встановило наявність швидкої реакції слизової оболонки на антигени пшениці. Так, у 22 із 36 хворих у слизовій оболонці збільшувалася кількість інтраепітеліальних лімфоцитів та міжворсинчасті проміжки [17]. Такий підхід міг би потенційно бути корисним у відокремленні хворих із СПК, чутливих до злакових.
Важливим питанням розуміння НГБЦ та його патогенезу залишається пошук тригерів, відповідальних за виникнення аномальних реакцій, та продукти харчування.
Основна увага у проблемі НГБЦ традиційно приділена взаємодії з глютеном. Проте встановлені інші компоненти злакових (зокрема пщениці), відповідальні за виникнення сипмтоматики. Серед них – інгібітори амілази/трипсину (ATI), аглютиніни зародків пшениці (АЗП) та олігосахариди, дисахариди, моносахариди та поліоли, що ферментуються (FODMAP) [4].
ATI пшениці являють собою родину з 17 білків [18], що складає до 4% загальної кількості її білків [19]. ATI патогенетично пов’язані з виникненням астми пекарів [20]. Їх почали активно вивчати як можливі етіологічні чинники НГБЦ з активацією реакцій вродженого імунітету. ATI пшениці викликають запалення слизової оболонки кишечнику через активацію Toll-подібного рецептора-4 in vitro та in vivo [21]. Вважається, що активація останнього призводить до посилення вивільнення прозапальних цитокінів та реакцій вродженої імунної відповіді [18]. Крім того, сучасні сорти пшениці відрізняються за своїм складом від історичних попередників, а саме – мають значно вищу активність ATI [18]. Лектини зазвичай розглядають як так звані антинутрієнти. АЗП є найбільш вивченим лектином зерна. У дослідженнях було продемонстровано, що АЗП викликають запальні реакції та активацію імунних клітин in vitro та in vivo [22], а також змінюють проникність ентероцитів, що може призвести до транслокації мікробних та харчових антигенів [22]. Однак важливо зазначити, що відомості про подібні реакції у людей на сьогодні відсутні [22].
Фруктани (включені до FODMAP) є основними коротколанцюговими вуглеводами, присутніми у зерні пшениці. Відомо, що саме FODMAP є причиною появи несприятливої симптоматики у багатьох хворих із СПК та НГБЦ. Це пов’язано з їх поганим всмоктуванням, що призводить до збільшення кількості води у тонкій кишці та змін у кишковому транзиті [23]. Оскільки далі вони ферментуються в порожнині товстої кишки, це призводить до підвищення газоутворення та здуття, на що часто скаржаться пацієнти і з СПК, і з НГБЦ [24].
Крім того, СПК та НГБЦ можуть накладатися один на одного, і тоді лікарі говорять про так зване перехрещення симптомів.
Відповідно до критеріїв експертів, необхідно запідозрити наявність НГБЦ у таких випадках:
- в осіб із персистуючою кишковою/позакишковою симптоматикою, що виникає та/або пов’язана зі споживанням глютену;
- після виключення целіакії та алергії на пшеницю.
Діагностика має відповідати двом етапам.
Етап I: виявлення пацієнтів, які реагують на БГД (серед пацієнтів, які вживають глютен)
Для цього пацієнт має знаходитися на харчуванні, що містить глютен, щонайменше 6 тижнів із заповненням відповідних опитувальників, де зазначає симптоми, які його турбують (вихідний рівень). Далі після детального роз’яснення дієтолога пацієнт переходить на БГД, у цей період він також заповнює опитувальник, в якому вказується наявність симптому та його інтенсивність.
За умов зниження бальності шкали опитувальника, який хворий заповнював протягом періоду спостереження, щонайменше на 30% від вихідного рівня, він переходить до етапу ІІ.
Етап II: провокація глютеном – підтвердження НГБЦ у пацієнтів, які відповіли на БГД
Призначений для осіб, що виконали умови, перераховані в етапі I.
Спочатку призначають сувору базову дієту без глютену протягом щонайменше 4 тижнів. Далі пацієнтам в раціон вводять глютен (рекомендовано 8 г/добу) або плацебо за принципом подвійного сліпого плацебо-контрольованого методу протягом 1 тижня із наступним заповненням опитувальника.
Для інтерпретації позитивного чи негативного результату необхідно враховувати щонайменше тридцятивідсоткову різницю між даними опитувальника (рис. 2).
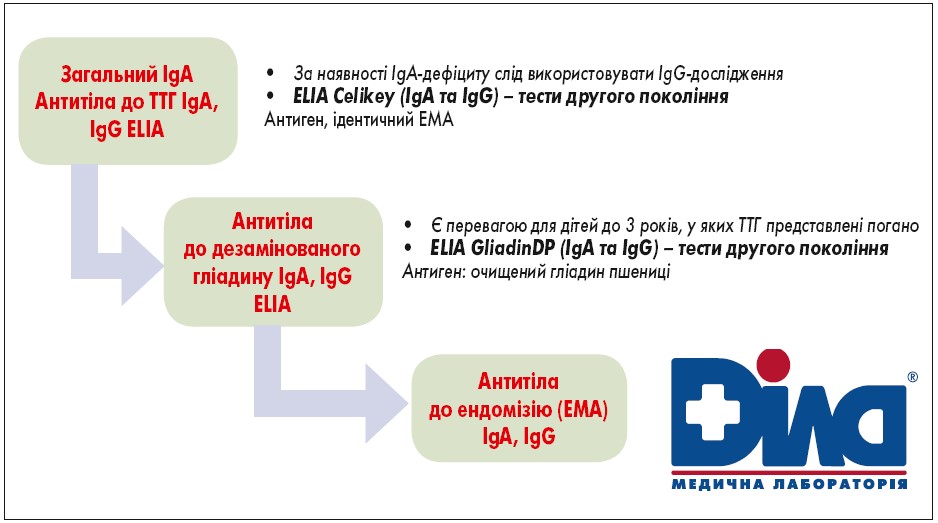 Рис. 1. Алгоритм серологічної діагностики глютенозалежних захворювань, що пропонує МЛ «Діла»
Рис. 1. Алгоритм серологічної діагностики глютенозалежних захворювань, що пропонує МЛ «Діла»
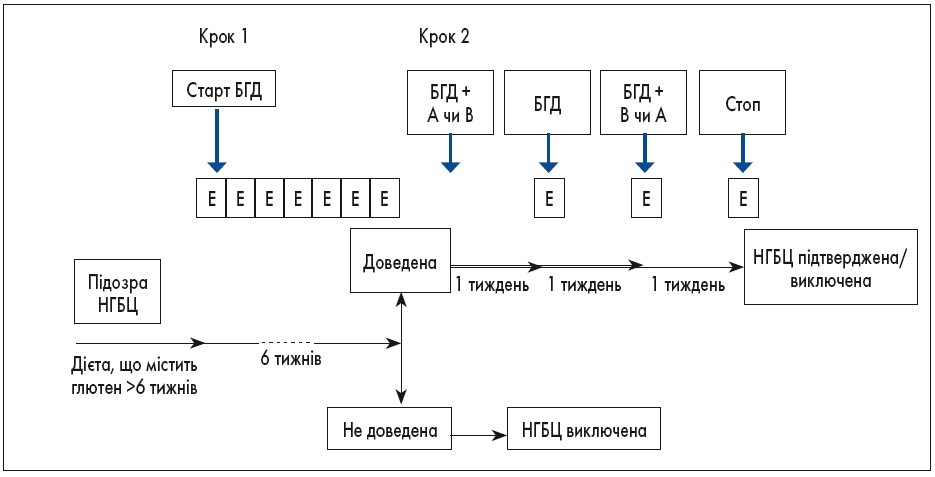 Рис. 2. Алгоритм діагностики НГБЦ [25]
Рис. 2. Алгоритм діагностики НГБЦ [25]
БГД – безглютенова дієта, А – продукт А (глютен або плацебо), В – продукт В (плацебо або глютен), Е – оцінка симптомів за опитувальником. Оцінка проводиться щотижня на етапі 1 і щодня на етапі 2.
Варто ще раз звернути увагу на наявність виразного перехрещування симптомів НГБЦ та СПК. Симптоматика пацієнтів із НГБЦ залежить від споживання глютену. При цьому пацієнти із СПК також можуть мати користь від БГД. Сьогодні ведуться дебати стосовно того, який саме компонент злакових та пшениці зокрема відповідає за виникнення симптоматики, тому продовжуються дослідження та розробка точних біомаркерів, що допоможуть розмежувати СПК та НГБЦ.
Для диференційної діагностики СПК у МЛ «Діла» доступне дослідження фекального кальпротектину, яке особливо має значення для виключення інших органічних захворювань кишечнику.
Література
- Niland B., Cash B.D. Health benefits and adverse effects of a gluten-free diet in non-celiac disease patients. Gastroenterol Hepatol (NY) 2018; 14: 82-91.
- Golley S., Corsini N., Topping D. et al. Motivations for avoiding wheat consumption in Australia: results from a population survey. Public Health Nutr 2015; 18: 490-499.
- Lebwohl B., Sanders D.S., Green P.H.R. Coeliac disease. Lancet 2018; 391: 70-81.
- Catassi C., Alaedini A., Bojarski C. et al. The overlapping area of non-celiac gluten sensitivity (NCGS) and wheat-sensitive irritable bowel syndrome (IBS): an update. Nutrients 2017; 9:pii: E1268.
- Tanpowpong P., Ingham T.R., Lampshire P.K. et al. Coeliac disease and gluten avoidance in New Zealand children. Arch Dis Child 2012; 97: 12-16.
- Aziz I., Lewis N.R., Hadjivassiliou M. et al. A UK study assessing the population prevalence of self-reported gluten sensitivity and referral characteristics to secondary care. Eur J Gastroenterol Hepatol 2014; 26: 33-39.
- Carroccio A., Giambalvo O., Blasca F. et al. Self-reported non-celiac wheat sensitivity in high school students: demographic and clinical characteristics. Nutrients 2017; 9: pii: E771.
- Volta U., Tovoli F., Cicola R. et al. Serological tests in gluten sensitivity (nonceliac gluten intolerance). J Clin Gastroenterol 2012; 46: 680-685.
- Carroccio A., Mansueto P., Iacono G. et al. Nonceliac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity. Am J Gastroenterol 2012; 107: 1898-1906.
- Lovell R.M., Ford A.C. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clin Gastroenterol Hepatol 2012; 10: 712-721.
- Carroccio A., Mansueto P., D’Alcamo A., Iacono G. Nonceliac wheat sensitivity as an allergic condition: personal experience and narrative review. Am J Gastroenterol 2013; 108: 1845-1852.
- Hollon J., Puppa E.L., Greenwald B. et al. Effect of gliadin on permeability of intestinal biopsy explants from celiac disease patients and patients with nonceliac gluten sensitivity. Nutrients 2015; 7: 1565-1576.
- Sapone A., Lammers K.M., Casolaro V. et al. Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions: celiac disease and gluten sensitivity. BMC Med 2011; 9: 23.
- Portincasa P., Bonfrate L., de Bari O. et al. Irritable bowel syndrome and diet. Gastroenterol Rep (Oxf) 2017; 5: 11-19.
- Vazquez-Roque M.I., Camilleri M., Smyrk T. et al. A controlled trial of gluten-free diet in patients with irritable bowel syndrome-diarrhea: effects on bowel frequency and intestinal function. Gastroenterology 2013; 144: 903.e3-911.e3.
- Wu R.L., Vazquez-Roque M.I., Carlson P. et al. Gluten-induced symptoms in diarrhea-predominant irritable bowel syndrome are associated with increased myosin light chain kinase activity and claudin-15 expression. Lab Invest 2017; 97: 14-23.
- Fritscher-Ravens A., Schuppan D., Ellrichmann M. et al. Confocal endomicroscopy shows food-associated changes in the intestinal mucosa of patients with irritable bowel syndrome. Gastroenterology 2014; 147: 1012.e4-1020.e4.
- Schuppan D., Zevallos V. Wheat amylase trypsin inhibitors as nutritional activators of innate immunity. Dig Dis 2015; 33: 260-263.
- Reig-Otero Y., Manes J., Manyes L. Amylase-trypsin inhibitors in wheat and other cereals as potential activators of the effects of nonceliac gluten sensitivity. J Med Food 2018; 21: 207-214.
- Gomez L., Martin E, Hernandez D. et al. Members of the alpha-amylase inhibitors family from wheat endosperm are major allergens associated with baker’s asthma. FEBS Lett 1990; 261: 85-88.
- Junker Y., Zeissig S., Kim S.J. et al. Wheat amylase trypsin inhibitors drive intestinal inflammation via activation of toll-like receptor 4. J Exp Med 2012; 209: 2395-2408.
- de Punder K., Pruimboom L. The dietary intake of wheat and other cereal grains and their role in inflammation. Nutrients 2013; 5: 771-787.
- Murray K., Wilkinson-Smith V., Hoad C. et al. Differential effects of FODMAPs (fermentable oligo-, di-, mono-saccharides and polyols) on small and large intestinal contents in healthy subjects shown by MRI. Am J Gastroenterol 2014; 109: 110-119.
- Spiller R. How do FODMAPs work? J Gastroenterol Hepatol 2017; 32 Suppl 1: 36-39.
- Catassi C., Elli L., Bonaz B. et al. Diagnosis of non-celiac gluten sensitivity (NCGS): the Salerno Experts’ Criteria. Nutrients 2015; 7: 4966-4977.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 4 (58) 2020 р.




