31 жовтня, 2024
Скринінг раку шийки матки. Ведення пацієнток з аномальними результатами скринінгу та передраковими станами шийки матки
Стандарт медичної допомоги
Тривала персистенція папіломавірусної інфекції, здебільшого вірусів 16-го і 18-го типу, є причиною більшості випадків раку шийки матки (РШМ). Доклінічна фаза від інфікування вірусами папіломи людини (ВПЛ) високого онкогенного ризику до розвитку інвазивного РШМ дає можливість ефективно проводити скринінг, діагностику та лікування передракових станів, що сприяє зниженню захворюваності та смертності жінок.
Загальна частина
Діагноз: Дисплазія шийки матки, або цервікальна інтраепітеліальна неоплазія.
Коди стану або захворювання. НК 025:2021 «Класифікатор хвороб та споріднених проблем охорони здоров’я»:
Z12.4 Спеціальне скринінгове обстеження з метою виявлення новоутворення шийки матки
N87 Дисплазія шийки матки
N87.0 Слабко виражена дисплазія шийки матки
N87.1 Помірна дисплазія шийки матки
N87.2 Різко виражена дисплазія шийки матки, не класифікована в інших рубриках
N87.9 Дисплазія шийки матки, неуточнена
Розділ І. Організація скринінгу РШМ та надання медичної допомоги при аномальних результатах скринінгу і передракових станах
Положення Стандарту медичної допомоги. Скринінг РШМ має здійснюватися за скеруванням лікаря загальної практики – сімейного лікаря або лікаря-гінеколога. Оцінку результатів та надання медичної допомоги при аномальних результатах скринінгу і передракових станах проводить лікар акушер-гінеколог або лікар гінеколог-онколог. При дисплазії шийки матки тяжкого ступеня та аденокарциномі in situ (AIS) консультацію надають лікарі гінеколог-онколог або гінеколог, який має досвід проведення кольпоскопії та лікування патології шийки матки.
Обґрунтування. До ВПЛ високого онкогенного ризику належать 12 типів (віруси 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59-го типу), які зараховують до канцерогенів класу 1 (однозначно канцерогенні агенти для організму людини) плюс 68-й тип, який вважається канцерогеном класу 2А (агенти, можливо, канцерогенні для людини). Інфікування ВПЛ при захворюваннях шийки матки відбувається переважно статевим шляхом.
Гістологічно верифіковану цервікальну інтраепітеліальну неоплазію (CIN) за трирівневою термінологією поділяють на CIN 1, 2 і 3, що відповідає легкій, помірній та тяжкій дисплазії шийки матки/раку in situ відповідно. CIN 1 включає ураження з койлоцитарними змінами та базальною атипією, що обмежується нижньою третиною товщини епітелію; CIN 2 – ураження з базальною атипією, що охоплює нижню і середню третину товщини епітелію; CIN 3 – ураження з базальною атипією на всю товщину епітелію.
Згідно із двостадійною системою гістологічної класифікації плоскоклітинних уражень аногенітальної ділянки (LAST) виділяють плоскоклітинне інтраепітеліальне ураження низького ступеня (LSIL), що відповідає ураженням гістологічно класифікованим, як койлоцитарна атипія та CIN 1, і плоскоклітинне інтраепітеліальне ураження високого ступеня (HSIL), що відповідає ураженням, які інтерпретуються як CIN 2 і CIN 3 при патологогістологічному дослідженні.
Позначення «CIN 2+» включає CIN 2, CIN 3, AIS та РШМ, «CIN 3+» – діагнози CIN 3, AIS та РШМ.
Критерії якості медичної допомоги
Обов’язкові
- Наявність узгодженого клінічного маршруту пацієнтки, що координує та інтегрує медичну допомогу для забезпечення своєчасного цервікального скринінгу, діагностики та лікування жінок з аномальними результатами скринінгу РШМ та передраковими станами.
- Забезпечення інформованості пацієнтки (за згодою, членів її сім’ї) щодо:
- етапів та наслідків скринінгу з особливим акцентом на довгострокових наслідках для її здоров’я;
- плану обстеження, лікування та подальшого спостереження, переваг і недоліків, пов’язаних із кожним методом, що застосовується для діагностики при аномальних результатах скринінгу та лікуванні передракових станів шийки матки;
- контактів для отримання додаткової інформації та консультації.
Бажані
3) У закладах охорони здоров’я (ЗОЗ), що надають гінекологічну та онкологічну допомогу, розміщують інформацію щодо етіології, факторів ризику та профілактики РШМ (панель 1).
4) Жінкам надають поради щодо здорового способу життя, припинення тютюнопаління, запобігання зараженню вірусом імунодефіциту людини (ВІЛ) та іншим інфекціям, що передаються статевим шляхом.
5) Вакцинація для запобігання виникненню CIN 2 і CIN 3, РШМ, раку піхви, вульви, генітальних кондилом та інших захворювань, що спричиняються ВПЛ, проводиться у жінок та чоловіків згідно із галузевими стандартами у сфері охорони здоров’я.
Панель 1
ФАКТОРИ РИЗИКУ РШМ
Пов’язані з інфікуванням ВПЛ
- Ранній початок статевого життя порівняно з віком першого статевого акту в 21 рік або пізніше –ризик збільшується у 1,5 раза для жінок 18-20 років і вдвічі – для жінок молодших 18 років.
- Кілька статевих партнерів порівняно з одним партнером – ризик збільшується вдвічі з двома партнерами та втричі – із шістьма або більше партнерами.
- Статевий партнер високого ризику (наприклад, із кількома сексуальними партнерами, інфекціями, що передаються статевим шляхом, у анамнезі або з наявним ВПЛ).
- Інфекції, що передаються статевим шляхом (наприклад, Chlamydia trachomatis, генітальний герпес, баквагіноз тощо) в анамнезі.
- Наявність в анамнезі плоскоклітинної інтраепітеліальної неоплазії або раку вульви чи піхви.
- Імуносупресія (наприклад, ВІЛ-інфекція).
- Не пов’язані з ВПЛ
- Низький соціально-економічний статус.
- Застосування комбінованих гормональних контрацептивів ≥5 років у ВПЛ-позитивних жінок.
- Тютюнопаління пов’язане із підвищеним ризиком плоскоклітинного раку шийки матки, але не аденокарциноми.
- Спадковість.
Розділ ІІ. Скринінг РШМ
Положення Стандарту медичної допомоги. Стратегії цервікального скринінгу включають або первинний скринінг на ВПЛ, або цитологічне дослідження шийки матки (ЦДШМ). Рутинний скринінг РШМ застосовується лише до жінок, які не здійснювали скринінгу раніше, не мають симптомів патології шийки матки, аномальних результатів попереднього скринінгового обстеження, тож не потребують спостереження з приводу аномальних результатів попередніх скринінгових обстежень.
Первинне скринінгове тестування на ВПЛ слід виконувати із генотипуванням (для визначення ВПЛ високого онкогенного ризику) раз на 10 років, починаючи із 35 років.
Позитивний результат первинного скринінгового тестування на ВПЛ потребує проведення і сортувального генотипування (для визначення ВПЛ 16-го та 18-го типу, якщо ця інформація не включена в результат первинного тестування), і сортувального ЦДШМ (тріаж), незалежно від генотипу ВПЛ, для визначення тактики подальшого ведення на основі оцінки ризику.
При використанні первинного цитологічного скринінгу обстеження проводиться раз на три роки. Аномальний результат первинного скринінгового ЦДШМ потребує проведення сортувального ВПЛ-генотипування (для визначення ВПЛ 16-го та 18-го типу). Надалі застосовується тактика, що наведена у Розділі ІІІ цього Стандарту.
Обґрунтування. Початок скринінгу РШМ не прив’язаний до початку статевого життя, оскільки, хоча інфікованість ВПЛ є найвищою у молодих жінок, інфекція зазвичай спонтанно елімінується у 90% випадків протягом двох років. Враховуючи високу поширеність транзиторної ВПЛ-інфекції серед молодих жінок, первинний скринінг РШМ у віці від 21-го до 24-х років проводиться тільки шляхом ЦДШМ.
Адекватний негативний результат попереднього скринінгу РШМ наразі визначається як два послідовні негативні тестування на ВПЛ або три послідовні негативні результати ЦДШМ протягом останніх 10 років, причому останнє обстеження потрібно провести в межах рекомендованого інтервалу скринінгу для використаного методу тестування (протягом попередніх п’яти або трьох років відповідно). Ці критерії не застосовуються до осіб, які потребують спостереження у зв’язку з аномальними результатами скринінгу РШМ.
Для припинення скринінгу РШМ, крім адекватного негативного результату, пацієнтка не повинна мати CIN 2+ протягом останніх 25 років.
Скринінг не рекомендовано жінкам старшим 65 років з адекватним негативним результатом попереднього скринінгу і які не належать до групи високого ризику РШМ.
Вагінальні зразки, зібрані жінкою самостійно для визначення генотипу ВПЛ, можна використовувати як основний метод при рутинному скринінгу РШМ.
Критеріям для рутинного скринінгу РШМ не відповідають такі пацієнтки:
- з імуносупресією в анамнезі (ВІЛ, трансплантація солідних органів, алогенна трансплантація гемопоетичних стовбурових клітин, запальні захворювання кишечника, системний червоний вовчак і ревматоїдний артрит з поточним лікуванням імуносупресивними препаратами);
- із дисплазією вульви або піхви в анамнезі; клінічними ознаками та симптомами захворювання шийки матки;
- з попередніми аномальними результатами скринінгу РШМ.
Критерії якості медичної допомоги
Обов’язкові
- Для рутинного скринінгу РШМ за інформованою згодою пацієнтки може проводитись ЦДШМ кожні три роки у жінок 21-65 років або первинне тестування на ВПЛ із генотипуванням (для визначення ВПЛ високого онкогенного ризику) кожні 10 років із 35-ти до 65-річного віку.
- Для скринінгу РШМ проводять забір матеріалу з ектоцервіксу та ендоцервіксу відповідно до методик, що наведені на панелі 2.
- Фарбування препаратів для ЦДШМ здійснюється за методикою Папаніколау. Результати оформлюються за стандартизованою класифікацією BETHESDA.
- Скринінг РШМ здійснюється незалежно від проведення вакцинації проти ВПЛ.
- При позитивному результаті первинного скринінгу на ВПЛ, незалежно від генотипу (включно із ВПЛ 16-го та 18-го типу), проводиться сортувальне ЦДШМ.
- Жінкам із незадовільним результатом ЦДШМ, згідно з класифікацією BETHESDA, перед повторним ЦДШМ, за наявності показань, потрібно провести лікування аномальних вагінальних виділень, інфекцій, що передаються статевим шляхом, або генітоуринарного синдрому згідно із відповідними стандартами медичної допомоги. ЦДШМ слід повторити не пізніше ніж через чотири місяці.
- Для жінок з імуносупресією, зокрема для осіб, які живуть із ВІЛ, скринінг РШМ потрібно продовжувати протягом усього життя. Під час первинної діагностики жінкам із імуносупресією проводять ЦДШМ. Якщо початкове ЦДШМ у такої пацієнтки є нормальним, наступне ЦДШМ проводять через 12 місяців. Якщо результати трьох послідовних щорічних ЦДШМ є нормальними, повторні ЦДШМ слід проводити кожні три роки.
- Тактика ведення пацієнток з аномальними результатами скринінгу визначається відповідно до Розділу ІІІ.
- Скринінг РШМ будь-яким методом припиняють у таких випадках: якщо у жінок, що старші 65 років, не було в анамнезі CIN 2+ протягом останніх 25 років і їм задокументували адекватний негативний результат попереднього скринінгу протягом 10-річного періоду до 65 років; якщо йдеться про осіб будь-якого віку з обмеженою очікуваною тривалістю життя.
- Жінкам, старшим 65 років, без захворювань, що обмежують очікувану тривалість життя, у яких невідомі результати попереднього скринінгу, проводять скринінг РШМ, доки не будуть виконані критерії для його припинення.
Бажані
11. Для визначення тактики ведення пацієнток з аномальними результатами скринінгу можуть бути використані відповідні рекомендації для оцінки результатів скринінгових обстежень включно із невідомим анамнезом (табл. 1, 2).
12. Для рутинного скринінгу РШМ за інформованою згодою пацієнтки може бути проведене ко-тестування (тестування на ВПЛ у поєднанні із ЦДШМ) у жінок віком 25-65 років кожні п’ять років.
13. Усім жінкам рекомендовані щорічні гінекологічні огляди від початку статевого життя для вчасного виявлення іншої гінекологічної патології.
14. Первинне скринінгове тестування на ВПЛ слід виконувати із генотипуванням (для визначення ВПЛ високого онкогенного ризику), за можливості, раз на п’ять років, починаючи із 25 років.
15. У пацієнток віком 30 років і старших із цитологічно підтвердженим NILM і відсутністю клітин ендоцервіксу/компонента зони трансформації та відсутнім або невідомим результатом тестування на ВПЛ тестування на ВПЛ та ЦДШМ проводиться не пізніше ніж через чотири місяці.
|
Таблиця 1. Рекомендації при аномальних результатах скринінгу |
||||||
|
Результат ВПЛ в анамнезі |
Результат поточного ВПЛтестування |
Результат поточного ЦДШМ |
Безпосередній ризик CIN 3+, % |
5річний ризик CIN 3+, % |
Рекомендоване ведення |
Оцінка достовірності рекомендації, % |
|
Невідомий |
ВПЛнегативний |
NILM |
0,00 |
0,12 |
5річне спостереження |
100 |
|
Невідомий |
ВПЛнегативний |
ASCUS |
0,04 |
0,40 |
3річне спостереження |
100 |
|
Невідомий |
ВПЛнегативний |
LSIL |
1,1 |
2,0 |
1річне спостереження |
100 |
|
Невідомий |
ВПЛнегативний |
ASCH |
3,4 |
3,8 |
Кольпоскопія* |
Особлива ситуація |
|
Невідомий |
ВПЛнегативний |
AGC |
1,1 |
1,5 |
Кольпоскопія* |
Особлива ситуація |
|
Невідомий |
ВПЛнегативний |
HSIL+ |
25 |
27 |
Кольпоскопія / лікування |
53 |
|
Невідомий |
ВПЛнегативний |
ALL** |
0,01 |
0,14 |
5річне спостереження |
95 |
|
Невідомий |
ВПЛпозитивний |
NILM |
2,1 |
4,8 |
1річне спостереження |
100 |
|
Невідомий |
ВПЛпозитивний |
ASCUS |
4,4 |
7,3 |
Кольпоскопія |
100 |
|
Невідомий |
ВПЛпозитивний |
LSIL |
4,3 |
6,9 |
Кольпоскопія |
96 |
|
Невідомий |
ВПЛпозитивний |
ASCH |
26 |
33 |
Кольпоскопія / лікування |
82 |
|
Невідомий |
ВПЛпозитивний |
AGC |
26 |
35 |
Кольпоскопія / лікування* |
80 |
|
Невідомий |
ВПЛпозитивний |
HSIL+ |
49 |
53 |
Кольпоскопія / лікування |
100 |
|
Примітки: 100% оцінка достовірності рекомендацій не є точною, але округлюється до 100%. Ризик, що визначає рекомендоване ведення, виділений жирним шрифтом. NILM – негативний щодо інтраепітеліального ураження або злоякісного новоутворення. *Подальше ведення ASCH і AGC згідно із цим Стандартом. **ALL, наприклад, первинний скринінг ВПЛ без ЦДШМ. |
||||||
|
Таблиця 2. Рекомендації при аномальних результатах скринінгу |
||||||
|
Результат ВПЛ в анамнезі |
Результат поточного ВПЛтестування |
Результат поточного ЦДШМ |
Безпосередній ризик CIN 3+, % |
5річний ризик CIN 3+, % |
Рекомендоване ведення |
Оцінка достовірності рекомендації, % |
|
ВПЛнегативний |
ВПЛнегативний |
NILM |
0,00 |
0,9 |
5річне спостереження |
100 |
|
ВПЛнегативний |
ВПЛнегативний |
ASCUS |
0,01 |
0,36 |
3річне спостереження |
100 |
|
ВПЛнегативний |
ВПЛнегативний |
LSIL |
0,44 |
0,79 |
1річне спостереження |
82 |
|
ВПЛнегативний |
ВПЛнегативний |
ASCH |
2,8 |
3,3 |
Кольпоскопія |
Особлива ситуація |
|
ВПЛнегативний |
ВПЛнегативний |
AGC |
0,78 |
0,88 |
Кольпоскопія |
Особлива ситуація |
|
ВПЛнегативний |
ВПЛнегативний |
HSIL+ |
14 |
14 |
Кольпоскопія |
98 |
|
ВПЛ–негативний |
ВПЛнегативний |
ALL** |
0,01 |
0,10 |
5річне спостереження |
100 |
|
ВПЛнегативний |
ВПЛпозитивний |
NILM |
0,74 |
2,3 |
1річне спостереження |
100 |
|
ВПЛнегативний |
ВПЛпозитивний |
ASCUS |
2,0 |
3,8 |
1річне спостереження |
100 |
|
ВПЛнегативний |
ВПЛпозитивний |
LSIL |
2,1 |
3,8 |
1річне спостереження |
100 |
|
ВПЛнегативний |
ВПЛпозитивний |
ASCH |
14 |
18 |
Кольпоскопія |
100 |
|
ВПЛнегативний |
ВПЛпозитивний |
AGC |
14 |
21 |
Кольпоскопія* |
100 |
|
ВПЛнегативний |
ВПЛпозитивний |
HSIL+ |
32 |
34 |
Кольпоскопія/ лікування |
100 |
|
Примітки: 100% оцінка достовірності рекомендацій не є точною, але округлюється до 100%. Ризик, що визначає рекомендоване ведення, виділений жирним шрифтом. *Подальше ведення ASCH і AGC згідно із цим Стандартом. **ВПЛ – негативний ALL, наприклад, первинний скринінг ВПЛ. Таблиці адаптовані з джерела Egemen D. et al. (2020). |
||||||
Панель 2
МЕТОДИКА ЗАБОРУ МАТЕРІАЛУ ДЛЯ СКРИНІНГУ РШМ
Забір зразків для цитологічного дослідження шийки матки
Проведіть огляд шийки матки в дзеркалах. Використовуйте інструмент, який дасть змогу зробити мазок – ексфоліат з ендоцервіксу та ектоцервіксу, намагаючись зібрати клітини із зони переходу.
1. Забір за допомогою цервікальної щітки
За допомогою цервікальної щітки клітини ендоцервіксу та ектоцервіксу відбираються одночасно. Довгі щетинки цервікальної щітки збирають ендоцервікальні клітини, тоді як короткі щетинки – клітини екзоцервіксу.
2. Забір клітин ендоцервіксу за допомогою ендоцервікальної щітки (цитобраш)
Введіть ендоцервікальну щітку на дві третини в цервікальний канал так, щоб нижня щетинка залишалася видимою, і обережно поверніть її на 90-180°. Ендоцервікальну щітку слід завжди використовувати разом із цервікальною.
3. Забір за допомогою комбінованої цервікальної щітки
Обережно введіть центральну частину щітки в цервікальний канал, доки бічні щетинки не торкнуться екзоцервіксу. Потім притисніть комбіщітку до шийки матки та поверніть на два оберти за годинниковою стрілкою, обертаючи ручку між великим і вказівним пальцями робочої руки
Комбіщітку не використовують під час вагітності.
Зразок для рідинного ЦДШМ береться так само, як і традиційний мазок, необхідно дотримуватися інструкцій виробника щодо забору зразків.
Методика забору зразка для тестування на ВПЛ для медичного персоналу
Матеріалом для дослідження слугує зішкріб із цервікального каналу та/або зони трансформації, виконаний цервікальною щіткою.
При огляді в дзеркалах вставте цервікальну щітку для збору зразка шийки матки для тестування на ВПЛ в зовнішнє вічко шийки матки, доки зовнішні або нижні щетинки не торкнуться екзоцервіксу (не вставляйте ендоцервікальну або цервікальну щітку повністю в цервікальний канал). Поверніть цервікальну щітку за годинниковою стрілкою п’ять-шість разів (кількість обертів може відрізнятися залежно від інструкцій виробника), обережно натискаючи на шийку матки. Вийміть щітку із цервікального каналу, уникаючи контакту зовнішньої сторони щітки або зразка з будь-яким іншим предметом.
Вставте кінець цервікальної щітки в ємність для забору зразків і покрутіть, щоб ретельно промити в розчині. Залежно від інструкції виробника пристрою для забору зразків зламайте стрижень щітки по лінії надрізу або від’єднайте щітку від ручки, залишивши щітку всередині ємності. Встановіть кришку на ємність та надійно її закрийте.
Помістіть ємність у мішок для зразків або контейнер для транспортування в лабораторію.
Забір зразка для тестування на ВПЛ жінка може зробити самостійно згідно з методикою, передбаченою діагностичною системою.
Розділ ІІІ. Діагностична тактика при аномальних результатах скринінгу
Положення Стандарту медичної допомоги. Діагностика передракових захворювань шийки матки ґрунтується на результатах цервікального скринінгу, сортувального дообстеження і, бажано, визначення ризику виникнення CIN 3+ на основі поєднання поточних та попередніх результатів скринінгу РШМ (включно з невідомим анамнезом). Кольпоскопія з прицільною біопсією та ендоцервікальний кюретаж (ЕЦК) є основними методами виявлення передракових захворювань шийки матки, що потребують лікування або спостереження.
Обґрунтування. Для виявлення потенційних уражень при кольпоскопії використовують 3-5% розчин оцтової кислоти та розчин Люголя. Візуальні зміни при кольпоскопії включають реакцію на оцтову кислоту (ацетобілий епітелій), характеристики країв ураження, рельєфу поверхні, розміри ураження, судинні малюнки та вираженість фарбування розчином Люголя тощо. Першочергове значення має отримання адекватних гістологічних зразків шляхом біопсії для ефективного виключення CIN 2+ при кожній кольпоскопії.
Під час вагітності рекомендоване ведення пацієнток з аномальними результатами скринінгу з показаннями для кольпоскопії, що встановлені для невагітних пацієнток. Прицільна біопсія шийки матки під контролем кольпоскопії у вагітних пацієнток вважається безпечною. Процедура діагностичної ексцизії або повторна біопсія шийки матки рекомендовані під час вагітності тільки при підозрі на РШМ на підставі ЦДШМ, кольпоскопії та/або патологогістологічного дослідження. ЕЦК та біопсія ендометрію протипоказані під час вагітності через ризик пошкодження плідних оболонок, плода або плаценти.
Ведення таких вагітних рекомендовано проводити спільно лікарями гінекологом-онкологом та акушером-гінекологом. Біопсію слід здійснювати за наявності інформованої згоди вагітної пацієнтки на її проведення в умовах стаціонару, що зменшує ризик невиношування та кровотечі.
Критерії якості надання медичної допомоги
Обов’язкові
- При аномальному результаті первинного ВПЛ-скринінгу (ВПЛ-позитивний) виконується сортувальне ЦДШМ.
- Якщо ВПЛ-позитивний поєднаний з аномальними результатами сортувального ЦДШМ, рекомендовано провести кольпоскопію.
- При отриманні ВПЛ-позитивного результату, цитологічного результату NILM рекомендоване повторне ВПЛ-дослідження через 12 місяців. Якщо через рік ВПЛ-негативний, NILM – повернення до рутинного скринінгу, якщо ВПЛ-позитивний, NILM – проведення кольпоскопії.
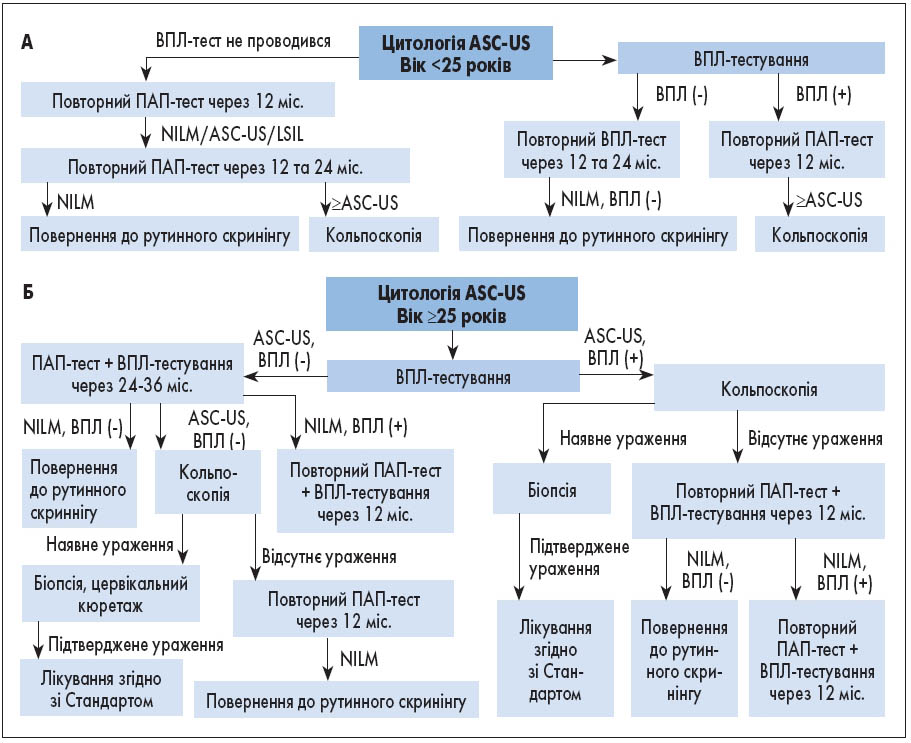
- Тактика ведення пацієнток залежно від результату цитологічного скринінгу та віку жінки має здійснюватися відповідно до алгоритмів (рис. 1).
- При персистенції ASCUS/ВПЛ-позитивний незалежно від віку пацієнтки (під час повторних обстежень) рекомендована кольпоскопія, за наявності ознак ураження проводяться біопсія, цервікальний кюретаж. Подальша тактика залежить від результатів гістологічного дослідження. За відсутності морфологічного підтвердження ураження необхідно здійснювати рутинний скринінг.
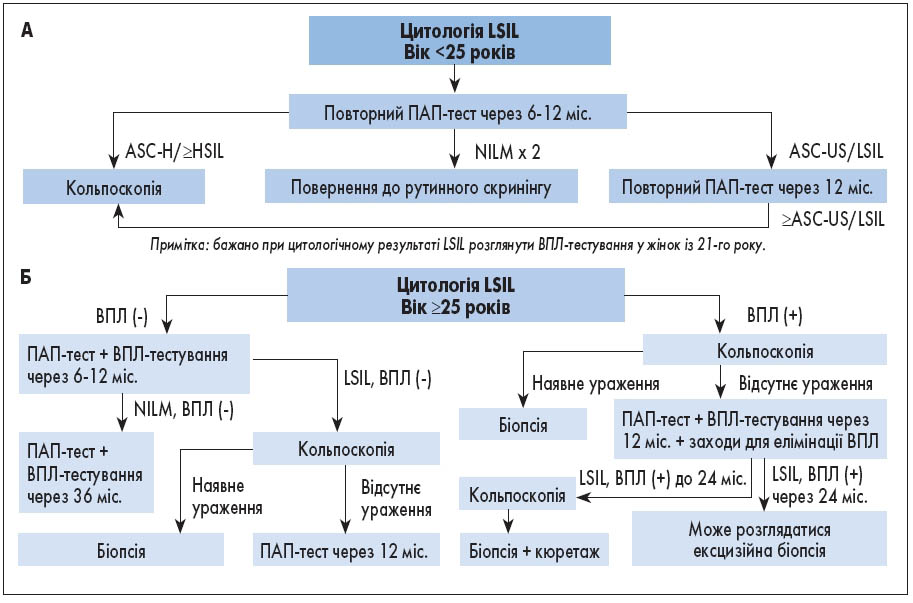
- Для вагітних із LSIL перевага надається кольпоскопії. За відсутності кольпоскопічних ознак вираженого ураження виконання біопсії не рекомендоване. Ендоцервікальний кюретаж у вагітних неприпустимий. Вагітним жінкам віком 21-24 роки рекомендовано подальше спостереження згідно з рекомендаціями щодо алгоритму ведення LSIL у жінок віком 21-24 роки (рис. 2). Відтермінування кольпоскопії (не раніше ніж через чотири тижні після пологів) є прийнятним.
- Варіанти ведення вагітних жінок з ASC-US ідентичні з тими, які описані для невагітних жінок, за винятком того, що у післяпологовому періоді кольпоскопію рекомендовано проводити не раніше ніж через чотири тижні після пологів.
- Діагностичні процедури, що проводяться при аномальних результатах скринінгу (панель 3).
Бажаний
9. При цитологічному результаті LSIL розглянути можливість проведення ВПЛ-тестування у жінок із 21-го року.
Рис. 1. Ведення ASC-US у пацієнток, молодших (А) і старших (Б) 25 років
Рис. 2. Ведення LSIL у пацієнток, молодших (А) та старших (Б) 25 років
Панель 3
Діагностичні процедури при аномальних результатах скринінгу та передракових станах шийки матки
1. Кольпоскопія при аномальних результатах скринінгу проводиться відповідно до показань, зазначених вище, з описом картини згідно з класифікацією IFCCP.
2. Прицільна біопсія шийки матки при кольпоскопії здійснюється з усіх ацетобілих ділянок, зазвичай від двох біопсій за показаннями, зазначеними вище, у невагітних пацієнток віком від 25 років і старших з оціненим безпосереднім ризиком CIN 3+ 25-100% на основі анамнезу та поточних результатів: при цитологічно підтвердженому HSIL незалежно від результату тестування на ВПЛ; при ВПЛ-позитивних цитологічно підтверджених ASC-H або AGC (усі категорії). Для знеболення при біопсії шийки матки та ЕЦК рекомендовані немедикаментозні методи та пероральні анальгетики або інфільтраційна анестезія.
3. ЕЦК виконується під час кольпоскопії (за винятком вагітних):
- при цитологічно підтверджених результатах HSIL, ASC-H;
- при усіх підкатегоріях AGC та AIS, крім випадків, коли визначаються атипові клітини ендометрію; при позитивному тестуванні на ВПЛ 16-го або 18-го типу;
- після лікування передраку шийки матки в анамнезі, незалежно від показань до кольпоскопії;
- при спостереженні за CIN 2;
- якщо перехід багатошарового плоского та циліндричного епітелію (перехідна зона) не повністю візуалізується при кольпоскопії, крім пацієнток віком до 30 років, які не народжували, із цитологічно підтвердженими ASCUS або LSIL;
- при позитивних результатах подвійного фарбування на p16/Ki67.
4. Ексцизійна біопсія як остаточний метод діагностики проводиться під місцевим або загальним знеболенням пацієнткам з аномальними результатами скринінгу в особливих випадках, а саме:
- при підозрі на мікроінвазію;
- при відсутності кореляції між результатами цитології, кольпоскопії та гістології, зокрема
- при персистенції протягом двох років цитологічних результатів HSIL, ASC-H без гістологічно верифікованого HSIL у жінок, молодших 25 років,
- при неповній візуалізації зони переходу багатошарового плоского та циліндричного епітелію (перехідної зони) чи верхньої межі всіх уражень;
- у жінок віком 25 років і старших при веденні LSIL (CIN 1), якому передували цитологічно підтверджені ASC-H або HSIL, зокрема із цитологічно підтвердженим HSIL та з результатом біопсії – гістологічно верифіковане LSIL (CIN 1);
- із цитологічно підтвердженим HSIL під час візиту через один-два роки або із цитологічно підтвердженими ASC-H, які зберігаються при візиті через два роки;
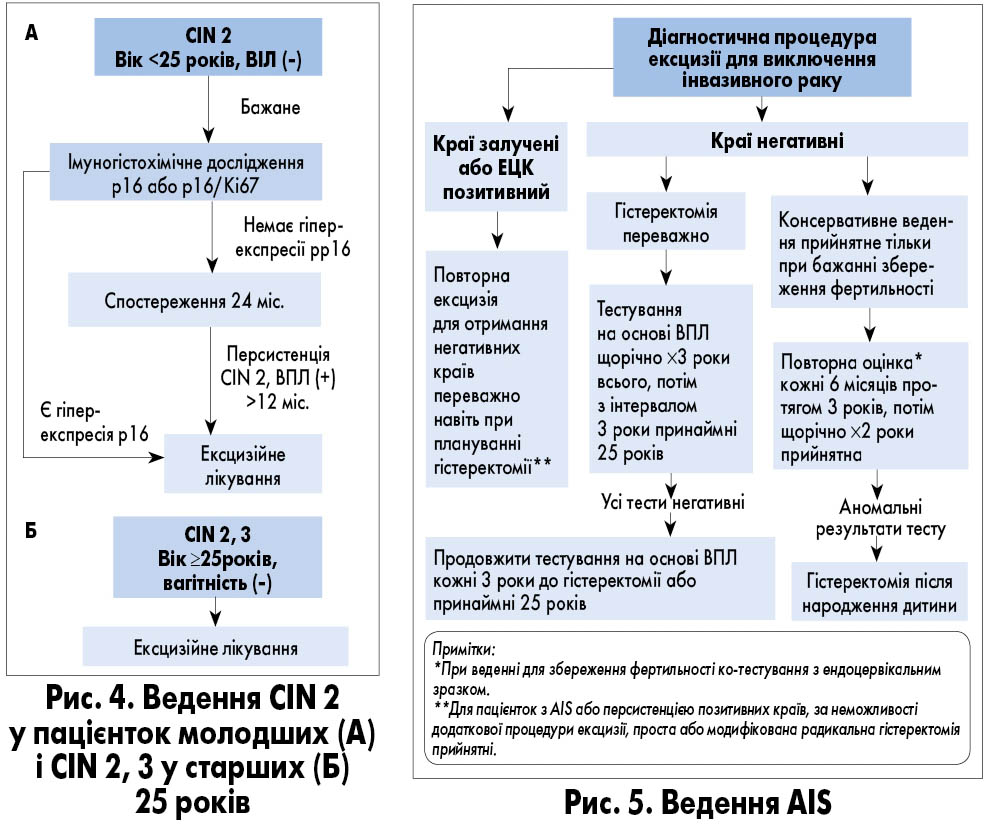
- з AIS, встановленим за результатами біопсії шийки матки, для виключення інвазивної аденокарциноми, навіть якщо у подальшому заплановане виконання гістеректомії.
5. Метод ділатації і кюретажу (фракційне вишкрібання цервікального каналу та порожнини матки) проводиться:
- у невагітних пацієнток, молодших 35 років, із підвищеним ризиком виникнення раку ендометрію на основі клінічних показань (аномальні маткові кровотечі, стани, що супроводжуються хронічною ановуляцією, або ожиріння);
- у невагітних пацієнток віком від 35 років і старших з усіма категоріями AGC та AIS;
- у пацієнток у постменопаузі із виявленими атиповими клітинами ендометрію при ЦДШМ відповідно до стандартів у сфері охорони здоров’я.
Перед проведенням діагностичної ексцизії шийки матки або дилатації і кюретажу проводиться стандартне обстеження гінекологічних хворих для малих діагностичних та лікувальних втручань згідно із чинними стандартами медичної допомоги.
Патологогістологічне дослідження операційного матеріалу, обстеження на ВІЛ, сифіліс, вірусні гепатити В та С здійснюються відповідно до стандартів у сфері охорони здоров’я. .
Жінкам репродуктивного віку проводять обстеження на наявність вагітності.
Розділ ІV. Ведення пацієнток із гістологічно підтвердженими передраковими захворюваннями шийки матки
Положення Стандарту медичної допомоги. Основною метою лікування є профілактика РШМ шляхом деструкції або ексцизії передракових уражень для запобігання розвитку інвазивного раку. Порогом/показанням для лікування залишаються гістологічно верифіковані HSIL/AIS (за термінологією LAST) або CIN 2+ (за трирівневою термінологією), за винятком особливих обставин: пацієнтки занепокоєні потенційним впливом лікування на результати майбутньої вагітності; вік жінки менший ніж 25 років; вагітність. Гістеректомія не є стандартним методом лікування CIN 2+, крім гістологічно верифікованої AIS. Невідкладне лікування без підтверджувальної біопсії під контролем кольпоскопії (наприклад, «побачити і лікувати») за інформованою згодою можливе лише у невагітних пацієнток від 25 років і старших за особливих обставин (обмежена доступність медичної допомоги, особи з інвалідністю тощо).
Обґрунтування. Морфологічні результати біопсії та ЕЦК в комплексі з поточними та попередніми результатами скринінгу, доповнені особистими факторами пацієнтки, зокрема такими, як вік та імуносупресія, дають змогу оцінити ризик наявності передраку та виникнення РШМ. Після оцінки індивідуального ризику може бути запропоновано кілька варіантів клінічної дії: лікування, одно-, три- або п’ятирічне спостереження/повернення до рутинного скринінгу.
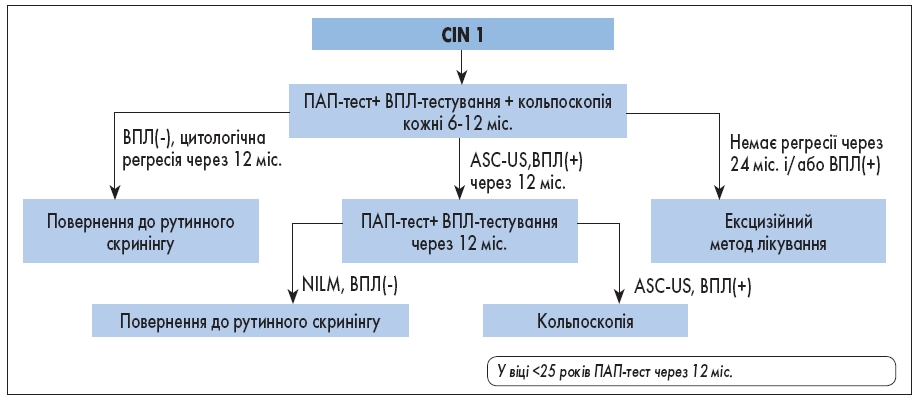
Гістологічно верифікована легка дисплазія LSIL – CIN 1 є проявом продуктивної фази ВПЛ-інфекції. CIN 1 може бути обумовлена і ВПЛ високого онкогенного ризику, і ВПЛ низького ризику, а також може бути спричинена персистуючою інфекцією одного типу чи послідовним інфікуванням різними типами ВПЛ. ВПЛ 16-го типу рідше трапляється при CIN 1, ніж при CIN 3. Показники регресії є високими, особливо у молодих пацієнток, а подальший діагноз CIN 2+ трапляється рідко, рекомендованим варіантом клінічної дії переважно є спостереження.
Гістологічно верифікована CIN 2 має більшу частоту і швидкість регресії, на відміну від CIN 3, що дає можливість відтерміновувати лікуванння в молодих жінок. Основним обґрунтуванням для відтермінування лікування CIN 2 є потенційний ризик несприятливих акушерських наслідків, зокрема передчасних пологів, після ексцизійної терапії або абляції.
CIN 3 вважається прямим попередником РШМ і завжди потребує лікування. Якщо не можна виключити CIN 3, пацієнтку слід вести як таку, у якої діагностовано CIN 3.
Вибір найбільш відповідного методу лікування залежить від характеристики ураження (уражень) шийки матки, поширення ураження в цервікальний канал або на піхву, візуалізації переходу багатошарового плоского та циліндричного епітелію (перехідної зони) і важкості супутньої патології.
Ексцизійне лікування включає процедури, що видаляють зону трансформації із отриманням матеріалу для патологогістологічного дослідження: процедуру петлевої електрохірургічної ексцизії (LEEP) або широку петлеву ексцизію зони трансформації (LLETZ), конізацію холодним ножем , лазерну та діатермоконізацію. Для уражень високого ступеня перевагою ексцизійного лікування є отримання гістологічного зразка, який може виявити вищий ступінь плоскоклітинного або залозистого ураження, а також надає інформацію про стан країв резекції, що є предиктором персистенції або рецидивування CIN 2+.
Причини вибору невідкладного лікування можуть включати особисті уподобання, обмежений доступ до медичної допомоги, фінансові проблеми та тривогу, пов’язану із РШМ. Вікова межа 25 років і старші для невідкладного лікування обрана через низькі показники захворюваності на РШМ і високі показники регресії передраку серед жінок вікової групи до 25 років.
Критерії якості медичної допомоги
Обов’язкові
- Тактика ведення пацієнток із гістологічно підтвердженими передраковими захворюваннями шийки матки з урахуванням віку пацієнтки має здійснюватися відповідно до алгоритмів, зображених на рис. 3-5.
- При обговоренні з пацієнтками питання про невідкладне лікування лікарі мають ретельно зважити ризики та переваги порівняно з кольпоскопією і прицільною біопсією.
- Методи абляції включають кріотерапію, лазерну абляцію, термоабляцію та інші. Проте при лікуванні уражень високого ступеня методи абляції мають низку обмежень і протипоказані у таких випадках: ураження поширюється на цервікальний канал; ураження покриває понад 75% площі поверхні ектоцервіксу або виходить за межі використовуваного кріонаконечника; перехідна зона або верхня межа будь-якого ураження не візуалізуються повністю; у зразку із цервікального каналу діагностовано CIN 2+ або CIN, яку неможливо оцінити; після попереднього лікування CIN 2+; при неадекватній біопсії шийки матки для підтвердження гістологічно верифікованого діагнозу; при підозрі на РШМ.
- Під час вагітності слід обирати варіанти ведення та лікування передракових станів, зважуючи ризик для плода та матері порівняно з ризиком відсутності раку. Лікування без проведення біопсії під час вагітності є неприйнятним.
- При цитологічних результатах HSIL у вагітних обов’язково проводять кольпоскопію. Біопсія виконується лише при кольпоскопічних ознаках вираженого ураження, при підозрі на інвазивний РШМ.
Бажані
6. Імуногістохімічне визначення білків р16 та Ki67 використовується для підтвердження діагнозу гістологічно верифікованого HSIL, якщо морфологічна оцінка препаратів із фарбуванням гематоксиліном і еозином відповідає CIN 2 або CIN 3.
7. За інформованою згодою невідкладне лікування (без попереднього патологогістологічного підтвердження шляхом біопсії) з використанням процедури ексцизії проводиться за один візит у невагітних пацієнток від 25 років і старших із безпосереднім ризиком розвитку CIN 3+ 25-100% на основі анамнезу та поточних результатів: цитологічно підтверджене HSIL незалежно від результату тестування на ВПЛ; ВПЛ-позитивні цитологічно підтверджені ASCH або AGC (усі категорії).
8. Абляція (лазерна, кріодеструкція) може розглядатися при лікуванні великих уражень шийки матки або таких, що поширюються на піхву, за умови, що всі інші критерії для абляції виконані. Однак перевага надається ексцизійним методам лікування.
9. Ад’ювантна (після лікування) вакцинація проти ВПЛ рекомендована для раніше невакцинованих осіб віком від 27 до 45 років, які проходять лікування CIN 2+.
Рис. 3. Ведення пацієнток із CIN 1
Розділ V. Спостереження при аномальних результатах скринінгу та передракових станах шийки матки
Положення Стандарту медичної допомоги. Після отримання аномальних результатів скринінгу РШМ для пацієнток 25 років і старших, результатів біопсії під контролем кольпоскопії або після лікування гістологічно верифікованого HSIL здійснюється спостереження з використанням тестування на основі ВПЛ. Спостереження за допомогою тільки ЦДШМ є прийнятним у разі, якщо тестування на основі ВПЛ є неможливим. У такому разі повторні ЦДШМ при спостереженні проводяться з інтервалом у шість місяців, якщо для тестування на основі ВПЛ рекомендовані інтервали в один рік, або щорічно, якщо для тестування на основі ВПЛ рекомендовані інтервали в три роки. ЦДШМ при спостереженні слід використовувати для пацієнток, молодших 25 років, з переходом на тестування на основі ВПЛ у віці 25 років або старшому.
Після завершення початкового довгострокового 25-річного періоду спостереження у жінок, які в анамнезі отримали лікування з приводу гістологічно верифікованих або цитологічно підтверджених змін високого ступеня та досягли віку 65 років, подальше спостереження із трирічними інтервалами триває доти, поки дозволяє стан здоров’я пацієнтки. Скринінг припиняють при обмеженні очікуваної тривалості життя.
Обґрунтування. Спостереження – це інтервальне обстеження осіб, які мали попередні аномальні результати скринінгу та передракові стани шийки матки, з проведенням лікування або без нього.
Спостереження включає подальше тестування через коротший інтервал ніж той, що наразі рекомендований для рутинного скринінгу, зокрема первинне тестування на основі ВПЛ з інтервалом меншим ніж п’ять років, або тільки ЦДШМ з інтервалом меншим ніж три роки.
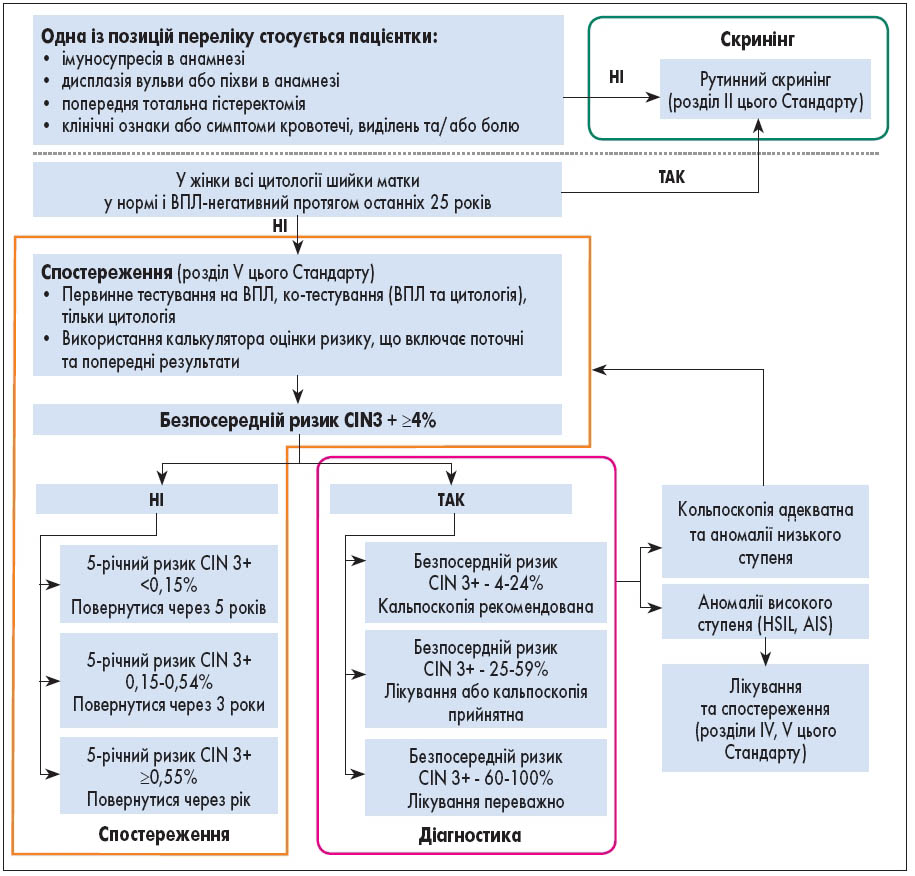
Спостереження рекомендоване пацієнткам, у яких безпосередній ризик CIN 3+ за даними поточних та попередніх результатів скринінгу РШМ становить менше 4%. На основі п’ятирічного ризику CIN 3+ визначається інтервал один, три або п’ять років, коли пацієнткам слід повернутися для спостереження (рис. 6).
Рис. 6. Алгоритм сортування для скринінгу, спостереження та діагностики РШМ на основі ризику
Спостереження для пацієнток, молодших 25 років, показане при цитологічно підтверджених результатах низького ступеня (ASC-US, LSIL), які, ймовірно, мають інфекції, не пов’язані з ВПЛ 16-го та 18-го типу, з високою ймовірністю регресії та низьким ризиком швидкого прогресування до раку.
Особи, які отримували лікування з приводу гістологічно верифікованого HSIL або з нещодавнім аномальним результатом скринінгу, мають підвищений ризик передраку шийки матки, що вимагає ретельного коротко- та довгострокового спостереження.
Тестування на основі ВПЛ є більш чутливим, ніж тільки ЦДШМ при виявленні CIN 2+ не лише після кольпоскопії, а й після лікування. Оскільки ЦДШМ менш чутливе, ніж тестування на основі ВПЛ, його необхідно проводити частіше, щоб досягти аналогічної чутливості для виявлення CIN 3+.
Попередній негативний результат ЦДШМ окремо не знижує подальший ризик, як ВПЛ-негативний результат скринінгу; тому тільки ЦДШМ не використовується для модифікації подальших рекомендацій щодо ведення пацієнток.
Критерії якості медичної допомоги
Обов’язкові
- Короткострокове спостереження після лікування гістологічно верифікованого HSIL здійснюється шляхом тестування на основі ВПЛ через шість місяців після лікування, незалежно від стану країв ексцизійного зразка. Якщо результати тестування на ВПЛ позитивні, проводять кольпоскопію і прицільну біопсію або повторне обстеження через шість місяців із проведенням кольпоскопії та ЕЦК. При позитивних результатах у краях зразка на CIN 2+ або при виявленні CIN 2+ при проведенні ЕЦК під час ексцизії у пацієнток віком 25 років і старших, які не занепокоєні потенційним впливом лікування на результати майбутньої вагітності, проводять повторну ексцизію або спостереження через шість місяців шляхом тестування на основі ВПЛ або кольпоскопії та ЕЦК.
- При довгостроковому спостереженні у пацієнток після лікування гістологічно верифікованого HSIL та після гістеректомії при AIS, після первинного тестування на основі ВПЛ через шість місяців проводиться щорічне тестування на основі ВПЛ до отримання трьох негативних результатів поспіль. Після початкового періоду інтенсивного спостереження рекомендовано продовжувати огляди з інтервалом у три роки протягом щонайменше 25 років після лікування гістологічно верифікованих змін високого ступеня (гістологічно верифіковані HSIL, CIN 2, CIN 3 або AIS) або цитологічно підтверджених змін високого ступеня (HSIL або персистенція ASC-H), навіть якщо вік пацієнтки перевищує 65 років.
- Довгострокове спостереження для пацієнток віком 25 років і старших після цитологічно підтверджених змін низького ступеня (ВПЛ-позитивні NILM, ASC-US або LSIL); гістологічно верифікованого LSIL (CIN 1) без ознак гістологічно верифікованих чи цитологічно підтверджених уражень високого ступеня або при ВПЛ-інфекціях продовжують відповідно до оцінки ризику.
Бажані
4. Рекомендації з тактики подальшого ведення і спостереження пацієнток залежно від клінічної ситуації визначаються за допомогою таблиць оцінок ризику.
5. Рутинний скринінг з інтервалом у п’ять років із використанням тестування на ВПЛ проводиться у пацієнток з оціненим п’ятирічним ризиком CIN 3+ <0,15% на основі даних анамнезу та поточних результатів тестування, зокрема після негативного результату скринінгу на основі ВПЛ.
6. Повторне тестування з інтервалом у три роки з використанням тестування на ВПЛ здійснюється у жінок з оціненим п’ятирічним ризиком CIN 3+ ≥0,15% та <0,55% на основі анамнезу та поточних результатів тестування, наприклад, у жінок із ВПЛ-позитивним ASC-US або LSIL із результатом подальшої кольпоскопії меншим ніж CIN 2, із негативним повторним тестуванням на основі ВПЛ; із ВПЛ-негативним ASC-US при невідомому анамнезі.
7. Повторне тестування через рік із використанням тестування на ВПЛ проводиться у пацієнток:
- з оціненим ризиком CIN 3+ ≥0,55% та <4,0% на основі анамнезу та поточних результатів скринінгу, зокрема у жінок із ВПЛ-позитивним NILM або ВПЛ-негативним LSIL із невідомим попереднім анамнезом скринінгу;
- після кольпоскопії з біопсією гістологічно верифікованим LSIL (CIN 1), якому передував результат тестування на ВПЛ та ЦДШМ низького ризику (визначений як ВПЛ-позитивний LSIL, ВПЛ-позитивний ASC-US або повторний ВПЛ-позитивний NILM);
- з новими ВПЛ-позитивними результатами ASC-US або LSIL після задокументованого ВПЛ-негативного тестування протягом попередніх п’яти років або кольпоскопії менше CIN 2 протягом останнього року.
Індикатори якості медичної допомоги
Наявність у ЗОЗ клінічного маршруту пацієнтки (КМП) зі скринінгу РШМ, аномальними результатами скринінгу та передраковими станами.
Цей індикатор характеризує організаційний аспект запровадження сучасних медико-технологічних документів.
Якість надання медичної допомоги пацієнткам, її відповідність вимогам КМП і чинному стандарту медичної допомоги цим індикатором висвітлюватися не може, але для аналізу цих аспектів необхідне обов’язкове запровадження КМП у ЗОЗ.
Дані надаються лікарями загальної практики – сімейними лікарями, лікарями-гінекологами та гінекологами-онкологами, що надають первинну та спеціалізовану медичну допомогу.
Затверджено наказом Міністерства охорони здоров’я України 18 червня 2024 р. № 1057
Дата оновлення стандарту – 2029 р.
Друкується скорочено.
Текст адаптовано та уніфіковано відповідно до стандартів Тематичного випуску Медичної газети «Здоров’я України».
Повний текст за посиланням: https://www.dec.gov.ua/wp-content/uploads/2024/07/1300_24072024_ykpmd_diabet_2.pdf
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 5 (91) 2024 р.