28 січня, 2022
Антипсихотичні препарати другого покоління: від рецепторних механізмів до клінічної ефективності
У листопаді 2021 р. відбулася ІV науково-практична конференція «Психосоматична медицина: наука та практика». Вітчизняні та іноземні фахівці обговорювали досягнення в галузі психосоматичної медицини, аспекти обстеження пацієнтів та сучасні підходи у психофармакотерапії
Антипсихотики другого покоління: переваги призначення
Із доповіддю про переваги призначення антипсихотичних препаратів (АП) другого покоління виступив професор Варшавського медичного університету (Польща) Пшемислав Беньковський.
Як зазначив спікер, у контексті рецепторної теорії розрізняють АП першого і другого покоління. Відмітною особливістю лікарських засобів першого покоління АП є блокування D2-рецепторів, виразність якого може маскувати інші рецепторні властивості. Клінічно це проявляється побічними ознаками ураження екстрапірамідної системи, як-от паркінсонізм, анергія, вторинні негативні симптоми.
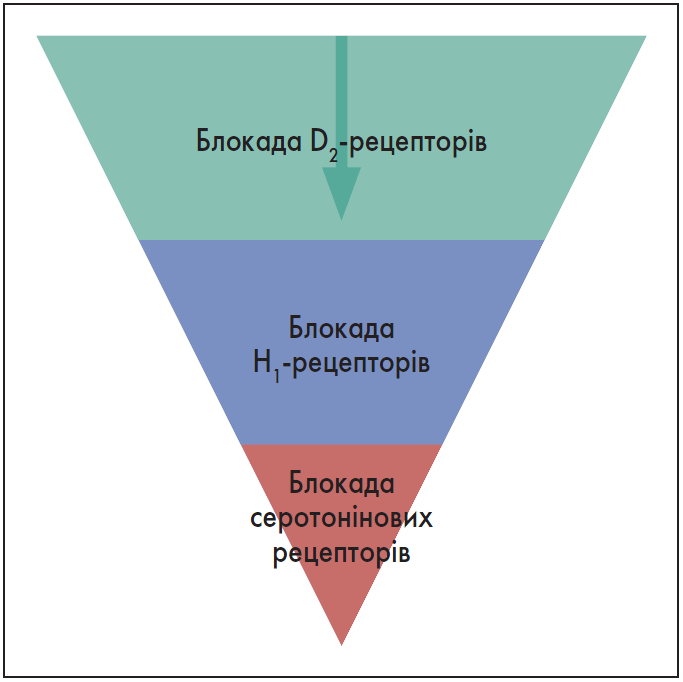
Піраміду рецепторних ефектів АП першого покоління, в якій превалює взаємодія із D2-рецепторами, зображено на рисунку 1. Це важливо пам’ятати, якщо лікар хоче використати ефект інгібування гістамінових рецепторів Н1 або властивість препарату блокувати серотонінові рецептори.
Рис. 1. Піраміда рецепторних ефектів антипсихотиків першого покоління
Адаптовано за P. Biénkowski, 2021
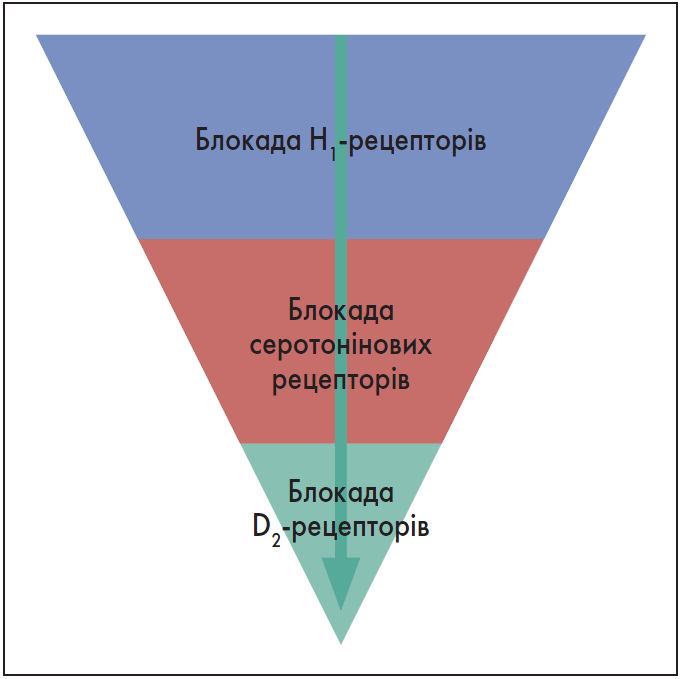
Іншу піраміду рецепторних ефектів – для АП другого покоління – зображено на рисунку 2. Її верхня частина відповідає здатності лікарського засобу блокувати Н1-рецептори. АП другого покоління меншою мірою впливають на інгібування серотонінових рецепторів і лише незначною – взаємодіють із D2-рецепторами.
Рис. 2. Піраміда рецепторних ефектів антипсихотиків другого покоління
Адаптовано за P. Biénkowski, 2021
Вдалим прикладом для розуміння механізмів дії АП другого покоління є оланзапін. На фармацевтичному ринку України оланзапін представлений препаратом Золафрен. Призначення оланзапіну навіть у високих дозах не викликає значного блокування D2-рецепторів, а отже, не чинить виразного впливу на екстрапірамідну систему. Однак при лікуванні пацієнтів із позитивними симптомами шизофренії та манії необхідно застосовувати вищі дози препарату для досягнення блокади D2-рецепторів. У менших дозах оланзапін може бути корисним для потенціювання та посилення ефектів антидепресантів, а також чинити седативний та анксіолітичний вплив. Така перевернута піраміда рецепторних механізмів може бути використана для лікування біполярних розладів (Correll, 2010; Schatzberg, Nemeroff, 2017).
При розгляді питання щодо ефективності препарату Золафен передусім необхідно оцінювати її з позиції лікування шизофренії, адже основною метою його призначення є саме терапія пацієнтів із цією хворобою. За даними метааналізу, оланзапін є найдієвішим АП другого покоління (Huhn et al., 2019). Якщо брати до уваги загальне поліпшення стану й елімінацію негативної або позитивної симптоматики, оланзапін входить до четвірки найефективніших препаратів разом із амісульпридом, рисперидоном та клозапіном. Як показано в метааналізі, такі результати є типовими при вивченні різних симптоматичних проявів.
Важливим практичним моментом є безпека препарату. Оланзапін належить до лікарських засобів зі сприятливим профілем ризику, що значною мірою корелює із його рецепторним профілем. Одним із метаболічних ефектів приймання оланзапіну є збільшення маси тіла. Ризик набору ваги при використанні оланзапіну може бути вищим, аніж на тлі терапії іншими АП другого покоління. Однак імовірність розвитку таких типових побічних дій, як-от медикаментозний паркінсонізм або акатизія, що часто спричиняють занепокоєння пацієнтів та змушують їх відмовлятися від лікування чи порушувати режим, за приймання оланзапіну зіставна із плацебо. Саме тому оланзапін знаходиться на верхівці переліку АП другого покоління із найнижчим ризиком припинення терапії.
Седативний ефект не можна вважати типовим несприятливим явищем для оланзапіну зважаючи на рецепторний профіль препарату. Потужна антигістамінна дія Золафену корелює із седацією, що для багатьох пацієнтів є перевагою, особливо на початку лікування, при загостренні шизофренії та безсонні. Седативні властивості АП можна використовувати для лікування гіперактивності хворих.
Подовження інтервалу QT є важливою складовою профілю безпеки. Оланзапін належить до препаратів із помірним ризиком аритмогенних ефектів. До того ж він не впливає на рівень пролактину.
Монотерапія – ідеальний підхід, до якого має прагнути лікар. Однак доволі мало пацієнтів психіатричного профілю отримують лише один препарат. На практиці оланзапін часто використовують у комбінації з іншими ліками. Це зумовлено рецепторними механізмами дії – призначення оланзапіну може посилювати ефективність препаратів із вузьким рецепторним профілем, як-от арипіпразол, амісульприд або рисперидон.
З позиції погляду на піраміду рецепторних механізмів оланзапін можна розглядати як справжній антидепресант. У низьких дозах він може чинити виразний анксіолітичний та антидепресивний ефект без ризику надмірної седації та антидофамінового впливу. Також є дані на користь комбінування оланзапіну із препаратами селективних інгібіторів зворотного захоплення серотоніну (СІЗЗС) та інгібіторів зворотного захоплення серотоніну й норадреналіну (ІЗЗСН).
Необхідно звернути увагу на групу препаратів ІЗЗСН, до якої відносять дулоксетин, доступний українським пацієнтам під торговельною назвою Депратал (кишковорозчинні таблетки). ІЗЗСН – ліки подвійного механізму дії, що забезпечує їх високу ефективність (Cipriani et al., 2018). Однак у низьких дозах такі препарати проявляють лише серотонінергічні властивості у вигляді блокади повторного захоплення серотоніну, особливо це стосується венлафаксину. Дулоксетин характеризується більш збалансованим профілем, але потрібно враховувати стартову дозу і титрувати її з обережністю для кращої переносимості препарату.
Вважається, що дулоксетин має виразну анальгетичну дію, що дозволяє розглянути призначення Депраталу як препарату вибору в пацієнтів із депресією та супутнім больовим синдромом. Підсумовуючи, доповідач зазначив, що у разі необхідності комбінування дулоксетину із АП варто розглянути застосування оланзапіну в низьких дозах, який потенціюватиме антидепресивний ефект дулоксетину і водночас обмежуватиме такі несприятливі явища, як надмірна активація, порушення сну й нудота (Zhong et al., 2014).
Ведення пацієнтів із психосоматичними розладами під час пандемії COVID‑19
Питання ведення пацієнтів із психосоматичними розладами під час пандемії COVID‑19 висвітлила у своїй доповіді професорка кафедри психосоматичної медицини і психотерапії Національного медичного університету імені О.О. Богомольця (м. Київ),  д. мед. н. Олена Олександрівна Хаустова.
д. мед. н. Олена Олександрівна Хаустова.
За прогнозами фахівців, відбиток інфікування COVID‑19 матиме довготривалий влив на суспільне здоров’я населення. Високі захворюваність і смертність, обмеження медичних ресурсів на нековідні стани, переривання курації осіб уразливих категорій – все це закладає фундамент для формування психічних розладів. На додачу, зростає потреба у фахівцях сфери психічного здоров’я.
Особливо уразливою є група пацієнтів із психічними порушеннями: супутні розлади можуть підвищувати ризик інфікування COVID‑19.
Це зумовлено впливом таких факторів, як:
- розвиток когнітивного дефіциту;
- низький рівень обізнаності щодо ризиків інфікування і, відповідно, зменшення зусиль стосовно особистого захисту пацієнтів.
Після зараження COVID‑19 особи із психічними розладами можуть мати бар’єри у доступі до отримання своєчасних медичних послуг через дискримінацію, пов’язану із психічними захворюваннями в медичних закладах. Крім того, мультиморбідність – одночасне існування декількох різних захворювань, які погіршують перебіг одне одного та мають психосоціальний компонент, – робить лікування таких пацієнтів складнішим і потенційно менш ефективним. Складність мультиморбідного стану зумовлює труднощі курації та викликає проблему поліфармації (Calderol-Larranaga et al., 2019). Стратегія терапії таких хворих має обговорюватися мультидисциплінарною командою та носити системний характер (Valderas et al,, 2019).
Для практичної допомоги лікарям були розроблені рекомендації щодо ведення стаціонарних хворих на COVID‑19 із психічними розладами (Anmella et al., 2020). При ажитованому делірії експерти запропонували призначення оланзапіну, оскільки у таких пацієнтів слід уникати приймання АП першого покоління. При тяжких психічних захворюваннях варто дотримуватися основних методів терапії. У разі нетяжких психічних розладів із симптомами депресії або тривоги доцільно надавати психологічну підтримку, виявляти симптоми та забезпечувати відповідне лікування.
Олена Олександрівна навела клінічний приклад, що демонструє важливість ефективної психофармакотерапії у лікуванні хворого на COVID‑19 із психічними розладами (Zeng et al., 2021).
Клінічний випадок 1
Пацієнт, 50 років, страждає на артеріальну гіпертензію (АГ), у зв’язку з чим отримує метопролол та ніфедипін, цукровий діабет 2-го типу (лікує метформіном та глібуридом) і шизофренію (приймає рисперидон та кветіапіну фумарат). Чоловік повідомляє, що контроль хронічних захворювань є прийнятним, але його психічний стан незадовільний, що проявляється депресією, тривогою та безсонням.
Скарги. Відчув занедужання: підвищення температури, легкий кашель, задишку, озноб. Через п’ять днів госпіталізований у зв’язку зі стійкою лихоманкою.
Обстеження. Індекс маси тіла – 28,34, АГ компенсована, тахіпное, зниження сатурації крові киснем до 93%, порушення апетиту та сну, очевидні симптоми шизофренії. За результатами комп’ютерної томографії органів грудної клітки: множинні вогнища помутніння («матового скла») в обох легенях. Під час лабораторного обстеження виявлено РНК SARS-CoV‑2 у діагностичному мазку з горла, що дозволило підтвердити COVID‑19.
Лікування. Оксигенотерапія через носовий катетер, метилпреднізолон для послаблення запалення в легенях та підтримувальна психотерапія. Лікування супутніх захворювань продовжене без змін.
Подальший перебіг хвороби. Після підтвердження зараження COVID‑19 пацієнт зазнав різкого погіршення настрою на ранній стадії госпіталізації, відчував тяжку депресію, тривожність, фізичну агресію, параною та виразні симптоми шизофренії. Отримував психологічні консультації та підтримувальну психотерапію, але ефект був слабким. Симптоми шизофренії, безсоння, тривожність перешкоджали лікуванню й були, принаймні частково, причиною переходу перебігу COVID‑19 від середнього до тяжкого.
Через два дні після госпіталізації стан пацієнта погіршився, на тлі носової інгаляції кисню з’явилися задишка та зниження сатурації крові киснем до 92%. Дихальна недостатність ІІ ступеня, гострий респіраторний дистрес-синдром, гіперлактична ацидемія та порушення обміну електролітів значно ускладнювали перебіг захворювання, тому пацієнт був переведений у палату інтенсивного спостереження з апаратом неінвазивної вентиляції легень та кардіомоніторингом.
Подальші терапевтичні заходи. Вкрай важливою для поліпшення прихильності пацієнта до лікування була оптимізація психотропної терапії. Кветіапіну фумарат та рисперидон замінили на оланзапін для зменшення тривожності, проявів безсоння, головного болю.
До схеми лікування додали мідазолам, діазепам та дексмедетомідин для полегшення тривоги та сприяння сну. Крім того, було підсилено підтримувальну психотерапію. У динаміці стан хворого значно поліпшився. Після двох негативних результатів тестування на РНК SARS-CoV‑2, а також редукції запальних уражень обох легень на КТ пацієнт був виписаний додому.
***
Оланзапін являє собою АП широкого спектра фармакологічної дії. Дані дослідження E.L. Altschuler і R.E. Kast (2020) дозволяють рекомендувати дапсон, колхіцин та оланзапін як допоміжні засоби для профілактики респіраторного дистрес-синдрому дорослих, пов’язаного із COVID‑19.
Клінічна ефективність Золафрену для лікування психосоматичних розладів пояснюється його фармакодинамічними рецепторними механізмами дії. Зв’язування з серотоніновими рецепторами 5-НТ2А/2С, 5-НТ3, 5-НТ6 зумовлює наступні ефекти препарату:
- антинегативні, антидефіцитарні та антидепресивні властивості;
- седативну та протитривожну дію;
- поліпшення когнітивних функцій;
- зниження схильності до судом;
- зменшення нудоти, блювання.
Вплив на дофамінові рецептори D1/D5 обґрунтовує призначення Золафрену для редукції позитивних симптомів. Окрім того, оланзапін є антагоністом мускаринових рецепторів М1/М5, адренергічного рецептора α1 і зв’язується із Н1-рецептором, що пояснює його седативний ефект. Хоча точний механізм дії оланзапіну при шизофренії досі невідомий, припускають, що антипсихотична активність опосередковується антагонізмом до рецепторів D2 зі швидкою кінетикою дисоціації ліганд – рецептор, що допомагає мінімізувати екстрапірамідні побічні симптоми.
Наступний клінічний випадок демонструє клінічну значущість усього спектра рецепторних ефектів оланзапіну.
Клінічний випадок 2
Пацієнт, 70 років, страждає на АГ, ішемічну хворобу серця та термінальну стадію ниркової недостатності, що потребувала гемодіалізу в анамнезі. Має ознаки депресії, три роки тому була спроба самогубства, отримує флуоксетин і міртазапін.
Скарги. Пропустивши кілька сеансів гемодіалізу, екстрено звернувся по допомогу, був госпіталізований у відділення невідкладної допомоги в тяжкому стані зі значною втратою ваги та порушенням балансу електролітів. Був замкнутий, дратівливий, часом розгублений, пропускав гемодіаліз. Відмовився від їжі. Було призначено консультацію психіатра.
За висновком психіатра. Прогресивне погіршення симптомів депресії, особливо гіпотимії, ангедонії, безсоння, втрата апетиту й енергії, уповільнення думок і фізичних рухів. Симптоми були виразнішими у другій половині дня, після сеансу гемодіалізу, із деяким зменшенням проявів на ранок наступного дня.
Терапія. Розпочате лікування оланзапіном у низьких дозах для посилення ефективності терапії депресії, з урахуванням можливості легкого делірію та переваг оланзапіну щодо стабілізації циклу сон/неспання. Рецепторний профіль оланзапіну дозволив використовувати його побічні ефекти (зокрема стимуляцію апетиту, набір ваги, протиблювотний ефект, а також основну дію – антигістамінергічну активність при свербінні й нічну седацію) найкращим чином для пацієнта.
* * *
Рішення психіатра було обґрунтоване перевагами використання оланзапіну в низьких дозах для поліпшення якості життя і узгоджувалося з цілями терапії, що у довгостроковій перспективі перевищує ризики. Лікарям-практикам необхідно навчитися працювати із побічними ефектами оланзапіну та надавати відповідні рекомендації пацієнтам. Відчуття сонливості або втоми може тривати кілька годин після отримання дози; в цей час не слід керувати автомобілем та варто уникати вживання алкоголю. За можливості, доцільно призначати приймання ліків у інший час. Відчуття запаморочення зазвичай відбувається на початку терапії і минає впродовж кількох тижнів. Для запобігання підвищенню ваги пацієнтам слід рекомендувати дієтичне харчування з великим вмістом овочів/клітковини та фізичні вправи.
Для лікування шизофренії рекомендована початкова доза оланзапіну становить 10 мг/добу (діапазон – 5‑20 мг). При маніакальному або депресивному епізоді ініціальна доза оланзапіну як монотерапії – 15 мг/добу, у межах комбінованого лікування – 5‑10 мг/добу. Для профілактики повторних нападів у пацієнтів із біполярними розладами рекомендованою є доза 10 мг/добу. Пацієнти з біполярними розладами, які отримували оланзапін для зменшення проявів маніакальних епізодів, продовжують приймати його у тому ж дозуванні для профілактики повторних нападів. За умови розвитку нового маніакального, депресивного або змішаного епізоду лікування доцільно продовжувати (у разі потреби – оптимізувати дозу) разом із підтримувальною терапією з метою зменшення симптомів порушення настрою, якщо є клінічна необхідність.
Важливо пам’ятати, що куріння значно знижує рівень психотропних препаратів у плазмі. Наприклад, кліренс оланзапіну в курців нижчий на 40%, що означає меншу концентрацію препарату в крові. Тютюновий дим містить поліароматичні вуглеводні, які індукують печінкові ферменти. Припинення куріння нормалізує активність ферментів і сприяє підвищенню у плазмі рівня деяких ліків протягом тижня. Так, до 50% збільшується сироваткова концентрація бензодіазепінів, дулоксетину, клозапіну, оланзапіну, флуфеназину після відмови від тютюнокуріння. При цьому необхідне зменшення дозування для уникнення токсичності лікарських засобів. Нікотинова замісна терапія, включно із використанням електронних сигарет, не впливає на печінкові ферменти, – перехід від куріння тютюну до інших форм споживання нікотину має такий самий ефект, як і припинення куріння (NHS, 2021).
Нині лише накопичуються дані щодо призначення оланзапіну для контролю нудоти і блювання. Але високий профіль безпеки препарату дозволяє внести його до рекоменадацій щодо для лікування нестримної нудоти і блювання під час терапії онкологічних захворювань (Ithimakin et al., 2020). До того ж результати систематичних оглядів визначають оланзапін засобом першої лінії для застосування під час лактації (NCBI, 2021).
Підготувала Ольга Загора
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 4 (59) 2021 р.