12 грудня, 2023
Міжнародний консенсус з алергології та ринології: алергічний риніт – 2023
 Алергічний риніт (АР) спричинюється IgE-опосередкованою гіперчутливістю 1 типу слизової оболонки носа в результаті впливу алергену на сенсибілізовану особу [5]. Цей стан характеризується появою таких симптомів, як передня або задня ринорея, закладеність носа, свербіж носа та чхання [13]. АР є широко поширеним станом і може призводити до значних фізичних наслідків і розвитку рецидивних або персистуючих захворювань [5]. Крім того, існує тісний взаємозв’язок між АР та астмою, що підтверджує теорію єдиних дихальних шляхів (ДШ), відповідно до якої запалення верхніх і нижніх ДШ має спільні патофізіологічні механізми [14]. Поширеність АР у світі коливається в межах 5-50%, при цьому найвищу захворюваність спостерігають серед дітей [15].
Алергічний риніт (АР) спричинюється IgE-опосередкованою гіперчутливістю 1 типу слизової оболонки носа в результаті впливу алергену на сенсибілізовану особу [5]. Цей стан характеризується появою таких симптомів, як передня або задня ринорея, закладеність носа, свербіж носа та чхання [13]. АР є широко поширеним станом і може призводити до значних фізичних наслідків і розвитку рецидивних або персистуючих захворювань [5]. Крім того, існує тісний взаємозв’язок між АР та астмою, що підтверджує теорію єдиних дихальних шляхів (ДШ), відповідно до якої запалення верхніх і нижніх ДШ має спільні патофізіологічні механізми [14]. Поширеність АР у світі коливається в межах 5-50%, при цьому найвищу захворюваність спостерігають серед дітей [15].
Визначення та класифікація алергічного риніту
Хоча діапазон поширеності АР широкий, треба брати до уваги, що в опублікованих дослідженнях можуть відрізнятися визначення АР, а в деяких АР може розглядатися як сенсибілізація до алергенів.
Оскільки для розвитку сенсибілізації потрібно декілька років, є низька ймовірність появи АР у дітей до 2-річного віку, зазвичай захворювання дебютує в шкільному віці. АР часто є результатом надмірної реакції Th2-лімфоцитів та ініціації системних IgE-опосередкованих реакцій, які домінують в імунній системі дитини до настання її зрілості.
У хворих з атопією контакт з алергенами спричиняє швидку продукцію алерген-специфічних IgE (sIgE). У подальшому вплив алергенів запускає як ранню, так і пізню реакції, що призводить до клінічних проявів АР. Рання реакція зазвичай виникає протягом декількох хвилин після повторного введення сенсибілізованого алергену, спричинюючи швидку появу свербежу в носі, закладеності носа та ринореї [16].
Пізня реакція часто виникає протягом 4-8 год після повторного контакту з алергеном і призводить до гіперемії, гіпосмії, посилення передньої і задньої ринореї та гіперчутливості носа.
Відповідно до Керівництва з АР та його впливу на астму (Allergic Rhinitis and its Impact on Asthma – ARIA), класифікують АР за ймовірними причинами та часом, протягом якого розвиваються симптоми, а також відповідно до тривалості і стійкості симптомів і за ступенем тяжкості (легкий/помірний/тяжкий). Отже, АР поділяють на сезонний АР (САР; сінна лихоманка) і цілорічний АР (ЦАР). САР зазвичай пов’язаний зі впливом алергенів довкілля, таких як пилок, і виникає в сезони з високою концентрацією пилку в повітрі [5]. ЦАР, як правило, зумовлений алергенами, наявними в приміщеннях, такими як кліщі домашнього пилу (КДП), комахи та лупа тварин [5]. Контакт із цвіллю може відбуватися як у приміщенні, так і на відкритому повітрі.
Варто зазначити, що поділ АР на САР або ЦАР може бути суперечливим. Наприклад, симптоми САР можуть спостерігатися протягом більш тривалого періоду часу внаслідок кліматичних змін, що призводять до тривалішої наявності підвищених концентрацій пилку. САР також може спостерігатися протягом кількох сезонів через полісенсибілізацію. Водночас ЦАР може проявлятися не протягом усього року. Це особливо стосується пацієнтів з алергією на КДП, в яких може спостерігатися легкий або помірної тяжкості / тяжкий інтермітуючий АР [17-20].
Через праймінг-ефект на слизову оболонку носа внаслідок впливу низьких рівнів пилку [21-26] і мінімальне, але стійке запалення носа в пацієнтів із «безсимптомним ринітом» [19, 27, 28] під час контакту з алергеном симптоми можуть зовсім не виникати. Це може призводити до неспецифічних загострень. Крім того, забруднення повітря також може сприяти змінам чутливості до алергенів, що призводить до коливань тяжкості симптомів залежно від місцевості / якості повітря [29].
Як вже зазаначалось вище, ARIA було запропоновано нову класифікацію, засновану на тривалості та стійкості симптомів [30]. Інтермітуючий АР характеризується наявністю симптомів протягом <4 днів на тиждень або <4 тиж поспіль. Стійкий АР характеризується наявністю симптомів упродовж >4 днів на тиждень протягом принаймні 4 тиж поспіль [31]. Крім того, було продемонстровано, що попередній поділ АР на САР і ЦАР не можна використовувати разом із новою класифікацією захворювання, згідно з якою виділяють інтермітуючий або постійний АР, оскільки вони являють собою різний підхід до визначення стану. Таким чином, терміни інтермітуючий АР і персистувальний АР не є синонімами САР і ЦАР [32-35].
У рекомендаціях ARIA також було запропоновано класифікацію АР за ступенем тяжкості (легкої тяжкості, помірної тяжкості і тяжкий) для врахування особливостей симптомів [18]. АР може призводити до значного порушення якості життя, зокрема порушень сну, повсякденної діяльності, відпочинку чи фізичної активності; погіршення продуктивності у школі, на роботі або виснажливих симптомів. АР вважають легким, якщо таких симптомів не виникає. Якщо наявний один або декілька з цих симптомів, АР класифікують як помірної тяжкості / тяжкий.
Фармакотерапія
АГП
Пероральні H1-АГП
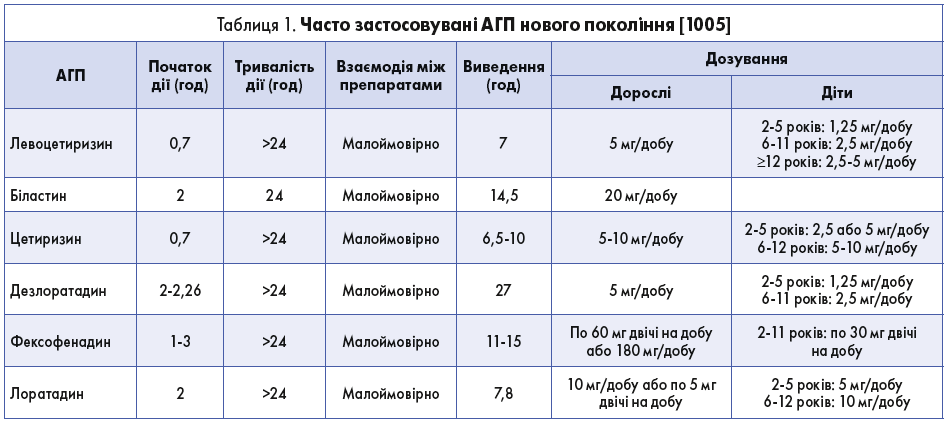
У разі АР sIgE зв’язуються з опасистими клітинами та базофілами, що призводить до вивільнення гістаміну. Ефектами гістаміну є вазодилатація, бронхоконстрикція, підвищення проникності ендотелію та стимуляція сенсорних нервів, що зумовлює виникнення класичних симптомів АР [1771]. АГП є зворотними агоністами гістаміну та призводять до інактивації рецепторів гістаміну [1772]. АГП поділяють на препарати І, ІІ і похідні ІІ покоління. Однак тут ми розглядаємо препарати ІІ покоління і його похідні – нові АГП (табл. 1).
АГП І покоління (наприклад, димедрол і хлорфенірамін) спричинюють антихолінергічні побічні ефекти (ПЕ) та можуть проникати крізь гематоенцефалічний бар'єр (ГЕБ), впливаючи на центральну нервову систему (ЦНС) і спричиняючи седативний ефект і сонливість [1773, 1774]. Ці ПЕ можуть бути вираженішими в осіб похилого віку, тому АГП І покоління слід застосовувати з обережністю [293]. АГП нового покоління (левоцетиризин, біластин, цетиризин, дезлоратадин, фексофенадин і лоратадин) блокують периферичні Н1-рецептори, не проникаючи крізь ГЕБ, що запобігає виникненню ПЕ із боку ЦНС. Декілька АГП нового покоління метаболізуються в печінці за участю ферментів цитохрому P450. Це потрібно враховувати, призначаючи їх на тлі супутнього застосування інших препаратів, які або зазнають метаболізму за участю цитохрому P450 або є його індукторами, оскільки одночасне застосування таких препаратів може призводити до підвищення або зниження концентрації АГП у плазмі [1774].
Оскільки АГП застосовують із 1940-х років, існує багато рандомізованих контрольованих досліджень (РКД) щодо використання пероральних АГП у лікуванні АР. Є кілька опублікованих рекомендацій щодо застосування пероральних АГП для лікування АР. У 2004 р. група ARIA та EAACI (European Academy of Allergy & Clinical Immunology – Европейська академія алергології і клінічної імунології) випустили рекомендації щодо фармакологічних критеріїв, яким мають відповідати загальновживані препарати для лікування АР.
З урахуванням ефективності, безпеки та фармакологічних властивостей, було показано, що АГП нового покоління мають сприятливий профіль «ризик-користь», тому було рекомендовано використовувати їх для лікування АР замість пероральних АГП І покоління [1775]. Рекомендації з клінічної практики Американської академії отоларингології та Фундації хірургії голови та шиї (AAO-HNSF) 2015 року і Канадського товариства алергології та клінічної імунології 2019 року також рекомендували АГП нового, а не І покоління для лікування АР [1005, 1773].
Оновлені рекомендації ARIA 2010 року наполегливо рекомендували застосування АГП нового покоління, які не мають седативного ефекту і не взаємодіють із цитохромом P450 [1004]. Перегляд керівництв ARIA 2016 року містить кілька рекомендацій щодо того, коли розглядати доцільність призначення пероральних АГП, беручи до уваги інші доступні препарати для лікування САР і ЦAР [1167]. У 2020 р. група ARIA опублікувала перші керівні принципи, засновані на GRADE, які об’єднали реальний досвід пацієнтів і клінічні дослідження щодо вибору лікування АР [1182]. У цих рекомендаціях було надано лікувальний алгоритм, який ураховував тяжкість симптомів пацієнта при попередньому і поточному прийомі ліків, щоб з’ясувати роль АГП нового покоління в терапії АР [1182]. Стандартне дозування представників АГП нового покоління наведено в таблиці 1.
Вибір АГП має бути індивідуалізованим, ураховувати дозування, взаємодію з іншими препаратами, ПЕ, початок дії і вартість. Велике дослідження, в якому вивчали всі електронні рецепти на пероральні АГП (n=2280) у Польщі у 2018 р., виявило, що приблизно кожен п’ятий рецепт не був використаний в аптеці [1776]. Це свідчить про те, що необхідно провести подальші дослідження щодо прихильності пацієнтів до пероральних АГП, з огляду на те що на неї можуть впливати різні чинники, вартість препарату і можливість його придбання без рецепту.
За винятком пероральних АГП, доступних лише за рецептом, вартість більшості пероральних АГП нового покоління становить приблизно 2 долари США на добу [1777].
Пероральні H2-АГП
Наше розуміння ролі Н2-рецепторів в опосередкуванні пов’язаних із гістаміном назальних симптомів при АР обмежене. Немає даних, які б порівнювали ефективність пригнічення H2-рецепторів зі звичайною терапією першої лінії, такою як інтраназальні кортикостероїди (ІнКС), і лише кілька відносно невеликих досліджень вивчали вплив антагонізму Н2-рецепторів. Найголовніше, що клінічне значення змін, пов’язаних із H2-АГП, чітко визначено не було. Проте АГП, що блокують H2-рецептори, мають відносно низький ризик міжлікарської взаємодії лікарських препаратів унаслідок зниження кислотності шлункового соку та інгібування цитохрому P450) [1797] та низьку вартість, і в деяких дослідженнях було підтверджено ефективність їх застосування в пацієнтів зі стійкою обструкцією носових ходів у поєднанні з пероральними H1-АГП.
Наявні дані про застосування Н2-АГП при АР обмежені за обсягом і якістю. Ефективність лікування щодо зменшення опору носових ходів свідчить про те, що Н2-рецептори модулюють реакцію назальної тканини на гістамін [1798-1801]. Однак клінічне значення цього механізму залишається неясним, особливо в контексті сучасних алгоритмів лікування [1800-1804]. Зважаючи на прийнятний профіль безпеки і вартість H2-АГП, вони можуть бути додатковим варіантом лікування для пацієнтів із резистентними симптомами АР. Однак додаткові дослідження щодо ефективності H2-АГП у комбінації з іншими місцевими препаратами можуть бути корисними в майбутньому.
Інтраназальні АГП
У Північній Америці наразі доступні два інтраназальні АГП у вигляді спрею – азеластину гідрохлорид і олопатадину гідрохлорид. Було проведено систематичний огляд англомовної літератури для пошуку клінічних випробувань будь-якого з цих препаратів для лікування АР. Усього було виявлено 44 статті, де повідомляли про результати РКД монотерапії інтраназальними АГП, у тому числі 24 дослідження з активною групою порівняння [1479, 1805-1827] та 29 досліджень із неактивною групою плацебо [1808, 1809, 1812-1814, 1816, 1818, 1820, 1822, 1824, 1825, 1828-1845]. Про монотерапію азеластином повідомляли у 37 дослідженнях [1479, 1805, 1806, 1808, 1810-1816, 1818-1828, 1831-1836, 1840-1848], тоді як монотерапія олопатадином була зареєстрована в 10 дослідженнях [1807, 1809, 1829, 1830, 1833, 1835, 1837-1839, 1847]. У деяких дослідженнях використовували кілька активних груп лікування АГП і/або КС. У жодному дослідженні не повідомляли про серйозні ПЕ від використання інтраназального АГП. Загалом зазначено, що ці препарати добре переносилися, а найчастішим зареєстрованим побічним ефектом була непереносимість смаку.
В одному дослідженні, в якому порівнювали засіб зі зміненим складом із комерційно доступною формою азеластину, не було виявлено різниці в частоті неприйняття смаку [1831]. В одному дослідженні повідомляли, що олопатадин має кращі органолептичні властивості, аніж азеластин [1847]. Іншими зареєстрованими ПЕ були сонливість, головний біль, носова кровотеча і дискомфорт у носі – у менш ніж 10% пацієнтів, які отримували лікування азеластином або олопатадином.
У 2021 р. Управління із санітарного нагляду за якістю харчових продуктів та медикаментів (США) (Food and Drug Administration, FDA) схвалило азеластину гідрохлорид для продажу без рецепту, після чого вперше інтраназальні АГП стали доступними без рецепта. Ця зміна може усунути деякі фінансові перешкоди для використання пацієнтами цього препарату та поліпшити його доступність як варіанта лікування АР.
Кортикостероїди
Пероральні КС
У ранніх публікаціях із використанням моделі назальної провокації повідомляли про протизапальну дію пероральних КС у разі АР. Pipkorn та співавт. [1849] проводили премедикацію пацієнтів із САР преднізоном або плацебо протягом 2 днів до провокації алергеном. У порівнянні з плацебо в пацієнтів, які отримували преднізон, спостерігали значно меншу частоту чхання, а також нижчі рівні гістаміну та інших медіаторів, що впливають на проникність судин, у змивах із носа під час пізньої фази відповіді. Активне лікування також зменшувало первинну реакцію на подальшу провокацію алергенами.
Таким чином, пероральні КС ефективні для лікування АР. Проте, з огляду на значні системні ПЕ, пов’язані з використанням цих засобів протягом тривалого часу, а також наявність ефективних інтраназальних препаратів, які виявляють менший системний вплив, пероральні КС не рекомендують для рутинного лікування АР.
Інтраназальні кортикостероїди
Традиційні спреї
ІнКС мають потужні протизапальні властивості та значно пригнічують вивільнення медіаторів і цитокінів, а також надходження запальних клітин до слизової оболонки носа та знижують їх уміст у назальному секреті [255, 496, 1859-1861]. ІнКС також зменшують індуковану антигенами гіперчутливість слизової оболонки носа до наступної провокації [255, 1862, 1863].
Клінічні випробування в дорослих і дітей продемонстрували ефективність IнКС щодо зменшення назальних симптомів АР [1864-1866]. ІнКС також значно поліпшують якість життя пацієнтів [1865, 1867, 1868] і якість сну [1053, 1107, 1108, 1869, 1870]. Ефект препаратів розвивається через 3-5 год після застосування, а тривалість дії становить до 60 год [1871-1874]. Хоча безперервне щоденне використання IнКС загалом є ліпшим [1875, 1876], дослідження продемонстрували перевагу використання інтраназального флутиказону пропіонату за потреби над плацебо [1877, 1878], а в одному дослідженні було показано еквівалентний ефект від використання IнКС за потреби і постійного їх застосування [1879].
ІнКС позитивно впливають на очні симптоми алергії [1880-1883] внаслідок зменшення назоокулярного рефлексу [1884]. Цей ефект є неоднаковим у різних препаратів [1885]. Деякі, але не всі, дослідження наводять на думку, що ІнКС поліпшують контрольованість астми та зменшують частоту загострень [1886-1888].
У порівняльних дослідженнях не було виявлено істотних відмінностей ефективності між наявними засобами [1867], в одному дослідженні було показано перевагу використання препарату в подвійній дозі [1889]. ІнКС продемонстрували ліпшу ефективність порівняно з H1-АГП щодо контролю назальних симптомів, у тому числі закладеності носа, без значущої різниці щодо очних симптомів [1890-1892]. Проте для швидкого полегшення закладеності носа (через годину після прийому) комбінація лоратадин-псевдоефедрин була кращою, ніж інтраназальний флутиказону пропіонат [1488]. ІнКС ефективніші за антагоністи лейкотриєнових рецепторів (АЛР) [1892-1894]. Різні препарати ІнКС мають схожу ефективність, це робить їхні органолептичні властивості важливим чинником, що впливає на вибір пацієнта [1895]. До них належать наявність післясмаку, витікання з носа, стікання препарату в горло та запах; за цими властивостями препарати дещо відрізняються [1896].
Найпоширеніші ПЕ ІнКС зумовлені місцевим подразненням і охоплюють сухість, печіння, поколювання, кров’янисті виділення та носові кровотечі.
Нетрадиційне застосування
ІнКС для лікування АР зазвичай застосовують за допомогою дозованих пристроїв. Вивчалися інші шляхи доставки препаратів (зрошення та небулізація).
ІнКС також використовують у вигляді крапель, зазвичай для лікування поліпів носа. У кількох випадках їх використання для лікування АР спостерігали системне всмоктування препаратів, що призводило до таких ПЕ, як пригнічення росту та надниркових залоз [1930] або ятрогенний синдром Кушинга [1931]. У дослідженні, в якому порівнювали флутиказону пропіонат у формі назальних крапель або водного спрею, краплі продемонстрували у вісім разів більшу системну біодоступність, ніж спрей [1932].
Ін’єкційні КС
КС для лікування АР вводили внутрішньом’язово або в носові раковини. Декілька ранніх досліджень продемонстрували значне покращення суб’єктивних симптомів алергії після внутрішньом’язових ін’єкцій КС. Чотири з цих досліджень були одноцентровими РКД із групою порівняння, що застосовувала плацебо, та обмеженою кількістю учасників [1933-1936].
Відомо, що ін’єкційні КС призводять до небажаних ПЕ на гіпоталамо-гіпофізарну вісь, ріст, спричинюють остеопороз, погіршують контроль глікемії та зумовлюють інші системні ПЕ протягом різного періоду часу після ін’єкції. КС, що вводять у носові раковини, характеризуються незначним, але потенційно серйозним ризиком виникнення ПЕ із боку очей, у тому числі зниження або втрата зору.
Деконгестанти
Пероральні деконгестанти
Пероральні деконгестанти (ПДК) – це препарати, які діють на адренергічні рецептори, що призводить до звуження малих кровоносних судин (наприклад, у слизовій оболонці носа), забезпечуючи полегшення закладеності носа у пацієнтів з АР. Найчастіше використовуваними ПДК є псевдоефедрин і фенілефрин, які являють собою симпатоміметичні вазоконстриктори, що вирізняються селективною дією на адренорецептори [1957]. У разі перорального прийому псевдоефедрину і фенілефрину обидва препарати виявляють системну дію і можуть спричинювати ПЕ, зокрема безсоння, головний біль, нервозність, тривожність, тремор, серцебиття, затримку сечі, підвищення артеріального тиску та ін. [1005, 1958-1960].
Інтраназальні деконгестанти
ІнДК – оксиметазолін, ксилометазолін і фенілефрин – є топічними α-адренергічними агоністами, що діють як судинозвужувальні засоби, зменшуючи набряк/товщину слизової носа [182].
Відомими ПЕ ІнДК є дискомфорт / відчуття печіння в носі, розвиток залежності від препарату, сухість, посилення закладеності носа, медикаментозний риніт, гіпертензія, тривожність і тремор. В одному дослідженні було виявлено істотне зниження частоти руху війок при застосуванні дози препарату 1000 мкг/мл, але при застосуванні дози 500 мкг/мл суттєвої різниці не спостерігали [1981]. Концентрація 500 мкг/мл (0,5 мг/мл; 0,05%) є типовою для доступних фармакологічних засобів. Загалом, з огляду на те що ІнДК ефективно зменшують закладеність носа, рекомендовано короткочасне їх застосування (протягом ≤3 дні), щоб уникнути повторного розвитку закладеності носа і медикаментозного риніту [111].
Антагоністи лейкотрієнових рецепторів
Вивчали застосування АЛР при лікуванні АР. Монтелукаст схвалений FDA для лікування САР у дорослих і дітей старше 2 років, а також ЦАР у дорослих і дітей старше 6 місяців. Іншими АЛР є пранлукаст (схвалений для лікування АР в Японії) і зафірлукаст (схвалений FDA для лікування астми).
Після того як 2018 року було опубліковано консенсус ICAR щодо АР [1], збільшилася кількість доказів щодо монотерапії АЛР. Під час систематичного огляду було виявлено 15 систематичних оглядів та метааналізів РКД, опублікованих із 2014 року. Загалом було виявлено 34 дослідження, які вивчали використання АЛР в лікування АР та які вважаються такими, що надають докази високого рівня.
Дослідження 1982-1986 років демонструють такі самі результати, згідно з якими монотерапія АЛР є ефективнішою за плацебо щодо контролю симптомів і поліпшення якості життя в разі як САР, так і ЦАР, за винятком одного РКД (1987), в якому різниці виявлено не було. Yoshihara та співавт. (1988) виявили, що АЛР є перспективним профілактичним засобом у дітей із САР при застосуванні перед сезоном пилкування японського кедра.
Однак є чіткі докази, що АЛР поступаються ІнКС щодо зменшення симптомів і поліпшення якості життя [1894, 1989, 1990]. У РКД, проведеному Chen та співавт. [1989], АЛР поступався ІнКС у поліпшенні показників акустичної ринометрії, концентрації медіаторів запалення у виділеннях із носа і складу запальних клітин (Th1, Th2, Treg), отриманого при цитологічному дослідженні зіскрібків із носових раковин. Dalgic та співавт. [1991] виявили, що АЛР поступаються ІнКС у поліпшенні нюхової функції в пацієнтів із САР. У порівнянні з пероральними АГП докази щодо відносної ефективності цих препаратів доволі суперечливі [1992-1994], а останні дослідження свідчать на користь пероральних АГП. Щодо добової варіації симптомів АР, Feng та співавт. [1992] виявили, що АЛР є ефективнішими за пероральні АГП щодо контролю симптомів уночі, але поступаються ефективністю щодо симптомів протягом дня. Монотерапію АЛР також порівнювали з алерген-специфічною імунотерапією (АСІТ) і виявили, що вона поступається АСІТ щодо ефективності контролю симптомів [1982, 1995].
У березні 2020 року FDA США оголосило про наявну пересторогу щодо безпеки монтелукасту та можливість серйозних нейропсихіатричних явищ, у тому числі виникнення суїцидальних думок. До інструкції про препарат було додано попередження в чорній рамці («boxed warning»), що є найсерйознішим попередженням FDA. Крім того, FDA рекомендувало обмежити застосування монтелукасту в лікуванні АР у пацієнтів, в яких лікування АР виявилося неефективним або з непереносимістю інших протиалергійних ліків [1997].
У Рекомендаціях із клінічної практики лікування АР 2015 року AAO-HNSF рекомендовано не застосовувати монотерапію АЛР, оскільки вона менш ефективна, аніж інші препарати першого ряду, а також дорожча [1005]. У 2020 р. ця настанова була схвалена American Academy of Family Physicians [1998]. Того ж року Спільна робоча група з практичних параметрів опублікувала оновлення, відповідно до якого не рекомендовано обирати АЛР для початкового лікування АР [182].
Попри те що монотерапія АЛР послідовно демонструвала більшу ефективність у лікуванні АР, ніж плацебо, зараз є велика кількість доказів, що альтернативні препарати, такі як ІнКС, є ефективнішими й дешевшими [1]. Ураховуючи ризики застосування АЛР, як попереджує FDA, монотерапія АЛР не рекомендована для першого ряду лікування в пацієнтів з АР, але може розглядатися в окремих пацієнтів, які мають протипоказання до застосування пероральних АГП та ІнКС.
Інтраназальний кромолін
Динатрію кромоглікат [ДНКГ; кромолін натрію, натрію кромоглікат, динатрій 4,4’-діоксо‑5,5’-(2-гідрокситриметилендіокси)ді(4Н-хромен‑2-карбоксилат] є стабілізатором опасистих клітин, який пригнічує вивільнення їхніх медіаторів, що сприяють IgE-опосередкованому запаленню [2015, 2016]. ДНКГ схвалено FDA для використання в дорослих і дітей (від 2 років) для профілактики та зменшення назальних симптомів АР і є доступним у вигляді назального спрею, що відпускається без рецепту. Препарат має швидкий початок дії, ефект триває до 8 год, застосовується по 1 вприскуванню 3-6 разів на добу, переважно для запобігання появі симптомів у разі контакту з алергеном, але може використовуватися і для купування симптомів [2017-2020]. (Примітка редакції: на сьогодні препарати цієї групи не зареєстровані в Україні.)
Інтраназальні антихолінергічні засоби
Іпратропію бромід (ІПБ) є синтетичним антихолінергічним препаратом четвертинної сполуки амонію, споріднений до атропіну. Ефекти ІПБ досліджували при назальному введенні метахоліну в пацієнтів з АР. Було встановлено, що він зменшує ринорею та чхання без впливу на опірність носових ДШ [2050, 2051]. Крім того, застосування ІПБ призводило до зниження ринореї після впливу холодного повітря та вживання гарячих страв. Це свідчить про те, що цей вид ринореї виникає в результаті рефлексу, який спричиняє гіперсекрецію носових залоз [2052]. ІПБ ефективно контролює передню ринорею, не впливаючи на закладеність носа або чхання [2053-2058]. IПБ доступний у концентрації 0,03% і 0,06% і є ефективним у дорослих і дітей із ЦАР (0,03%) і застудою (0,06%) [2056, 2059]. Препарат має швидкий початок дії та короткий період напіввиведення і може застосовуватися до 6 разів на добу, а його абсорбція у діапазоні доз 84-336 мкг/добу становить менш ніж 10% [2060].
Інтраназальний ІПБ погано всмоктується, при застосуванні терапевтичних доз системні ПЕ не спостерігали, оскільки для виникнення системних антихолінергічних ефектів концентрації препарату в плазмі крові мають перевищувати 1,8 нг/мл [2060].
Однак при застосуванні препарату потрібно бути обережними, щоб уникнути передозування, яке може призвести до створення вищих концентрацій препарату в сироватці крові. ПЕ топічного застосування ІПБ переважно мають місцевий характер. IПБ схвалено FDA для лікування САР як у дорослих, так і в дітей ≥5 років. IПБ ефективний для контролю ЦАР у дітей і дорослих.
Імунобіологічні препарати
Імунобіологічними препаратами, які досліджували для лікування алергічних захворювань, є омалізумаб, меполізумаб, дупілумаб, бенралізумаб і реслізумаб [2069]. Ці сполуки діють шляхом таргетного впливу на конкретні компоненти шляхів, задіяних у запаленні 2 типу. Омалізумаб діє на IgE; дупілумаб на α-субодиниці рецептора IL‑4 (розпізнається IL‑4 та IL‑13); меполізумаб, бенралізумаб і реслізумаб впливають на IL‑5 або його рецептор [2069]. Щодо лікування АР вивчали лише омалізумаб і дупілумаб. Імунобіологічні препарати наразі схвалені FDA для лікування персистуючої астми середньої тяжкості та середньо-тяжкого ступеня, атопічного дерматиту, хронічного риносинуситу з назальними поліпами, хронічної ідіопатичної кропив’янки та еозинофільного езофагіту (EoE), але не для АР [2070].
Імунобіологічні препарати демонструють багатообіцяючі результати в лікуванні АР, який не відповідає на оптимальне фармакологічне лікування. Омалізумаб є найбільш вивченим і видається ефективним щодо зменшення вираженості симптомів, потреби в застосуванні інших ліків та поліпшення якості життя, а також є безпечним із точки зору ПЕ. Нині широке застосування імунобіологічних препаратів для лікування АР обмежене через високу вартість лікування і відсутність схвалення FDA. Крім того, вважають, що використання імунобіологічних препаратів має бути тривалим і після припинення його застосування симптоми захворювання можуть повернутися. Хоча не було проведено аналіз підгруп для визначення ефективності біопрепаратів у лікуванні АР із супутньою бронхіальною астмою, очікують, що співвідношення витрат і переваг у таких клінічних випадках значно поліпшиться [2072].
Інтраназальне застосування розчину натрію хлориду
Назальний розчин натрію хлориду (сольовий розчин) часто використовують у лікуванні АР. Однак термін «сольовий розчин для назального застосування» охоплює широкий спектр терапевтичних схем. Вони можуть відрізнятися за характеристиками розчину, наприклад концентрацією солі (гіпертонічний або ізотонічний/ фізіологічний розчин) і буферними властивостями (буферниий або небуферний), а також частотою, об’ємом і способом уведення.
Загалом, є переконливі докази, що підтримують інтраназальне використання сольового розчину для лікування АР. Дані щодо оптимальної концентрації сольового розчину в дорослих суперечливі. Щодо дітей є деякі дані, що підтверджують більшу ефективність гіпертонічного розчину. Хоча назальний сольовий розчин зменшує симптоми і поліпшує якість життя при монотерапії, його часто застосовують паралельно з іншими препаратами, такими як ІнКС, інтраназальними або пероральними АГП. Як у дорослих, так і в дітей назальний сольовий розчин виявляє додатковий ефект при використанні в поєднанні з іншими стандартними методами лікування АР. Ба більше, назальний сольовий розчин має відносно низьку вартість і є безпечним. Хоча й рідко, сольовий розчин може спричинювати подразнення носа, чхання, кашель і закладеність вух.
Рекомендації з лікування АР наведено на рисунку.
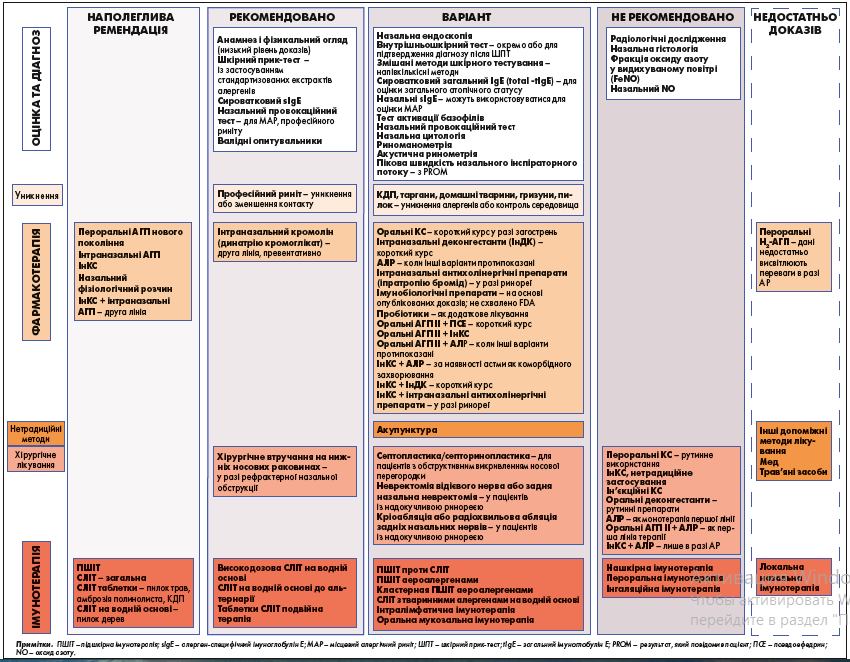 Рис. Рекомендації щодо лікування АР
Рис. Рекомендації щодо лікування АР
Комбінована терапія
Пероральні АГП і ІнКС
Комбінація перорального АГП з ІнКС широко застосовують для лікування пацієнтів з АР. Зазвичай, перевагу віддають АГП ІІ покоління (левоцетиризину, цетиризину, фексофенадину, лоратадину, дезлоратадину, тощо), з огляду на їх поліпшений профіль безпеки. ІнКС зменшують вивільнення медіаторів запалення та цитокінів; пригнічують рекрутування еозинофілів, нейтрофілів, базофілів, лімфоцитів, моноцитів і макрофагів у носі і можуть зменшувати гіперреактивну відповідь на контакт з антигеном.
ІнКС характеризується відмінним профілем безпеки та низькою системною абсорбцією.
Було проведено декілька РКД, які вивчали використання комбінації пероральних АГП і ІнКС для лікування АР. Pinar та співавт. [2141] для порівняння 4 груп використовували шкалу TNSS, шкалу оцінки ринокон’юнктивіту і пікову швидкість назального інспіраторного потоку (PNIF): 1-ша група застосовувала інтраназальний мометазон і пероральний дезлоратадин, 2-га – інтраназальний мометазон і пероральний монтелукаст, 3-тя – інтраназальний мономометазон, 4-та – плацебо. Це дослідження показало, що інтраназальний мометазон у комбінації з дезлоратадином або монтелукастом забезпечував кращий ефект, аніж монотерапія інтраназальним мометазоном або плацебо, щодо поліпшення оцінки TNSS та якості життя.
Anolik [2142] досліджував оцінку TNSS і TSS у пацієнтів, які отримували комбіноване лікування інтраназальним мометазоном і пероральним лоратадином, монотерапію інтраназальним мометазоном, монотерапію пероральним лоратадином або плацебо. Це дослідження продемонструвало, що інтраназальний мометазон плюс лоратадин, а також монотерапія інтраназальним мометазоном були статистично еквівалентними щодо TNSS і TSS. Усі групи лікування перевершували плацебо щодо поліпшення оцінки за шкалою TNSS та TSS. У дослідженні також повідомляли, що ефективність інтраназального мометазону і комбінації мометазону-лоратадину перевершує таку монотерапії лоратадином або плацебо щодо оцінки за шкалою TNSS і TSS, тоді як ефективність монотерапії лоратадином перевершує таку плацебо щодо оцінки за шкалою TNSS [2142].
Ratner та співавт. [2145] досліджували ефективність комбінації інтраназального флутиказону з пероральним лоратадином проти монотерапії флутиказоном, лоратадином або плацебо. Було виявлено, що флутиказон і флутиказон–лоратадин ефективніші за лоратадин і плацебо щодо загальних і індивідуальних оцінок клініциста і пацієнта назальних симптомів і що монотерапія лоратадином еквівалентна до плацебо щодо оцінки назальних симптомів. Поліпшення якості життя було більшим у пацієнтів, що отримували флутиказон і комбінацію флутиказон–лоратадин, порівняно з монотерапією лоратадином або плацебо. Поліпшення якості життя було статистично еквівалентним у пацієнтів, що отримували флутиказон–лоратадин, порівняно з монотерапією флутиказоном.
Пероральний АГП і АЛР
Комбінацію пероральних АГП–АЛР для лікування АР було розглянуто як терапевтичний варіант у попередньому консенсусі ICAR–Алергічний риніт 2018 [1].
Під час оновленого систематичного пошуку було виявлено 3 додаткові систематичні огляди та 2 РКД [1983, 1985, 2153-2155], що загалом становить 17 досліджень, які відповідають критеріям 1 або 2 рівня доказовості.
У багатьох РКД було показано, що комбінація пероральний АГП–АЛР перевершує плацебо. Останні дослідження намагалися з’ясувати ефективність комбінованої терапії порівняно з монотерапією АЛР або пероральними АГП, що раніше було визначено недостатньо.
Загалом, комбінація пероральний АГП–АЛР є ефективним варіантом терапії порівняно з плацебо. Однак, зважаючи на профіль несприятливих ефектів монтелукасту, ми рекомендуємо розглянути інші ефективні засоби, такі як ІнКС, які забезпечують кращий контроль симптомів, комбінація пероральний АГП–АЛР рекомендована в рідкісних випадках, коли пацієнти мають протипоказання до альтернативних методів лікування.
ІнКС та інтраназальний АГП
Для лікування АР доступна комбінована терапія ІнКС плюс інтраназальний АГП у вигляді спрею. Один комбінований препарат для інтраназального застосування у вигляді комбінації азеластину гідрохлориду і флутиказону пропіонату (AzeFlu) сьогодні доступний у Північній Америці. Цей засіб ще може позначатися в літературі як MP-AzeFlu або MP29-02. Друга комбінація – олопатадину та мометазону (OloMom) була схвалена FDA у січні 2022 року.
Поточний дозвіл FDA на комбінований препарат AzeFlu поширюється на дітей віком від 6 років, хоча показаннями до монотерапії є АР у пацієнтів віком від 4 років для флутиказону та 6 міс – для азеластину. Застосування препарату в дітей віком від 6 до 12 років вивчали у двох дослідженнях, в яких було продемонстровано перевагу AzeFlu над плацебо щодо поліпшення симптомів та якості життя пацієнтів [2170, 2180]. Кілька досліджень повідомляли про те, що AzeFlu починав діяти швидше за монотерапію ІнКС.
У жодному дослідженні не повідомляли про серйозні ПЕ від використання комбінації ІнКС–інтраназальний АГП. Така комбінована терапія загалом добре переносилася, а найпоширенішим побічним ефектом була неприйнятність смаку. Інші зареєстровані ПЕ виникали менш ніж у 5% випадків у будь-якому дослідженні та охоплювали сонливість, головний біль, носову кровотечу і дискомфорт у носі. В одному дослідженні, в якому порівнювали комбіновану терапію флутиказону пропіонатом з азеластином або олопатадином, повідомляли про більшу кількість ПЕ, пов’язаних із лікуванням, у групі азеластину, ніж у групі олопатадину [2177]. Очні зміни, такі як підвищення внутрішньоочного тиску і розвиток катаракти, малоймовірні, проте рекомендовано з обережністю призначати ці препарати пацієнтам із глаукомою в анамнезі [1922]. Під час вибору комбінованої терапії потрібно враховувати додаткові специфічні чинники з боку пацієнта.
ІнКС–АЛР
Було досліджено застосування комбінації АЛР з ІнКС для лікування АР. Монтелукаст є єдиним схваленим FDA АЛР для лікування САР у дорослих і дітей старше 2 років, а також ЦАР у дорослих і дітей старше 6 місяців. Проте попередження FDA у 2020 р. рекомендує обмежити застосування монтелукасту при лікуванні АР через серйозні нейропсихіатричні ефекти, починаючи від поведінкових змін до суїцидальних думок або суїцидальної поведінки [1997]. Для пацієнтів з астмою та АР АЛР можна розглядати для лікування, з урахуванням ризиків із точки зору психічного здоров’я.
Монтелукаст вивчали в комбінації з ІнКС, щоб визначити, чи застосування АЛР на додаток до ІнКС забезпечує поліпшення результатів лікування. З огляду на попередження FDA [1997] та неоднорідні результати досліджень, використання АЛР у комбінації з ІнКС передусім треба розглядати в пацієнтів із коморбідною астмою, а не ізольованим АР. Необхідне відповідне консультування щодо ризиків для психічного здоров’я пацієнтів і сімей, підкреслюючи важливість моніторингу будь-яких нейропсихіатричних симптомів незалежно від наявності в анамнезі психіатричних розладів.
Алерген-специфічна імунотерапія
Вибір методу і кандидатів для проведення алерген-специфічної імунотерапії
Із трьох основних методів лікування АР – уникнення алергенів, фармакотерапія та алерген-специфічна імунотерапія (АСІТ) – остання є єдиним методом, що модифікує перебіг хвороби завдяки індукуванню імунологічної толерантності [2418]. АСІТ можна розглядати в разі, якщо в пацієнта IgE-позитивний результат шкірного або in vitro тестування на алерген, який корелює з контактом з алергеном і симптомами захворювання. Наявність лише sIgE вказує на чутливість до алергену, яка може не призводити до виникнення клінічно значущих симптомів алергії.
Більшість позиційних документів щодо AСIT рекомендують її застосування в пацієнтів із помірними та тяжкими симптомами, які не контролюються за допомогою уникнення алергенів і/або фармакотерапії [2418, 2419]. Однак є докази того, що ПШІТ є принаймні так само ефективною, як і фармакотерапія, щодо контролю симптомів САР уже протягом першого сезону алергії після початку лікування [2420]. Хоча немає прямих доказів того, що АСІТ так само ефективна, як і фармакотерапія для первинного лікування АР, більшість РКД, які оцінювали ефективність СЛІТ або ПШІТ, показали поліпшення симптомів і/або зменшення потреби в ліках у разі АСІТ порівняно з плацебо. Одним із застережень щодо цих досліджень є той факт, що пацієнтам у групах плацебо було дозволено використовувати протиалергічні препарати і по суті ці пацієнти становили групи фармакотерапії, а не справжню групу плацебо [2421, 2422].
Пацієнти, в яких розвивалися побічні реакції на традиційну фармакотерапію або які відмовлялися від тривалого прийому ліків, також є відмінними кандидатами для AСIT. Є переконливі докази, що вказують на зменшення вживання ліків протягом 3 років після завершення як ПШІТ, так і СЛІТ [2423-2425]. У подвійному сліпому плацебо-контрольованому рандомізованому дослідженні не було виявлено різниці в оцінці симптомів у пацієнтів через 4 роки після АСІТ та в тих, хто продовжив імунотерапію [2423].
Існує теорія, що перевагою застосування імунотерапії і, можливо, показанням для АСІТ є можливість запобігти прогресуванню вже існуючого розвитку або зменшити ризик розвитку іншого алергічного захворювання. Однак недавній метааналіз 32 досліджень не виявив переконливих доказів того, що АСІТ знижує ризик розвитку в довготривалій перспективі нових алергічних захворювань і сенсибілізації як у дітей, так і в дорослих [2426]. Це дослідження виявило зниження короткочасного ризику розвитку астми в пацієнтів з АР (ВР 0,4; 95% ДІ 0,30-0,54). В інших дослідженнях було виявлено докази, що АСІТ допомагає знизити ризик розвитку астми [2427, 2428]. У подвійно сліпому РКД за участю 812 дітей віком 5-12 років із клінічно значущим АР без астми в анамнезі пацієнти протягом 3 років отримували СЛІТ із пилком трав або плацебо; протягом 2 років проводили спостереження за пацієнтами. В учасників із групи СЛІТ спостерігали значне зниження ризику виникнення симптомів астми або зменшення застосування ліків від астми протягом періоду лікування і наприкінці 5-річного періоду [2429].
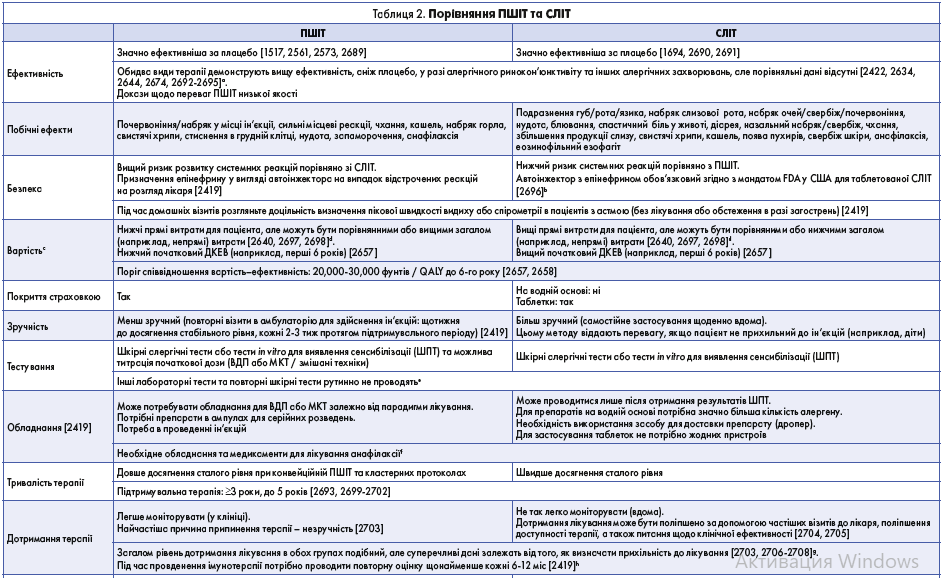
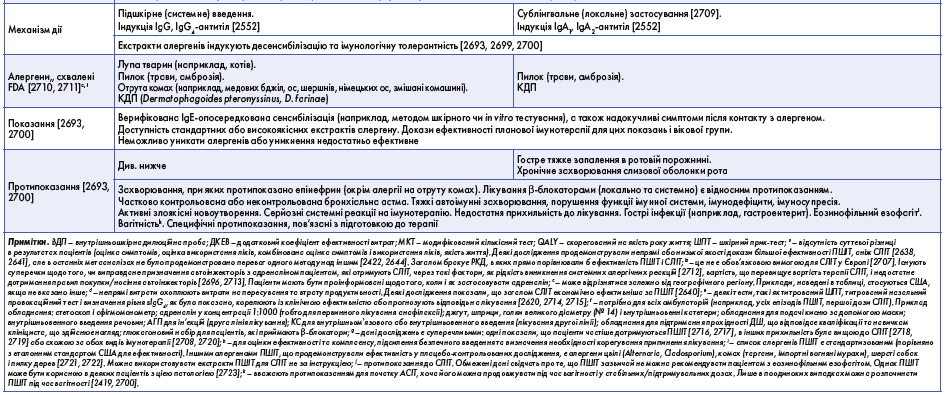
Клініцисти мають знати, що деяким групам пацієнтів АСІТ не підходить. Абсолютні та відносні протипоказання до АСІТ розглянуто нижче. Є обмежені докази ефективності АСІТ для лікування АР у дітей віком до 5 років. Водночас є дані, які свідчать про ефективність і безпеку як СЛІТ, так і ПШІТ у дітей ≥5 років [2430, 2431]. Доволі складна ситуація з дотриманням АСІТ, тому під час вибору лікування треба ретельно обдумати ризики й переваги її застосування, варто врахувати погіршення якості життя, фінансову доцільність АСІТ та побажання пацієнта. Порівняльна характеристика ПШІТ та СЛІТ наведена в таблиці 2.
Переваги АСІТ при АР
Підшкірна імунотерапія є найліпше вивченою формою АСІТ, вона ефективна при АР та ринокон’юнктивіті, алергічній астмі та алергії на отруту перетинчастокрилих [2432]. ПШІТ використовують уже понад століття у вигляді водних екстрактів природних алергенів; її ефективність і безпека поліпшилися з появою стандартизованих екстрактів і дослідженням механізмів дії імунотерапії [2433]. ПШІТ передбачає повторні підшкірні ін’єкції екстракту алергену, до якого сенсибілізований пацієнт, починаючи з дуже малих доз із поступовим їх збільшенням. Далі, упродовж 3-5 років, проводять повторні ін’єкції алергену в найвищій або підтримувальній дозі для зменшення симптомів у разі контакту з цим алергеном. Клінічне та фізіологічне поліпшення можна помітити незабаром після того, як пацієнт досягає підтримувальної дози алергену [2419]. Також AСIT може затосовуватися в сублінгвальній формі (СЛІТ); розчинні таблетки FDA було схвалено для обмеженої кількості алергенів [2434] (див. табл. 2).
На відміну від інших варіантів лікування алергічних захворювань, АСІТ допомагає досягти стійких імунологічних змін, змінюючи реакції імунної системи та індукуючи тривалу імунну толерантність до алергенів.
Незважаючи на великий досвід застосування цієї терапії протягом десятиліть, механізми, що лежать в основі АСІТ, не були повністю з’ясовані. Хоча існує менше досліджень механізмів СЛІТ порівняно з ПШІТ, наявні дані вказують, що обидві форми АСІТ спричинюють подібні імунологічні зміни. Наприклад, зменшення дегрануляції мастоцитів і базофілів; початкове збільшення, потім зменшення рівнів sIgE та підвищення рівня алерген-специфічних IgG (sIgG) блокувальних антитіл; продукування алерген-специфічних регуляторних Т- і В-клітин і пригнічення алерген-специфічних ефекторних Т-лімфоцитів і лімфоїдних клітин вродженого імунітету; зменшення кількості тканинних мастоцитів і еозинофілів, що супроводжується зменшенням шкірних реакцій 1 типу [2435, 2436]. Клінічно виражені зміни виникають раніше при застосуванні ПШІТ, а при СЛІТ більш виражена sIgG4 відповідь [2437].
Ефективність АСІТ для лікування АР підтверджується великою кількістю доказів і, як правило, визначається зменшенням вираженості симптомів алергії і потреби в протиалергічних препаратах [2438-2440]. Хоча метааналіз демонструє, що AСIT є ефективною, оцінка ефективності (і безпеки) має обмежуватися продуктами алергенів, які досліджували в ході клінічних випробувань. Неправильно робити загальне припущення, що всі форми AСIT ефективні, оскільки це може призвести до клінічного використання продуктів, які не були належним чином вивчені [1].
Під час оцінки потреби проведення AСIT необхідно враховувати тяжкість і тривалість симптомів АР, а також супутні захворювання, такі як астма [2419]. Рішення про початок АСІТ залежить від низки чинників, у тому числі побажань пацієнта, дотримання лікування, відповіді на уникнення контакту з алергенами, необхідності у застосуванні препаратів і ПЕ ліків. Під час АСІТ треба оцінювати стан пацієнтів кожні 12 міс [182]. Хоча після припинення АСІТ у багатьох пацієнтів спостерігають тривалу клінічну ремісію алергічного захворювання, в інших можуть виникати рецидиви. Рішення про продовження ефективної AСIT, як правило, потрібно приймати після початкового лікування тривалістю 3-5 років [182].
Як зазначалося, у метааналізі 2017 року, що оцінював профілактичні ефекти АСІТ (ПШІТ і СЛІТ), було виявлено докази зменшення розвитку астми в пацієнтів з АР в короткостроковій перспективі (<2 роки) [2426]. Аналіз також вивчав довгостроковий ризик розвитку астми, а також здатність АСІТ запобігати виникненню першого алергічного захворювання у сенсибілізованих, але безсимптомних осіб або запобігати сенсибілізації до нових алергенів. Було виявлено тенденції, що вказували на переваги АСІТ, але висновки є непереконливими.
Протипоказання до АСІТ
Протипоказання до АСІТ трапляються рідко, але в усіх пацієнтів треба перед початком лікування перевіряти наявність таких протипоказань. У разі як СЛІТ, так і ПШІТ найважчим побічним ефектом є анафілаксія. Тому багато абсолютних і відносних протипоказань до АСІТ безпосередньо пов’язані з ризиком анафілаксії, у тому числі супутня неконтрольована астма, застосування β-блокаторів, протипоказання до ін’єкцій адреналіну і вагітність.
Неконтрольована астма може бути єдиним найважливішим чинником ризику. Про меншу кількість серйозних реакцій на ін’єкції повідомляли в тих амбулаторіях, в яких регулярно перевіряли пацієнта на наявність ознак неконтрольованої астми та не виконували ін’єкції таким пацієнтам [2441]. Більшість летальних реакцій були пов’язані з бронхоспазмом і/або дихальною недостатністю [2441, 2442].
Через те що ін’єкційний адреналін не здатний діяти на β-адренергічні рецептори, використання β-блокаторів вважають відносним протипоказанням до АСІТ. Оскільки приблизно 0,1% ін’єкцій АСІТ можуть призводити до системних симптомів і 0,003% реакцій можна вважати тяжкими, здатність надати невідкладну допомогу за допомогою адреналіну в разі анафілактичної реакції є життєво необхідною [2443]. Використання β-блокаторів не збільшує ймовірність виникнення системних реакцій, але, хоча вони не спостерігаються постійно, можуть бути пов’язані з тяжчим перебігом анафілактичної реакції [2444, 2445]. Таким чином, відсутність ефекту від звичайного підшкірного введення адреналіну в пацієнта, що використовує β-блокатори, є дилемою для лікаря.
Хоча рекомендації варіюють, деякі гайдлайни вважають активні системні автоімунні захворювання та активні злоякісні пухлини протипоказанням до АСІТ [2446]. Ця рекомендація ґрунтується на повідомленнях про випадки та серії випадків і доказах нижчої якості вищого ризику анафілаксії під час застосування АСІТ у пацієнтів із цими захворюваннями або що імуномодулювальний ефект може негативно вплинути на основне захворювання. У кількох випадках повідомляли про успішне проведення АСІТ у пацієнтів зі злоякісними новоутвореннями [2447]. Подібним чином, теоретичне занепокоєння щодо автоімунних захворювань заперечується кількома випадками, в яких було продемонстровано відносну безпеку й ефективність АСІТ у пацієнтів із супутніми автоімунними захворюваннями [2448]. Крім того, у великому обсерваційному дослідженні за участю 1888 пацієнтів не спостерігали посилення симптомів автоімунних захворювань у разі лікуванн АР за допомогою АСІТ протягом 20-річного періоду спостереження [2449].
Починати АСІТ під час вагітності протипоказано, хоча в більшості консенсусних документів зазначено, що продовження підтримувальної імунотерапії під час вагітності не протипоказано [2418, 2419]. Рекомендація уникати починати АСІТ під час вагітності, імовірно, зумовлена тим, що є ризик розвитку тяжкої анафілактичної реакції під час збільшення дози алергену, а також що анафілаксія або її лікування можуть зашкодити розвитку плода. Є обмежені дані для прийняття рішення в такій ситуації, але в когорті, що охоплювала 102 вагітні пацієнтки, які отримували АСІТ, не було виявлено збільшення кількості ускладнень із боку плода порівняно з випадками, коли вагітні не отримували АСІТ. У трьох пацієнток розвинулися системні реакції, що потребували застосування адреналіну – жоден із випадків не призвів до ускладнень вагітності [2450]. Більш недавнє дослідження продемонструвало відносну безпеку СЛІТ, розпочатої під час вагітності [2451].
FDA схвалено кілька видів таблеток з алергенами для СЛІТ. Протипоказаннями до цієї терапії є нестабільна або неконтрольована астма. Терапію не можна починати за наявності в пацієнта захворювання, яке здатне погіршувати відновлення після анафілаксії, або в пацієнтів, в яких терапія адреналіном або β-агоністами може бути менш ефективною [2452]. Таблетки для СЛІТ також протипоказані пацієнтам з еозинофільним езофагітом [2452-2455].
Існує низка відносних протипоказань, у разі яких необхідно спільно приймати рішення щодо призначення АСІТ. Серцево-судинні захворювання, системні автоімунні хвороби в стадії ремісії, тяжкі психічні розлади, недотримання лікування, первинні та вторинні імунодефіцити та серйозні системні реакції на АСІТ в анамнезі вважають відносними протипоказаннями до АСІТ. Робоча групи EAACI у 2019 р. розглянула ще деякі додаткові стани. Використання інгібіторів АПФ є відносним протипоказанням для імунотерапії з отрутами, але не до імунотерапії аероалергенами [2446]. Нездатність поскаржитися на симптоми, які можуть свідчити про початок анафілактичної реакції, є потенційним протипоказанням і може бути особливою перепоною для використання в дуже маленьких дітей (менше 5 років).
Інфікування вірусом імунодефіциту людини зазвичай не вважають протипоказанням, якщо в пацієнта не розвинувся синдром набутого імунодефіциту. Цю та інші хронічні інфекції потрібно враховувати під час оцінки загального ризику та користі АСІТ.
Висновки
У документі узагальнено доступні дані літератури щодо АР і створено рекомендації на основі доказів найвищого рівня. Завдяки цьому огляду визначено декілька галузей із надійними даними літератури та переконливою доказовою базою. З моменту публікації ICAR–Allergic Rhinitis 2018 було досягнуто багато успіхів, але залишаються помітні прогалини в знаннях. Є кілька напрямів вивчення АР, які обмежені через особливості дизайну досліджень. Наприклад, неможливо провести сліпі або рандомізовані дослідження для деяких методів лікування АР, а епідеміологічні дослідження для оцінки чинників ризику можуть бути обмежені внаслідок їх ретроспективної природи та наявності інших причин. Тому для кожної основної сфери ми запропонували практичні та здійсненні напрями дослідження, які, на нашу думку, дадуть можливість поліпшити наші знання про АР.
Реферативний огляд статті Wise S.K., Damask C., Roland L.T. et al. International consensus statement on allergy and rhinology: Allergic rhinitis – 2023. Int Forum Allergy Rhinol. 2022;1-567.
Підготувала Христина Ключківська
Повну версію дивіться: https://onlinelibrary.wiley.com/doi/full/10.1002/alr.23090
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 3-4 (64-65) 2023 р.