19 травня, 2021
Спадковий ангіоневротичний набряк: останні дані про причини, прояви і терапію
Спадковий ангіоневротичний набряк (САН) – рідкісне генетичне захворювання, спричинене дефіцитом інгібітора C1-естерази (C1-INH) і характеризується повторюваними епізодами виражених набряків кінцівок, обличчя, кишечнику й дихальних шляхів (ДШ). Оскільки набряк гортані є загрозливим для життя станом із ризиком задухи, швидка і правильна постановка діагнозу, а також лікування САН мають без перебільшення життєво важливе значення. Напади САН опосередковуються брадикініном (БК), синтез якого регулюється C1-INH. Терапія САН ґрунтується на лікуванні гострих нападів, а також на короткочасній та довготривалій їх профілактиці. Рекомендоване самостійне лікування, адже воно сприяє підвищенню якості життя осіб, які страждають на САН. Сучасні досягнення в діагностиці й лікуванні цього захворювання значно поліпшили результати терапії та якість життя таких пацієнтів.
Ключові слова: аутосомні хвороби, спадковий ангіоневротичний набряк, набряк гортані, дефіцит інгібітора С1-естерази, С1-INH, активація брадикініну, С1-інгібітор на основі плазми, Сінрайз
Класичний САН – аутосомно-домінантне захворювання, що характеризується рецидивними епізодами підшкірного або підслизового набряку тривалістю 2-5 днів із залученням переважно кінцівок, обличчя, ДШ і органів травного тракту. Ця рідкісна спадкова патологія виникає внаслідок мутацій гена SERPING1, які призводять до недостатнього синтезу або продукції нефункціонального білка – C1-INH, що, своєю чергою, стає причиною надлишкового синтезу БК. Інші типи САН розглянуто нижче.
БК-опосередкований АН не варто плутати з більш поширеним гістамін-опосередкованим АН, який може супроводжуватися кропив’янкою і свербежем шкіри, за відсутності терапії триває 24-48 год і який лікують за допомогою кортикостероїдів (КС) і антигістамінних препаратів (АГП). Більшість випадків гістамін-опосередкованого АН – спонтанні, виникають за відсутності прямого тригера і розвивається впродовж декількох годин. Менша частина таких випадків є наслідком алергічної реакції на наявний тригерний алерген і характеризується бурхливим початком і швидким прогресуванням. У тяжких випадках цей тип АН супроводжується анафілаксією, бронхоспазмом, швидкою обструкцією верхніх ДШ (ВДШ) або вазодилатацією у вигляді гіпотонії.
Навпаки, для БК-опосередкованого АН не характерні утворення ямки при натисканні, свербіж, кропив’янка або бронхоспазм, він триває до 5 днів і не реагує на терапію АГП і КС.
Якщо причиною гістамін-опосередкованого АН є дегрануляція опасистих клітин (IgЕ-опосередкована або спонтанна), яка призводить до вивільнення медіаторів, зокрема гістаміну, БК-опосередкований АН виникає після активації контактної системи, що призводить до надмірної продукції БК. Через патофізіологічні відмінності та різну тактику лікування БК- і гістамін-опосередкованого АН у рекомендаціях Всесвітньої організації алергії (World Allergy Organization, WAO) підкреслюється важливість встановлення точного діагнозу для призначення відповідного лікування. Крім того, деякі шкірні захворювання можуть також супроводжуватися набряком тканин, схожим на АН: гострий контактний дерматит, дерматоміозит, гіпотиреоз, підшкірна емфізема. Знання ключових особливостей усіх цих станів необхідно для того, щоб швидко відрізнити захворювання, які нагадують АН, від класичного АН для уникнення зволікань з його діагностикою та лікуванням, особливо у відділенні невідкладної допомоги.
Точні частота й поширеність САН у світовій популяції невідомі, імовірно, на нього страждає приблизно 1 людина з 50 тис осіб. Діагноз часто встановлюють значно пізніше дебюту захворювання, у середньому через 1,4-8,5 року з моменту появи перших симптомів. Затримка в діагностиці призводить до того, що пацієнти з не встановленим вчасно діагнозом зазнають вищого ризику смерті від задухи внаслідок набряку гортані. Через помилкові діагнози пацієнтам не призначається своєчасне та адекватне лікування, що також знижує якість їхнього життя і суттєво збільшує ризик летального кінця.
Напади САН значуще погіршують особисте, соціальне, професійне і психічне благополуччя пацієнтів, оскільки утруднюють або взагалі роблять неможливими виконання повсякденних справ, заняття спортом, відпочинок, прогулянки, зустрічі з друзями тощо. У довгостроковій перспективі загострення САН заважають кар’єрі і навчанню через пропуски, знижують продуктивність праці і загалом стають причиною втрачених можливостей. Пацієнти часто живуть у постійному страху перед новим нападом задухи і мають високий рівень тривоги і депресії. Тягар САН впливає на якість життя не лише самих пацієнтів, а й на їхню сім’ю/опікунів.
Види САН
Набряк у разі САН передусім спричинений БК, продукція якого опосередковується контактною системою. Остання активується негативно зарядженими поверхнями, що призводить до активації фактора XII (FXII). Активований FXII (FXIIa) перетворює прекалікреїн на калікреїн, а той згодом розщеплює високомолекулярний кініноген для синтезу БК, який, своєю чергою, сприяє вазодилатації і збільшує проникність судин, що призводить до АН. Контактна система регулюється за допомогою C1-INH, головного інгібітора FXIIa і калікреїну. При недостатньому рівні функціонального C1-INH синтез БК збільшується через тривалу активацію FXIIa і калікреїну.
САН із дефіцитом C1-INH
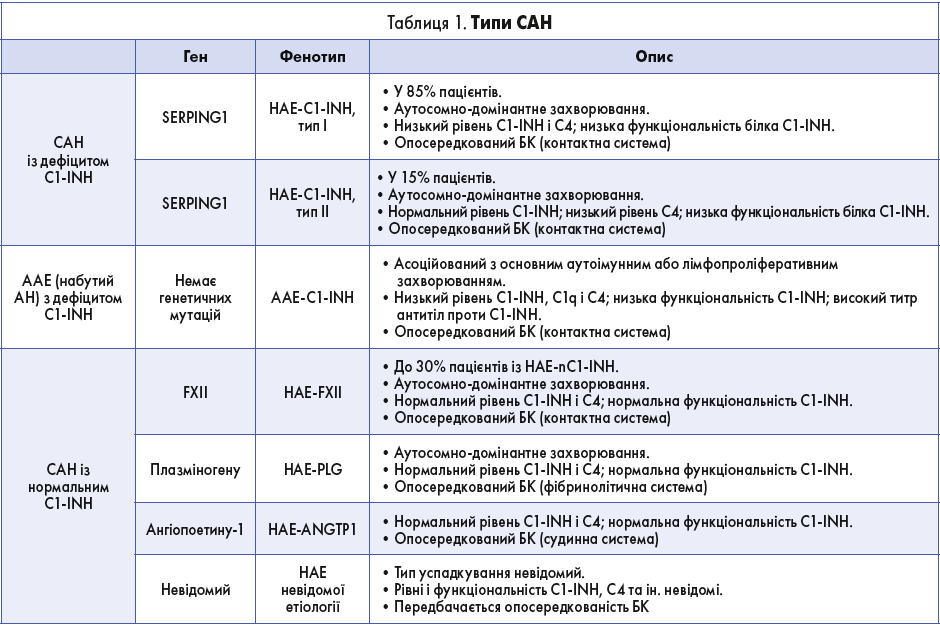
На сьогодні вивчено два типи САН, спричиненого дефіцитом функціонального C1-INH (англ. Hereditary angioedema caused by deficiency of functional C1-inhibitor, HAE-C1-INH). Обидва типи мають схожі фенотипічні прояви і успадковуються за аутосомно-домінантним типом (табл. 1).
САН I типу – найпоширеніша форма HAE-C1-INH (85% випадків), спричинена недостатнім рівнем C1-INH у плазмі. Цей тип САН зумовлений мутаціями гена SERPING1, які призводять до порушення продукції білка C1-INH.
САН II типу – менш поширена форма HAE-C1-INH (15% випадків). Характеризується нормальним рівнем C1-INH у плазмі, проте функціональна активність цього білка знижена або повністю відсутня.
При обох типах САН не відбувається адекватного інгібування ані FXIIa, ані калікреїну, що веде до гіперпродукції БК і, як наслідок, до підвищення проникності судин.
Дефіцит C1-INH також може виникати внаслідок підвищеного катаболізму C1-INH, зумовленого наявністю в пацієнта лімфопроліферативного захворювання. Така форма САН (англ. Acquired angioedema with C1-inhibitor deficiency, AAE-C1-INH) не асоційована з генетичними мутаціями (табл. 1), і хоча клінічно вона схожа на HAE-C1-INH, відрізняється пізнішим початком і відсутністю спадкової/сімейної обтяженості.
САН із нормальним рівнем C1-INH
САН із нормальним рівнем C1-INH (HAE-nC1-INH) розвивається внаслідок мутацій, які можна розділити на 4 групи: мутації генів FXII, плазміногену та ангіопоетіну‑1, а також САН невідомої етіології (табл. 1). Клінічні прояви HAE-nC1-INH такі самі, як і HAE-C1-INH, однак HAEn-C1-INH є менш поширеним і середній вік становлення симптоматики в пацієнта – пізніший. Діагностика HAE-nC1-INH утруднена, оскільки при даному типі САН плазмовий рівень і функціональність C1-INH у нормі, а лабораторні тести для виявлення інших причин зазвичай недоступні (точна діагностика цього типу САН заснована на генетичному тестуванні).
Отримані в дослідженнях дані свідчать про те, що HAE-nC1-INH також опосередковується збільшенням синтезу БК.
У жінок HAE-nC1-INH, асоційований із мутаціями гена FXII (HAE-FXII), характеризується такими клінічними симптомами, як набряк шкірних покривів (переважно обличчя) та язика. Набряк часто виникає або посилюється після прийому оральних контрацептивів, замісної гормональної терапії або під час вагітності, що свідчить про важливу роль естрогенів у розвитку цієї форми. На відміну від HAE-C1-INH клінічні симптоми при HAE-FXII зазвичай виникають у зрілому віці. У чоловіків цей тип САН спостерігають рідко, переважно за наявності зовнішніх кофакторів (застосування інгібіторів [ангіотензинперетворювального ферменту] АПФ). Як і у випадку з HAE-C1-INH, у патофізіології АН в разі HAE-FXII задіяні активація контактної системи і гіперпродукція БК.
САН, асоційований із мутацією гена плазміногену (HAE-PLG), – аутосомно-домінантне захворювання, яке характеризується частими випадками набряку язика, що може призвести до асфіксії. HAE-PLG, очевидно, опосередковується БК. Передбачається, що надлишкова продукція БК при згаданій формі може бути пов’язана з підвищенням активації фібринолітичної системи. У результаті збільшується синтез плазміну і, оскільки плазмін здатний активувати контактну систему, підвищується вироблення БК з наступним розвитком АН.
САН, асоційований із мутацією гена ангіопоетину‑1 (HAE-ANGPT1). Ангіопоетин‑1 регулює проникність судин, захищаючи мікросудинне русло від витоку плазми, спричинюваного БК. Мутації гена ангіопоетину‑1 зумовлюють підвищення судинної проникності з виникненням АН. На тлі HAE-ANGPT1 порушується взаємодія білка ангіопоетину‑1 з його мембранним рецептором на ендотелії судин – кіназою. Таким чином, у разі цього судинного варіанта САН підвищується сприйнятливість до нормального рівня БК.
У багатьох випадках HAE-nC1-INH мутації інших генів залишаються нез’ясованими.
Клінічна характеристика САН
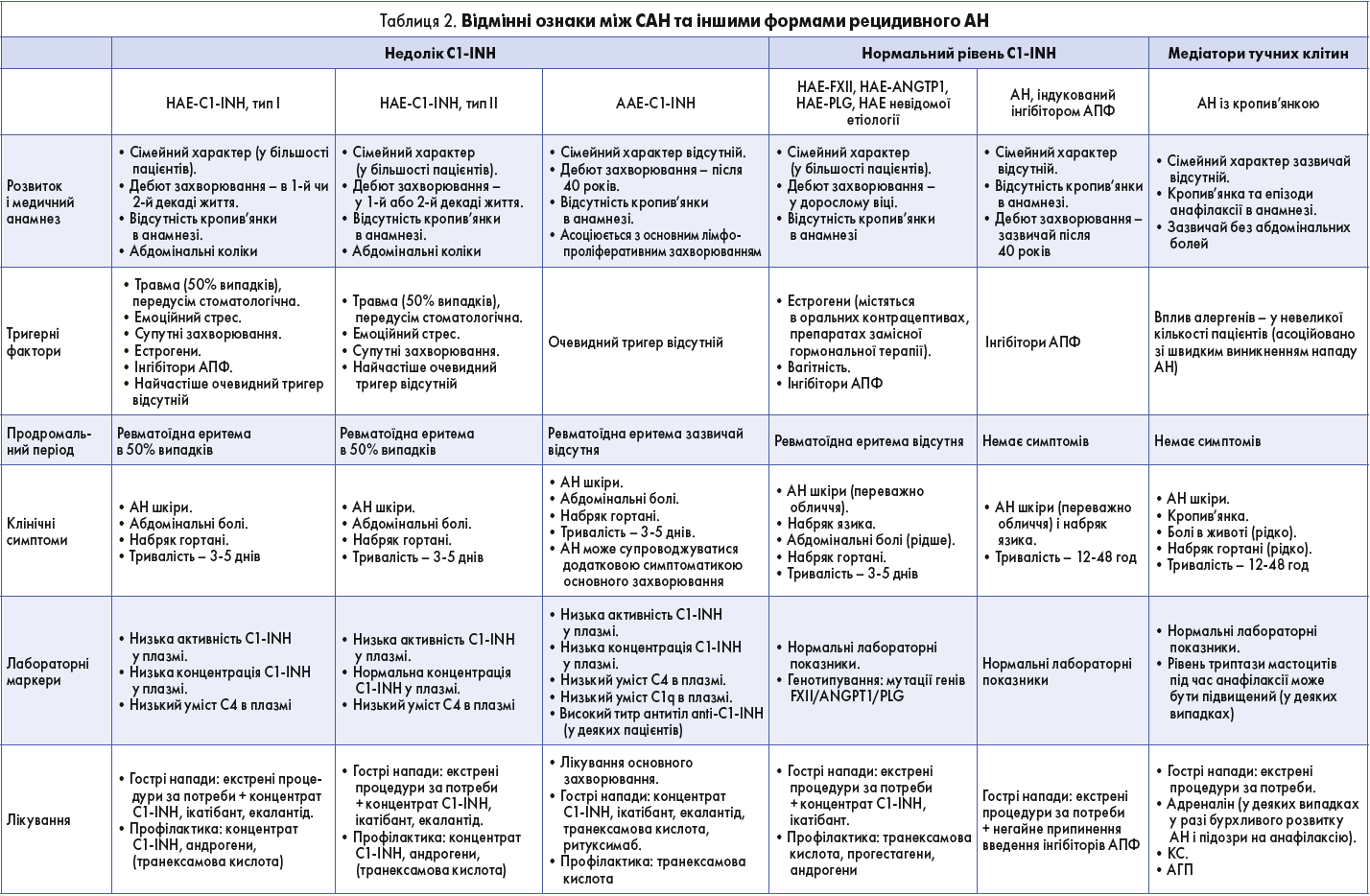
САН проявляється у вигляді повторюваних епізодів локалізованого набряку підшкірних тканин кінцівок, обличчя, тулуба або зовнішніх геніталій, підслизових тканин травного тракту і ВДШ (табл. 2). Характерними ознаками підшкірного набряку є відсутність ямки при натисканні, свербежу, кропив’янки або пухирів. Зазвичай такий набряк зникає через 2-5 днів. Абдомінальні напади часто виражені й болючі, виникають унаслідок непрохідності кишечнику або вісцерального набряку і стають іноді причиною непотрібних оперативних втручань. Гострий набряк гортані (ГНГ) при САН є загрозливим для життя станом через ризик асфіксії.
Нападам САН часто передує продромальний період у вигляді перевтоми, нездужання, змін настрою, болей у суглобах, м’язах, нудоти, спраги або ревматоїдної еритеми (остання не характерна для HAE-nC1-INH).
Більшість нападів АН відбуваються спонтанно, проте були ідентифіковані також і деякі тригерні фактори: місцева травма, інфекційні захворювання, емоційне перенапруження. Частота нападів САН дуже варіює в пацієнтів: у декого захворювання має безсимптомний перебіг, в інших напади виникають кожні кілька днів. Перші клінічні симптоми САН проявляються не пізніше 20 років (у більшості пацієнтів – у першій декаді життя).
ГНГ асоціюється з високим ризиком задухи зі смертельними наслідками, переважно в недіагностованих або помилково діагностованих випадках. Летальний наслідок у разі ГНГ – це найперше результат затримки діагностики та неефективності медикаментозного лікування. Швидка й точна діагностика, а також адекватна ургентна терапія ГНГ – таким має бути алгоритм надання вчасної медичної допомоги в разі САН.
ГНГ зазвичай виникає після травми порожнини рота (зокрема внаслідок стоматологічних хірургічних утручань) або спонтанно. Достатньо в середньому декількох годин, щоби настала смерть, однак є повідомлення про смертельні випадки ГНГ, які тривали менш ніж 20 хвилин.
З огляду на непередбачуваність виникнення й тяжкості нападів ГНГ, пацієнти, їхні родичі та лікарі мають знати про наявні у хворого ризики і методи їх усунення. Особливо важлива термінова та ефективна медикаментозна терапія, оскільки полегшення симптомів нападу відбувається через 15-60 хв після прийому препарату. У разі ГНГ з бурхливим перебігом, а також за неефективності лікарських засобів або через брак часу необхідно вдатися до екстрених заходів: інтубації, конікотомії або трахеотомії. Лікар швидкої допомоги має вміти розрізняти типи АН (табл. 2) і враховувати той факт, що пацієнти із САН не реагують на терапію КС, АГП і введення адреналіну. Відстрочене лікування прогресуючого ГНГ може призвести до гіпоксемії з ознаками органічного пошкодження головного мозку, у тому числі до необоротної сліпоти і тетраплегії.
Діагноз HA-EC1-INH підтверджують за допомогою лабораторних аналізів крові. Для диференційної діагностики САН I і II типу необхідно визначення активності і концентрації C1-INH у плазмі. Для діагностування HAE-nC1-INH треба проводити генетичне тестування. Однак під час гострого нападу здебільшого немає можливості провести жоден зі згаданих діагностичних аналізів. Визначення рівнів D-димерів можливе в клінічних лабораторіях, але підвищення цих рівнів при САН не є специфічним. Вкорочення активованого часткового тромбопластинового часу може допомогти в діагностиці HAE-C1-INH і AAE-C1-INH у разі відсутності можливості визначити рівень C1-INH.
Лікування САН
Оскільки HAE-C1-INH є генетичним захворюванням, етіологічного лікування немає. Лікувальні стратегії спрямовані на запобігання нападам або швидке їх купірування, зменшення захворюваності та смертності, а також поліпшення якості життя пацієнтів із цим захворюванням. Є два підходи до терапії САН: лікування гострих нападів (on-demand therapy) і профілактичне лікування (короткочасне й довготривале, табл. 3).
Лікування гострих нападів (терапія на вимогу, on-demand therapy)
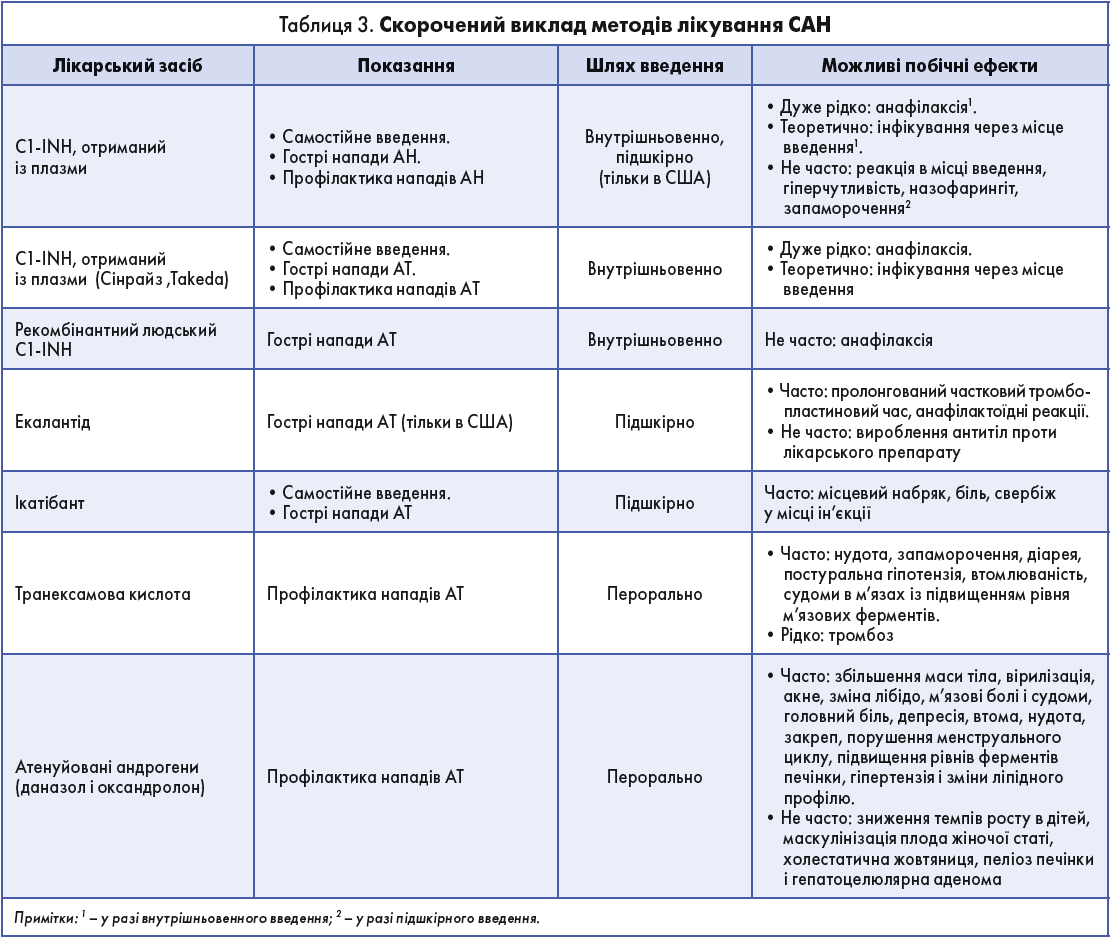
WAO наполегливо рекомендує ранній початок лікування нападів HAE-C1-INH за допомогою концентрату C1-INH, ікатібанту або екалантіду. Зазначається, що транексамова кислота й андрогени неефективні при гострих нападах САН (табл. 3). Терапія на вимогу скорочує тривалість нападу і зменшує кількість наслідків проти відсутності лікування. Оскільки атаки САН можуть виникати навіть на тлі профілактичного лікування, пацієнту рекомендується мати чіткий план дій щодо самодопомоги.
Концентрат C1-INH, отриманий із плазми або рекомбінантний, є основою замісної терапії в разі дефіциту або дисфункції C1-INH, адже він регулює вироблення БК шляхом гальмування контактної системи. Як отриманий із плазми, так і рекомбінантний концентрат однаково ефективні в лікуванні гострих нападів і добре переносяться. На сьогодні для лікування на вимогу наявні два концентрати C1-INH, отримані з плазми, – Берінерт (Berinert, CSL Behring) і Сінрайз (Cinryze, Shire) – і один рекомбінантний концентрат C1-INH – Руконест (Ruconest, Pharming).
Є також два препарати для підшкірного введення, що застосовують для купірування нападів САН:
- ікатібант– інгібітор B2-рецептора БК – для лікування на вимогу гострих нападів САН;
- екалантід – інгібітор калікреїну. Препарат зареєстрований тільки в США. Вводять підшкірно обов’язково під наглядом медичного персоналу через ризик анафілактоїдних реакцій, тоді як інші препарати пацієнти або особи, які здійснюють догляд за ними, після спеціального навчання можуть застосовувати самостійно.
Профілактичне лікування
Короткочасна профілактика
Пацієнти зі САН мають отримувати короткочасну профілактику концентратом C1-INH напередодні подій, здатних індукувати напад, наприклад перед хірургічними, стоматологічними процедурами, інвазивними медичними втручаннями. Концентрат C1-INH ефективний для короткочасної профілактики і добре переноситься. Однак, оскільки атаки можуть відбутися навіть на тлі запобіжної терапії, важливо забезпечити пацієнтові доступ до препаратів для купірування нападів. Для короткочасної профілактики застосовують ліцензовані плазмові концентрати C1-INH – такі як препарат Сінрайз (Cinryze) від компанії Takeda (табл. 3).
Довготривала профілактика
Довготривала профілактика спрямована на зниження частоти і тяжкості нападів САН. Питання про необхідність такої профілактики вирішують індивідуально для кожного пацієнта на підставі таких чинників, як частота, ступінь тяжкості та місце виникнення нападів, супутні захворювання і рівень контролю АН за допомогою терапії на вимогу.
Пацієнти, які отримають довготривалу профілактику, мають перебувати під регулярним наглядом для оцінки ефективності і переносимості лікування; їм також має бути доступна терапія на вимогу для купірування раптових нападів.
Концентрати C1-INH, отримані з плазми, зазвичай застосовують у пацієнтів зі САН із профілактичними цілями (табл. 3). Рутинна профілактика за допомогою внутрішньовенного введення плазмового C1-INH ефективна і добре переноситься пацієнтами. Дослідження продемонстрували хороший профіль безпеки і високу ефективність підшкірного застосування C1-INH (середнє зниження частоти нападів на 95%). Крім того, підшкірне введення зручніше і легше для пацієнтів, які потребують тривалої профілактики.
З метою довготривалої профілактики також застосовували атенуйовані андрогени, зокрема даназол. Пероральне введення андрогенів є їх перевагою, а ефективність оцінена як висока (середнє зниження кількості атак на 83%). Однак за умови тривалого використання андрогенів можливе виникнення низки дозозалежних побічних ефектів (табл. 3). Тому, призначаючи атенуйовані андрогени, важливо підібрати мінімальну ефективну дозу (даназол у максимальній добовій дозі 100-200 мг).
Проти атенуйованих андрогенів транексамова кислота не настільки ефективна, проте має менше побічних ефектів. Точних даних щодо її ефективності на сьогодні немає. Зазвичай транексамову кислоту застосовують у педіатричній практиці і не рекомендують для тривалої профілактики САН.
Лікування САН на пізніх стадіях
У ІІІ фазі багатоцентрового рандомізованого подвійно сліпого плацебо-контрольованого клінічного дослідження за участю 125 пацієнтів зі САН I або II типу вивчали переносимість і ефективність підшкірного введення ланаделумабу – моноклональних антитіл проти калікреїну плазми для профілактики нападів САН (HELP; NCT02586805).
При лікуванні ланаделумабом значно зменшилася середня частота нападів проти плацебо (0,26-0,53 нападу проти 1,97 нападу на місяць відповідно) впродовж 26-тижневого періоду лікування. Відкрите розширене дослідження дало можливість оцінити довготривалу переносимість і ефективність ланаделумабу в профілактиці нападів САН.
Пероральний інгібітор калікреїну плазми BCX7353 поки перебуває в стадії розробки. Перша частина ІІ фази плацебо-контрольованого дослідження (визначення оптимальної дози, оцінка ефективності, переносимості, фармакокінетики та фармакодинаміки BCX7353 в профілактиці нападів САН) виявила, що добова доза перорального BCX7353 ≥125 мг значуще, якщо порівняти з плацебо, знижувала частоту нападів АН з найкращими показниками за умови прийому добової дози 125 мг (74%; р=<0,001). Небажані явища були найчастішими з боку травного тракту: 29%, 50% і 44% на терапії BCX7353 з добовою дозою 125 мг, 250 мг і 350 мг відповідно.
САН із нормальним рівнем C1-INH
Підвищена продукція БК опосередковує виникнення як HAE-C1-INH, так і HAE-nC1-INH. Тому лікування, ефективне в разі HAE-C1-INH, зокрема концентрат C1-INH та ікатібант, так само ефективне за різних типів HAE-nC1-INH.
Терапія в амбулаторних умовах і самостійне введення препаратів
Лікування нападів САН на ранніх стадіях має вирішальне значення. Тому WAO рекомендує надати пацієнтам доступ до терапії на вимогу і навчити їх швидко і правильно діяти в разі виникнення небезпечних для життя нападів. Причому навчити треба не лише пацієнта, а й особу, яка допомагає хворому вдома. Очікування в разі нападу АН швидкої професійної допомоги в умовах медичної установи зазвичай призводить до затримки початку адекватної терапії, транспортування пацієнта потребує часу, до того ж співробітники бригади швидкої допомоги іноді обирають неправильну лікувальну тактику. У разі ГНГ все це може зіграти фатальну роль. Тому терапія нападу може бути безпечно та ефективно здійснена пацієнтом у домашніх умовах, це знижує тривалість і частоту виникнення нападів САН. Самостійне введення препаратів покращує психологічний стан пацієнтів, оскільки вони відчувають свою незалежність від термінової медичної допомоги. Можливість і вміння швидко застовувати лікування в будь-який час і в будь-якому місці послаблює страх пацієнтів перед нападами і допомагає відновити контроль над своїм приватним життям, повернутися до роботи і навчання. Самостійне призначення ліків також сприяє зменшенню необхідності відвідувати лікаря або бути госпіталізованим, а також кількості пропусків роботи.
Внутрішньовенні концентрати C1-INH, такі як Сінрайз, ліцензовані для самолікування в дітей (вводяться особою, яка здійснює догляд), підлітків і дорослих; для самостійного підшкірного застосування підлітками і дорослими схвалений препарат C1-INH Егарда. Ікатібант ліцензовано і схвалено для самостійного введення дорослим і дітям (особою, яка здійснює догляд за дитиною).
Ключові моменти
- САН – рідкісне аутосомно-домінантне захворювання, спричинене дефіцитом інгібітора C1-естерази (C1-INH).
- САН характеризується повторюваними епізодами гострого набряку тканин без кропив’янки, який вражає обличчя, кінцівки, дихальні шляхи або кишечник.
- Нестача C1-INH у плазмі або його дисфункція призводить до активації брадикініну, який підвищує проникність капілярів, спричинюючи набряк.
- Гострий набряк гортані потенційно небезпечний для життя через високий ризик задухи і потребує негайного лікування.
- Тактика лікування САН спрямована на запобігання смерті і зниження частоти й тяжкості нападів ангіоневротичного набряку за допомогою профілактичних заходів.
Висновки
САН характеризується раптовими нападами, болючими і потенційно смертельними. Украй важливий у разі нападу САН негайний і точний діагноз, оскільки такі пацієнти не реагують на лікування лікарськими засобами, які зазвичай призначають для купірування нападу гістамін-опосередкованого ангіоневротичного набряку. Затримка в діагностиці нападу може обернутися фатальними наслідками, передусім за умови розвитку гострого набряку гортані.
Сьогодні для негайного купірування нападу САН доступні кілька варіантів лікування: концентрат C1-INH та ікатібант (дозволені для використання в амбулаторних умовах).
Доступність спеціалізованого догляду та ефективного лікування за останнє десятиліття дали можливість значуще поліпшити якість життя і знизити смертність серед пацієнтів зі САН.
За матеріалами Longhurst H.J., Bork K. Hereditary angioedema: an update on causes, manifestations and treatment. British Journal of Hospital Medicine. July 2019. Vol 80. № 7.
Підготувала Ірина Чумак
Повну версію статті дивіться на сайті https://www.magonlinelibrary.com