17 квітня, 2021
Мистецтво ведення пацієнтів з остеоартритом: на стику рекомендацій
Остеоартрит (ОА) є найпоширенішою формою артриту та провідною причиною інвалідності серед літніх осіб. ОА супроводжується деградацією хряща, ремоделюванням кісток, утворенням остеофітів і запаленням синовіальної оболонки, що призводить до розвитку болю, ригідності та порушення функції суглоба. У лікуванні ОА найчастіше застосовують нестероїдні протизапальні препарати (НПЗП) і симптоматичні засоби повільної дії для лікування ОА (SYSADOA). Утім, НПЗП можуть спричиняти серйозні побічні ефекти з боку шлунково-кишкового тракту та серцево-судинної системи, а питання ефективності SYSADOA, особливо глюкозаміну й хондроїтину, все ще залишається дискусійним.
 У рамках IX Всеукраїнського конгресу «Профілактика. Антиейджинг. Україна» про сучасні підходи до лікування ОА розповіла керівник Центру ревматології Клінічної лікарні «Феофанія» Державного управління справами (м. Київ), доктор медичних наук, професор Ірина Юріївна Головач. На початку своєї доповіді спікерка підкреслила, що ОА залишається центральною фігурою в ревматології та патології опорно-рухового апарату. Про це свідчать як висока поширеність ОА в популяції (12-13%), так і значні соціальні наслідки цього захворювання. Поглиблюють проблему відсутність ефекту патогенетичної терапії, висока частота залишкового болю й інвалідізації, необхідність хірургічних методів лікування, низька доступність реабілітаційних заходів у нашій країні.
У рамках IX Всеукраїнського конгресу «Профілактика. Антиейджинг. Україна» про сучасні підходи до лікування ОА розповіла керівник Центру ревматології Клінічної лікарні «Феофанія» Державного управління справами (м. Київ), доктор медичних наук, професор Ірина Юріївна Головач. На початку своєї доповіді спікерка підкреслила, що ОА залишається центральною фігурою в ревматології та патології опорно-рухового апарату. Про це свідчать як висока поширеність ОА в популяції (12-13%), так і значні соціальні наслідки цього захворювання. Поглиблюють проблему відсутність ефекту патогенетичної терапії, висока частота залишкового болю й інвалідізації, необхідність хірургічних методів лікування, низька доступність реабілітаційних заходів у нашій країні.
Загалом ОА посідає перше місце в структурі кістково-м’язової патології, друге – за кількістю звернень до сімейного лікаря, поступаючись лише серцево-судинним захворюванням; третє – у структурі інвалідизації.
В основі патогенезу цього захворювання лежить анормальне ремоделювання суглобових тканин під впливом прозапальних цитокінів. Хронічний повільний низькоінтенсивний запальний процес призводить до прогресуючої деструкції суглобового хряща. Перебіг і прогресування ОА залежать від багатьох чинників, у зв’язку з чим сьогодні розрізняють чимало ендотипів і клінічних фенотипів ОА.
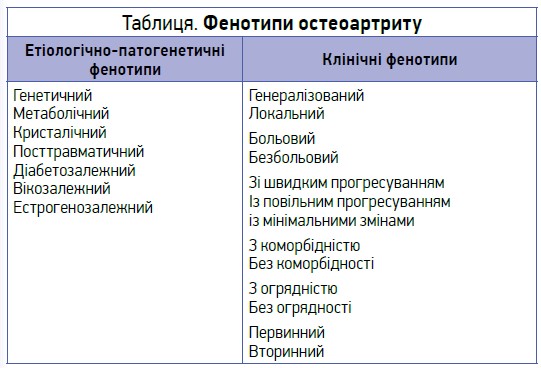 До чинників, які потенційно можуть вплинути на формування фенотипу ОА, відносять генетичні фактори, вік, ступінь навантаження на суглоб і механіку ходи, системні чи локальні ознаки запалення, гормональні зміни, силу м’язів, кількість уражених суглобів, больову сенситизацію, ураження суглобових тканин, швидкість прогресування, соціально-економічний статус, стадію хвороби, мінеральну щільність кістки, наявність ерозій або кальцифікації. Відповідно до цього виділяють етіопатогенетичні та клінічні фенотипи ОА (табл.).
До чинників, які потенційно можуть вплинути на формування фенотипу ОА, відносять генетичні фактори, вік, ступінь навантаження на суглоб і механіку ходи, системні чи локальні ознаки запалення, гормональні зміни, силу м’язів, кількість уражених суглобів, больову сенситизацію, ураження суглобових тканин, швидкість прогресування, соціально-економічний статус, стадію хвороби, мінеральну щільність кістки, наявність ерозій або кальцифікації. Відповідно до цього виділяють етіопатогенетичні та клінічні фенотипи ОА (табл.).
В основі відокремлення зазначених фенотипів лежить ідея знайти «правильних» пацієнтів для «правильного» препарату. Тобто фахівці фенотипують ОА та стратифікують пацієнтів для того, щоб дати відповідь на запитання, яка терапія буде найефективнішою та чи асоціюватиметься вона із серйозними побічними ефектами. Іншою метою фенотипування ОА є розроблення кращих лікарських засобів і визначення основних цілей їхнього впливу.
Загальні підходи до лікування ОА охоплюють немедикаментозні методи, місцеві лікарські засоби, системні лікарські препарати, внутрішньосуглобові ін’єкції, хірургічні методи.
Класифікація препаратів для лікування ОА традиційно включає:
- симптом-модифікуючі препарати – агенти, котрі впливають на симптоми хвороби (біль, функціональну недостатність), із відсутністю впливу на структурні зміни;
- структурно-модифікуючі препарати – засоби, котрі впливають на прогресування патологічних змін; окрім того, вони можуть мати додатковий вплив на симптоми хвороби (симптом-модифікуюча дія) або ж не мати його.
Наразі рекомендації профільних фахових спільнот щодо доцільності застосування тих чи інших препаратів при ОА істотно відрізняються між собою. Основні розбіжності стосуються використання SYSADOA. Наприклад, якщо застосування глюкозаміну гідрохлориду взагалі не визнається більшістю товариств та асоціацій із вивчення ОА, то доцільність використання глюкозаміну сульфату підтримують EULAR (2003), ESCEO (2016, 2019), хондроїтину сульфату – EULAR (2003), NICE (2008), ESCEO (2016, 2019). Досі немає одностайної думки щодо необхідності призначення й інших хондропротекторів.
«SYSADOA-ївські війни» тривали й у 2020-му. OARSI повністю заперечує необхідність застосування хондропротекторів при ОА. Натомість експерти EULAR, так само як і представники ACR, вважають, що хондроїтину сульфат може призначатися для лікування ОА кисті (слабка рекомендація). Фахівці ESCEO дотримуються думки, що глюкозаміну сульфат або хондроїтину сульфат є ефективними в лікуванні ОА колінного суглоба (сильна рекомендація).
Основними причинами розходження в клінічних рекомендаціях щодо ведення ОА є різниця в результатах клінічних досліджень (неоднорідність критеріїв включення, різні методи оцінки ефективності, різні популяції пацієнтів), різні підходи до оцінки результатів дослідження та формування рекомендацій; різний склад і ступінь ангажування й упередженості експертів.
На сьогодні запитань стосовно лікування ОА набагато більше, ніж відповідей. Невизначеність щодо доцільності застосування тих чи інших препаратів дає змогу говорити про ситуацію «терапевтичного провалу».
Щоб розібратися з цією проблемою, X. Zhu та співавт. (2018) провели найбільший метааналіз, у який було включено 30 рандомізованих плацебо-контрольваних досліджень (7172 пацієнти з ОА) високої методологічної якості, в яких оцінювали ефективність і безпеку глюкозаміну, хондроїтину та їх комбінації для лікування ОА колінного та/або кульшового суглоба. Результати метааналізу дали змогу зробити висновок, що порівняно з плацебо зазначені представники SYSADOA не показали достовірної різниці загального ефекту за впливом на зменшення болю, поліпшення функції та скутості порівняно з плацебо.
За даними проспективного міжнародного дослідження, в реальній практиці близько 54% пацієнтів із гонартрозом відчувають постійний біль на тлі прийому знеболювальних засобів. Такі невтішні результати змушують науковців продовжувати пошук нових лікарських речовин.
Останнім часом увага дослідників прикута до неденатурованого колагену ІІ типу (UC-IIТМ), представленого на фармацевтичному ринку засобом Меркана. Цей хондропротектор характеризується принципово новим унікальним механізмом впливу на суглобовий хрящ, пов’язаним із формуванням оральної толерантності.
Оральна толерантність – це вид регуляції імунної відповіді, котрий дає організму змогу розрізняти безпечні речовини й антигени, що потрапляють з їжею. Ключова роль у формуванні оральної толерантності належить лімфоїдній тканині кишечнику, представленій брижовими лімфатичними вузлами та пеєровими бляшками. Саме в них відбуваються розпізнавання нерозчинних антигенів і подальша індукція імунної відповіді організму.
При пероральному прийомі UC-IIТМ із порожнини кишечнику захоплюється дендритними клітинами, розташованими в пейєрових бляшках тонкого кишечнику, не всмоктуючись при цьому в кров. Дендритна клітина визначає цей антиген (UC-IIТМ) як безпечний для організму та передає інформацію на наївні Т-лімфоцити, перетворюючи їх на спеціалізовані регуляторні Т-лімфоцити (Treg). Останні через лімфатичну систему брижі потрапляють у системний кровоток. Активовані Treg продукують два основні протизапальні цитокіни: інтерлейкін‑10 (ІL‑10) – головний протизапальний цитокін і трансформуючий фактор росту-β (TGF-β).
Саме через дію цих цитокінів реалізується протизапальний вплив UC-IIТМ на рівні суглобового хряща. ІL‑10 чинить вплив на рецептори макрофагів і синовіоцитів, інгібуючи продукцію та вивільнення основного прозапального цитокіну – інтерлейкіну-1 (ІL-1). TGF-β стимулює синтез міжклітинної складової речовини хряща за рахунок пригнічення катаболічної активності хондроцитів (що призводило до розпаду колагену й інших білків позаклітинного матриксу) й активації анаболічної функції та проліферації хондроцитів, гальмуючи при цьому їх термінальну диференціацію на догіпертрофічній стадії.
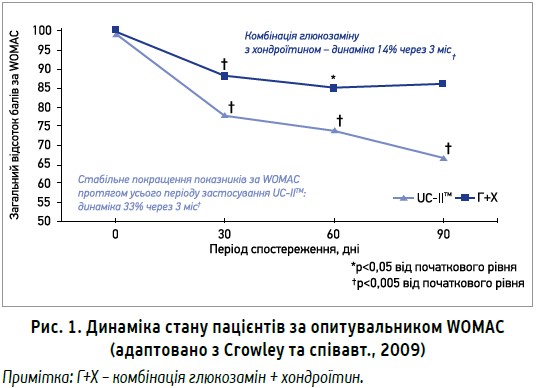 Висока ефективність Меркани була підтверджена результатами клінічних випробувань. Метою рандомізованого подвійного сліпого дослідження, проведеного Crowley та співавт., було оцінити ефективність і переносимість UC-IIТМ при ОА колінного суглоба порівняно з комбінацією глюкозамін + хондроїтин. Пацієнтів розподілили на групи щоденного прийому UC-IIТМ 40 мг або комбінації глюкозамін 1500 мг + хондроїтин 1200 мг протягом 90 днів. Ефективність лікування оцінювали за динамікою балів згідно з опитувальником WOMAC (пацієнти відзначали вираженість болю, скутості та функції суглобів); вплив на динаміку больового синдрому – за візуально-аналоговою шкалою (ВАШ) болю. Дослідження продемонструвало значно вищу ефективність UC-IIТМ порівняно з комбінацією глюкозамін + хондроїтин за показниками опитувальника WOMAC, починаючи з перших місяців лікування. Через 3 міс застосування UC-IIТМ (активний інгредієнт Меркани) перевершила результати комбінації глюкозамін + хондроїтин у 2,3 раза (рис. 1).
Висока ефективність Меркани була підтверджена результатами клінічних випробувань. Метою рандомізованого подвійного сліпого дослідження, проведеного Crowley та співавт., було оцінити ефективність і переносимість UC-IIТМ при ОА колінного суглоба порівняно з комбінацією глюкозамін + хондроїтин. Пацієнтів розподілили на групи щоденного прийому UC-IIТМ 40 мг або комбінації глюкозамін 1500 мг + хондроїтин 1200 мг протягом 90 днів. Ефективність лікування оцінювали за динамікою балів згідно з опитувальником WOMAC (пацієнти відзначали вираженість болю, скутості та функції суглобів); вплив на динаміку больового синдрому – за візуально-аналоговою шкалою (ВАШ) болю. Дослідження продемонструвало значно вищу ефективність UC-IIТМ порівняно з комбінацією глюкозамін + хондроїтин за показниками опитувальника WOMAC, починаючи з перших місяців лікування. Через 3 міс застосування UC-IIТМ (активний інгредієнт Меркани) перевершила результати комбінації глюкозамін + хондроїтин у 2,3 раза (рис. 1).
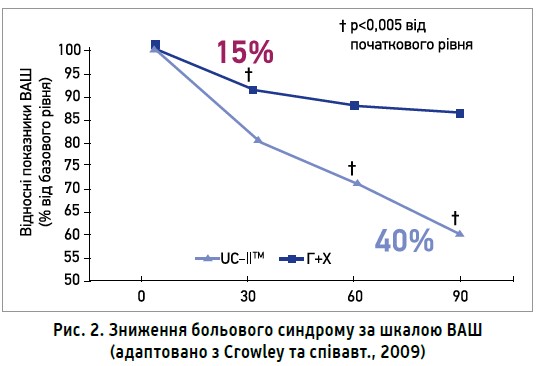 Водночас в учасників, які отримували Меркану, спостерігалося вираженіше зменшення болю. Так, зниження больового синдрому за шкалою ВАШ у пацієнтів групи UC-IIТМ на 3-й місяць терапії становило 40% порівняно з початковим рівнем, тоді як у групі, учасники котрої застосовували комбінацію глюкозамін + хондроїтин, – лише 15% без достовірної динаміки покращення протягом 2-го та 3-го місяців терапії. Наприкінці дослідження за знеболювальною ефективністю UC-IIТМ (активний інгредієнт Меркани) перевершила комбінацію глюкозамін + хондроїтин у 2,5 раза (рис. 2).
Водночас в учасників, які отримували Меркану, спостерігалося вираженіше зменшення болю. Так, зниження больового синдрому за шкалою ВАШ у пацієнтів групи UC-IIТМ на 3-й місяць терапії становило 40% порівняно з початковим рівнем, тоді як у групі, учасники котрої застосовували комбінацію глюкозамін + хондроїтин, – лише 15% без достовірної динаміки покращення протягом 2-го та 3-го місяців терапії. Наприкінці дослідження за знеболювальною ефективністю UC-IIТМ (активний інгредієнт Меркани) перевершила комбінацію глюкозамін + хондроїтин у 2,5 раза (рис. 2).
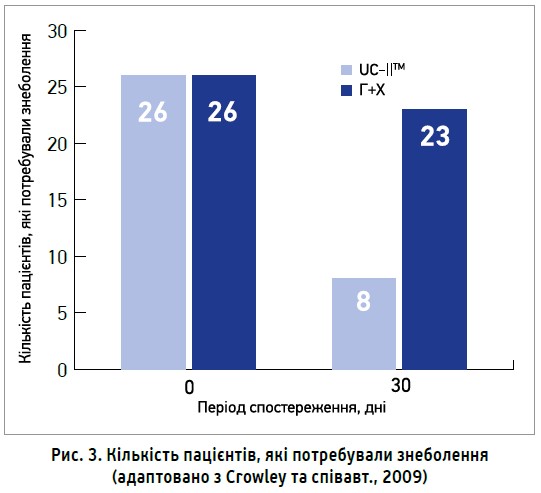
Ще однією суттєвою перевагою застосування UC-IIТМ (активний інгредієнт Меркани) було зниження потреби в додатковому прийомі знеболювальних засобів. Після 1-го місяця лікування в групі комбінованої терапії глюкозамін + хондроїтин додаткове знеболення не знадобилося лише 11,5% пацієнтів, натомість у групі UC-IIТМ 69,2% пацієнтів не потребували додаткового прийому знеболювальних. Отже, прийом UC-IIТМ (активний інгредієнт Меркани) знижував потребу в додатковому знеболенні в пацієнтів з ОА в 6 разів ефективніше, ніж комбінація глюкозамін + хондроїтин, уже на 1-му місяці лікування (рис. 3).
 Слід зазначити, що застосування UC-IIТМ здатне гальмувати погіршення стану суглобового хряща, що було продемонстровано на експериментальній (миші лінії Lewis) моделі остеоартриту (Bagi та співавт., 2017). З метою індукціїї травматичного ОА проводили часткову медіальну меніскектомію на задніх кінцівках. Безпосередньо після втручання 10 мишам уводили UC-IIТМ у дозі 0,66 мг/кг/добу перорально протягом 8 тиж, іншим мишам – індиферентний носій. Кінцеві точки дослідження включали несучу здатність передніх і задніх кінцівок, сироваткові біомаркери метаболізму кісткової та хрящової тканини, гістологічне дослідження. Дебют ОА спостерігали через 6-8 тиж після індукції травматичного ОА, про що свідчила втрата вантажопідйомності ураженої кінцівки (тварини переносили вагу на передні лапи). Проте в групі мишей, які отримували UC-IIТМ, вдалося зберегти опірну здатність ураженої кінцівки, цілісність губчастої кістки великогомілкового метафіза, а також сповільнити ріст остеофітів і руйнування суглобового хряща.
Слід зазначити, що застосування UC-IIТМ здатне гальмувати погіршення стану суглобового хряща, що було продемонстровано на експериментальній (миші лінії Lewis) моделі остеоартриту (Bagi та співавт., 2017). З метою індукціїї травматичного ОА проводили часткову медіальну меніскектомію на задніх кінцівках. Безпосередньо після втручання 10 мишам уводили UC-IIТМ у дозі 0,66 мг/кг/добу перорально протягом 8 тиж, іншим мишам – індиферентний носій. Кінцеві точки дослідження включали несучу здатність передніх і задніх кінцівок, сироваткові біомаркери метаболізму кісткової та хрящової тканини, гістологічне дослідження. Дебют ОА спостерігали через 6-8 тиж після індукції травматичного ОА, про що свідчила втрата вантажопідйомності ураженої кінцівки (тварини переносили вагу на передні лапи). Проте в групі мишей, які отримували UC-IIТМ, вдалося зберегти опірну здатність ураженої кінцівки, цілісність губчастої кістки великогомілкового метафіза, а також сповільнити ріст остеофітів і руйнування суглобового хряща.
Отже, UC-IIТМ (активний інгредієнт Меркани) запобігав дегенеративним змінам у хрящовій тканині суглоба й утворенню остеофітів. Це свідчить про потенційний структурно-модифікуючий ефект UC-IIТМ, який потребує подальшого вивчення в популяції хворих на ОА.
Також спікерка зазначила, що для отримання можливого структурно-модифікуючого ефекту та зменшення швидкості прогресування ОА засоби з групи SYSADOA, в тому числі на основі неденатурованого колагену II типу, потрібно застосовувати тривало та безперервно – протягом 1 року й більше.
Вивченням ролі похідних колагену у відновленні суглобового хряща при ОА займалася група ревматологів зі світовими іменами. Зокрема, до неї увійшли професор Germain Honvo, Jean-Yves Reginster, Olivier Bruyere, котрі є авторами останніх рекомендацій ESCEO з лікування ОА. Експерти спланували проведення систематичного огляду, ключовими тезами котрого слугували відсутність хворобомодифікуючих засобів для лікування ОА та проблеми безпеки добре відомих традиційних препаратів, що зумовлює нагальну необхідність пошуку альтернативних підходів, до яких можна віднести застосування похідних колагену. Важливо, що похідні колагену є безпечними для застосування в пацієнтів з ОА; це підтверджується результатами лабораторних досліджень на токсичність.
Дані, отримані дослідниками, дають переконливі підстави припустити, що використання похідних колагену як харчових добавок може бути доречною стратегією у веденні пацієнтів з ОА.
Довідка «ЗУ»
Загалом до систематичного огляду Germain Honvo та співавт. (2020) включили 41 опубліковане дослідження; з них 16 – доклінічні дослідження, 25 – клінічні (включно з 4 систематичними оглядами / метааналізами). Ці дослідження були проведені в різних частинах світу. У відібраних роботах вивчали 2 похідні колагену – гідролізат колагену (СН) і неденатурований колаген (UC-ІІ®).
Доклінічні та клінічні дослідження in vivо продемонстрували здатність похідних колагену (СН та UC-ІІ®) зменшувати руйнування хряща й навіть сприяти його відновленню незалежно від джерела походження (курка, риба, свиня, бик, кальмар) та молекулярної маси.
Утім, результати експериментальних досліджень in vitro з оцінки впливу похідних колегену на структуру хряща суттєво відрізнялися. Зокрема, дослідницька група з Німеччини, котра порівнювала похідні СН (гідролізату колагену) з різних джерел, зробила висновок, що деякі з них відрізняються за пептидним складом і можуть бути неефективними й навіть згубними для хряща при ОА (Schadow S. et al., 2017). Подібних висновків дійшли й тайські дослідники, котрі порівнювали СН риб’ячого походження з різною молекулярною вагою (Boonmaleerat K. et al., 2018).
На відміну від досліджень із неденатурованим колагеном, які без виключення показали його ефективність у запобіганні прогресуванню ОА та відновленні структури хряща, похідні гідролізату колагену в 3 із 4 досліджень виявилися або неефективними, або спричиняли прогресування ушкодження хряща.
На завершення своєї доповіді професор зазначила, що ведення ОА в майбутньому має обов’язково включати такі напрями:
- покращення технологій стратифікації пацієнтів;
- виокремлення предикторів ризику ОА;
- скринінг фенотипів пацієнтів з ОА;
- таргетне лікування, спрямоване на запобігання ушкодженню хряща.
Підготував В’ячеслав Килимчук



