10 жовтня, 2023
Синергічна дія нестероїдних протизапальних препаратів та глюкозаміну сульфату в лікуванні остеоартриту колінного суглоба
 Остеоартрит (ОА) є поширеним дегенеративним захворюванням опорно-рухового апарату, яке спричиняє істотні медичні та соціальні проблеми. У країнах західного світу ОА уражає понад 70% дорослих віком 55-70 років (Bijlsma J. et al., 2007; Dillon C. et al., 2006). Ця хвороба характеризується прогресивною втратою суглобового хряща, склерозом субхондральної кістки, утворенням остеофітів і синовіальним запаленням, які призводять до інвалідизації. Основними симптомами ОА є хронічний біль, функціональні розлади, нестабільність і деформації суглобів. Ці симптоми значно погіршують якість життя та супроводжуються частими зверненнями по медичну допомогу (Hunter D.J., Bierma-Zeinstra S., 2019; Tenti S. et al., 2020; Sangha O. et al., 2000).
Остеоартрит (ОА) є поширеним дегенеративним захворюванням опорно-рухового апарату, яке спричиняє істотні медичні та соціальні проблеми. У країнах західного світу ОА уражає понад 70% дорослих віком 55-70 років (Bijlsma J. et al., 2007; Dillon C. et al., 2006). Ця хвороба характеризується прогресивною втратою суглобового хряща, склерозом субхондральної кістки, утворенням остеофітів і синовіальним запаленням, які призводять до інвалідизації. Основними симптомами ОА є хронічний біль, функціональні розлади, нестабільність і деформації суглобів. Ці симптоми значно погіршують якість життя та супроводжуються частими зверненнями по медичну допомогу (Hunter D.J., Bierma-Zeinstra S., 2019; Tenti S. et al., 2020; Sangha O. et al., 2000).
Дані дослідження Global Burden of Disease (2019) свідчать, що поширеність ОА з 1990 до 2019 року зросла з 247,51 млн до 527,81 млн випадків, тобто на 113,25% (Long H. et al., 2022). Лише на симптомний ОА колінного суглоба страждають понад 250 млн осіб у світі (Cui A. et al., 2020). Оскільки поширеність ОА зростає з віком, ця хвороба є і продовжуватиме залишатися глобальною медичною та соціоекономічною проблемою протягом прийдешніх десятиліть.
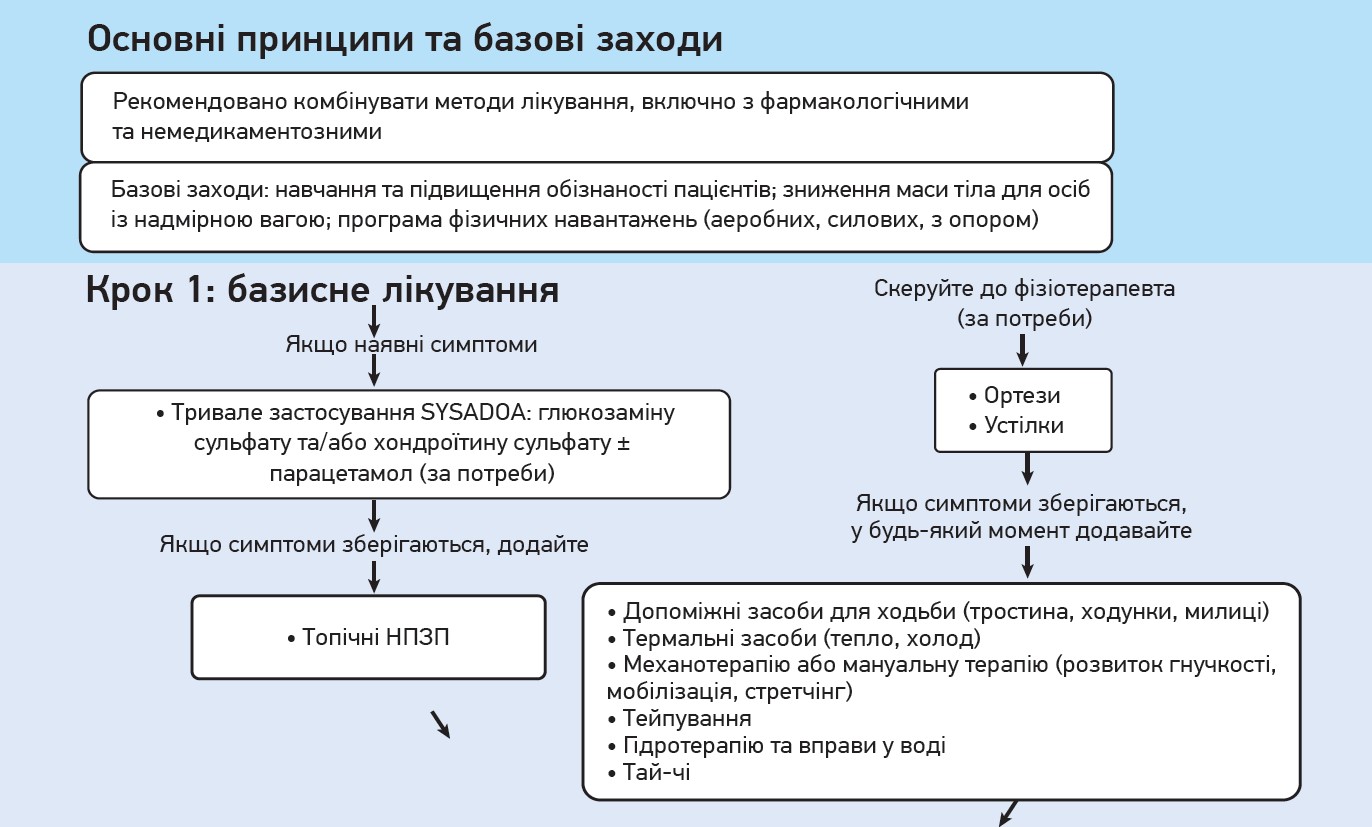
Залежно від тяжкості хвороби й ураженого суглоба лікування ОА може передбачати нефармакологічні, фармакологічні та хірургічні методи (Arden N.K. et al., 2021). Ключовим принципом ведення пацієнтів з ОА є комбінація нефармакологічних та фармакологічних методів лікування. Рекомендовані Європейським товариством клінічних та економічних аспектів остеопорозу, остеоартриту та захворювань опорно-рухового апарату (ESCEO) нефармакологічні методи включають проведення навчання пацієнтів стосовно їхньої хвороби, зменшення маси тіла (для осіб із надмірною вагою й ожирінням) та програму фізичних навантажень (аеробних, силових, вправ з опором тощо). Слід, однак, зауважити, що співвідношення користі й ризику для фізичних навантажень і дієт недостатньо вивчене для осіб віком 70-80 років, які складають значну частку пацієнтів з ОА (Bruyere O. et al., 2019).
Що стосується фармакотерапії, то ESCEO рекомендує застосовувати симптоматичні засоби повільної дії для лікування ОА, відомі під англомовною абревіатурою SYSADOA (symptomatic slow-acting drugs for osteoarthritis). До них належать рецептурні препарати глюкозаміну сульфату (ГС) та хондроїтину сульфату, які виступають першою лінією терапії для довготривалого лікування (Bruyere O. et al., 2019).
Глюкозамін, природний аміномоносахарид, є компонентом глікозаміногліканів позаклітинного матриксу хряща, синовіальної рідини та суглобового хряща (Colletti A., Cicero A.F.G., 2021). Вважається, що ГС чинить протизапальний та антиапоптотичний вплив на суглобовий хрящ і кістки (Chiu H.W. et al., 2019; Mousavi S.H. et al., 2018; Shmagel A. et al., 2019). ГС застосовується як хворобомодифікуючий засіб при ОА вже майже 60 років (Vetter G., 1965). Важливо, що цей препарат має відмінні показники безпеки та дозволяє зменшити вживання нестероїдних протизапальних препаратів (НПЗП), яким притаманна низка побічних ефектів (Dougados M., 2006).
T. Conrozier і T. Lohse (2022) провели огляд літератури, присвячений ГС, і виявили, що для цього препарату описаний симптоматичний ефект при ОА, котрий перевищує відповідні показники для плацебо і є не гіршим, ніж у деяких НПЗП. Відмінності в результатах досліджень, присвячених ГС, можна пояснити різним дизайном і якістю цих досліджень, а також різними типами глюкозаміну, які вивчалися в них. Аналгетичний ефект ГС виникає через кілька тижнів лікування й утримується протягом кількох тижнів після припинення терапії, що підтверджує приналежність цього препарату до SYSADOA. В дослідженні PREDOA клінічно значуще покращення спостерігалося в 63% пацієнтів, які отримували лікування ГС протягом 6 місяців. У кількох подвійних сліпих рандомізованих контрольованих дослідженнях тривалістю щонайменше 1 рік було продемонстровано перевагу ГС над плацебо в зменшенні швидкості звуження суглобової щілини в пацієнтів з ОА колінного суглоба. ГС сповільнював прогресування ОА в середньому на 54%. I. Nagaoka та співавт. (2019) висловили гіпотезу про доцільність застосування ГС як первинної профілактики ОА, виявивши нормалізацію маркерів синтезу та руйнування колагену ІІ типу після 3-місячного курсу цього препарату в молодих спортсменів.
Показано, що в різних людей біодоступність ГС може відрізнятися в 100 разів; для збільшення біодоступності запропоновано приймати його натще та ввечері (відповідно до природних циркадних ритмів) (Seto Y. et al., 2020). Слід також зауважити, що сумісне призначення глюкозаміну та хондроїтину сульфату зменшує всмоктування першого на 58% (Jackson C. et al., 2010).
Цікаво, що нещодавні дослідження виявили зниження кардіоваскулярної смертності у пацієнтів, які отримують довготривале лікування ГС чи хондроїтину сульфатом. Після стандартизації груп порівняння за віком, статтю, расовою приналежністю, статусом куріння та рівнем фізичної активності застосування цих хондропротекторних засобів супроводжувалось зменшенням смертності від усіх причин на 27%, а кардіоваскулярної смертності – на 58% (King D., Xiang J., 2020). Головним механізмом загальних сприятливих ефектів ГС вважають його здатність протидіяти хронічному запаленню через посттрансляційну модуляцію білків (Herrero-Beaumont G., Largo R., 2020). У зв’язку із цим ГС розглядають як корисний препарат для лікування ОА в пацієнтів із метаболічним синдромом, цукровим діабетом та серцево-судинними захворюваннями в анамнезі, що нерідко є протипоказаннями до застосування НПЗП й інтраартикулярного введення кортикостероїдів (Conrozier T., Lohse T., 2022).
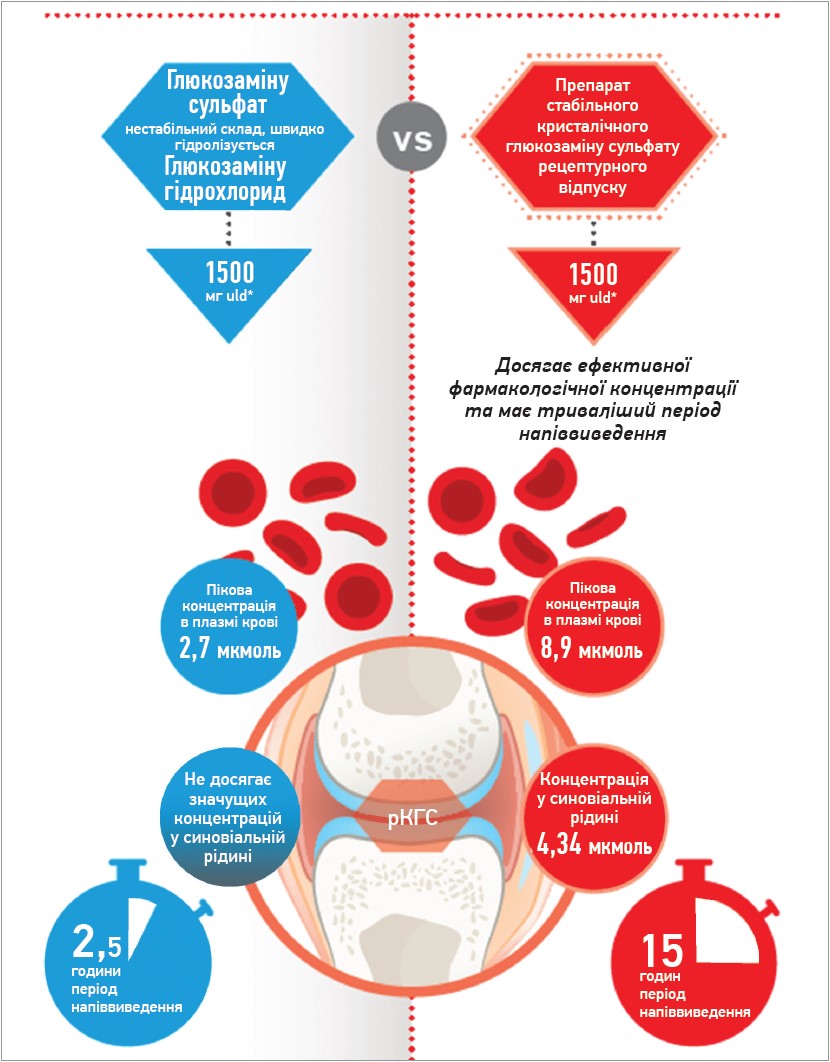
У першому і єдиному станом на зараз метааналізі, присвяченому довгостроковому контролю болю та покращенню функції суглоба при ОА (n=22 037), порівнювали вплив засобів, які ймовірно модифікують захворювання, хондропротекторів, НПЗП, аналгетиків, антиоксидантів і внутрішньосуглобового введення гіалуронової кислоти та кортикостероїдів. Кристалічний (стабільний) ГС виявився єдиним засобом, застосування якого супроводжувалося стійким зменшенням болю, покращенням функції та уповільненням звуження суглобової щілини в пацієнтів з ОА колінного суглоба. Застосування ГС достовірно зменшувало біль, причому ця закономірність збереглася після оцінки больового синдрому за нормалізованою шкалою та виключення досліджень із високим ризиком упередженості (Gregori D. et al., 2018). Слід зауважити, що йдеться саме про кристалічний ГС рецептурного відпуску, який має низку переваг (рис. 1), а не про будь-який ГС, представлений у формі дієтичної добавки.
Рис. 1. Переваги кристалічного рецептурного ГС над іншими формами ГС та глюкозаміну гідрохлориду
Примітка: * наднизька доза (ultra low dose).
Рекомендіції ESCEO чітко вказують, що другим після SYSADOA кроком лікування ОА колінного суглоба у випадку болю або функціональних обмежень є пероральні НПЗП (рис. 2). Препарат класу НПЗП має призначатися в інтермітувальному режимі, а оптимальну молекулу слід обирати на основі індивідуального профілю ризику пацієнта (Bruyere O. et al., 2019).
Рис. 2. Покроковий алгоритм лікування ОА колінного суглоба
Керівні настанови Американської колегії ревматології / Фундації артриту (ACR/AF, 2019), Міжнародного товариства з дослідження ОА (OARSI, 2019) та Європейського альянсу ревматологічних асоціацій (EULAR, 2003) рекомендують застосовувати в разі ОА коліна, кульшового суглоба чи суглобів кисті пероральні НПЗП. В осіб із шлунково-кишковими коморбідними станами перевагу слід віддавати селективним інгібіторам циклооксигенази‑2 (ЦОГ‑2), які мають сприятливіший профіль гастроінтестинальної безпеки, ніж неселективні НПЗП (Kolasinski S.L. et al., 2020; Bannuru R.R. et al., 2019; Jordan K.M. et al., 2003). НПЗП, якому варто віддати перевагу, можна вважати целекоксиб, котрому притаманні висока ефективність і низький потенціал токсичності, особливо щодо шлунково-кишкових та кардіоваскулярних побічних ефектів (Bruyere O. et al., 2019). За результатами дослідження PRECISION, застосування целекоксибу супроводжувалось достовірно нижчим кардіоренальним ризиком, ніж застосування ібупрофену; аналогічна тенденція була виявлена і для порівняння з напроксеном (Obeid S. et al., 2022). В іншому клінічному дослідженні було показано достовірно нижчий ризик клінічно значущих подій із боку верхніх і нижніх відділів шлунково-кишкового тракту за умови застосування целекоксибу порівняно з комбінацією диклофенак + омепразол (Chan F.K. et al., 2010). Відповідно до вже цитованого масштабного метааналізу F. Gregori та співавт. (2018), целекоксиб виявився єдиним НПЗП, прийом якого супроводжувався довгостроковим полегшенням болю. Автори також відзначили кращу гастроінтестинальну переносимість при тривалому застосуванні порівняно з неселективними НПЗП і відсутність зв’язку з підвищенням ризику кардіоваскулярних подій.
Доказова база останніх років свідчить, що інгібітори ЦОГ‑2 можуть мати не лише аналгетичний і протизапальний, а й хворобомодифікуючий ефект. Зокрема, це було продемонстровано для целекоксибу (Zweers M.C. et al., 2011; Nakata K. et al., 2018; Matsuda K. et al., 2006; Ou Y. et al., 2012; Mastbergen S.C. et al., 2006).
У разі ОА хондроцити неспроможні підтримувати рівновагу між синтезом і деградацією позаклітинного матриксу, що призводить до порушення структурної цілісності хряща. Спочатку хондроцити компенсують посилений катаболізм за рахунок збільшення синтезу колагену та протеогліканів, але в міру прогресування ОА збалансувати катаболічну активність стає неможливо (Abramson S.B., Attur M., 2009). Целекоксиб здатний стимулювати синтез протеогліканів і їх затримку в хрящовій тканині людини на відміну від інших НПЗП, які не впливають на обмін протеогліканів у хрящі (диклофенак, напроксен). Нормалізація вмісту протеогліканів у хрящовій тканині під впливом целекоксибу свідчить про те, що раннє застосування цього препарату здатне сповільнити хондродеструкцію або навіть забезпечити її зворотний розвиток (Mastbergen S.C. et al., 2005; 2006; El Hajjaji L. et al., 2003). Механізмами хондропротекторної дії целекоксибу можуть виступати пригнічення вивільнення простагландину Е2, підтримання збалансованої дії протеолітичних ферментів у циклі деструкції й утворення хряща та зменшення вироблення оксиду азоту, який індукує апоптоз хондроцитів й активує руйнувальні ферменти – матриксні металопротеїнази (Zweers M.C. et al., 2011).
Хоча раніше ОА розглядали як незапальну артропатію, нині визнано вагому роль синовіального запалення в прогресуванні цієї хвороби. В моделях артриту на тваринах продемонстровано, що целекоксиб зменшує синовіт, лейкоцитарну інфільтрацію та синовіальну гіперплазію (Thwin M.M. et al., 2009; El-Ghazaly M.A. et al., 2010). Імовірно, це пояснюється тим, що зазначений препарат пригнічує запущену інтерлейкіном‑1β активацію прозапальних біохімічних каскадів у синовіальних фібробластах (Alvarez-Soria M.A. et al., 2008), перериваючи патогенетичний ланцюг ОА.
В експериментальній моделі колаген-індукованого ОА целекоксиб зменшував пошкодження хрящової тканини: гістопатологічне дослідження виявило в групі лікування меншу кількість ерозій, нижчі показники фібриляції хряща, меншу втрату хондроцитів і вищий вміст протеогліканів у хрящі порівняно з групою контролю (Huh J.E. et al., 2009).
Цікавою методологією, яка дозволяє дослідити хрящ живих пацієнтів, є лікування осіб із тяжким ОА, котрі очікують на суглобозамісну операцію, з подальшим вивченням препаратів їхніх суглобових тканин ex vivo. Дослідження такого типу виявило, що 4 тижні застосування целекоксибу достовірно збільшує швидкість синтезу протеогліканів і затримку новоутворених протеогліканів порівняно з відсутністю лікування або застосуванням індометацину (de Boer T.N. et al., 2009).
В обсерваційному дослідженні C. Ding і співавт. (2009) застосування стандартних неселективних НПЗП супроводжувалось посиленою деструкцією хряща порівняно із селективними інгібіторами ЦОГ‑2. До того ж селективні целекоксиб і рофекоксиб продемонстрували сприятливий вплив на стан дефектів великогомілкового хряща при ОА колінного суглоба порівняно з відсутністю лікування.
Крім хрящових змін, ОА характеризується ремоделюванням кістки, яке є двофазним: спочатку зменшується утворення трабекулярної кісткової тканини, а згодом наростають щільність і жорсткість субхондральної кістки. Для целекоксибу, але не для інших НПЗП описана здатність протидіяти зниженню мінеральної щільності кістки та збільшувати об’єм трабекулярної кісткової тканини (Katagiri M. et al., 2006; Noguchi M. et al., 2008; Taketa T. et al., 2008).
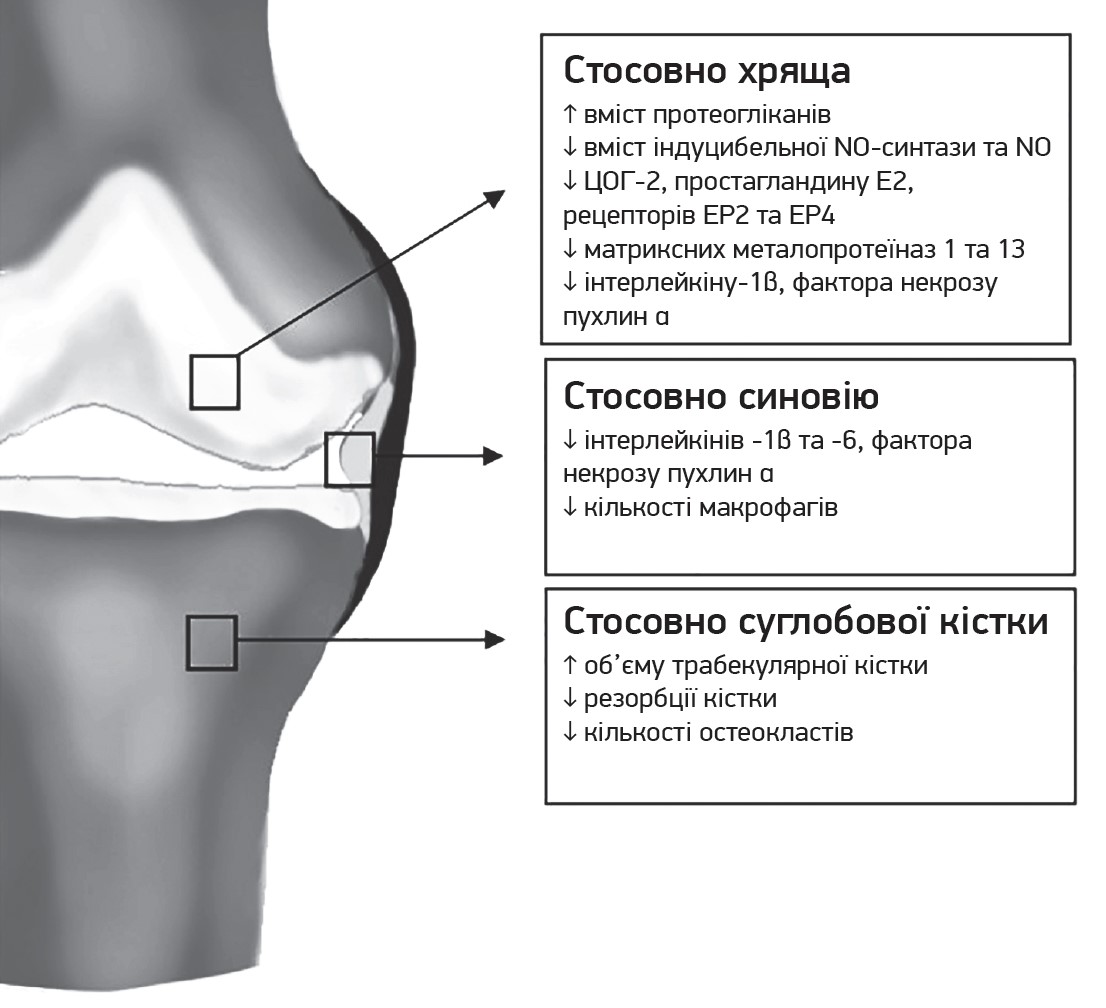
Узагальнення ефектів целекоксибу in vivo представлено на рисунку 3.
Рис. 3. Ефекти целекоксибу in vivo
Загалом ОА притаманна висока частота невдач лікування та субоптимальний контроль симптоматики, що виражено погіршує якість життя. Мультимодальний підхід може бути ефективнішим у покращенні самопочуття пацієнтів і досягненні високої частки успішності терапії порівняно з монотерапією. Цей погляд підтримують міжнародні керівні настанови та консенсусні документи (Jordan K.M. et al., 2003; Yeap S.S. et al., 2021; Zhang Z. et al., 2021; Gnylorybov A.M. et al., 2020; Kucharz E.J. et al., 2019). Відповідно до алгоритму ESCEO, у пацієнтів зі стійкими симптомами доцільно поєднувати пероральні НПЗП із SYSADOA. Для цих двох груп препаратів описаний синергічний ефект, який дозволяє зменшити тяжкість симптоматики, відтермінувати прогресування хвороби та поліпшити структуру суглобових тканин. При поєднанні НПЗП та SYSADOA останні виконують роль фонової підтримувальної терапії, натомість пероральні НПЗП усувають гострі симптоми та потенційно сповільнюють прогресування патологічного стану (Veronese N. et al., 2022).
Нещодавнє дослідження in vitro виявило, що ГС і целекоксиб чинять синергічну хондропротекторну, протизапальну, антиапоптотичну й антиоксидантну дію в культурі хондроцитів людини, оброблених прозапальним інтерлейкіном‑1β. Інкубація клітин із цими фармакопрепаратами зменшувала експресію генів і вивільнення ЦОГ‑2, простагландину Е2, інтерлейкінів 1β та 6, фактора некрозу пухлин α, матриксних металопротеїназ 1, 3 та 13, водночас підвищуючи вивільнення колагену ІІ типу. На думку авторів, при ОА целекоксиб може виступати не лише симптоматичним, а й хворобомодифікуючим препаратом (Cheleschi S. et al., 2021).
Систематичний огляд і метааналіз N. Veronese та співавт. (2022), який включав 4 рандомізовані клінічні дослідження й одне проспективне обсерваційне дослідження, продемонстрував достовірну перевагу комбінації ГС + НПЗП над монотерапією ГС або НПЗП у лікуванні ОА. Зокрема, в дослідженні G. Deng і співавт. (2019), 120 пацієнтів з ОА колінного суглоба було рандомізовано в групи ГС + целекоксиб та монотерапії целекоксибом протягом 8 тижнів. Сумарна ефективність комбінованої терапії склала 93,33%, а монотерапії целекоксибом – 71,66% (p<0,05). Аналогічно комбінація ГС та целекоксибу забезпечила зменшення вмісту маркерів запалення, показників окисного стресу, оцінки болю за візуальною аналоговою шкалою, індексу ОА за WOMAC і Лісгольмською шкалою для колінного суглоба. Всі ці покращення були достовірно вираженішими, ніж у контрольній групі монотерапії. Побічні ефекти в групі ГС + целекоксиб спостерігалися достовірно рідше, ніж у групі целекоксибу (10% проти 21,67%; p<0,05). Автори дійшли висновку, що комбінація ГС + целекоксиб дієво сповільнює прогресування ОА та покращує функцію суглоба.
У проспективному обсерваційному дослідженні F. Amuzadeh і співавт. (2015) зіставили результати терапії групи жінок віком 37-49 років з ОА колінного суглоба, які отримували целекоксиб або його комбінацію з ГС. Через 8 тижнів лікування група комбінованої терапії мала достовірно кращий результат за індексом WOMAC (в цілому і за субшкалами болю, ранкової скутості та функції суглоба), ніж група монотерапії.
Дослідження G. Wang і співавт. (2006) передбачало порівняння 3 груп лікування ОА колінного суглоба: монотерапії целекоксибом, монотерапії ГС і комбінованого лікування. У групах целекоксибу та комбінованого лікування вже через 1 місяць було зафіксовано різке зменшення інтенсивності симптомів. Через 6 місяців від початку лікування при проведенні магнітно-резонансної томографії в групах ГС і комбінованої терапії спостерігали зменшення стирання суглобового хряща, яке було вираженішим, ніж у групі целекоксибу, однак через 12 місяців результати магнітно-резонансної томографії виявили достовірно кращий стан суглобових тканин у групі ГС + целекоксиб порівняно з обома іншими групами монотерапії. Автори зауважили, що комбінація ГС та целекоксибу не лише швидко усуває біль і функціональні розлади на ранніх етапах лікування, а й захищає суглобовий хрящ від стирання та сприяє його відновленню у випадку тривалого застосування.
Таким чином, застосування мультимодального підходу (комбінації ГС та НПЗП) до ведення пацієнтів з ОА колінного суглоба є ефективним і безпечним. Доказова база такого підходу доводить його переваги над монотерапією будь-яким із включених до комбінації препаратів щодо симптоматики ОА, функції суглоба та структурного стану суглобового хряща.
Мультимодальний підхід підтримують у своїх рекомендаціях усі провідні фахові товариства: ESCEO, Американська колегія ревматології, Європейський альянс ревматологічних асоціацій (EULAR). Синергічний протизапальний підхід із використанням ГС як базисної терапії та целекоксибу як перорального НПЗП із добре вивченим профілем безпеки й ефективності здатен забезпечити пацієнтам оптимальний довгостроковий вплив.
Список літератури знаходиться в редакції.
Підготувала Лариса Стрільчук
DON-2023-0234