5 травня, 2023
Ефективність розчину повідон-йоду проти резистентних мікроорганізмів, які формують біоплівки
Біоплівки являють собою скупчення патогенів, прикріплених до поверхні та вбудованих в екстрацелюлярний матрикс [1]. Утворення біоплівки є вдалою стратегією; вона захищає бактерії, грибки та дріжджі від небезпеки в навколишньому просторі, антимікробних пептидів, антибіотиків, фагоцитозу, а також надає можливість тривало персистувати в організмі хазяїна.
Біоплівки – це не просто шари бактеріального слизу; вони являють собою складні біологічні системи.
Мікроорганізми, які входять до складу біоплівки, організовані в скоординоване функціональне угруповання. Біоплівки часто прикріплюються до поверхні та можуть бути представлені одним видом або різнорідною групою малорухливих мікроорганізмів. Ці спеціалізовані гетерогенні угруповання в такий спосіб зміцнюються та захищаються біоплівкою, що сприяє зниженню експресії шкідливих генів і маніфестації патогенних факторів. Доведено, що хронічні рани містять біоплівки, представлені як штамами бактерій, так і грибів [2, 3]. Саме за таких умов мікроорганізми біоплівки здатні ділитися поживними речовинами та захищатися від шкідливих факторів навколишнього середовища, наприклад, зневоднення, антибіотиків та імунної системи організму [4, 5].
Нещодавно зазначено, що бактеріальні біоплівки здатні погіршувати загоєння шкірних ран, а також знижувати ефективність топічних антибактеріальних засобів при загоєнні чи лікуванні інфікованих ран шкіри [6]. Хронічні рани часто виникають унаслідок оперативного втручання на шкірі, судинної недостатності або травми, що нерідко потребує звернення до лікарів первинної ланки, дерматологів, пластичних хірургів і фахівців із лікування ран. Під час нормального загоєння ранової поверхні процес, який спричиняє регенерацію тканини, являє собою результат серії чітко регульованих послідовних подій [7, 8]. У випадку хронічних незагойних ран цей процес порушується, що зумовлює пролонгацію запальної реакції та затримку загоєння. Припускають, що мікробна колонізація та формування біоплівки в рановому ложі асоційовані з переходом із гострого стану в хронічний, навіть за умов відсутності класичних ознак інфекції [9]. За утворення біоплівки проникнення всередину неї деяких протимікробних препаратів зменшується, а окремі її компоненти переводять свій метаболізм у сплячий стан, що може зумовити неефективність інших антибіотиків. Стратегії лікування ускладнюються наявністю супутніх захворювань, які впливають на кровообіг, наприклад, цукрового діабету, поганої перфузії та мальнутриції, що підвищує ризик інфікування та знижує ефективність пероральних антибактеріальних засобів [9]. Отже, раннє виявлення біоплівок у ранах має вирішальне значення для успішного лікування хронічних ран.
Більшість з нині доступних способів лікування розроблено для гострих ранових інфекцій, які на відміну від хронічних інфекцій мають тенденцію швидко виникати та загоюватися протягом невеликого періоду часу. Вільноплаваючі бактерії зазвичай реагують на антибіотики та легко знищуються здоровою імунною системою. І навпаки, хронічні рани характеризуються стійкою та надмірною запальною реакцією порівняно з гострими ранами та меншою чутливістю до антибіотиків [10]. Отже, недостатня антимікробна ефективність може бути пов’язана зі зниженням або неповним проникненням антимікробних препаратів до біоплівки. Новий підхід до вирішення вищезазначеної проблеми ґрунтується на використанні звичайного антисептика повідон-йоду (на вітчизняному фармацевтичному ринку представлений брендовим препаратом Бетадин® компаніїї «Егіс». – Прим. ред.) в дуже низьких концентраціях [11, 12]. Наше дослідження проведено в умовах in vitro з метою детальної характеристики протибіоплівкової активності цього клінічно ефективного препарату проти мікроорганізмів, здатних формувати біоплівки при ранових інфекціях шкіри.
Матеріали та методи
Приготування розчину повідон-йоду
Тестові розчини для біоплівок містять близько ≤2% повідон-йоду (відсоткове відношення мас, в/в) у розчинних системах, які можуть бути використані для утворення розчинів, що містять диметилсульфоксид як допоміжний розчинник. Ці розведені повідон-йод-вмісні системи дозволяють приготувати та стабілізувати при кімнатній температурі повідон-йод у концентраціях від 1 до 0,15% у розчинах. Для цих дослідів розчини повідон-йоду отримували при 2% розведенні. Наступні розведення розчинів готували з метою утворення розчинів низьких концентрацій для подальшої оцінки.
Антимікробні препарати порівняння та контроль
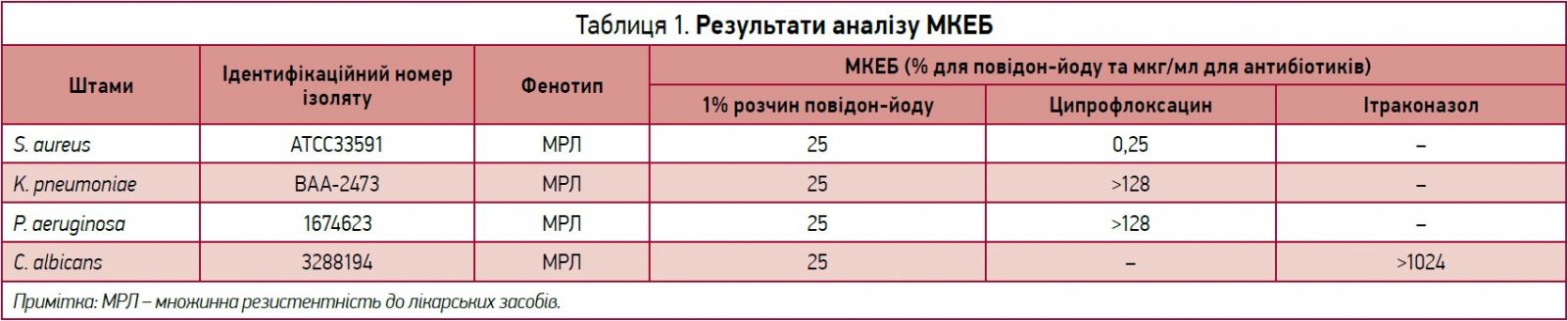
Мінімальну концентрацію, необхідну для ерадикації біоплівки (МКЕБ), визначали за допомогою ципрофлоксацину й ітраконазолу.
Протигрибкові препарати порівняння та контроль
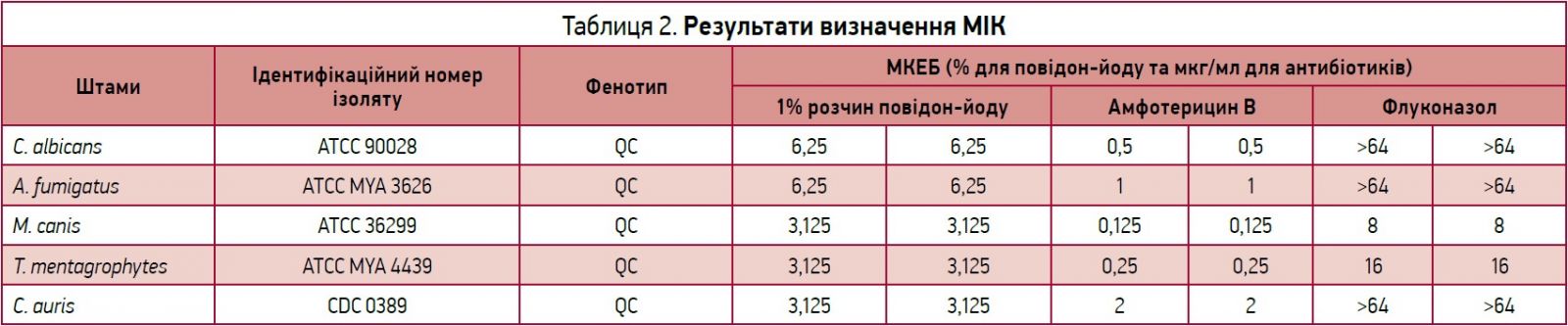
Мінімальну інгібувальну концентрацію (МІК) для грибів визначали за допомогою амфотерицину В та флуконазолу.
Мінімальна концентрація для ерадикації біоплівки
Значення МКЕБ являє собою оціночну концентрацію антимікробного препарату, необхідну для знищення / руйнування бактеріальної біоплівки. Планшети з технологією Calgary Biofilm Device (CBD) дозволяють утворювати біоплівки на поверхні, яка містить 96 блоків-осередків. Інокулят розводили до 1×107 КУО/мл у триптичному соєвому бульйоні для бактеріальних штамів і в середовищі RPMI для C. albicans перед інокуляцією в планшеті з CBD. Планшет із CBD із досліджуваним мікроорганізмом інкубували протягом 24 год за температури 35 °C у шейкері при 150 об/хв. Аналіз MКЕБ проводили відповідно до Ceri та співавт. [15].
Дослідження ерадикації біоплівки
Дослідний планшет обробляли трьома досліджуваними розчинами та антибіотиком порівняння. Двовідсоткові розчини повідон-йоду послідовно розводили 2 рази; отримані та розведені в такий спосіб досліджувані зразки тестували до досягнення 0,00018% (співвідношення об’єм-об’єм, о/о). Ципрофлоксацин та ітраконазол використовували як позитивний контроль для бактеріальних штамів і C. albicans. Ципрофлоксацин застосовували в таких концентраціях (мкг/мл): 128, 64, 32, 16, 8, 4, 2, 1, 0,5, 0,25, 0,125 і 0,0625 мкг/мл. Ітраконазол тестували в таких концентраціях (мкг/мл): 1024, 512, 256, 128, 64, 32, 16, 8, 4, 2, 1 і 0,5 мкг/мл.
Бульйон Мюллера – Хінтона зі стандартизованим умістом катіонів (CAMHB)/RPMI (для C. albicans) використовували як негативний контроль. Планшет CBD з осередками, що містили міцну біоплівку, спочатку промивали в фосфатно-сольовому розчині, а потім переносили на досліджуваний планшет, який містив досліджувані зразки та контроль. Планшет інкубували протягом 24 год за температури 35 °C, згодом використовували для визначення значень МІК. Після інкубації осередки двічі промивали в фосфатно-сольовому розчині та переносили до планшета відновлення зі свіжим культуральним середовищем. Осередки обробляли ультразвуком на водяній бані протягом 30 хв із метою видалення залишків адгезивної біоплівки. Планшет інкубували протягом ночі за температури 35 °C з метою оцінки росту та визначення значень МКЕБ.
Визначення чутливості грибків до МІК
Кожне дослідження MIК містило 11 2-кратних серійних розведень протигрибкових засобів. Тестові концентрації досліджуваних зразків аналізували в таких концентраціях: 50; 25; 12,5; 6,250; 3,125; 1,563; 0,781; 0,391; 0,195; 0,098; 0,049% о/о. Амфотерицин B і флуконазол досліджували в концентраціях 64, 32, 16, 8, 4, 2, 1, 0,5, 0,25, 0,125 і 0,0625 мкг/мл.
Дослідження MIК‑мікророзведення в бульйоні виконували відповідно до процедури, детально описаної у рекомендаціях CLSI в документах M38-A2 та М27-А3 [1, 2]. 2-X‑маткові розчини досліджуваних зразків виготовляли з концентрацією 128 мкг/мл для амфотерицину B і флуконазолу. Проводили 2-кратні серійні розведення маткових (вихідних) розчинів. Розведені вихідні розчини грибкових спор коректували (до досягнення еквівалентності 8×104 КУО/мл). 1-X‑кінцеву концентрацію протигрибкових засобів або антибіотиків отримували при їх комбінуванні з бульйоном грибкових спор у мікротитраційному планшеті. Остаточна концентрація грибкових спор у мікропланшеті складала 4×104 КУО/мл. Планшети інкубували протягом 7 днів за температури 30±2 °C для M. canis і 48 год за температури 27-30 °C для всіх інших штамів в інкубаторі навколишнього повітря. Значення МІК реєстрували у вигляді мінімальної концентрації досліджуваних зразків, яка пригнічувала видимий ріст під час огляду неозброєним оком. Значення МІК виражали у вигляді о/о у % для досліджуваного зразка та в мкг/мл для контрольних антибіотиків (табл. 1). Досліджування виконували в двох паралельних випробуваннях.
Результати
Дослідження МКЕБ проводили з метою визначення того, чи зможе низька концентрація повідон-йоду зруйнувати вже наявну міцну біоплівку мікроорганізмів, які вирощували в осередках протягом 24 год. Розчини повідон-йоду в концентраціях до 0,25 (в/в) повідон-йоду повністю знищували біоплівки всіх досліджуваних мікроорганізмів. Антибіотики порівняння визнано неефективними в знищенні біоплівок досліджуваних мікроорганізмів за винятком ципрофлоксацину, який мав значення МКЕБ 0,25 мкг/мл проти S. aureus ATCC33591.
Дослідження МІК проводили з метою визначення того, чи має низька концентрація досліджуваного зразка повідон-йоду протигрибкову дію. В серійно розведених концентраціях 6,25 і 3,125% розчини повідон-йоду продемонстрували протигрибкову активність проти всіх досліджуваних штамів. Флуконазол виявився неефективним проти C. albicans, A. fumigatus і C. auris. Амфотерицин В мав хорошу протигрибкову активність проти всіх досліджуваних штамів (табл. 2).
Обговорення
Повідон-йод є одним із небагатьох топічних протимікробних засобів, ефективних проти бактерій, вірусів, грибків, спор, найпростіших та амебних цист [16]. У розчинах повідон-йод утворює комплекс із синтетичним полімерним носієм полівінілпіролідоном, який сам собою не має мікробіцидної активності [17]. У водному середовищі вільний йод вивільнюється в розчин із повідон-йодового комплексу та встановлюється рівновага [18, 19]. Як хірургічні антисептики для звичайної медичної практики використовуються препарати повідон-йоду у вигляді 5 (в/в) або 10% (в/в) розчинів, проте аналіз in vitro парадоксально доводить, що розчини з нижчою концентрацією можуть бути ефективнішими, ніж такі з вищими концентраціями [20]. Унікальна хімія повідон-йоду дозволила в цьому дослідженні ефективно проаналізувати властивості надзвичайно низьких концентрацій, які забезпечили повну ерадикацію всіх досліджуваних мікроорганізмів, здатних утворювати біоплівки. Серійно розведені концентрації, як-от 6,25 і 3,125% розчини повідон-йоду, продемонстрували протигрибкову активність проти всіх досліджуваних штамів. На відміну від інших антисептиків не повідомлялося щодо набутої або перехресної резистентності до молекулярного йоду протягом >150 років його використання [21].
Біоплівки зустрічаються в ≈60% хронічних ран і 6% гострих ран. Знищення резидентних бактерій є своєрідним викликом у лікуванні цих випадків. Ефективні антисептики для загоєння ран в ідеалі мають впливати як на запалення, так і на утворення біоплівки, асоційованої з хронічними ранами [22]. Дані, отримані in vitro, свідчать, що йод не лише має широкий спектр антибактеріальної дії, а й протидіє запаленню, спричиненому як патогенами, так і відповіддю організму господаря. Ці протизапальні ефекти виявляються багатофакторними та клінічно значущими [23]. Антисептики як альтернатива місцевому лікуванню ран мають мікробіцидну дію та ширший спектр протимікробної дії, ніж антибіотики. Крім того, порівняно з більшістю антибіотиків і протигрибкових засобів, антисептики знижують імовірність виникнення резистентності, що з’являється завдяки численним механізмам дії, спрямованим на різні аспекти клітинної біології мікробів; отже, слід уникати використання місцевих антибіотиків і протигрибкових засобів, якщо в наявності є відповідні антисептики [24]. Хоча амфотерицин B був ефективним проти всіх грибкових штамів грибів, а інші контрольні антибіотики та протигрибкові засоби в цьому дослідженні визнано частково ефективними, до кожного з них може виникати резистентність, тому вони не виробляються в топічних формах. Порівняння антимікробного спектра з таких широко застосовуваних антисептиків (повідон-йод 10%, полігексанід, хлоргексидин, октенідин, етанол 70%) проти грампозитивних, грамнегативних, актинобактерій, спор, грибків і вірусів демонструє сильну мікробіцидну активність 10% повідон-йоду проти всіх класів мікроорганізмів. Інші категорії антисептиків не мають значної біоцидної дії у всіх категоріях [24].
Застосування повідон-йоду для хронічних ран добре описано в літературі. В дослідженнях, проведених у людської популяції in vivo в різних умовах, доведено ефективність повідон-йоду в зниженні бактеріального навантаження як при гострих, так і хронічних ранах [25-31]. Висловлюються побоювання щодо передбачуваної цитотоксичності повідон-йоду та його потенційного шкідливого впливу на процес загоєння ран; широко обговорюється здатність біоплівок, котра зафіксована в декількох дослідженнях in vitro, виявляти дозозалежну цитотоксичність повідон-йоду в культурах гранулоцитів, моноцитів, кератиноцитів і фібробластів [32-34]. Дослідження in vivo не змогли довести шкідливого впливу на загоєння ран; надзвичайно низькі концентрації повідон-йоду, використані в цьому дослідженні, добре зменшують цю потенційну можливість. Низькодозові розчини повідон-йоду нещодавно розпочали використовувати в офтальмології, оториноларингології та дерматології для лікування різних захворювань без жодних повідомлень про токсичність [11, 12, 35].
Також слід відзначити ефективність низьких доз повідон-йоду проти біоплівок, що містять C. auris, який визнано стійким до багатьох лікарських засобів; складно культивувати патогени, що виникають, котрі можуть спричиняти появу як системних, так і ранових інфекцій. Імовірно, це дослідження є першим локальним підходом до C. auris.
Висновки
Отримані біоплівки багаторезистентних штамів S. aureus, P. aeruginosa, K. pneumoniae і C. albicans можуть бути ефективно зруйновані in vitro шляхом обробки розведеним розчином повідон-йоду. Низькі концентрації повідон-йоду, як-от 6,25 і 3,125% розчини, продемонстрували протигрибкову активність щодо Candida auris, Trichophyton mentagrophytes, Microsporum canis, Candida albicans і штамів Aspergillus fumigatus в аналізі MIК. Пошук потужних, нетоксичних засобів, здатних протидіяти біоплівкам, продовжується; подальші дослідження розбавлених повідон-йод-вмісних систем in vitro та in vivo можуть надати новий клас терапевтичних агентів із хорошою ефективністю проти хронічних ран, що складно лікуються.
Стаття друкується в скороченні.
Список літератури доступний в оригінальній публікації.
Capriotti K., Pelletier J., Barone S., Capriotti J., 2018. Efficacy of Dilute Povidone-Iodine against Multi-Drug Resistant Bacterial Page 2 of 5 Biofilms, Fungal Biofilms and Fungal Spores. Clin Res Dermatol Open Access 5 (1): 1-5. doi: http://dx.doi.org/10.15226/2378-1726/5/1/00174.
Переклала з англ. Тетяна Можина