24 серпня, 2023
Медикаментозне лікування глаукоми: рекомендації Японського товариства глаукоми (2023)
У цьому огляді містяться окремі розділи 5-го видання клінічних практичних рекомендацій з лікування глаукоми (Glaucoma Clinical Practice Guidelines, GCPG) Японського товариства глаукоми (Japan Glaucoma Society), опублікованих на початку 2023 року. GCPG уперше представлено в 2003 році; це перші рекомендації щодо лікування глаукоми в Японії, які є найприйнятнішими для пацієнта. Принцип лікування глаукоми полягає у зниженні внутрішньоочного тиску (ВОТ); основні засоби для цього – ліки, лазери та хірургія. Нижче наведено інформацію щодо загальних принципів терапії та медикаментозного лікування глаукоми.
Принципи терапії глаукоми
1. Мета лікування глаукоми – підтримка якості зору (quality of vision, QoV) і якості життя (quality of life, QoL) пацієнтів. QoV та QoL знижуються із прогресуванням погіршення зору, зокрема за порушень поля зору через глаукому. Соціальний, психологічний та економічний тягар, пов’язаний з лікуванням, також може знизити якість життя.
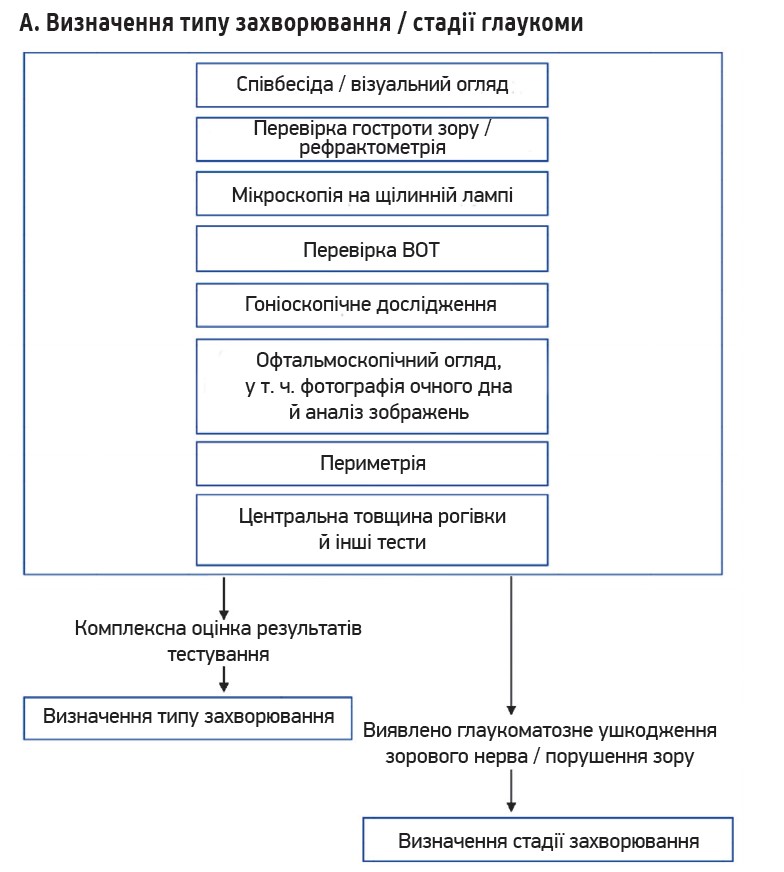
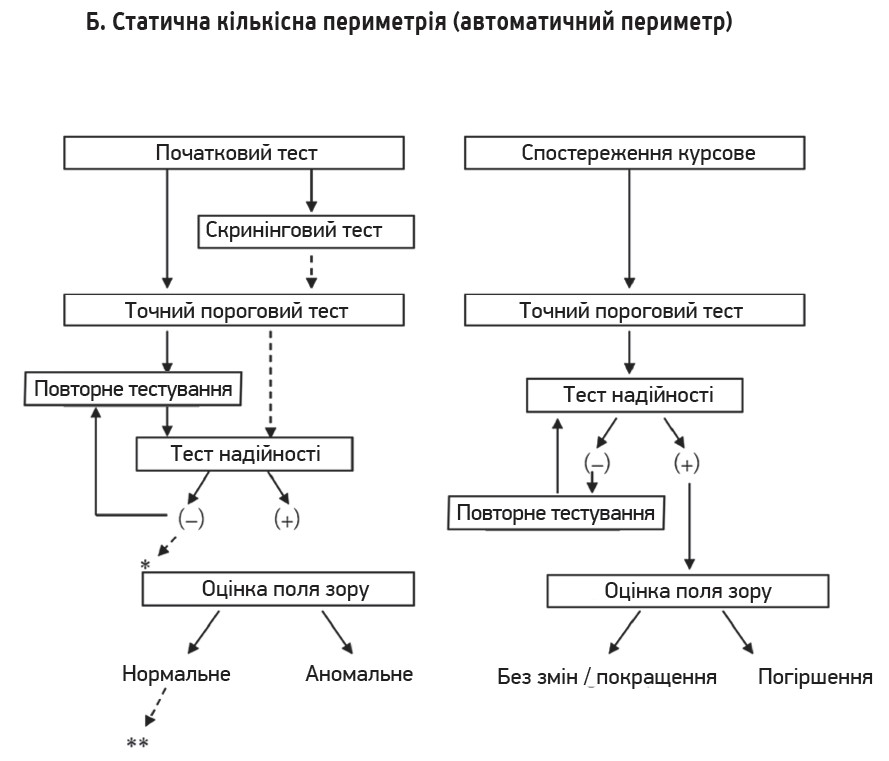
2. Найнадійніше лікування – зниження ВОТ. Зниження ВОТ – це єдиний надійний та заснований на доказах метод лікування глаукоми. Результати рандомізованих контрольованих досліджень підтверджують, що зниження ВОТ гальмує як початок, так і прогресування глаукоми. Зниження ВОТ є ефективним незалежно від типу чи стадії глаукоми. Під час лікування необхідно приділяти увагу ВОТ і його коливанням. Крім добових, сезонних і позиційних коливань, властивості рогівки також мають значний вплив на вимірювання ВОТ. Окрім вроджених відмінностей товщини рогівки, слід зазначити, що ВОТ може змінюватися внаслідок впливу інших захворювань або рефракційної хірургії (рис.).
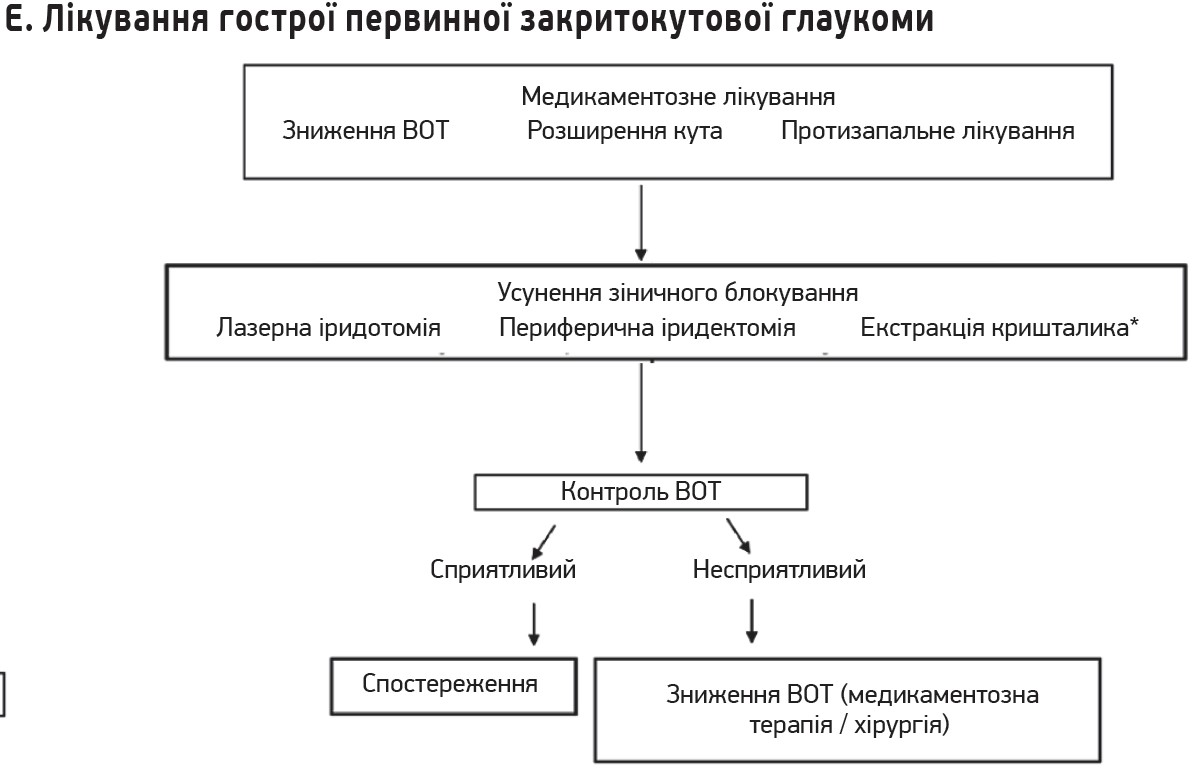
Рис. Алгоритми діагностики і лікування глаукоми
3. Лікування причини за умов її виліковності. Якщо причину підвищення ВОТ можна вилікувати, її слід лікувати разом зі зниженням ВОТ.
До таких методів належать:
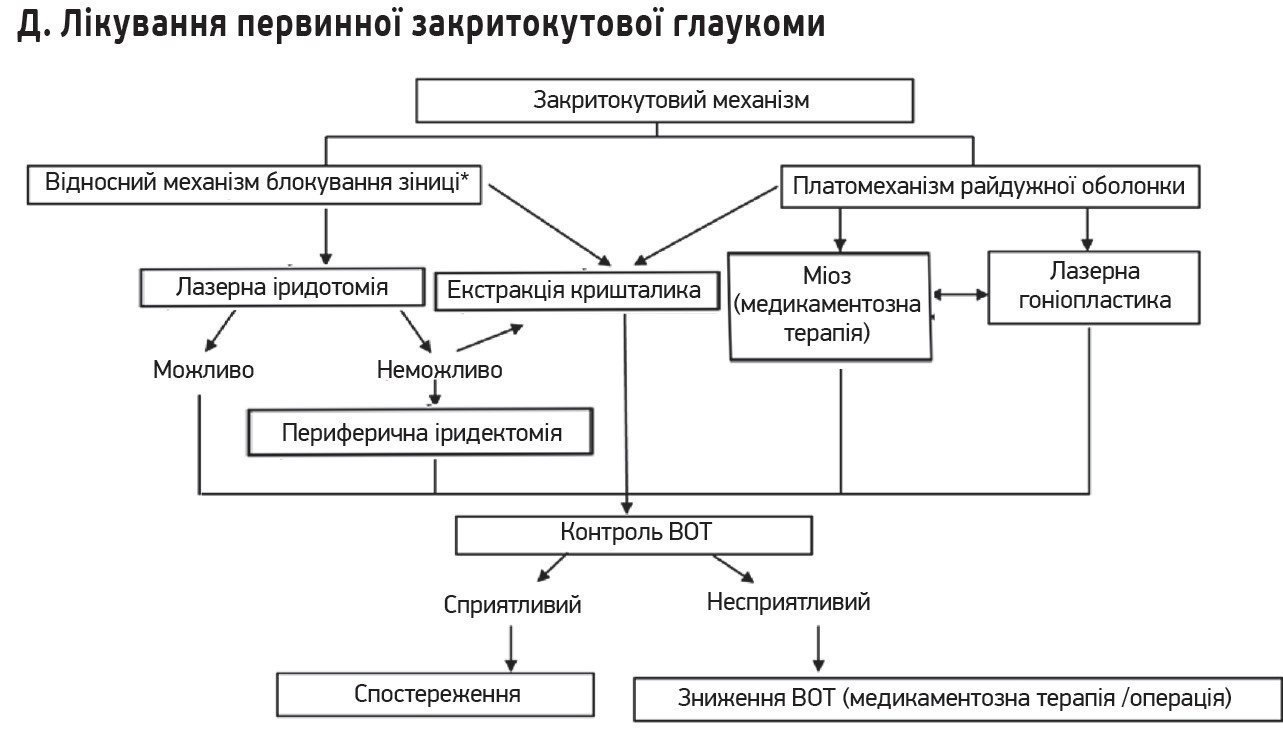
- іридотомія та екстракція кришталика при глаукомі, спричиненій блоками зіниці, наприклад, за первинної закритокутової глаукоми;
- протизапальне лікування глаукоми, пов’язаної з увеїтом;
- фотокоагуляція сітківки в разі неоваскулярної глаукоми;
- припинення введення кортикостероїдів при глаукомі, індукованій стероїдами.
4. Важливість раннього виявлення. При глаукомі втрачена зорова функція не може бути відновлена. Навіть за адекватної терапії, що знижує ВОТ, відомо про деякі випадки прогресування цього захворювання, особливо на пізніх стадіях. Саме тому раннє виявлення та раннє лікування є важливими в лікуванні глаукоми.
5. Максимальний ефект за мінімуму необхідних препаратів. Важливим є досягнення максимального ефекту при мінімальній кількості препаратів і побічних ефектів, тому необхідно розуміти механізм дії, побічні ефекти, протипоказання кожного препарату.
6. Вибір між ліками, лазером і хірургією. Лікування глаукоми передбачає медикаментозну, лазерну терапію та хірургічне втручання. Необхідно розглянути ефекти та побічні дії, переваги і недоліки кожного методу лікування; обраний метод має відповідати стадії, а також типу захворювання пацієнта. Під час обрання методу лікування рішення варто ухвалювати спільно лікарем і пацієнтом з огляду не лише на вік і тяжкість захворювання, а й на можливість продовження лікування, фінансовий стан, прихильність пацієнта до лікування (комплаєнс).
Одночасне застосування декількох препаратів здатне спричинити посилення побічних ефектів, а також зниження комплаєнсу. Використання комбінованого офтальмологічного розчину може розглядатися для покращення комплаєнсу, однак доцільно розпочинати лікування з одного препарату.
7. Підбір індивідуального лікування. Персоналізована терапія глаукоми має забезпечити лікування, що відповідає потребам окремого пацієнта. Вибір лікування базується на показнику ВОТ, ступені змін очного дна та порушеннях поля зору, ефекті лікування, якості життя хворого, очікуваній тривалості життя і наявності факторів ризику. Діагноз стадії та типу глаукоми, прогноз, план лікування і можливість довгострокового лікування також мають бути визначені для кожного пацієнта.
8. Уповільнення темпу прогресування. Лікування глаукоми спрямовано на уповільнення прогресування порушення поля зору шляхом зниження ВОТ. Оцінка швидкості прогресування порушення поля зору внаслідок глаукоми – важливий аспект для оцінки лікування пацієнтів, зокрема для визначення того, чи встановлений цільовий ВОТ відповідає установленим нормам і чи достатньо поточного лікування.
9. Оцінка факторів ризику, пов’язаних із прогресуванням глаукоми. Основні фактори ризику сліпоти – тяжкість захворювання на момент виявлення й очікувана тривалість життя. За результатами декількох досліджень продемонстровано, що найважливішим прогностичним фактором для сліпоти є серйозніше порушення поля зору на момент виявлення, тому в занедбаних випадках слід застосовувати агресивніше лікування. Пацієнти із серйозним порушенням поля зору на одному оці мають вищий ризик прогресування на іншому оці.
Фактори ризику виникнення та прогресування відкритокутової глаукоми й очної гіпертензії:
- високий рівень ВОТ: вихідний, середній під час перебігу захворювання, значні коливання ВОТ;
- вік;
- сімейний анамнез;
- велике співвідношення C/D, мала площа обода зорового нерва;
- дисковий крововилив;
- значна β-зона перипапілярної хоріоретинальної атрофії;
- стоншення рогівки;
- низький гістерезис рогівки;
- низький очний перфузійний тиск;
- низький діастолічний і систолічний артеріальний тиск;
- цукровий діабет 2 типу;
- синдром відшарування;
- низька прихильність до лікування.
Практичні рекомендації з лікування
Описане лікування охоплює первинну відкритокутову (ширококутову), первинну закритокутову глаукому після іридотомії та видалення кришталика, а також хронічну вторинну глаукому.
Лікування глаукоми спрямовано на:
1) контроль ВОТ;
2) підтримку зорового нерва та сітківки;
3) підтримку поля зору.
1. Вихідні дані – статус пацієнта до лікування. Для оцінки ефективності лікування необхідно визначити рівень ВОТ до лікування – це ВОТ, що зумовлює порушення зорового нерва, за якого очікується подальше прогресування. Крім того, важливо розуміти стан очного дна та полів зору до лікування не лише для визначення тактики терапії, а й з метою виявлення прогресування порушень на ранній стадії, а також для негайного коригування лікування. Саме тому перед початком лікування важливо отримати вихідні дані: ВОТ, кут, очне дно та поля зору.
2. Цільовий ВОТ. Метою лікування глаукоми є підтримка QoV та QoL. Оскільки нейропатія зорового нерва є незворотною та прогресує повільно, для визначення ефекту від лікування потрібен тривалий період.
Глаукому слід лікувати шляхом установлення цільового рівня ВОТ для кожного пацієнта:
1) встановлення цільового ВОТ.
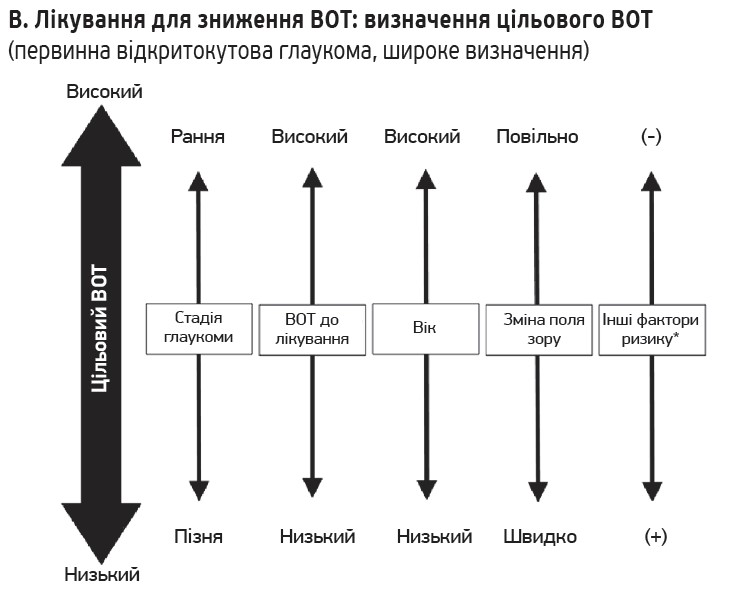
На початку лікування для кожного хворого встановлюється цільовий ВОТ з огляду на фактори ризику, як-от стадія глаукоми, ВОТ до лікування, очікувана тривалість життя та вік, прогресування ураження поля зору, сімейний анамнез і стан другого ока. Загалом цільовий ВОТ має бути нижчим у випадках глаукоми на пізній стадії через більший вплив на якість життя. При визначенні стадії та тяжкості захворювання важливо не лише оцінити функціональні зміни внаслідок порушення поля зору, а й структурні зміни, в т. ч. депресію диска зорового нерва.
Цільовий ВОТ установлюється відповідно до стадії глаукоми: ≤19 мм рт. ст., ≤16 мм рт. ст., ≤14 мм рт. ст. – для ранньої, середньої та пізньої стадій відповідно, однак без урахування початкового ВОТ. З огляду на результати різних рандомізованих контрольованих досліджень рекомендується встановити ціль у вигляді відсотка зниження ВОТ: 20% зниження від початкового ВОТ або 30% зниження від ВОТ під час лікування;
2) оцінка прогресування та модифікація цільового ВОТ.
Відповідність цільового ВОТ можна підтвердити лише тоді, коли прогресування нейропатії зорового нерва є достатньо сповільненим. Цільовий ВОТ не є абсолютним; деякі випадки прогресують швидко, навіть якщо досягнуто цільового ВОТ, тоді як інші не прогресують або прогресують повільно, навіть якщо цільового ВОТ не досягнуто. Отже, цільовий ВОТ необхідно переглянути під час подальшого спостереження. Якщо структурні чи функціональні зміни внаслідок нейропатії зорового нерва прогресують і становлять ризик погіршення QoV або QoL у довгостроковому прогнозі, цільовий ВОТ необхідно переглянути до нижчого значення. А якщо лікування має побічні ефекти чи впливає на якість життя, необхідно визначити доцільність підтримання цільового ВОТ. Якщо протягом тривалого періоду не спостерігається прогресування, слід переглянути те, чи є поточний цільовий ВОТ необхідним. Оскільки цільовий ВОТ – це засіб, а не мета лікування, його слід розглядати лише як орієнтир для лікування.
3. Спостереження за глаукомою та оцінка прогресування. Фотографії очного дна й оптичну когерентну томографію (ОКТ) можна використовувати для визначення прогресування на основі структурних змін. Фотографії очного дна необхідно робити на початковому етапі та під час подальшого спостереження – порівнюють западину, форму обідка та площу дефекту нервових волокон сітківки (retinal nerve fiber layer, RNFL). Дисковий крововилив вважається ознакою прогресування; якщо він проявляється під час спостереження, варто розглянути посилене лікування. На основі результатів вимірювання перипапілярної товщини RNFL і товщини макулярного внутрішнього шару сітківки за допомогою ОКТ можна спостерігати прогресування захворювання. Функціональні зміни оцінюють пробою поля зору. Аналіз тенденцій за допомогою статичного периметра дозволяє визначити не лише наявність або відсутність прогресування, а і його швидкість, що корисно для прогнозування зорової функції, а також оцінки ефекту лікування. Водночас важливо оцінювати локальне та загальне прогресування.
4. Глаукома та якість життя. Підтримка якості життя – одна з найважливіших цілей, пов’язаних із лікуванням глаукоми, адже внаслідок її прогресування знижується здатність керувати автомобілем, читати, розпізнавати обличчя, крім того, порушуються когнітивні функції, ризик падінь і травм зростає. Прогресування глаукоми ускладнює використання очних крапель і пероральних препаратів, що може зумовити зниження точності лікування не лише глаукоми, а й інших захворювань. Діагноз глаукоми, яка потенційно здатна спричинити сліпоту, є приводом для тривоги в пацієнтів та їхніх сімей, а також може зумовити зниження психологічної якості життя. Побічні ефекти лікування, фінансовий тягар і часові обмеження також можуть негативно вплинути на якість життя.
Щоб підтримувати якість життя хворого, необхідно враховувати не лише лікування захворювання, а й вплив діагностики і лікування на пацієнтів та їхні родини.
5. Прихильність до медикаментозної терапії глаукоми. Прихильність (комплаєнс) визначається як готовність пацієнта брати участь у процесі ухвалення рішень та впровадження лікування. Оскільки глаукома – прогресувальна хвороба, що потребує тривалого використання ліків, регулярного спостереження та часто не має суб’єктивних симптомів, комплаєнс значною мірою впливає на успіхи чи невдачі лікування.
Низький комплаєнс – один із найважливіших факторів прогресування глаукоми, тому важливо обирати препарати для лікування, які не лише ефективні, а й легкі в застосуванні. Якщо контроль ВОТ неадекватний або зорова дисфункція прогресує, варто перевірити комплаєнс.
Багато факторів сприяють поганій прихильності, тому це може спричиняти проблеми:
- в побутовому житті пацієнта;
- з лікуванням (значні витрати, побічні ефекти, складні схеми);
- з боку хворого (ускладнення інших захворювань, нерозуміння хвороби);
- з боку медичного працівника (відсутність спілкування з пацієнтом).
Для покращення та підтримки прихильності необхідна співпраця між хворим і медичними працівниками, включаючи лікарів, медсестер і сертифікованих ортоптистів.
Для покращення прихильності важливо:
1) повністю пояснити мету лікування, методи, побічні ефекти;
2) обрати метод лікування з найменшим тягарем і побічними ефектами;
3) налаштувати лікування відповідно до способу життя пацієнта;
4) надати правильні настанови щодо використання офтальмологічного розчину;
5) зібрати інформацію від хворого щодо статусу прихильності.
Ідеальним варіантом є надання письмових пояснень щодо конкретного пацієнта, щоб покращити прихильність і ведення відвідувань, а також надсилання повідомлень для сталого довгострокового лікування.
Класифікація ліків від глаукоми
Препарати місцевого застосування.
1.1. Препарати, пов’язані з простаноїдними рецепторами.
1.1.1. Агоністи простаноїдних рецепторів FP (агоністи FP).
1.1.2. Селективний агоніст простаноїдних рецепторів EP2 (агоніст EP2).
1.2. β-адреноблокатори (β-блокатори).
1.2.1. Неселективні β-блокатори.
1.2.2. Селективні β1-блокатори.
1.2.3. α1β-блокатори.
1.3. Інгібітори карбоангідрази.
1.4. α2-адренергічні агоністи (α2-агоністи).
1.5. Інгібітори Rho-кінази (інгібітор ROCK).
1.6. Парасимпатоміметичні препарати.
1.7. α1-адрегенний блокатор (α1-блокатор).
1.8. Відкривач іонних каналів.
1.9. Комбіновані офтальмологічні розчини фіксованого складу.
Системні препарати.
2.1. Інгібітор карбоангідрази (системна форма).
2.2. Гіпертонічні осмотичні препарати.
Обрання та введення препарату
Агоністи FP – найвикористовуваніші препарати 1-ї лінії при відкритокутовій глаукомі завдяки їхньому чудовому ефекту зниження ВОТ і хорошій переносимості. β-блокатори й агоністи EP2 також можуть бути препаратами 1-ї лінії з огляду на ефективність та переносимість, однак слід ураховувати протипоказання і побічні ефекти. Агоністи EP2, які мають механізм дії, відмінний від агоністів FP, були схвалені у вересні 2018 року та вважаються не гіршими за латанопрост щодо зниження ВОТ. Вони протипоказані при інтраокулярних лінзах і не рекомендовані для використання в комбінації з агоністами FP.
Препарати 2-ї лінії включають офтальмологічний розчин інгібітора карбоангідрази, α2-агоністи, інгібітори ROCK, α1-блокатори, засіб-відкривач іонних каналів і парасимпатоміметики. Комбіновані офтальмологічні розчини корисні для покращення комплаєнсу в пацієнтів, які приймають декілька препаратів.
Важливо навчити хворого правильному методу введення офтальмологічного препарату з метою збільшення внутрішньоочного переміщення розчину, підвищуючи в такий спосіб ефективність та зменшуючи місцеві побічні ефекти (для досягнення зниження ВОТ):
- перед введенням офтальмологічного розчину необхідно вимити руки;
- кінчик флакона не має торкатися вій;
- на один офтальмологічний розчин слід використовувати одну краплю;
- слід обережно закрити повіки та натиснути на слізний мішок після введення;
- рідину навколо очей варто витерти, а рідину, що потрапила на руки, потрібно змити;
- за комбінованого застосування декількох офтальмологічних розчинів інтервал між кожним введенням – не менше 5 хв.
З повним текстом 5-го видання Glaucoma Clinical Practice Guidelines від Japan Glaucoma Society можна ознайомитися за посиланням: https://link.springer.com/article/10.1007/s10384-022-00970-9#Sec41.
Довідка «ЗУ»
В Україні аналог простагландину F2a травопрост, що є його повним селективним агоністом із високим ступенем спорідненості з FP-рецепторами простагландину і знижує ВОТ, представлений під назвою Травінор (АТ «Київський вітамінний завод»). Цей препарат доступний у формі очних крапель (розчин 0,04 мг/мл) у флаконах по 2,5 мл із крапельницею та контролем першого розкриття.
Травінор рекомендовано застосовувати дорослим по 1 краплі в кон’юнктивальний мішок (мішки) ураженого ока (очей) 1 р/добу. Оптимальний ефект досягається за введення дози ввечері.
Лікарський засіб застосовується протягом тривалого періоду. Тривалість застосування залежить від показань та ефективності лікування.
Комбінований офтальмологічний розчин (1 мл розчину містить 20 мг дорзоламіду і 5 мг тимололу) представлений в Україні препаратом Дорзітім (АТ «Київський вітамінний завод»). Дорзоламіду гідрохлорид є потужним інгібітором карбоангідрази ІІ типу, тимололу малеат – неселективний блокатор β-адренергічних рецепторів. Поєднана дія двох компонентів спричиняє вираженіше зниження ВОТ порівняно з монотерапією цими препаратами. Показаний пацієнтам із відкритокутовою або псевдоексфоліативною глаукомою, коли місцеве застосування одних лише β-блокаторів є недостатнім.
Дорзітім призначають по 1 краплі в кон’юнктивальний мішок 2 р/добу. Лікарський засіб можна застосовувати протягом тривалого часу.
Підготувала Олена Костюк