13 березня, 2024
Можливості лікування розладів уваги у пацієнтів після інсульту
За матеріалами Міжнародної неврологічної конференції «XV Нейросимпозіум» (12‑15 вересня 2023 р., Львів, Україна)
 Міжнародна неврологічна конференція «XV Нейросимпозіум», яка проходила в онлайн форматі, була присвячена обговоренню таких актуальних напрямів, як сучасні питання лікування пацієнтів із судинною патологією; психосоматичні розлади; сучасні підходи до лікування болю; діагностування та лікування розсіяного склерозу тощо. Пропонуємо до вашої уваги огляд доповіді в.о. завідувача кафедри неврології Національного університету охорони здоров’я України імені П.Л. Шупика (Київ) Марини Анатоліївни Тріщинської, яка була присвячена проблемі порушень когнітивної функції у пацієнтів після інсульту.
Міжнародна неврологічна конференція «XV Нейросимпозіум», яка проходила в онлайн форматі, була присвячена обговоренню таких актуальних напрямів, як сучасні питання лікування пацієнтів із судинною патологією; психосоматичні розлади; сучасні підходи до лікування болю; діагностування та лікування розсіяного склерозу тощо. Пропонуємо до вашої уваги огляд доповіді в.о. завідувача кафедри неврології Національного університету охорони здоров’я України імені П.Л. Шупика (Київ) Марини Анатоліївни Тріщинської, яка була присвячена проблемі порушень когнітивної функції у пацієнтів після інсульту.
Розпочинаючи свою доповідь, пані Тріщинська зазначила, що когнітивний дефіцит, як відомо, розвивається у понад половини пацієнтів, які перенесли інсульт (Hochstenbach et al., 1998). За даними різних авторів, ця частка пацієнтів може становити від 46 до 92% (Nys, 2005; Hyndman, 2009). Порушення когнітивних функцій, імовірно, є більш важливим чинником загального прогнозу, ніж фізична інвалідність.
Що таке увага?
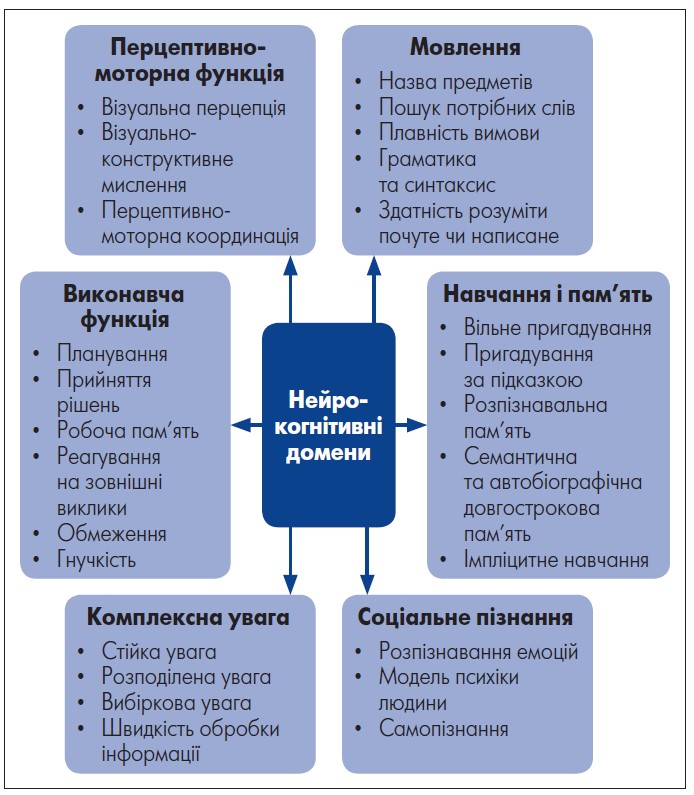
Діагностичний і статистичний посібник із психічних розладів п’ятого видання (DSM‑5) визначає шість ключових доменів когнітивної функції: 1) комплексна увага; 2) виконавча функція; 3) навчання та пам’ять; 4) мовлення; 5) перцептивно-моторний контроль; 6) соціальне пізнання (рисунок).
Рис. Домени когнітивної функції згідно з DSM‑5
Адаптовано за Diagnostic and Statistical Manual of Mental Disorders 5th edition.
URL: https://www.researchgate.net/figure/Neurocognitive-domains-The-DSM‑5- defines-six-key-domains-of-cognitive-function-and-each_fig1_266325299.
Увага – це здатність психічної діяльності людини зосереджуватися на кількох об’єктах чи явищах одночасно або вибирати, на чому зосередитися, а що проігнорувати. Цей процес передбачає інтенсивні процеси, як-от настороженість (alertness) і пильність (vigilance), а також вибірковість уваги. Порушення уваги після інсульту може суттєво знизити когнітивну продуктивність, навіть якщо інші когнітивні функції не порушено (Lezak, 1995). За висновками I. H. Robertson et al. (1997), збереження стійкої уваги через два місяці після інсульту сприяє функціональному відновленню за два роки. Наявні когнітивні порушення через тиждень після інсульту дають змогу спрогнозувати якість життя через шість місяців та скласти план фізичної реабілітації пацієнта після інсульту (Nys, 2005).
Основою будь-якого виду уваги є настороженість. Вона являє собою стан загального неспання, який зумовлює швидку й адекватну реакцію людини на будь-який раптовий запит на дію. Настороженість може підвищувати ефективність уваги на короткий період завдяки висхідним (тобто зовнішнім стимулам) або низхідним процесам (внутрішнім чинникам). Стійка увага або пильність (вігільність) – це психологічна здатність людини зосередити увагу на нових враженнях, тобто «зберігати зосереджену увагу на подразниках упродовж тривалих періодів часу» (Warm et al., 2008).
Під порушенням вігільності розуміють такі процеси:
- Інертність (малу рухливість).
- Погіршення сприйняття та довільної уваги (проблеми із зосередженням та вибірковістю уваги).
- Зниження ініціативності (низька активність людини на тлі нижчого рівня цікавості до навколишнього світу).
Доповідачка зауважила, що серед аспектів вибірковості процесів уваги за моделлю ван Зомерена розрізняють фокусовану або вибіркову увагу (тобто здатність людини зосереджуватися на окремих особливостях одного завдання і витісняти реакцію на несуттєві об’єкти) і розподілену увагу (здатність виконувати два завдання одночасно) (van Zomeren, 1994). Є докази того, що дефіцит уваги пов’язаний з іншими нейропсихологічними дефіцитами, зокрема афазією та забудькуватістю (neglect) (Varkanitsa et al., 2023; Takamura et al., 2021).
L. L. Murray (2002, 2012) встановив, що пацієнти з афазією мали значуще порушення функцій уваги з варіабельністю за типом і тяжкістю її дефіциту. Ще в одному дослідженні встановлено, що пацієнти з афазією, порівняно зі здоровими особами такого самого віку, часто не мали проблем із пильністю, однак мали порушення розподіленої уваги (Zimmermann et al., 2002). За даними низки досліджень, пацієнти із забудькуватістю зазвичай демонструють низьку загальну активність із дефіцитом зосередженості та постійної уваги, а також значне зниження пильності з часом (Spaccavento et al., 2019).
Що відбувається у головному мозку?
Результати численних досліджень засвідчили, що функції уваги можуть бути вибірково порушені залежно від ділянки ураження тканин головного мозку (Spaccavento et al., 2019). За допомогою методу нейровізуалізації було встановлено, що до процесів стійкої уваги залучені мережі нейронів ділянок кори та підкірки в межах правої півкулі мозку (Sturm, 2001). Механізми лівої півкулі задіяні до складніших функцій уваги, як-от вибіркова, виконавча та часова зосередженість (Spaccavento et al., 2019).
Однак у деяких дослідженнях, у межах яких порівнювали пацієнтів з ураженням правої або лівої півкулі, не вдалося виявити суттєвих відмінностей (Audet, 2000; Bub, 1990).
Марина Анатоліївна зауважила, що натепер недостатньо клінічних досліджень, які були присвячені вивченню кореляції внутрішньомозкової локалізації вогнища та ступеня дефіциту уваги. Втім, в одному з таких досліджень P.R.A. Malik et al. (2018) вивчали зв’язок між локалізацією вогнища інсульту та пильністю. За отриманими даними, локалізація підкіркового інсульту була предиктором ефективності виконання психомоторного тесту на вігільність у цій когорті пацієнтів. Учасники з найнижчими результатами тестування мали ураження променевого вінця, внутрішньої капсули, блідої кулі та таламуса. Автори дослідження дійшли висновку, що пильність залежить від цілісності підкіркових структур та їхніх зв’язків із кірковими ділянками мозку.
За результатами іншого дослідження, локалізація ураження в зоні від таламуса до базальних гангліїв на домінантному боці була пов’язана з продуктивністю виконання тесту на увагу (Murakamiet et al., 2014). Ці дані свідчать про масштабну мультимодальну нейронну мережу, яка відповідає за увагу, із залученням таламуса і базальних гангліїв.
Так, за даними досліджень, задня поясна ділянка кори відіграє важливу роль у когнітивних процесах. За однією з гіпотез, ця зона головного мозку відіграє центральну роль у підтримці внутрішнього пізнання: під час відновлення автобіографічних спогадів або планування майбутнього, а також відпочинку, коли діяльність мозку є «вільною». Крім того, активність цієї ділянки змінюється залежно від стану збудження, отже, взаємодія задньої поясної частини кори з іншими зонами мозку може бути важливою для формування свідомості. До того ж задня поясна ділянка кори може відігравати безпосередню роль у регулюванні фокусу уваги.
Як зазначають G. Leech і D. J. Sharp (2014), ця зона добре захищена від ішемічного інсульту, тож даних про наслідки вогнищевих уражень натепер відносно мало. Однак за інших патофізіологічних умов (як-от хвороби Альцгеймера, черепно-мозковій травмі тощо) ураження задньої поясної ділянка кори асоціюється з порушенням уваги.
Постінсультна втома
Нині постінсультну втому визначають як суб’єктивне «нездоланне відчуття виснаження, зниження рівня енергійності або важкість підтримувати звичайну щоденну активність», яке не пов’язане з фізичним навантаженням і зазвичай не зникає після відпочинку (De Groot et al., 2003).
Це один із найпоширеніших наслідків інсульту, що вражає кожного другого пацієнта (Cumming et al., 2016). Зазвичай стан постінсультної патологічної втоми відрізняють від постінсультної депресії, хоча вони можуть співіснувати. Патофізіологію постінсультної втоми не встановлено. Нейроанатомічні аномалії (як-от ураження білої речовини, атрофія мозку), нейроендокринні дисрегуляції, зміни нейромедіаторів і процес запалення пов’язані із втомою за інших станів, відмінних від інсульту (Kutlubaev et al., 2012). Стан постінсультної втоми визначають як непропорційне психічне або фізичне зниження працездатності та брак енергії порівняно з доінсультним періодом, що має хронічний характер, спричинений простими видами діяльності. За результатами досліджень, постінсультна втома належить до найскладніших порушень після інсульту і є комплексним, мультифакторним патологічним станом, що має певні чинники ризику, механізми розвитку, клінічні особливості та потребує специфічних підходів у діагностуванні й лікуванні (Acciarresi, 2014; Alenljung, 2019; Liljehult, 2022).
Люди працездатного віку зазвичай займаються складною діяльністю у повсякденному житті, як-от побутові обов’язки, роботу, сімейне життя, догляд дітей тощо. Такі функції потребують планування, багатозадачності (здатність виконувати кілька завдань одночасно чи паралельно) та навичок із розв’язання проблем. Внаслідок інсульту може виникати дефіцит уваги, що посилюється через патологічно підвищену втому. Це може погіршувати прогноз щодо довгострокового функціонального відновлення та поліпшення якості життя пацієнта.
Порушення свідомості
Розлади свідомості – це клінічні стани, за яких у пацієнтів порушується реакція на зовнішню стимуляцію, їх важко розбудити або ж вони не реагують на подразники пробудження взагалі. Одним із порушень свідомості є кома, що визначається як патологічний стан «незбудливої відсутності реакції», для якої характерна повна втрата здатності пізнавати довкілля і себе за допомогою усвідомленості. Терміни «оглушення» та «сопор» стосуються станів між пильністю (збудливістю, що відповідає нормі) та комою.
Висхідна ретикулярна активувальна система (ВРАС) – це мережа нейронів, що беруть початок із верхнього моста та середнього мозку людини. Її вважають невід’ємною частиною індукції та підтримки уваги. Ці нейронні шляхи формуються до структур у проміжному мозку, зокрема таламуса і гіпоталамуса, а звідти – до кори головного мозку. Зміни пильності (ступеня свідомості) можуть бути спричинені вогнищевими ураженнями у верхній частині стовбура мозку внаслідок безпосереднього ураження ВРАС. Ушкодження півкуль головного мозку також може призвести до коми, але в цьому разі таке ураження обов’язково має двобічний і дифузний характер або, якщо воно однобічне, то є достатньо великим, щоб чинити віддалений вплив на контрлатеральну півкулю або стовбур мозку. Механізм розвитку коми полягає в тому, що внаслідок токсичних, метаболічних, інфекційних і фізичних причин погіршується постачання кисню, що, своєю чергою, змінює церебральний метаболізм і перешкоджає збудливості нейронів та/або синаптичній функції.
Деякі пацієнти, перебуваючи в комі, можуть прокидатися (розплющувати очі), але не реагувати при цьому на подразники. Такий клінічний стан раніше називали апалічним синдромом, або стійким вегетативним станом (vegetative state, VS). Нині медична спільнота послуговується терміном «синдром неспання без реакції» (unresponsive wakefulness syndrome, UWS). Цей нейтральний термін використовують щодо пацієнтів, які мають низку клінічних ознак, характерних для розладу життєво важливих функцій (тобто не демонструють нерефлекторної поведінки або виконання команд) у стані неспання (із розплющуванням очей спонтанно або за певної стимуляції) (Laureys et al., 2010).
Як зазначила пані професорка, результати все більшої кількості досліджень із застосуванням функціональної нейровізуалізації та зумовленого когнітивного потенціалу свідчать, що лікарям слід з обережністю робити заяви про усвідомлення у деяких пацієнтів безповедінкових реакцій. Оскільки такі діагностичні помилки прямо корелюють із тактикою лікування, доглядом пацієнта і потенційним прогнозом. У певної частки таких осіб ніколи не відновляться поведінкові ознаки свідомості; деякі матимуть неврологічні порушення, які не відповідатимуть критеріям UWS, хоча демонструватимуть поведінкові ознаки свідомості. На відміну від тих, хто перебуває у вегетативному стані, такі пацієнти можуть періодично виявляти обмежену взаємодію з навколишнім середовищем через візуальне відстеження, виконання простих команд, подання сигналів «так» чи «ні» (не обов’язково адекватно) або зрозумілої вербалізації чи обмеженої цілеспрямованої поведінки. Цей патологічний стан називається станом мінімальної свідомості (minimally conscious state, MCS) (Giacino et al., 1997).
Ефективність амантадину в лікуванні когнітивних порушень
Рання діагностика розладу дефіциту уваги в пацієнтів після інсульту та їхня реабілітація схвалені Американською кардіологічною асоціацією (AHA) (Duncan, 2005). Лікування когнітивних порушень має бути спрямованим на усунення причин основного захворювання та порушень вігільності, оскільки останні знижують здатність пацієнта до взаємодії з оточенням і збільшують його потребу в догляді, зменшуючи, своєю чергою, ефективність терапевтичних і реабілітаційних заходів.
Згідно з настановами Французького товариства фізичної та реабілітаційної медицини (SOFMER, 2016) рекомендовано застосовувати в комплексному лікуванні пацієнтів із травматичним ураженням головного мозку амантадин для зменшення ознак апатії та мотиваційних розладів, поліпшення процесу прийняття рішень.
Амантадину сульфат упродовж багатьох років успішно використовують для лікування паркінсонізму. Механізм препарату зумовлює зростання позаклітинної концентрації дофаміну завдяки підвищенню його рівня, доступного для синаптичного вивільнення; блокування пресинаптичного повторного захоплення дофаміну та збільшення його синтезу за допомогою стимуляції дофа-декарбоксилази. Нейропротективні можливості амантадину пов’язують із його антагонізмом до N-метил-D-аспартатних рецепторів, що спричиняє пригнічення глутаматної ексайтотоксичності.
Доведено, що застосування амантадину сприяє підтриманню рівноваги між процесами гальмування та збудження в ЦНС, запобігає ушкодженню нейронів і в такий спосіб допомагає відновленню психічної й нейрофізіологічної реакції на навколишнє середовище, зокрема й здатності до концентрації уваги, ініціативності та мотивації.
У практичній настанові щодо розладів свідомості Американської академії неврології (AAN, 2018) рекомендовано призначати амантадин (100‑200 мг двічі на добу) дорослим пацієнтам із травматичним VS/UWS або MCS (4‑16 тижнів після травми), щоб прискорити функціональне відновлення та зменшити ступінь інвалідизації на ранніх стадіях відновлення (рівень доказовості В).
Лікування амантадином сприяє пробудженню та активізації участі пацієнтів у ранній реабілітації. За даними дослідження, яке тривало протягом 3,7 року, застосування амантадину в середньому через 7 днів після інсульту (діапазон 1‑27 днів) для лікування сонливості (77%осіб), невиконання команд (32%), без розплющування очей (28%) або за низької оцінки за шкалою ком Глазго (17%) сприяло ефективності у 55% пацієнтів, які отримували монотерапію препаратом. Найпоширенішою початковою дозою амантадину є 200 мг (по 100 мг двічі на добу). Середній час від початку терапії до клінічної відповіді становив три доби. Пацієнтів, які відповіли на терапію частіше виписували додому або скеровували для проходження курсу реабілітації (Leclerc et al., 2021).
Дослідники вивчали вплив терапії амантадином (200 мг внутрішньовенно протягом 10 днів) у поєднанні зі стандартним лікуванням порівняно з лише стандартною терапією в осіб із ішемічним інсультом (Barrett et al., 2007). Більшість пацієнтів розпочала терапію впродовж 24‑48 год після інсульту. Ефективність інтервенцій визначали за допомогою шкали оцінювання інсульту Національного інституту охорони здоров’я США (NIHSS) на 10-й день перебування в стаціонарі та через три місяці після інсульту. Автори повідомили про значуще зниження неврологічного дефіциту за показником NIHSS на 10-й день в учасників групи терапії амантадином, незалежно від віку чи підтипу інсульту, а також зменшення в них неврологічного дефіциту на 58,7% через три місяці, тоді як у контрольній групі неврологічний дефіцит знизився на 41,8%. Терапія амантадином (200 мг/добу) у дослідженні O. V. Krivonos et al. (2010) сприяла виразнішому регресу неврологічного дефіциту в пацієнтів з ішемічним інсультом протягом 90 днів, ніж на тлі стандартної терапії. У дослідженні E.F. Akcil et al. (2018) пацієнтів після субарахноїдального крововиливу рандомізували на дві групи. Учасники однієї групи отримували тільки стандартне лікування (хірургічні втручання та терапію антиконвульсантами), другої групи – на додаток до стандартного лікування приймали амантадин (по 200 мг на добу впродовж 30 днів). За даними спостереження протягом шести місяців, додавання амантадину до схеми стандартного лікування сприяло ефективнішому відновленню нейрокогнітивних функцій. Амантадину сульфат також був корисним для лікування наслідків цереброваскулярних подій у дослідженні Y. Gao et al. (2020). Результати ретроспективного когортного дослідження засвідчили, що терапія амантадином (100‑200 мг/добу перорально) прискорювала одужання пацієнтів із персистентним вегетативним станом після тяжкого крововиливу в мозок.
Підсумовуючи, пані Тріщинська зазначила, що амантадин рекомендовано пацієнтам за порушення свідомості різної етіології для підвищення вігільності. Лікування амантадином сульфату забезпечує стабільну концентрацію препарату в плазмі та тканинах головного мозку за хорошої переносимості та мінімальної кількості побічних ефектів. Виробництво амантадину сульфату (ПК-Мерц®) у формі інфузійного розчину робить можливим приймати препарат пацієнтами в постінсультному періоді, зокрема в разі порушення свідомості.
Підготувала Ольга Загора
UA-PKMZ-PUB-022024-027
Тематичний номер «Інсульт» №1 2024 р.