10 січня, 2023
Аналіз ефективності цефдиніру в лікуванні гострого гнійного остеомієліту в дітей
 Антибіотики широкого спектра дії, націлені на значний різновид збудників, є важливим інструментом у боротьбі із серйозними інфекціями. Їх нераціональний вибір при гнійних інфекціях призводить до збільшення терміну лікування, підвищеного ризику розвитку побічних реакцій, а також до надмірних витрат на медичне обслуговування.
Антибіотики широкого спектра дії, націлені на значний різновид збудників, є важливим інструментом у боротьбі із серйозними інфекціями. Їх нераціональний вибір при гнійних інфекціях призводить до збільшення терміну лікування, підвищеного ризику розвитку побічних реакцій, а також до надмірних витрат на медичне обслуговування.
З метою досягнення швидшого результату клініцисти часто застосовують парентеральне введення антибіотиків. Однак внутрішньовенна антибактеріальна терапія має додаткові вагомі ризики на тлі тяжких бактеріальних інфекцій (катетер-асоційовані інфекції, тромбоз, несприятливі ефекти на печінку та нирки). Тому, не дивлячись на досягнення певних результатів під час лікування серйозних бактеріальних інфекцій, лишаються контраверсійними питання щодо шляхів введення та тривалості антибактеріальної терапії у педіатричних пацієнтів.
Удосконалення схеми призначення антибіотиків дітям із бактеріальними інфекціями має вирішальне значення для оптимізації лікування, мінімізації загрози резистентності та покращення догляду за пацієнтами.
Гострий гематогенний остеомієліт (ГГО) є захворюванням мікробної етіології, збудник якого потрапляє до кісткової тканини гематогенним шляхом [16]. Захворюваність у дитячому віці становить 2-20 дітей на 100 000 дитячого населення в розвинених країнах [10].
За даними літератури, основний збудник гематогенного остеомієліту в новонароджених та дітей раннього віку – Staphylococcus aureus, зокрема метицилінрезистентний [3, 17]. Однак у дітей більш старшого віку остеомієліт можуть викликати стрептококи груп A і B, особливо β-гемолітичний стрептокок групи A (Streptococcus pyogenes). Streptococcus pneumoniae (пневмокок) може спричиняти остеомієліт у дітей, які мають підвищений ризик інвазивного пневмококового захворювання, включаючи дітей віком <2 роки, що не повністю імунізовані проти пневмокока [16]. За певну частку випадків ГГО відповідають Escherichia coli та інші коліформи, які викликають захворювання в новонароджених та немовлят [6, 12].
У дітей кістки та хребетні диски кровопостачаються через метафізарні й періостальні судини внутрішньохребцевих дисків. Факторами ризику розвитку остеомієліту в дітей є ранній вік, шкідливі чинники довкілля, недотримання санітарних норм у сім’ї, часті захворювання, штучне вигодовування. З огляду на те що ГГО в дітей переважно має гематогенне походження, антибіотики, які мають вплив на етіологічну похідну захворювання, можуть легко проникнути до осередку інфекції [6, 15]. Але посів крові, проведений перед призначенням антимікробної терапії у дитини з підозрою на ГГО, наразі визначає мікробну етіологію ГГО приблизно усього в третині випадків і зазвичай протягом 12-24 год [7]. Часто клініцистам доводиться лікувати ГГО без наявності позитивних культур [5]. Початкову емпіричну терапію використовують у 35-47% випадках на основі місцевої епідеміології та характеру резистентності збудників [9]. Сприятлива клінічна та лабораторна відповідь на емпіричну терапію свідчить про те, що антимікробні препарати, які використовуються, є ефективними в процесі розгортання інфекційного запалення [13, 14].
Діагноз ГГО встановлюється відповідно до діагностичних критеріїв, розроблених Товариством дитячих інфекційних хвороб і Товариством інфекціоністів Америки, – рекомендації щодо діагностики та лікування ГГО в педіатрії (2021) [4]. Для оптимізації лікування та покращення прогнозу експертами було запропоновано в більш короткий і ранній періоди переводити лікування антибіотиками з парентеральної форми введення до перорального призначення антибактеріальних препаратів. Рішення про перехід на пероральні антибіотики залежить від зникнення симптомів лихоманки, інтоксикації, покращання фізичного стану і зниження рівня С-реактивного білка (СРБ) та швидкості осідання еритроцитів (ШОЕ).
Оптимальний пероральний препарат повинен мати спектр дії, зіставний з парентеральним, завдяки якому дитина продемонструвала клінічне та лабораторне покращення [4, 8, 11].
Нещодавно розроблені рекомендації щодо безпеки застосування раннього ступеневого лікування антибіотиками (перехід від парентерального до перорального) вплинули на клінічну практику лікування інфекцій кісток у нашій лікарні.
Матеріали та методи
Діагностичними критеріями для встановлення діагнозу ГГО були клінічні ознаки, які вказували на інфекцію кісток (локальний біль у кістках, набряки, локальна гіпертермія та/або почервоніння), в поєднанні з рентгенологічним візуалізаційним дослідженням, характерним для остеомієліту (ознаки запалення кісткового мозку, скупчення рідини поруч із кісткою), підвищені значення ШОЕ, СРБ, виявлення збудника з вогнища гнійного процесу, хронічних вогнищ інфекції із вмістом мікробного спектра з локусу запалення кістки. Якщо патоген не був виявлений, діагноз ГГО та ефективність емпіричної терапії оцінювали за позитивною динамікою даних клініко-лабораторних та інструментальних обстежень. Для оцінки тяжкості захворювання використовували комбінацію 7 клінічних ознак і лабораторних результатів протягом перших 4 днів госпіталізації, щоб передбачити загальну тривалість перебування в лікарні як прояв тяжкого захворювання в дітей з ГГО.
Після отримання інформаційної згоди до дослідження було залучено 34 дитини з підтвердженим діагнозом ГГО, які отримували лікування в хірургічному відділенні КНП КМКДЛ № 1 з вересня 2021 по жовтень 2022 року.
Пацієнтів залучали, якщо остаточний клінічний діагноз ГГO підтверджувався мікробіологічними, гістопатологічними та/або рентгенографічними доказами інфекції, не було попереднього травматичного ураження або супутнього поширення інфекції з екстраскелетних ділянок. Окрім того, тривалість симптомів з явищами інтоксикації та лихоманки під час надходження до стаціонару становила ≤4 днів.
Діти, яким було проведено лікування ГГО шляхом внутрішньовенного введення цефалоспорину ІІІ покоління (цефтріаксону) з переведенням у разі позитивної клінічної динаміки на пероральний цефалоспорин ІІІ покоління цефдинір, склали 1 групу (14 дітей віком 9-12 років, з них 9 хлопчиків і 5 дівчаток). Діти з ГГО, імовірно спричиненим гематогенним поширенням бактерій, які в процесі лікування отримували парентерально цефалоспорин ІІІ покоління (цефтріаксон), увійшли до 2-ї групи (20 дітей віком 9-12 років, з них 13 хлопчиків і 7 дівчаток).
Хворим 1-ї групи (14 дітей) цефтріаксон парентерально був призначений стартово курсом 5-7 діб, потім пацієнтів перевели на пероральний препарат Родинір (цефдинір, цефалоспорин ІІІ покоління) у дозі 7 мг/кг маси тіла 1 р/12 год. Для лікування дітей з масою тіла до 43 кг Родинір випускається у формі порошку для приготування суспензії 100 мл, завдяки чому флакона було достатньо для проведення 10-денного курсу лікування. В дітей з масою тіла від 43 кг ми використовували капсули Родиніру по 300 мг, які пацієнти приймали 2 р/добу.
Під час вибору антибактеріального препарату для продовження ступеневої терапії ми користувалися такими міркуваннями: цефдинір є напівсинтетичним цефалоспориновим пероральним антибіотиком широкого спектра дії III покоління. Як і інші антибіотики групи цефалоспоринів, цефдинір чинить бактерицидну дію щодо чутливих мікроорганізмів завдяки пригніченню синтезу клітинної стінки. Діюча основа є стійкою до дії багатьох β-лактамаз. Цефдинір має широкий спектр дії проти багатьох грамнегативних та грампозитивних аеробних організмів, зокрема частих збудників ГГО – Streptococcus pneumoniae, Staphylococcus aureus, Streptococcus pyogenes, Escherichia coli. Цефдинір швидко всмоктується зі шлунково-кишкового тракту (середній час до досягнення пікової концентрації у плазмі крові – 3 год) і майже повністю виводиться через нирки в незмінному вигляді. Кінцевий період напіввиведення цефдиніру становить 1,5 год. Слід зазначити, що у вітчизняній літературі дослідженню клінічної ефективності цефдиніру присвячені поодинокі дослідження, адже, за нашою інформацією, до 2020 року препарати цефдиніру не були доступними для клінічної практики [1].
Діти 2-ї групи (20 дітей) у зв’язку з ГГО отримували антибактеріальний препарат цефтріаксон парентерально протягом 12-20 днів, на тлі чого спостерігалася позитивна динаміка основних симптомів.
Окрім оцінювання клініко-лабораторних та інструментальних показників, серед дітей з ГГО проводилося анкетування сприйняття лікувальних заходів пацієнтами. Відповіді на запитання анкети отримали в 1-й день призначення антибактеріальних препаратів та на 10-й день лікування. Відповіді просили оцінювати за 10-бальною шкалою для характеристики почуттів: «так» або «ні» на конкретні запитання.
Статистична обробка отриманих даних проведена методами медичної статистики. Безперервні змінні з нормальним розподіленням вказувалися як середнє значення зі стандартним відхиленням. Для зіставлення показників клінічних груп використовували t-test. Також для зіставлення категоріальних змінних використовували тест χ-квадрат. Кореляцію Пірсона виконано для встановлення зв’язків між видом проведеного лікування та наслідками. Достовірність відмінностей було встановлено p<0,05 при значенні χ-квадрату Пірсона 3,93 із 1 ступенем свободи, що вважали наявним зв’язком між обраними показниками.
Результати
Середній вік пацієнтів клінічних груп становив 10,3 року, а співвідношення хлопчиків та дівчаток складало 1,8:1. Пацієнти з 1-ї та 2-ї групи мали подібні демографічні характеристики (р>0,05). Усі діти на момент надходження до стаціонару мали попередню або поточну лихоманку, нездужання, слабкість та біль у кістках. Показник ШОЕ при госпіталізації здавався дещо вищим у дітей 1-ї групи порівняно з таким у хворих 2-ї групи (48 проти 43 мм/год відповідно; р=0,06), але різниця не була достовірною. Значення кількості лейкоцитів і рівня СРБ під час госпіталізації були схожими.
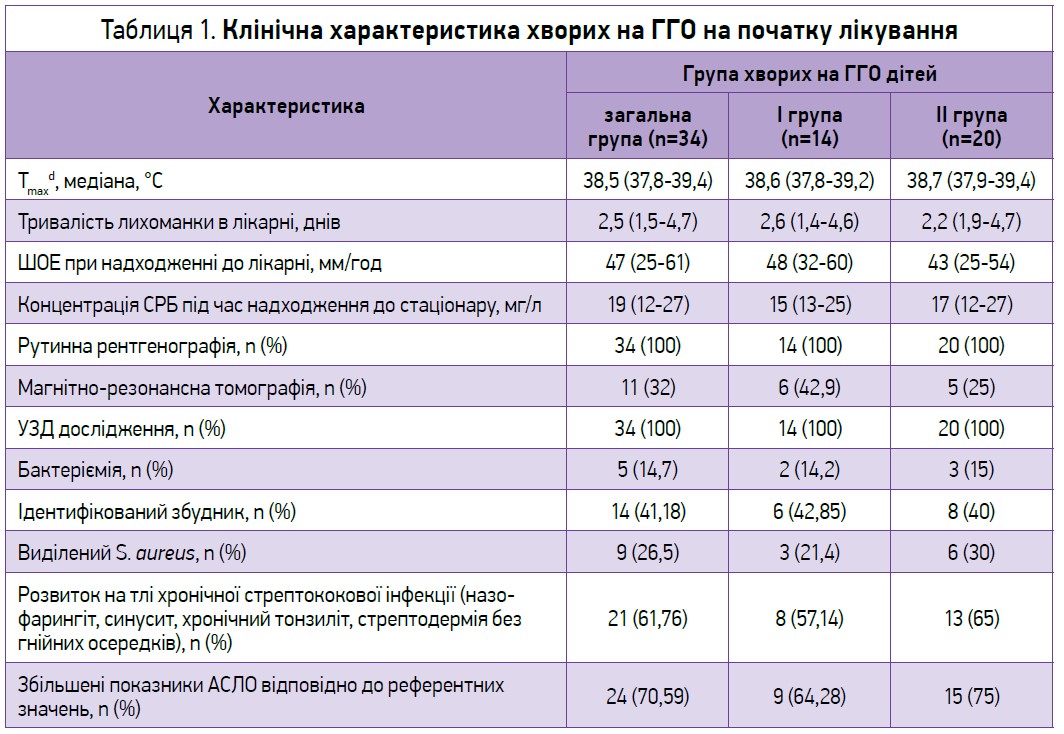
Клінічна характеристика пацієнтів, залучених до дослідження, представлена в таблиці 1. Відповідно до наведених даних клінічні групи за складом, клінічними проявами, методами обстеження були повністю репрезентативними. Ми ретельно збалансували групи пацієнтів із застосуванням цефдиніру або без нього, використовуючи зіставлення балів схильності, щоб забезпечити подібні базові клінічні характеристики та маркери тяжкості захворювання.
Змінні, відібрані для відповідності показників схильності: вік, стать, бактеріємія, обробка кісток, концентрація СРБ, отримана через 2-4 дні після початку прийому антибіотиків, температура тіла >48 год після початку прийому антибіотиків.
У всіх дітей клінічних груп діагноз ГГО був підтверджений результатами рутинної простої рентгенографії. Додатково магнітно-резонансну томографію (МРТ) виконано 32% пацієнтів.
На початку захворювання 79,4% пацієнтів установлено діагнози синуситу, тонзиліту, фарингіту, артриту, лихоманки неясного генезу, у зв’язку із чим було розпочато прийом антибактеріального препарату в амбулаторних умовах. Як антибактеріальний препарат напівсинтетичний пеніцилін призначено 64,7% хворих, макролід – 18,5%. Інші діти антибактеріальні препарати не приймали, їм установили діагноз ГРВІ та призначили симптоматичні препарати (антипіретики).
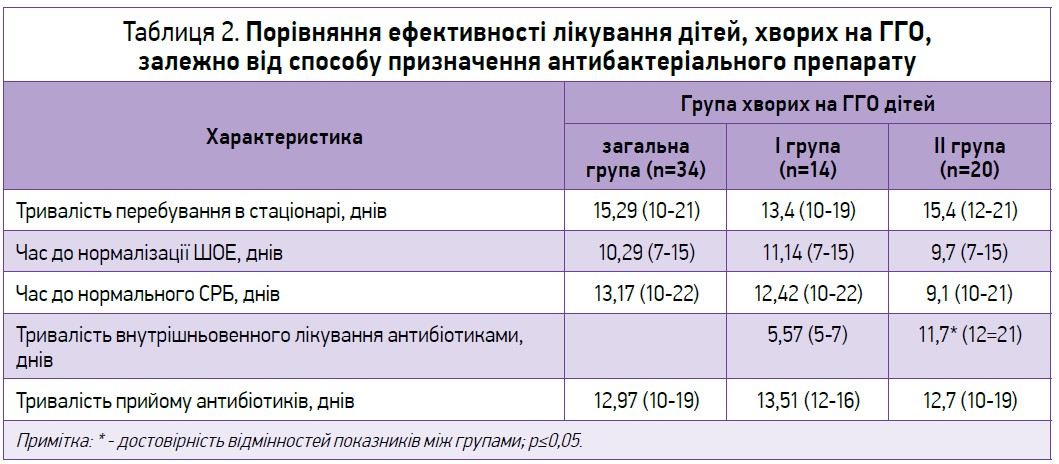
Результати порівняння ефективності парентерального та комбінованого (ступеневого) прийому антибактеріального препарату наведено в таблиці 2.
З огляду на зазначені дані діти, які отримували ступеневу терапію, перебували в стаціонарі в середньому на 2 дні менше, ніж хворі, котрі отримували антибактеріальний препарат парентерально. А ось час нормалізації ШОЕ та СРБ був відносно швидшим у групі дітей з парентеральним методом призначення антибактеріального препарату, хоча достовірної різниці між показниками виявлено не було. Не спостерігалося і різниці в загальній тривалості прийому антибактеріального препарату.
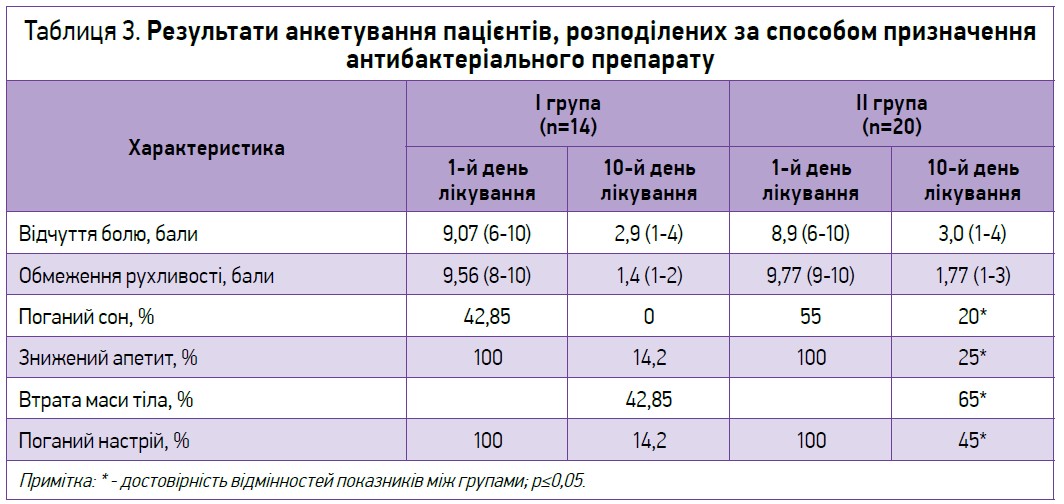
Результати аналізу анкет представлені в таблиці 3. На початку лікування в стаціонарі результати анкетування в обох клінічних групах були тотожними. Діти відчували сильний біль, обмеження рухливості, а половина з них на початку лікування скаржилася на поганий сон, зниження апетиту. У всіх пацієнтів із ГГО спостерігався поганий настрій.
Аналіз характеристик на 10-ту добу лікування виявив, що при парентеральному прийомі антибактеріальних препаратів у дітей 2-ї групи майже половина мала поганий настрій, чверть – незадовільні апетит і сон. У 65% дітей 2-ї клінічної групи відзначалося зниження маси тіла, тоді як у дітей 1-ї групи цей показник становив 42,8%. За інтенсивністю болю та ступенем обмеження рухливості не встановлено достовірної різниці.
Обговорення результатів
Оцінка результатів стратегії лікування інфекцій кісток у дітей методом ступеневої терапії з переведенням із внутрішньовенного введення антибактеріального препарату (цефалоспорину ІІІ покоління) на пероральний препарат цефдинір (цефалоспорин ІІІ покоління) та стандартним парентеральним введенням є ретропроспективним аналізом клініко-лабораторних та інструментальних даних 34 дітей, госпіталізованих з документально підтвердженим ГГО різного ступеня тяжкості за відсутності супутніх захворювань. Результати проведеного дослідження продемонстрували, що використання методу ступеневої антибактеріальної терапії надає можливість зменшити термін лікування в умовах стаціонару, отже, й витрати на медичне обслуговування, а також позитивно впливає на соматичний стан хворих. Отримані результати мають потенційно спонукати клініцистів до раннього переходу від парентеральної антибактеріальної терапії до перорального її продовження.
Отримані нами дані є зіставними з дослідженням M. Pääkkönen і співавт. (2011) щодо можливості застосування перорального антибактеріального курсу при ГГО в дітей та тенденції до скорочення загального курсу лікування з метою зменшення частоти розвитку негативних явищ [13]. Автори дослідження відзначають, що СРБ є хорошим маркером перебігу хвороби. В нашому дослідженні саме позитивна динаміка СРБ стала критерієм переходу на пероральний прийом цефдиніру.
В нещодавньому дослідженні X. Wang і співавт. (2020) повідомлено, що навіть за тяжкого перебігу ГГО з необхідністю хірургічної обробки вогнища та використанням високих доз внутрішньовенних антибіотиків доцільним є перехід на пероральний прийом антибактеріальних препаратів, а скорочення курсу парентерального способу введення до <1 тижня не має істотного впливу на прогноз [2]. Особлива увага у представленому дослідженні надається таким небажаним явищам під час антибактеріальної парентеральної терапії, як аномальні рівні печінкових трансаміназ АлАТ та АсАТ, а також підвищенню концентрації креатиніну, хоча в педіатричних пацієнтів застосовувалися не тільки цефалоспорини (цефазолін, цефуроксим, цефтріаксон), а й ванкоміцин, лінезолід. Водночас автори констатують, що дані є обмеженими стосовно належної тривалості лікування пероральними препаратами та методів контролю за одужанням.
Обмеження нашого дослідження – малий розмір вибірки, що свідчить про необхідність продовження відповідного випробування.
Висновки
Стратегія лікування ГГО в дітей може здійснюватися методом переведення на 5-7-му добу з парентерального введення антибактеріального препарату (цефалоспорину ІІІ покоління) на пероральний препарат цефдинір (цефалоспорин ІІІ покоління), який пропонується у вигляді 2 форм випуску (порошок для приготування оральної суспензії та капсули).
Використання методу ступеневої терапії для лікування ГГО в дітей із застосуванням перорального цефалоспорину ІІІ покоління Родинір (цефдинір) дає можливість зменшити термін лікування в умовах стаціонару, витрати на медичне обслуговування, а також позитивно впливає на соматичний стан хворих.
Дослідження показало високий ступінь безпечності препарату Родинір, побічні та алергічні реакції при його використанні не спостерігалися.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 18-19 (535-536), 2022 р.