1 грудня, 2016
Діагностика і лікування хронічної серцевої недостатності: Рекомендації Європейського товариства кардіологів, 2016 р.
Вельмишановні колеги!
Вашій увазі пропонується український переклад нових (2016 р.) рекомендацій Європейського кардіологічного товариства (ESC) з діагностики та лікування хронічної серцевої недостатності (ХСН). Цей документ, який був уперше оприлюднений наприкінці травня поточного року, у стислій формі узагальнює основні досягнення клінічної кардіології у відповідній галузі на поточний період та пропонує практичним лікарям добре обґрунтовані якісні алгоритми практичних дій при веденні зазначеної категорії пацієнтів.
Чинні рекомендації ESC є продуктом колективної і водночас добре скоординованої праці провідних спеціалістів багатьох країн Європи. Вони ґрунтуються на значному за обсягом даних масиві доказової медицини та експертних висновках, базованих на клінічному досвіді.
Цей переклад підготовлений під егідою Української Асоціації фахівців з серцевої недостатності у вигляді спеціального випуску нашого фахового журналу. Він публікується з мінімальними скороченнями оригінального тексту та без розділу «Гостра серцева недостатність», який у документі ESC відокремлений від ХСН. Упевнений, що ознайомлення з цим вельми важливим документом, який наразі виступає базою для підготовки відповідних національних рекомендацій в усіх європейських країнах, включаючи Україну, стане для вас корисним та сприятиме подальшому поліпшенню надання допомоги нашим пацієнтам.
Головний редактор журналу «Серцева недостатність», президент Української Асоціації фахівців з серцевої недостатності, доктор медичних наук, професор Л.Г. Воронков
1. Преамбула
Представлені Рекомендації узагальнюють та оцінюють усі доступні на час їх написання докази, що стосуються предмета розгляду. Мета Рекомендацій – допомогти медичним працівникам обрати найкращу тактику ведення кожного окремого пацієнта з урахуванням його стану, впливу на наслідки хвороби, а також співвідношення ризик/користь для методів діагностики і терапії. Настанови та Рекомендації мають допомагати медичним працівникам обирати рішення в їх повсякденній практиці. Проте ухвалення остаточного рішення, яке стосується кожного окремого пацієнта, належить до сфери відповідальності медичних працівників, хворого та інших осіб, що надають допомогу.
Останніми роками ESC, як і інші професійні товариства, оприлюднила низку Рекомендацій. Оскільки Рекомендації впливають на клінічну практику, було розроблено критерії їхньої якості, що допомагає користувачам ухвалювати відповідне рішення. Рекомендації, розроблені ESC, можна знайти на веб-сайті товариства (http://www.escardio.org/Guidelines-&-Education/Clinical-Practice-Guidelines/Guidelines-development/Writing-ESC-Guidelines). Вони, відображаючи офіційну точку зору ESC на відповідні проблеми, регулярно оновлюються.
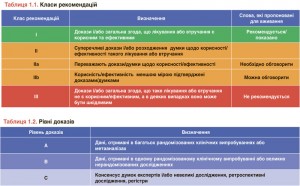
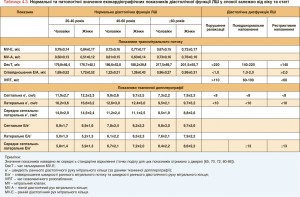
Члени цієї Робочої групи були обрані ESC серед кваліфікованих фахівців, які надають допомогу хворим з СН. Обрані експерти відповідно до політики комітету ESC з розробки практичних Рекомендацій (CPG) виконали ретельний огляд опублікованих доказів, що стосуються ведення (у тому числі діагностики, лікування, профілактики та реабілітації) хворих із цією патологією. Було здійснено критичну оцінку методів діагностики та лікування, у тому числі оцінено співвідношення ризик/користь. Де це було можливо – включено оцінку очікуваних наслідків для здоров’я хворих, яка ґрунтується на даних, отриманих у великих популяціях пацієнтів. Встановлено і класифіковано (відповідно до обраних шкал) рівень доказів та силу тих чи інших рекомендацій (табл. 1.1 і 1.2).
Експерти, які брали участь у створенні Рекомендацій, надавали форми-декларації щодо всіх реальних або можливих джерел конфлікту інтересів. Ці форми зібрані в єдиний файл, який можна знайти на веб-сайті ESC (http://www.escardio.org/guidelines). Про будь-які зміни, що вносяться в декларації інтересів у період написання Рекомендацій, слід повідомляти ESC, а самі декларації необхідно оновлювати. Робоча група отримувала фінансування лише від ESC, але не від представників індустрії охорони здоров’я.
ESC CPG очолює та координує підготовку нових Рекомендацій робочими, експертними та консенсусними групами. Крім того, CPG відповідає за процес ухвалення цих Рекомендацій, які ретельно аналізуються як самою CPG, так і зовнішніми експертами. Після відповідного перегляду Рекомендації мають ухвалюватися всіма експертами Робочої групи. Публікація фінального документа ухвалюється CPG European Heart Journal. Рекомендації було розроблено після ретельного вивчення наукових і медичних фактів, а також доказів, доступних на час датування Рекомендацій.
Завдання щодо створення Рекомендацій ESC полягає не лише в інтеграції результатів останніх наукових досліджень, а й у розробці освітніх інструментів та програм, що імплементують рекомендації. З метою імплементації створено кишенькові версії Рекомендацій, слайди з узагальнюючою інформацією, буклети з ключовими фактами, узагальнюючі картки для нефахівців, а також електронну версію для гаджетів (смартфонів тощо). Ці версії є скороченими, і, отже, якщо виникає потреба, можна звернутися до повного тексту, який надається безкоштовно на веб-сайті ESC.
Національні кардіологічні товариства, що належать до ESC, заохочуються до ухвалення, перекладу та імплементації всіх Рекомендацій ESC. Імплементаційні програми необхідні, оскільки було встановлено, що ретельне впровадження клінічних рекомендацій позитивно впливає на наслідки хвороби.
Опитувальні дослідження й регістри, які вивчають ті чи інші аспекти впровадження рекомендацій, необхідні для дослідження повсякденної клінічної практики в реальному житті. Вони замикають зворотний зв’язок між клінічним дослідженням, створенням Рекомендацій, їх розповсюдженням та імплементацією у клінічну практику.
Медичні фахівці заохочуються до того, щоб використовувати Рекомендації ESC в процесі ухвалення клінічного рішення, а також визначення та впровадження профілактичної, діагностичної і лікувальної тактики. Водночас Рекомендації ESC у жодному разі не заміняють особистої відповідальності медичних фахівців за вибір належного та точного рішення, яке враховує стан здоров’я хворого. Крім того, відповідальність медичного фахівця полягає в перевірці чинних на час призначення правил і регуляторних документів, що стосуються лікарських засобів та медичних пристроїв.
2. Вступ
Усі рекомендації, видані Європейським товариством кардіологів (ЄТК), допомагають медичним працівникам щодня обирати клінічну тактику, керуючись принципами доказової медицини. Незабаром ми святкуватимемо 30-ту річницю клінічних випробувань, у яких вперше беззаперечно продемонстровано можливість суттєвого покращення несприятливого прогнозу у пацієнтів із серцевою недостатністю (СН) [2]. З того часу в терапії СН було здійснено багато досягнень, які сприяли з’ясуванню низки патофізіологічних особливостей цього синдрому, а також – і це найважливіше – поліпшили результати лікування хворих [3]. Безумовно, зараз, у 2016 р., завдяки досягненням доказової медицини СН стає курабельним захворюванням, яке можна попередити.
Мета цього документа – забезпечити медичних працівників науково обґрунтованими рекомендаціями щодо діагностики й терапії СН. Головні відмінності цих Рекомендацій від попередніх (2012 р.) полягають у наступному:
1) нова термінологія для СН, що перебігає з фракцією викиду (ФВ) лівого шлуночка (ЛШ) у межах 40-49% – «СН із проміжною (mid-range) ФВ ЛШ» (HFmrEF); ми впевнені, що виокремлення такої групи стимулюватиме дослідження клінічних особливостей, механізмів розвитку та лікування цієї патології;
2) наявність чітких діагностичних критеріїв для СН зі зниженою ФВ ЛШ (HFrEF), HFmrEF і СН зі збереженою ФВ ЛШ (HFpEF);
3) новий алгоритм діагностики негострої СН, заснований на оцінці її імовірності;
4) рекомендації, спрямовані на профілактику/гальмування маніфестної СН або попередження летального наслідку до розвитку симптомів;
5) показання для прийому нового засобу – сакубітрилу/валсартану, першого препарату, що інгібує неприлізин та блокує ангіотензинові рецептори;
6) зміна показань до серцевої ресинхронізуючої терапії (СРТ);
Ми зберегли формат викладення, застосований у попередніх рекомендаціях 2012 р. У таблицях для рекомендацій з лікування наведено їхні клас і рівень. Рекомендації з хронічної СН із систолічною дисфункцією ЛШ приділяють багато уваги таким кінцевим точкам, як смертність і захворюваність. Наведено детальні резюме ключових доказів, що обґрунтовують основні лікувальні рекомендації. Як правило, рекомендації з діагностики мають рівень доказів С. Це пояснюється тим, що застосування більшості діагностичних тестів не обґрунтовано результатами рандомізованих контрольованих випробувань (РКВ), які демонструють зниження захворюваності та/або смертності. Запропоновано практичні настанови з використання діуретиків і важливих лікарських засобів, здатних впливати на перебіг хвороби. За можливості, аби уникнути невиправданого збільшення обсягу тексту, ми посилалися на інші Рекомендації, консенсусні документи та методичні пропозиції експертів. Усі таблиці треба читати лише одночасно з текстом, що їх супроводжує.
Цей документ, розроблений на основі консенсусу, що враховує думку всіх експертів, які над ним працювали, було створено завдяки інтенсивному спілкуванню членів Робочої групи, а також команди, що здійснювала огляд, та комітету ЄТК зі створення практичних рекомендацій. Тим часом інші експерти незалежно працювали над оновленими (2016 р.) рекомендаціями ACC/AHA/HSFA із сучасної фармакотерапії СН. Обидві групи експертів незалежно одна від іншої вивчали результати наукових досліджень, дійшли аналогічних висновків і створили схожі, але неідентичні рекомендації. Враховуючи відповідність рекомендацій, зазначені товариства вирішили оприлюднити їх одночасно, щоб мінімізувати потенційні суперечності та підвищити ефективність лікування хворих з СН.
3. Визначення, епідеміологія і прогноз
3.1. Визначення СН
СН є клінічним синдромом з характерними скаргами (наприклад, задишка, набряк кісточок, слабкість), що можуть супроводжуватися певними об’єктивними ознаками (наприклад, збільшеним тиском у яремних венах, крепітацією у легенях, периферійними набряками). Ця симптоматика зумовлена морфологічними і/або функціональними порушеннями серця, які спричиняють зменшення його викиду та/або підвищення інтракардіального тиску у спокої чи на тлі навантаження.
Наведене визначення дозволяє констатувати СН лише за її клінічної маніфестації. Але до того часу у хворих можуть бути наявні безсимптомні органічні або функціональні серцеві розлади (систолічна чи діастолічна дисфункція ЛШ), що передують власне СН.
Своєчасне розпізнавання цих розладів є вельми важливим, оскільки вони асоціюються з поганим прогнозом, а лікування пацієнтів із безсимптомною систолічною дисфункцією ЛШ знижує їх смертність (див. розділ 6) [4, 5].
Найважливішим для діагностики СН є встановлення її етіологічного чинника. Звичайно, це патологія міокарда, яка спричиняє систолічну і/або діастолічну дисфункцію шлуночка. Проте причинами СН можуть також бути ураження клапанів, перикарда, ендокарда, серцеві аритмії та ін. (часто у пацієнта наявні декілька причин). Розпізнавання серцевого захворювання, що зумовило СН, є надзвичайно важливим з терапевтичної точки зору, оскільки етіологічний чинник визначає характер лікування (наприклад, пластика або заміщення клапанів при вадах серця, специфічна терапія HFrEF, зниження частоти серцевого ритму при тахікардіоміопатії тощо).
3.2. Термінологія
3.2.1. СН зі збереженою ФВ, проміжними значеннями ФВ та зниженою ФВ
Основна термінологія, що використовується для опису СН, сформувалася історично та базується на величині ФВ ЛШ. У хворих з СН цей показник широко варіює – від нормальних значень (їх зазвичай констатують, якщо ФВ ЛШ становить ≥50% – HFpEF) до знижених (як правило, <40% – HFrEF) (табл. 3.1). Пацієнти з ФВ ЛШ, що становить 40-49%, належать до «сірої зони», яку відтепер ми визначаємо як HFmrEF (табл. 3.1). Поділ хворих з СН залежно від величини їхньої ФВ ЛШ важливий з огляду на відмінності в етіологічних чинниках, демографічних особливостях, супутній патології та ефективності лікування [6]. У більшості клінічних випробувань, результати яких було опубліковано після 1990 р., пацієнтів розподіляли залежно від величини ФВ ЛШ (зазвичай її визначали за допомогою ехокардіографії, радіонуклідних методів або серцевої магнітно-резонансної томографії – МРТ). При цьому здатність лікування зменшувати смертність і захворюваність вдалося продемонструвати лише у пацієнтів з HFrEF.

Діагностика HFрEF складніша, ніж розпізнавання HFrEF. Загалом хворі з HFрEF не мають дилатованого ЛШ, натомість у них спостерігається потовщення стінки ЛШ і/або збільшення розмірів лівого передсердя як ознаки підвищеного тиску наповнення. У більшості пацієнтів є додаткові «докази» порушень наповнення ЛШ або його ємності, що також трактується як діастолічна дисфункція, яку зазвичай вважають найімовірнішою причиною СН у таких хворих (звідси походить термін «діастолічна СН»). Проте в більшості осіб з HFrEF (яку раніше називали «систолічна СН») наявна також і діастолічна дисфункція ЛШ. З іншого боку, при HFрEF продемонстровано ознаки незначних порушень систолічної функції ЛШ. Отже, доцільніше констатувати збереження або зниження не «систолічної функції», а саме ФВ ЛШ.
У попередніх Рекомендаціях зазначалося, що між HFrEF і HFрEF існує «сіра зона» [7]. У таких пацієнтів величина ФВ ЛШ варіює від 40 до 49%, і зараз для таких випадків вживається термін «HFmrEF». Виокремлення цієї групи стимулюватиме дослідження її клінічних особливостей, механізмів розвитку і лікування. Ймовірно, такі хворі мають первинну легку систолічну дисфункцію та окремі риси діастолічної дисфункції ЛШ (табл. 3.1).
Пацієнти, у яких не вдалося встановити ураження міокарда ЛШ, можуть мати інші серцево-судинні причини СН (наприклад, легеневу гіпертензію, вади серця та ін.). Екстракардіальна патологія (наприклад, анемія, хвороби легенів, нирок або печінки), спричиняючи скарги, схожі чи ідентичні з такими самими при СН, може її ускладнювати або загострювати.
3.2.2. Термінологія, яку використовують для опису перебігу СН
У цих Рекомендаціях термін «серцева недостатність» використовується для того, щоб описати клінічно маніфестний синдром, який класифікують згідно з NYHA (див. підрозділ 3.2.3). Водночас на тлі терапії пацієнти можуть ставати безсимптомними. У представлених Рекомендаціях ті хворі зі зниженою ФВ ЛШ, у яких ніколи не було характерних скарг і/або фізикальних ознак СН, трактуються як пацієнти з безсимптомною систолічною дисфункцією ЛШ. Хворі з СН, що триває певний час, мають «хронічну СН». Якщо завдяки лікуванню суб’єктивні та об’єктивні симптоми СН не змінюються впродовж ≥1 міс, вона є стабільною. У разі погіршення перебігу хронічної стабільної СН пацієнти вважаються «декомпенсованими». Це може траплятися раптово або поступово і часто спричиняє госпіталізацію хворих – випадок, який має важливу прогностичну значущість. СН, що виникає вперше («de novo»), також може маніфестувати гостро (наприклад, унаслідок гострого інфаркту міокарда – ІМ) чи підгостро або поступово (наприклад, при дилатаційній кардіоміопатії (ДКМП), коли до встановлення діагнозу симптоми тривають протягом тижнів або місяців). Хоча симптоми СН можуть зникати, некориговане причинне захворювання серця зумовлює збереження ризику повторної «декомпенсації».
Проте іноді хворі страждають на СН з повністю зворотною причиною (наприклад, гострий вірусний міокардит, кардіоміопатія Такоцубо, тахікардіоміопатія). В інших пацієнтів, зокрема з «ідіопатичною» ДКМП, систолічна функція ЛШ може повністю відновитися завдяки сучасній терапії, що впливає на перебіг хвороби (інгібітором ангіотензинперетворювального ферменту (ІАПФ), бета-блокатором, антагоністом мінералокортикоїдних рецепторів (АМР), івабрадином і/або СРТ). «Застійна СН» – термін, який інколи застосовують, щоб описати гостру чи хронічну СН з ознаками об’ємного перевантаження. Більшість або навіть усі з наведених термінів можуть бути коректно використані для одного й того самого пацієнта в різний час, тобто на різних етапах перебігу його хвороби.
3.2.3. Термінологія, що описує тяжкість СН залежно від ступеня вираження її симптомів Функціональною класифікацією NYHA (табл. 3.2)
користуються, щоб описати тяжкість симптоматики та непереносимість навантажень. Водночас тяжкість симптомів погано корелює з багатьма показниками функції ЛШ. Хоча існує чіткий зв’язок між тяжкістю симптомів і виживаністю, хворі з легкими симптомами також мають ризик потреби в госпіталізації або виникнення летального випадку [8-10].
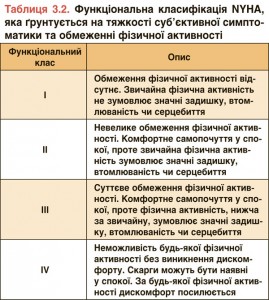
Іноді для того, щоб охарактеризувати хворих з тяжкими симптомами, рецидивуючою декомпенсацією і тяжким ураженням серцям, вживають термін «СН, що далеко зайшла (advanced)» [11]. ACCF/AHA класифікують стадійність розвитку СН залежно від морфологічних змін і скарг (табл. 3.3) [12].
3.3. Епідеміологія, етіологія та перебіг СН
Показник поширеності залежить від застосовуваних критеріїв для визначення СН. У розвинених країнах приблизна її оцінка становить 1-2% від дорослої популяції, а в осіб віком >70 років вона зростає до ≥10% [14-17]. Серед пацієнтів віком >65 років, які зі скаргами на задишку при навантаженні звертаються до закладів надання первинної допомоги, на недіагностовану СН (головним чином, HFpEF) страждає кожна шоста особа [18, 19]. У чоловіків і жінок віком 55 років ризик виникнення СН впродовж подальшого життя становить 33 і 28% відповідно [16]. Залежно від обраних діагностичних критеріїв СН, медичного закладу (центр надання первинної допомоги, стаціонар, приймальний покій), вікових і гендерних особливостей обстеженої популяції, наявності ІМ в анамнезі та року публікації результатів дослідження частка пацієнтів з HFpEF варіює від 22 до 73% [17, 18, 20-30].
Дані, що стосуються захворюваності на СН серед госпіталізованих пацієнтів, свідчать, що цей показник з часом, можливо, зменшується, причому для HFrEF ця динаміка є більш вираженою, ніж для HFpEF [31, 32]. Очевидно, HFpEF і HFrEF за своїми епідеміологічними властивостями та етіологією несхожі. Так, порівняно з хворими на HFpEF пацієнти з HFrEF – старші, серед них переважають жінки, вони частіше мають артеріальну гіпертензію (АГ) та фібриляцію передсердь (ФП), тоді як ІМ у них виникає рідше [32, 33]. Профіль HFmrEF є проміжним порівняно з HFrEF і HFpEF [34], проте щоб ліпше з’ясувати його особливості, необхідні подальші дослідження у відповідній популяції.
Етіологія СН у різних країнах неоднакова. Однієї, загальновживаної, класифікації причин СН немає, а класифікаційні категорії істотно пересікаються (табл. 3.4). Багато пацієнтів мають декілька різних – як серцево-судинних, так і екстракардіальних – захворювань, що спричиняють СН. Розпізнавання цих хвороб має бути частиною діагностичного пошуку, оскільки причина СН може визначати характер лікування.
У багатьох пацієнтів з СН та ішемічною хворобою серця (ІХС) в анамнезі є перенесений ІМ або ре-
васкуляризація. Нормальна коронарна ангіограма не виключає можливості наявності інших ознак ІХС – міокардіального рубця (наприклад, за даними серцевої МРТ) або патології коронарної мікроциркуляції.
У клінічній практиці досі складно розрізняти набуті та вроджені кардіоміопатії. У більшості пацієнтів зі встановленим діагнозом СН рутинне генетичне тестування для підтвердження діагнозу не потрібне. Водночас хворим з гіпертрофічною кардіоміопатією (ГКМП), «ідіопатичною» ДКМП і аритмогенною правошлуночковою кардіоміопатією рекомендується проводити генетичне консультування (див. підрозділ 5.10.1), оскільки результати відповідних тестів можуть мати певну клінічну значущість.
Упродовж останніх 30 років удосконалення терапії та її впровадження у клінічну практику поліпшило виживаність і зменшило частоту госпіталізацій хворих з HFrEF, хоча її прогноз часто лишається незадовільним. За результатами найсвіжішого європейського дослідження (ESC-HF pilot study), частота летальних випадків від усіх причин протягом 12 міс у госпіталізованих і стабільних/амбулаторних хворих з СН становить 17 і 7% відповідно, а частота госпіталізацій за той самий період – 44 і 32% відповідно [35]. У пацієнтів з СН (як госпіталізованих, так і амбулаторних) більшість летальних випадків зумовлені серцево-судинними причинами, переважно раптовою смертю та погіршенням перебігу СН. Смертність від усіх причин загалом вища при HFrEF, ніж у разі HFрEF [35, 36]. Госпіталізація часто пов’язана з екстракардіальними причинами, зокрема у пацієнтів з HFрEF. З 2000 до 2010 р. показник частоти госпіталізацій, зумовленої серцево-судинними причинами, не змінився, тоді як частота госпіталізацій з екстракардіальних причин зросла [31].
3.4. Прогноз
Прогностична оцінка захворюваності, інвалідизації та смертності допомогає пацієнтам, їхнім родинам і лікарям обрати адекватне і своєчасне лікування (зокрема, те, що потребує використання спеціальних пристроїв), а також планувати організацію медичного та соціального обслуговування і розподіл ресурсів.
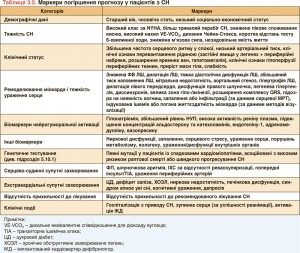
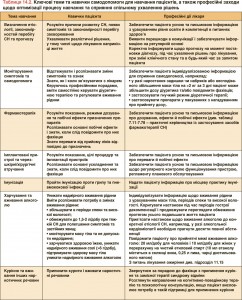
Встановлено численні прогностичні маркери летальних випадків і/або госпіталізації з приводу СН (табл. 3.5). Проте клінічне використання цих маркерів є обмеженим, а точне встановлення ризику розвитку СН залишається проблематичним.
В останні десятиріччя було розроблено декілька шкал для прогнозування ризику в різних категорій пацієнтів з СН [36-41]. Деякі з цих шкал доступні як інтерактивні програми в режимі онлайн.
Мультифакторні шкали ризику допомогають передбачати летальні випадки у хворих з СН, але їхня користь для прогнозування госпіталізації, зумовленої СН, значно менша [37, 38]. Систематичний огляд, у якому було проаналізовано 64 прогностичні моделі [37], та метааналіз і метарегресійне дослідження 117 прогностичних моделей [38] встановили помірну точність шкал для прогнозування летального випадку. З іншого боку, моделі, розроблені для прогнозування комбінованої кінцевої точки (смерть або госпіталізація) чи лише госпіталізації, характеризуються навіть гіршою дискримінаційною здатністю.
4. Діагностика
4.1. Скарги та об’єктивні ознаки
Скарги часто неспецифічні, а отже, не можуть допомогти диференціювати СН та інші стани (табл. 4.1) [42-46]. Скарги та об’єктивні ознаки, зумовлені затримкою рідини, швидко зникають на тлі діуретичної терапії. Такі об’єктивні ознаки, як підвищений тиск у яремних венах і зміщення верхівкового поштовху, більш специфічні, але їх складніше виявити, і вони характеризуються гіршою відтворюваністю [18, 46, 47]. Симптоми СН особливо важко розпізнати і трактувати при ожирінні, в осіб похилого віку та пацієнтів із хронічним захворюванням легень [48-50]. Порівняно з пацієнтами старших вікових груп у більш молодих осіб СН часто відрізняється за етіологією, клінічною картиною та прогнозом [51, 52].
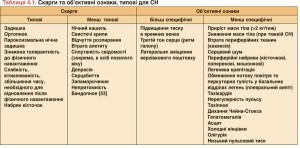
Необхідно зібрати детальний анамнез. СН нехарактерна для осіб, у яких відсутня відповідна історія хвороби (тобто наявність потенційної причини ураження серця). З іншого боку, певні анамнестичні особливості, зокрема перенесений ІМ, суттєво підвищують імовірність СН у хворого з відповідними скаргами та об’єктивними ознаками [42-45].
Під час кожного огляду треба оцінювати скарги й об’єктивні ознаки СН. При цьому особливу увагу необхідно приділяти симптомам застою. Скарги та об’єктивні ознаки важливі для моніторування ефективності терапії та стабільності перебігу СН упродовж певного часу. Якщо ознаки хвороби, незважаючи на лікування, зберігаються, це вказує на необхідність посилення терапії. Погіршення симптоматики – серйозний показник несприятливого перебігу СН, який збільшує ризик смерті й потреби у невідкладній госпіталізації та свідчить про необхідність термінового огляду медичним працівником.
4.2. Необхідний мінімум початкового обстеження: НУП, електрокардіографія та ехокардіографія
Плазмову концентрацію НУП використовують як початковий діагностичний тест, зокрема в закладах, у яких надають планову допомогу і в яких відсутній безпосередній доступ до ехокардіографічного дослідження. Підвищений рівень НУП допомагає встановлювати початковий діагноз і виявляти тих осіб, які потребують подальшого кардіологічного обстеження. Хворим, у яких величина НУП нижче рівня, що дозволяє констатувати суттєве ураження серця, проводити ехокардіографію не потрібно (також див. підрозділ 4.3 і розділ 12). Пацієнти з нормальним рівнем плазмового НУП швидше за все не страждають на СН. Верхня межа норми для НУП (BNP) типу В за відсутності гострого стану становить 35 пг/мл, а N-кінцевого попередника BNP (NT-proBNP) – 125 пг/мл. У разі загострення треба користуватися більшими значеннями для верхньої межі норми: для BNP – <100 пг/мл, для NT-proBNP – <300 пг/мл, а для середньорозташованого попередника НУП типу А (MR-proANP) – <120 пмоль/л. Ці показники використовують для діагностики як HFrEF, так і HFpEF. Проте в цілому при HFpEF їх значення нижче, ніж у разі HFrEF [54, 55]. Для вищезазначених точок поділу негативна передбачувальна цінність є високою (0,94-0,98) і для хронічного, і для гострого станів. Водночас позитивна передбачувальна цінність є низькою як для хронічної (0,44-0,57), так і для гострої (0,66-0,67) СН [54, 56-61]. Отже, використання НУП рекомендують для виключення СН, але не для її діагностики.
Існують численні серцево-судинні та екстракардіальні чинники, які зумовлюють підвищення рівня НУП, що знижує корисність цих показників у діагностиці СН. Серед таких чинників, які утруднюють трактування результатів вимірювання НУП, найважливішими є ФП, вік і ниркова недостатність [55]. З іншого боку, за наявності ожиріння рівень НУП може виявитися неадекватно низьким [62] (див. підозділ 12.2 і табл. 12.3).
Патологічні зміни електрокардіограми (ЕКГ) збільшують імовірність діагнозу СН, хоча й характеризуються низькою специфічністю [18, 46, 63, 64]. Деякі зміни на ЕКГ допомагають з’ясувати етіологію СН (наприклад, перенесений ІМ). Інші ЕКГ-ознаки є показанням для призначення терапії (наприклад, антикоагулянтів при ФП, пейсмекера при брадикардії, СРТ у разі розширення комплексу QRS) (див. розділи 8 і 10). СН малоймовірна у пацієнтів з абсолютно нормальною ЕКГ (чутливість 89%) [43]. Таким чином, рутинне використання ЕКГ можна рекомендувати головним чином лише для виключення СН.
Ехокардіографія – найкорисніший метод дослідження, легко доступний у пацієнтів, у яких необхідно підтвердити діагноз СН. Він безпосередньо забезпечує інформацією щодо об’єму камер серця, систолічної та діастолічної функції, товщини міокардіальної стінки, клапанів і наявності легеневої гіпертензії [65-74]. Ці дані є критично важливими для встановлення діагнозу та вибору відповідної терапії (див. підрозділи 5.2-5.4, у яких наведено більш детальну інформацію).
Дані, які отримують за допомогою клінічного обстеження та вищенаведених тестів, дозволяють встановити початковий діагноз і розробити план лікування для більшості хворих. Інші тести необхідні головним чином в тих випадках, якщо діагноз залишається невизначеним (наприклад, у разі незадовільної ехокардіографічної візуалізації або якщо підозрюється незвичайна причина СН (детальніше див. у підрозділах 5.5-5.10).
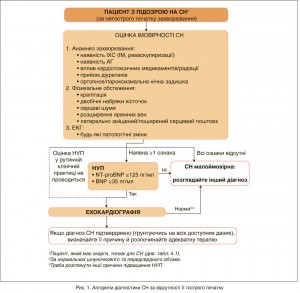
4.3. Алгоритм діагностики СН
4.3.1. Алгоритм діагностики СН за відсутності її загострення
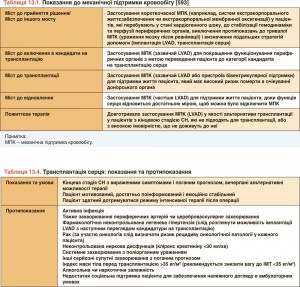
Алгоритм діагностики СН за відсутності її загострення наведено на рисунку 1.
Якщо хворий з першою в житті маніфестацією симптомів звернувся за неекстреною допомогою до лікаря загальної практики або до поліклініки (табл. 4.1), необхідно оцінити імовірність наявності у нього СН. Ця оцінка насамперед має ґрунтуватися на анамнестичних даних (наприклад, наявності ІХС, АГ, використанні діуретиків), певних скаргах (наприклад, ортопное), результатах фізикального обстеження (наприклад, наявності двобічних набряків, збільшеного тиску в яремних венах, зміщення верхівкового поштовху) та ЕКГ, зареєстрованої у спокої. Якщо дослідження не виявило патології, СН малоймовірна, і треба обговорити можливість інших діагнозів. За наявності хоча б одного симптому необхідно, якщо це доступно, визначати рівень НУП, щоб ідентифікувати тих пацієнтів, кому потрібна ехокардіографія (вона показана при збільшеній концентрації циркулюючого НУП або у разі неможливості дослідження його вмісту) [55-60, 75-78].
4.3.2. Діагностика СН зі збереженою ФВ ЛШ
Діагностика HFpEF залишається складною проблемою. У таких хворих ФВ ЛШ є нормальною, а скарги й об’єктивні дані (табл. 4.1) часто неспецифічні і можуть чітко не відрізнятися від аналогічних за інших клінічних станів. Цей підрозділ узагальнює практичні рекомендації, необхідні для встановлення відповідного діагнозу в клінічній практиці.
Діагностика хронічної HFpEF, зокрема в типового літнього пацієнта із супутніми хворобами і відсутністю очевидних ознак центрального перевантаження рідиною, досі є складною, а валідований «золотий стандарт» відсутній. Для покращення специфічності розпізнавання HFpEF її клінічна діагностика має базуватися на об’єктивній оцінці серцевого ураження у спокої та на тлі навантаження. Діагноз HFpEF має відповідати таким критеріям:
• наявність скарг і/або об’єктивних ознак СН (див. табл. 4.1);
• «збереженість» ФВ ЛШ (≥50% або 40-49% для HFmrEF);
• збільшений рівень НУП (BNP >35 пг/мл і/або NT-proBNP >125 пг/мл);
• об’єктивні ознаки інших функціональних та органічних порушень, властивих СН (детальніше див. нижче);
• в умовах невизначеності для підтвердження діагнозу можуть бути потрібні навантажувальні тести або інвазивне дослідження для вимірювання підвищеного тиску наповнення ЛШ (детальніше див. нижче).
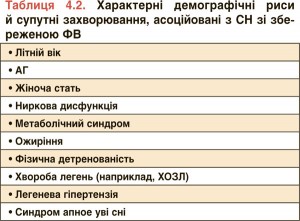
Початкова оцінка складається з діагностичного пошуку, що відповідає вищенаведеному алгоритму, та ехокардіографічного вимірювання ФВ ЛШ. Точка поділу в 50% для встановлення HFрEF є суперечливою. У клінічних випробуваннях пацієнтів з ФВ ЛШ 40-49% часто класифікували як хворих з HFрEF [79]. Але в цих Рекомендаціях ми говоримо про HFрEF, якщо ФВ ЛШ становить ≥50%. ФВ ЛШ, що дорівнює 40-49%, ми розглядаємо як «сіру зону», яка вказує на наявність HFmrEF. Скарги та фізикальні ознаки у хворих з HFrEF, HFmrEF і HFрEF є подібними. Характерні демографічні риси й супутні захворювання наведено в таблиці 4.2. На ЕКГ спокою можуть виявлятися ФП, гіпертрофія ЛШ і порушення реполяризації. Нормальна ЕКГ і/або плазмові концентрації BNP <35 пг/мл і/або NT-proBNP <125 пг/мл роблять діагноз HFрEF, HFmrEF та HFrEF малоймовірним.
Наступний крок, який потрібний, якщо вже спочатку існують докази на користь HFрEF/HFmrEF, полягає в поглибленому обстеженні. Воно об’єктивізує органічні та/або функціональні ураження серця як причини клінічних проявів. Ключовими органічними змінами є індекс об’єму лівого передсердя (LAVI) >34 мл/м2 або індекс маси міокарда ЛШ (LVMI) ≥115 г/м2 для чоловіків і ≥95 г/м2 для жінок [65, 67, 72]. До ключових функціональних змін належать Е/е’ ≥13 та середня е’ для септальної і латеральної стінок <9 см/с [65, 67, 70, 72, 80-84]. Іншими (непрямими) ехокардіографічними параметрами є поздовжнє напруження та швидкість трикуспідальної регургітації (TRV) [72, 82]. У представлених Рекомендаціях збережені попередні референтні значення не для всіх показників діастолічної функції ЛШ (табл. 4.3). Це пояснюється публікацією нових даних, зокрема наведених у роботі L. Cabarello і співавт. [70].
Тестування діастолічної функції в умовах навантажувального тесту виконують за допомогою велоергометрії та ехокардіографії. При цьому зазвичай застосовують протокол з напівлежачим велоергометром, що дозволяє оцінити динаміку на тлі навантаження низки показників: тиску в ЛШ (Е/е’) та легеневій артерії (TRV), систолічної дисфункції ЛШ (за поздовжнім напруженням), ударного об’єму й серцевого викиду [85, 86]. Існують різні протоколи динамічного навантаження, проте найчастіше користуються напівлежачою велоергометрією з ехокардіографією у спокої та на тлі субмаксимального навантаження [85].
При цьому враховують не лише діагностично значуще (>13) збільшення Е/е’, індуковане навантаженням, а й інші непрямі показники систолічної та діастолічної функції ЛШ, наприклад поздовжнє напруження або TRV. З іншого боку, якщо інвазивне дослідження гемодинаміки у спокої з оцінкою тисків наповнення (тиск заклинювання легеневих капілярів ≥15 мм рт. ст. або кінцево-діастолічний тиск ЛШ ≥15 мм рт. ст.) не демонструє патологічних змін, наступним кроком має бути навантажувальне тестування з вивченням динаміки тисків наповнення, систолічного тиску в легеневій артерії, ударного об’єму і серцевого викиду [87].
Діагностика HFpEF у пацієнтів з ФП асоціюється з певними труднощами. Так, при ФП збільшується рівень НУП. Отже, щоб використовувати NT-proBNP і BNP для розпізнавання HFpEF, значення цих показників, імовірно, треба стратифікувати залежно від наявності синусового ритму (з меншою точкою поділу) або ФП (з більшою точкою поділу). При ФП підвищується LAVI, а значення функціональних показників, що свідчать на користь діастолічної дисфункції ЛШ, визначено з меншою впевненістю, ніж за відсутності ФП. Імовірно, для цих показників необхідно користуватися іншими точками поділу. З іншого боку, ФП може бути ознакою HFpEF, і тому пацієнти з ФП та хворі на HFpEF часто мають однакові клініко-демографічні характеристики. Окрім того, при HFpEF і ФП порівняно з HFpEF на тлі синусового ритму перебіг СН є більш тяжким.
Хворі на HFpEF є гетерогенною групою з різними етіологією та механізмами розвитку захворювання. Залежно від чинника, який вважають найбільш імовірною причиною СН, призначають додаткові діагностичні тести (див. табл. 4.4) [71, 88-94]. Проте проводити їх рекомендовано лише в тому випадку, якщо вони надають інформацію, корисну для вибору схеми лікування.
5. Кардіовізуалізація та інші діагностичні методи
Кардіовізуалізація відіграє провідну роль у встановленні діагнозу СН та призначенні лікування. Доступними є декілька візуалізуючих методик, при цьому у пацієнтів з підозрою на СН методом вибору є ехокардіографія (через її точність, доступність (у тому числі портативність), безпечність і вартість) [68, 69, 72]. Поряд з ехокардіографією можна використовувати й інші методи дослідження, вибір яких визначається, по-перше, їх здатністю відповідати на конкретні клінічні питання, а по-друге, врахуванням протипоказань до них і ризиком, асоційованим з ними [71, 73].
Загалом методи візуалізації необхідно використовувати лише в тому випадку, якщо вони здатні надати клінічно значущу інформацію. Це залежить від обраного методу, досвіду фахівця та медичного центру, якості візуалізації. Нормативи визначаються віком, статтю й методом дослідження.
5.1. Рентгенографія органів грудної клітки
Рентгенографія органів грудної клітки має обмежену значущість в обстеженні пацієнтів з підозрою на СН. Імовірно, вона найкорисніша у встановленні інших (легеневих) причин, що можуть пояснити виникнення у пацієнта симптомів (наприклад, злоякісного новоутворення легені або інтерстиційної хвороби легень). Водночас комп’ютерна томографія грудної клітки вважається сучасним стандартом дослідження. Для діагностики астми або ХОЗЛ необхідно проводити дослідження функції зовнішнього дихання зі спірометрією. Проте у хворих на СН рентгенографія органів грудної клітки здатна візуалізувати венозний застій у легенях або їх набряк, а отже, вона інформативніша не за хронічних, а за гострих станів [49, 64]. Важливо мати на увазі, що навіть значна дисфункція ЛШ може формуватися без рентгенологічних ознак кардіомегалії [49, 64].
5.2. Трансторакальна ехокардіографія
У цьому документі термін «ехокардіографія» використовується для позначення будь-якої з методик ультразвукової візуалізації серця, зокрема двомірної/тримірної ехокардіографії, пульсової та тривало-хвильової, кольорової потокової, тканинної допплерографії, контрастної ехокардіографії, а також деформаційної візуалізації (напруження або частоти напруження).
Трансторакальна ехокардіографія є методом вибору для оцінки систолічної та діастолічної функції міокарда як ЛШ, так і правого шлуночка (ПШ).
5.2.1. Оцінка систолічної функції ЛШ
Для визначення ФВ ЛШ рекомендується використовувати модифікований 2-проекційний метод Simpson. Вимірювання кінцево-діастолічного (КДО) та кінцево-систолічного (КСО) об’ємів ЛШ здійснюють з верхівкового 4- або 2-камерного доступу. Цей метод потребує точного визначення ендокардіальної межі. У разі поганої якості візуалізації для поліпшення межі ендокарда небхідно застосовувати контрастні речовини [72]. Розпізнавання локальних порушень руху шлуночкової стінки може виявитися особливо важливим для пацієнтів, у яких підозрюють ІХС або міокардит.
Не рекомендовано використовувати ані методи Teichholz чи Quinones, які застосовують для розрахунку ФВ ЛШ у разі двомірних моделей, ані вимірювання фракційного скорочення. Це пояснюється неточністю результатів, зокрема у пацієнтів з локальною дисфункцією і/або ремоделюванням ЛШ. Тривимірна ехокардіографія відповідної якості поліпшує кількісну оцінку об’ємів ЛШ і ФВ ЛШ. Як продемонстровано в дослідженні, у якому референтним методом була серцева МРТ, тривимірна ехокардіографія забезпечує найточніші результати [95].
Допплерографічні методики, визначаючи швидкісно-часовий інтеграл у зоні виносного тракту ЛШ, дозволяють розраховувати низку показників гемодинаміки, зокрема індекс ударного об’єму та серцевий викид.
Останніми роками продемонстровано, що показники, які отримують за допомогою тканинної допплерографії (хвиля S) і деформаційних візуалізуючих методик (напруження та частота напруження), є відтворювальними й адекватними для застосування у клінічній практиці, особливо для розпізнавання незначних порушень систолічної функції на безсимптомній стадії. Проте необхідно мати на увазі, що результати вимірювань варіюють залежно від апаратури і програмного забезпечення [74].
5.2.2. Оцінка діастолічної функції ЛШ
Вважається, що діастолічна дисфункція ЛШ – основний патофізіологічний чинник, який визначає формування HFpEF, а можливо, й HFmrEF. Отже, її встановлення відіграє важливу роль у діагностичному пошуку. Хоча ехокардіографія є поки що єдиною візуалізуючою методикою, яка дозволяє розпізнавати діастолічну дисфункцію, не існує якогось одного показника, яким можна користуватися ізольовано для точної діагностики цього порушення. Тому з такою метою рекомендується застосовувати повне ехокардіографічне дослідження, що має складатися з відповідної двовимірної методики та допплерографії (див. підрозділ 4.3.2).
5.2.3. Оцінювання функції ПШ й артеріального тиску в легеневій артерії
Обов’язковою частиною ехокардіографічного обстеження є оцінювання структури і функції ПШ, у тому числі об’ємів правих камер, а також систолічної функції ПШ і артеріального тиску (АТ) в легеневій артерії. Серед показників, що характеризують систолічну функцію ПШ, найважливішими є систолічний рух кільця трикуспідального клапана (TAPSE, якщо цей показник становить <17 мм, констатують систолічну дисфункцію ПШ) та систолічна швидкість латеральної частини кільця трикуспідального клапана (s’; систолічну дисфункцію ПШ встановлюють у разі значення цього показника <9,5 см/с) [72, 96]. Систолічний тиск у легеневій артерії визначають за допомогою оптимального запису потоку максимальної регургітації та систолічного градієнта на трикуспідальному клапані в сукупності з оцінкою тиску ПЖ (враховуючи розмір нижньої порожнистої вени та її респіраторне колапсування) [97]. Розмір ПЖ треба вимірювати рутинно, за допомогою звичайної двовимірної ехокардіографії, користуючись декількома акустичними вікнами. Звіт ехокардіографічного обстеження має включати як якісні, так і кількісні показники. Якщо інформація щодо об’ємів ПШ має клінічну значущість, а заклад має відповідний досвід, рекомендовано визначення цих показників з використанням тривимірної ехокардіографії [95]. Як додатковий кількісний метод оцінювання функції ПШ у спеціалізованих центрах можна застосовувати тривимірну спекл-трекінг ехокардіографію [98].
5.3. Черезстравохідна ехокардіографія
Для рутинної оцінки стану хворих з СН потреби у проведенні черезстравохідної ехокардіографії немає. З іншого боку, іноді цей метод може бути корисним при клапанних чи набутих вадах серця, у разі підозри на розшарування аорти чи інфекційний ендокардит, а також для виключення наявності внутрішньосерцевих тромбів у хворих, які потребують кардіоверсії. Якщо тяжкість мітральної чи аортальної вади серця не відповідає ознакам хвороби, отриманим за допомогою трансторакальної ехокардіографії, необхідно виконати черезстравохідну ехокардіографію.
5.4. Стрес-ехокардіографія
Стрес-ехокардіографію з фізичним навантаженням або введенням фармакологічних засобів використовують для оцінки індуцибельної ішемії і/або життєздатності міокарда [99], а також, у деяких випадках, при клапанних вадах серця (наприклад, у разі динамічної мітральної недостатності чи низькопоточного/низькоградієнтного аортального стенозу) [99, 100]. Існує думка, що стрес-ехокардіографія допомагає встановлювати діастолічну дисфункцію ЛШ, яка провокується навантаженням, у хворих із задишкою при фізичному навантаженні, збереженою ФВ ЛШ та діагностично невизначеними показниками діастолічної функції ЛШ у спокої [85, 86].
5.5. Серцева МРТ
Серцева МРТ вважається золотим стандартом у вимірюванні об’ємних показників, маси міокарда та ФВ як для ЛШ, так і для ПШ. Серцева МРТ є найкращим візуалізуючим методом у хворих, у яких ехокардіографія не надала діагностично значущої інформації (зокрема, у разі потреби у візуалізації ПЖ), а також у пацієнтів зі складними набутими вадами серця [91, 101, 102].
Серцева МРТ з використанням пізнього посилення гадолінієм (LGE) та Т1-картуванням є найкращим методом розпізнавання фіброзу міокарда і встановлення етіології СН [91, 103]. Так, серцева МРТ з LGE дозволяє здійснювати диференційну діагностику між ішемією міокарда та неішемічними чинниками СН, а також візуалізує фіброз/рубцеві зміни в серцевому м’язі. Окрім того, серцева МРТ характеризує стан міокарда при міокардиті, амілоїдозі, саркоїдозі, хворобах Чагаса й Фабрі, некомпактності серцевого м’яза та гемохроматозі [91, 101, 103, 104].
Серцеву МРТ можна використовувати для оцінки ішемії і життєздатності міокарда у пацієнтів з СН та ІХС, яким, можливо, показана коронарна реваскуляризація. Проте обмежені дані, отримані в РКВ, не продемонстрували корисність оцінки життєздатності міокарда (за даними серцевої МРТ або інших методик) для ідентифікації хворих, яким корисно виконувати коронарну реваскуляризацію [105-107].
До вад серцевої МРТ, що обмежують її клінічне використання, належать необхідність місцевої експертної оцінки, недостатня доступність через високу вартість (порівняно з ехокардіографією), невизначеність з її безпечністю в осіб з металевими імплантами (в тому числі із серцевими пристроями), менша точність даних у пацієнтів з тахіаритміями. Ще одним важливим обмежуючим чинником є клаустрофобія. Лінійні контрастні речовини, що містять гадоліній, протипоказані в осіб зі швидкістю клубочкової фільтрації (ШКФ) <30 мл/хв/1,73 м2. Це пояснюється здатністю таких агентів слугувати тригером нефрогенного системного фіброзу (можливо, в цьому відношенні безпечнішими є нові циклічні речовини, що містять гадоліній) [108].
5.6. Однофотонна емісійна комп’ютерна томографія та радіонуклідна вентрикулографія
Однофотонна емісійна комп’ютерна томографія (SPECT) може бути корисною для оцінки ішемії та виживаності міокарда [109]. Режим gated SPECT надає інформацію щодо шлуночкових об’ємів і функції, хоча пацієнти при цьому отримують більше променеве навантаження. Сцинтиграфія з 3,3-дифосфоно‑1,2-пропанодикарбоксильною кислотою може допомогти у розпізнаванні транстиретинового амілоїдозу серця [110].
5.7. Позитронно-емісійна томографія
Позитронно-емісійну томографію – ПET (яку застосовують самостійно або сумісно з комп’ютерною томографією) можна використовувати для оцінки ішемії та життєздатності міокарда, хоча такі радіоактивні агенти, як амоній N‑13 і вода О‑15, вимагають застосування циклотрону [92, 111]. Рубідій – інший радіоактивний агент для діагностики ішемії за допомогою ПЕТ – може вироблятися локально і відносно дешево. Головними недоліками ПЕТ є обмежена доступність, променеве навантаження та висока вартість.
5.8. Коронарна ангіографія
Показання до проведення коронарної ангіографії у пацієнтів з СН є такими самими, як і в інших відповідних Рекомендаціях ЄТК [112-114]. Коронарна ангіографія рекомендована хворим з СН, які страждають на стенокардію напруження, резистентну до медикаментозної терапії [115]. Її виконують пацієнтам, яким можна проводити коронарну реваскуляризацію. Окрім того, коронарна реваскуляризація показана при маніфестній шлуночковій аритмії або зупинці серця з успішною реанімацією в анамнезі. Питання про застосування цього методу доцільно розглянути у пацієнтів з СН та проміжною/високою претестовою імовірністю ІХС і наявністю, за даними неінвазійних методів, ішемії. Мета його використання – довести ішемічну етіологію хвороби та встановити тяжкість ІХС.
5.9. Серцева комп’ютерна томографія
При СН серцеву комп’ютерну томографію застосовують (за відсутності відносних протипоказань) головним чином як неінвазійний метод візуалізації коронарних судин у хворих з низькою проміжною претестовою імовірністю ІХС або у пацієнтів з відповідними результатами неінвазійних стрес-тестів з метою виключення діагнозу ІХС. Однак цей метод треба застосовувати лише у тому разі, якщо його результати здатні вплинути на вибір лікувальної тактики.
У таблиці наведено найважливіші клінічні показання для використання певних візуалізуючих методів у хворих з імовірним або підтвердженим діагнозом СН.
5.10. Інші діагностичні тести
Усебічне обстеження хворих з СН складається, окрім збору анамнезу й фізикального дослідження, ще з правильно обраних методів кардіовізуалізації, а також комплексу додаткових діагностичних тестів, тобто дослідження низки лабораторних показників, ЕКГ, рентгенографії органів грудної клітки, навантажувальних методик, інвазивного дослідження гемодинаміки та ендоміокардіальної біопсії. Основні типові показання до виконання діагностичних тестів у пацієнтів з СН наведено нижче, у таблиці. Біомаркери СН (наприклад, ST2, галектин 3, копептин, адерномедулін) є об’єктом інтенсивних наукових досліджень. Проте дані, що дозволяють рекомендувати їх використання у клінічній практиці, відсутні.
5.10.1. Генетичне обстеження при СН
Пацієнтам з кардіоміопатією молекулярний генетичний аналіз рекомендується проводити в тому разі, якщо мутація, яку збираються виявити, достатньо поширена, щоб виправдати рутинне застосування генетичного скринінгу. Рекомендації щодо генетичного обстеження у хворих з СН ґрунтуються на меморандумі Робочої групи з хвороб міокарда та перикарда ЄТК [94]. У більшості хворих з визначеним діагнозом СН рутинне генетичне обстеження не відіграє ніякої ролі в підтвердженні діагнозу. Генетичну консультацію рекомендовано проводити у пацієнтів з ГКМП, ідіопатичною ДКМП та аритмогенною правошлуночковою кардіоміопатією. Рестриктивна кардіоміопатія й ізольована некомпактність міокарда, ймовірно, мають генетичне походженняя, і тому за наявності цих хвороб також необхідно обговорити доцільність генетичного обстеження.
У більшості випадків ГКМП є вродженою, аутосомно-домінантною хворобою з різною експресивністю та залежною від віку пенетрантністю. Уже встановлено понад 20 причинних генів і 1400 їх мутацій. Більшість із них виникають у саркомерних генах, що кодують важкий ланцюг серцевого β-міозину (MYH7) та міозин-зв’язуючий протеїн С (MYBPC3) [88, 122].
ДКМП має ідіопатичне походження у 50% випадків, третина з яких є спадковими. Уже ідентифіковано понад 50 генів, що асоціюються з виникненням ДКМП. Багато генів мають відношення до цитоскелета. Найпоширенішими з них є тітін (TTN), ламін (LMNA) і десмін (DES) [88, 123].
Аритмогенна правошлуночкова кардіоміопатія в більшості випадків є спадковою. Вона спричиняється мутацією генів, що кодують структурні компоненти десмосоми. Мутацією десмосомальних генів пояснюють 50% усіх випадків цієї хвороби. На цей час відомо 10 генів, які асоціюються з нею [124].
Консультацію може проводити фахівець, достатньо обізнаний у специфічних психологічних, соціальних і медичних наслідках встановленого діагнозу. Важливо визначити генотип, оскільки деякі форми (наприклад, мутації LMNA та фосфоламбану) асоціюються з гіршим прогнозом. Аналіз ДНК також може допомогти у встановленні діагнозу рідкісних форм, зокрема мітохондріальних кардіоміопатій. Для їх ранньої діагностики рекомендується проводити скринінг родичів першої лінії, причому вже у підлітковому віці. Проте залежно від віку, в якому почалася хвороба в інших членів родини, можна розглянути доцільність проведення скринінгу в більш ранньому віці.
Нещодавно було запропоновано класифікацію спадкових кардіоміопатій MOGE(S). Вона включає морфофункціональний фенотип (М), залучення органів (О), профіль генетичного успадкування (G), етіологічні чинники (Е), у тому числі генетичні дефекти або причинні хвороби/субстрати, а також функціональний статус пацієнта (S) [125].
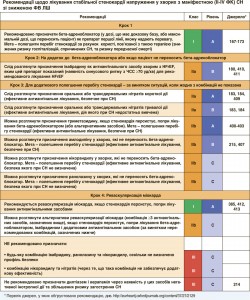
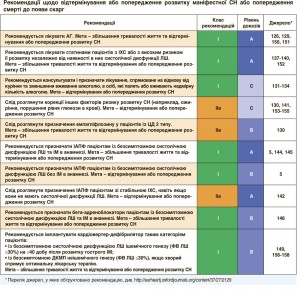
6. Відтермінування або попередження розвитку маніфестної СН
Отримано суттєві докази того, що розвиток СН можна гальмувати або попереджати завдяки заходам, спрямованим на корекцію факторів ризику розвитку СН, які модифікуються, або на лікування безсимптомної систолічної дисфункції ЛШ (див. таблицю з рекомендаціями). У багатьох випробуваннях було доведено, що контроль АГ здатний затримувати маніфестацію СН, а за даними деяких досліджень, – також подовжувати тривалість життя [126-129]. Продемонстровано ефективність різних антигіпертензивних засобів (діуретиків, ІАПФ, блокаторів рецепторів ангіотензину ІІ (БРА), бета-адреноблокаторів), зокрема в осіб похилого віку, незалежно від наявності в анамнезі ІМ [126-128]. Зараз триває дискусія щодо оптимального цільового рівня АТ у пацієнтів з АГ без ЦД. У випробуванні SPRINT продемонстровано, що в осіб похилого віку (≥75 років), які мають АГ, або в осіб з АГ, які належать до групи високого ризику, зниження АТ до більш «жорсткого» цільового рівня (систолічний АТ <120 мм рт. ст. порівняно з <140 мм рт. ст.) зменшує ризик виникнення серцево-судинного захворювання, смерті та госпіталізації, спричиненої СН [129].
Нещодавно встановлено, що емпагліфлозин (інгібітор глюкозо-натрієвого котранспортера 2) покращує прогноз (у тому числі зменшує смертність і частоту госпіталізацій з приводу СН) у пацієнтів із ЦД 2 типу [130]. Щодо інших цукрознижувальних засобів не вдалося переконливо продемонструвати здатність зменшувати ризик серцево-судинних випадків. Натомість вони можуть підвищувати ризик виникнення СН. Посилення цукрознижувальної терапії для зниження рівня глікозильованого гемоглобіну (HbA1c) за допомогою інших, ніж емпагліфлозин, засобів не знижує ризик розвитку СН (детальніше див. у підрозділі 11.6).
Здатність відмови від куріння зменшувати ризик розвитку СН ще не доведено. Проте, за даними епідеміологічних досліджень, між курінням і виникненням серцево-судинних захворювань зв’язок існує [131]. Отже, якщо дотримуватися цієї поради, вона може виявитися корисною.
Зв’язок між уживанням алкоголю та виникненням de novo СН має U-подібний вигляд: найменший ризик спостерігається за помірного уживання алкоголю (до 7 «дринків» щотижня) [132-134]. Вживання більшої кількості алкоголю може провокувати розвиток токсичної КМП. У разі розвитку останньої рекомендується повністю виключити алкоголь.
Встановлено наявність зворотного зв’язку між рівнем фізичної активності та ризиком розвитку СН. Згідно з висновками нещодавнього метааналізу для суттєвішого зниження ризику розвитку СН потрібний більший, ніж це пропонується в Рекомендаціях, рівень фізичної активності [135].
Якщо особа віком ≥40 років має фактори серцево-судинного ризику або кардіоваскулярне захворювання (за винятком безсимптомної дисфункції ЛШ або маніфестної СН), то її орієнтоване на рівень BNP ведення лікарем загальної практики сумісно зі спеціалізованим серцево-судинним центром зменшує частоту комбінованої кінцевої точки – систолічної дисфункції ЛШ і маніфестної СН [136].
Статини знижують частоту серцево-судинних подій і смертності. Також існують докази того, що вони здатні попереджати або стримувати розвиток СН [137-140]. Ані аспірин або інші антитромбоцитарні засоби, ані реваскуляризація не зменшують ризик розвитку СН або смерті у хворих з ІХС стабільного перебігу. Ожиріння є ще одним фактором ризику розвитку СН [141], проте невідомо, чи впливає його корекція на розвиток СН.
У хворих з ІХС без систолічної дисфункції ЛШ і СН ІАПФ попереджають або стримують розвиток СН та зменшують як загальну, так і серцево-судинну смертність. Щоправда, у сучасних умовах користь від їх застосування може бути невеликою, зокрема в пацієнтів, які приймають аспірин [142]. Титрація антагоністів РАС і бета-адреноблокаторів до тих доз, що максимально переносяться, покращує прогноз, у тому числі при СН, якщо у хворого збільшена плазмова концентрація НУП [136, 143].
Первинне черезшкірне втручання на коронарних артеріях упродовж ранньої фази ІМ з елевацією сегмента ST здійснюють для зменшення його розміру. Це знижує ризик суттєвого зниження ФВ ЛШ і формування HFrEF [112]. Призначення ІАПФ, бета-адреноблокаторів та АМР безпосередньо після розвитку ІМ, зокрема якщо він супроводжується систолічною дисфункцією ЛШ, знижує смертність і частоту госпіталізацій з приводу СН [144-148]. Такий самий ефект властивий і статинам [137-139].
У безсимптомних хворих з постійно зменшеною ФВ ЛШ будь-якої етіології ІАПФ знижують ризик СН, що потребує госпіталізації [5, 144, 145]. Цього не було продемонстровано для бета-адреноблокаторів та АМР.
У хворих із безсимптомною систолічною дисфункцією ЛШ ішемічного генезу (ФВ ЛШ <30%) на ≥40 добу після розвитку гострого ІМ для збільшення тривалості життя рекомендується імплантація кардіовертера-дефібрилятора [149].
7. Фармакологічне лікування СН зі зниженою ФВ ЛШ
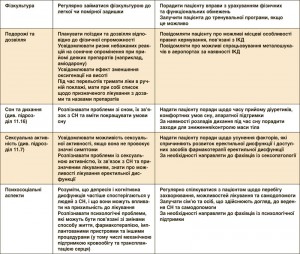
7.1. Цілі лікування СН
Цілями лікування хворих з СН є покращення їхнього клінічного статусу, функціональних можливостей та якості життя, попередження госпіталізацій і зменшення смертності. Продемонстровано, що декілька засобів, розроблених для лікування СН, погіршують довготривалий прогноз, хоча при цьому позитивно впливають на короткочасні сурогатні маркери. Цей факт пояснює, чому регуляторні акти та Рекомендації для клінічної практики, схвалюючи або рекомендуючи ті чи інші лікувальні методи для хворих з СН, базуються на показниках смертності/захворюваності. З іншого боку, зараз зрозуміло, що здатність засобу попереджати госпіталізацію та покращувати функціональні можливості пацієнта з СН можна констатувати лише у разі виключення його негативного впливу на виживаність [159-161].
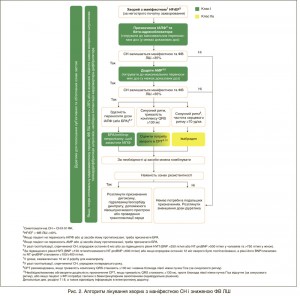
На рисунку 2 продемонстровано стратегію використання лікарських засобів (та пристроїв) у хворих з HFrEF. Рекомендації для кожного з наведених методів лікування узагальнено нижче.
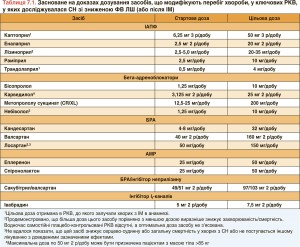
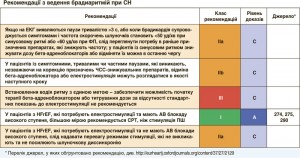
Встановлено, що нейрогормональні антагоністи (ІАПФ, АМР і бета-адреноблокатори) при HFrEF покращують виживаність. Їх рекомендують призначати всім пацієнтам з HFrEF за відсутності протипоказань та поганої толерантності до цих засобів. Згідно з результатами одного клінічного випробування, у якому застосовували жорсткі критерії включення/виключення, нова сполука (LCZ696), що складається з БРА (валсартан) та інгібітора неприлізину (сакубітрил), має переваги перед ІАПФ (еналаприлом) у здатності зменшувати ризик смерті та госпіталізації, спричинених СН [162]. Отже, сакубітрил/валсартан рекомендовано призначати замість ІАПФ амбулаторним хворим з HFrEF, які, попри оптимальну терапію, мають симптоми хвороби. Окрім того, ці пацієнти мають відповідати критеріям, які було застосовано в зазначеному дослідженні. Немає достатніх доказів того, що БРА здатні зменшувати смертність при HFrEF, їх призначення має бути обмежене хворими, які не переносять ІАПФ, або пацієнтами, які приймають ІАПФ, але при цьому не переносять АМР. Івабрадин знижує підвищену частоту серцевих скорочень (ЧСС), що властива HFrEF, а також покращує прогноз. Доцільність призначення цього засобу треба обговорювати у всіх відповідних випадках.
У хворих з ознаками застою наведені вище лікарські засоби треба використовувати у поєднанні з діуретиками. Їх призначення необхідно коригувати залежно від змін у клінічному статусі пацієнта.
Рекомендовані дози препаратів, здатних модифікувати перебіг хвороби, представлено в таблиці 7.1. Рекомендації, наведені в підрозділах 7.5 і 7.6, узагальнюють інформацію щодо препаратів, які при HFrEF не треба приймати або необхідно призначати з обережністю.
7.2. Засоби, рекомендовані для всіх хворих з маніфестною СН зі зниженою ФВ ЛШ
7.2.1. ІАПФ
Показано, що у хворих з HFrEF ІАПФ зменшують смертність та захворюваність [2, 5, 163-165]. Їх призначення рекомендовано всім симптомним хворим, якщо в них відсутні протипоказання і вони толерантні до цих засобів. Щоб досягти належного пригнічення ренін-ангіотензин-альдостеронової системи (РААС), дози ІАПФ мають титруватися до максимально можливих. Доведено, що в реальній практиці більшість хворих отримують субоптимальні дози ІАПФ [166]. Вони також рекомендовані для пацієнтів із безсимптомною систолічною дисфункцією ЛШ, оскільки зменшують ризик розвитку СН, спричиненої нею госпіталізації та смерті (див. розділ 6).
Практичні рекомендації, як саме треба призначати ІАПФ, наведено в таблиці 7.2.
7.2.2. Бета-адреноблокатори
Незалежно від того, чи приймають хворі з маніфестною HFrEF ІАПФ та, у більшості випадків, діуретики, бета-адреноблокатори зменшують у таких пацієнтів смертність і захворюваність [167, 168, 170, 172, 173]. Водночас дія бета-адреноблокаторів у пацієнтів з ознаками застою або декомпенсації не перевірялася. Не існує єдиної точки зору, чи здатні бета-адреноблокатори та ІАПФ до взаємного потенціювання та чи можливе їх сумісне призначення одразу після встановлення діагнозу HFrEF. Також відсутні докази того, що бета-адреноблокатори можливо призначати до призначення ІАПФ [176]. Починати терапію бета-адреноблокаторами можливо з низьких доз і лише у клінічно стабільних хворих. Далі дозу треба поступово титрувати до тієї максимальної, що переноситься пацієнтом. У хворих, госпіталізованих з приводу гострої СН, застережливе лікування бета-адрено-блокаторами необхідно розпочинати в лікарні одразу після стабілізації стану.
Згідно з висновками метааналізу, який залучав індивідуальні дані пацієнтів, що брали участь у всіх великих клінічних випробуваннях бета-адреноблокаторів при HFrEF, ці засоби не мають позитивного впливу на частоту госпіталізацій і смертність серед хворих із загостренням HFrEF [177]. Проте, по-перше, то був лише ретроспективний аналіз у підгрупі, а, по-друге, бета-адреноблокатори не збільшували ризик. Тому експерти, які створювали Рекомендації, вирішили не давати окремих настанов для пацієнтів з різним серцевим ритмом. Бета-блокатори мають розглядатися з метою контролю частоти шлуночкових скорочень (ЧШС) у пацієнтів з HFrEF та ФП, особливо у тих хворих, у яких ЧШС є високою (детальніше див. у підрозділі 10.1).
Бета-адреноблокатори рекомендовані для зниження ризику смерті пацієнтам з ІМ в анамнезі та безсимптомною систолічною дисфункцією ЛШ (див. розділ 6).
Практичні рекомендації, як саме треба призначати бета-адреноблокатори, наведено в таблиці 7.3.
7.2.3. АМР
АМР (спіронолактон і еплеренон) блокують рецептори, які зв’язують альдостерон, а також – з різним ступенем афінності – інші рецептори стероїдних гормонів (наприклад, кортикостероїдів, андрогенів). Спіронолактон або еплеренон рекомендовані всім симптомним хворим (незалежно від того, чи приймають вони ІАПФ і бета-адреноблокатори) з HFrEF і ФВ ЛШ ≤35%. Мета призначення – зменшити смертність та частоту госпіталізацій з приводу СН [174, 175].
Треба бути обережними при застосуванні АМР у хворих з порушеною функцією нирок, а також в осіб, у яких сироватковий рівень калію становить >5,0 ммоль/л. Необхідно періодично перевіряти сироватковий рівень калію та ниркову функцію пацієнта залежно від його клінічного статусу.
Практичні рекомендації, як саме треба призначати АМР, наведено в таблиці 7.4.
7.3. Інші засоби, рекомендовані для окремих категорій хворих з маніфестною СН зі зниженою ФВ ЛШ
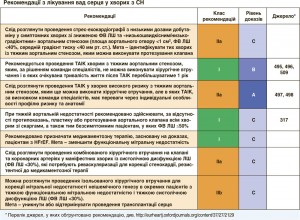
Діуретики рекомендується призначати хворим з HFrEF для корекції застійних явищ. Водночас їх вплив на смертність і захворюваність у РКВ не досліджено. Кокранівський метааналіз продемонстрував, що у хворих з хронічною СН петльові та тіазидні діуретики порівняно з плацебо знижують ризик смерті і погіршення СН, а порівняно з активним контролем покращують здатність виконувати фізичні навантаження [178, 179].
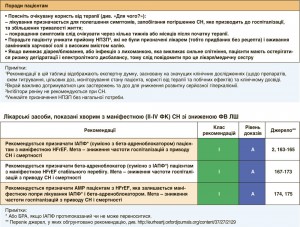
Порівняно з тіазидними діуретиками петльові спричиняють інтенсивніший та коротший діурез, хоча загалом вони діють синергічно, і їх комбінацію можна використовувати при резистентних набряках. З іншого боку, це збільшує імовірність розвитку побічних ефектів, тому таку комбінацію слід використовувати з обережністю. Мета діуретичної терапії полягає в тому, щоб досягти еуволемії, а далі підтримувати її за допомогою найменшої з можливих доз. Доза діуретика впродовж часу має коригуватися залежно від індивідуальних потреб пацієнта. У деяких безсимптомних хворих призначення діуретика може бути (тимчасово) припинено. Пацієнта бажано навчити самостійно коригувати дозу діуретика. Допомогти цьому може спостереження за скаргами/об’єктивними ознаками застою та щоденне вимірювання маси тіла.
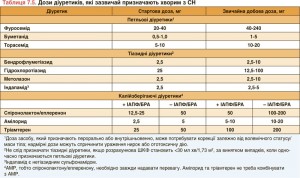
Дози діуретиків, які зазвичай застосовують для лікування СН, наведено в таблиці 7.5. Практичні рекомендації, як саме треба призначати діуретики, представлено в таблиці 7.6.
7.3.2. БРА/інгібітор неприлізину
Розроблено новий клас фармакологічних засобів, які впливають на РАС та систему ендопептидаз (БРА/інгібітор неприлізину). Першим засобом, що належить до цього класу, є LCZ696 – молекула, яка поєднує в собі молекули валсартану та сакубітрилу (інгібітора неприлізину). Інгібування неприлізину затримує деградацію НУП, брадикініну та інших пептидів. Високі рівні циркулюючого НУП типу А (ANP) та BNP потенціюють власні фізіологічні ефекти через зв’язування з рецепторами НУП і стимулювання синтезу цГМФ. Це збільшує діурез та натрійурез, полегшує розслаблення міокарда й опосередковує антиремоделювання. ANP та BNP також пригнічують секрецію реніну й альдостерону. Селективна блокада АТ1-рецепторів зменшує вазоконстрикцію, гіпертрофію міокарда та затримку натрію і води [187, 188].
Нещодавно у клінічному випробуванні досліджували довготривалий вплив сакубітрилу/валсартану порівняно з ІАПФ на захворюваність і смертність у амбулаторних пацієнтів з маніфестною HFrEF. Критеріями включення були ФВ ЛШ ≤40% (упродовж дослідження вона знижувалася до ≤35%); збільшений плазмовий рівень НУП (BNP ≥150 пг/мл чи NT-proBNP ≥600 пг/мл або, якщо хворих госпіталізували з приводу СН протягом попередніх 12 міс, BNP ≥100 пг/мл чи NT-proBNP ≥400 пг/мл); розрахункова ШКФ (рШКФ) ≥30 мл/хв/1,73м2 площі поверхні тіла; здатність переносити окремі періоди лікування еналаприлом (10 мг 2 р/добу) та сакубітрилом/валсартаном (97/103 мг
2 р/добу) [162]. Виявилося, що сакубітрил/валсартан (97/103 мг 2 р/добу) більшою мірою, ніж ІАПФ (еналаприл 10 мг 2 р/добу), знижував серцево-судинну та загальну смертність, а також частоту госпіталізацій, спричинених погіршенням перебігу СН [162]. Отже, пацієнтам з HFrEF, які відповідають критеріям, наведеним вище, рекомендовано приймати сакубітрил/валсартан.
Попри продемонстровані у РКВ PARADIGM-HF переваги сакубітрилу/валсартану перед еналаприлом, залишаються деякі питання стосовно безпеки застосування цього засобу в клінічній практиці. Так, серед осіб віком ≥75 років у групі сакубітрилу/валсартану частіше спостерігали випадки симптомної артеріальної гіпотензії (18% порівняно з 12% у групі еналаприлу), хоча зростання частоти відміни препарату при цьому не зареєстровано [162]. Ризик виникнення ангіоневротичного набряку обмежували тим, що в дослідження включали лише тих хворих, які були толерантні до еналаприлу (в дозі 10 мг 2 р/добу) і сакубітрилу/валсартану впродовж 5-9 тижнів активної початкової фази (завдяки цьому частота ангіоневротичного набряку становила 0,4% у групі сакубітрилу/валсартану та 0,2% у групі еналаприлу). Окрім того, у випробуванні була відносно невелика кількість пацієнтів афроамериканського походження, у яких ризик розвитку ангіоневротичного набряку є вищим. Щоб мінімізувати ризик розвитку такого ускладнення, відміняти ІАПФ треба щонайменше за 36 год до призначення сакубітрилу/валсартану. Комбінована терапія ІАПФ (або БРА) та сакубітрилом/валсартаном протипоказана. Додаткові труднощі пов’язані із впливом на руйнування мозкового бета-амілоїдного пептиду. Теоретично це може прискорювати відкладання амілоїдних депозитів [189-191]. Проте, за даними невеликого 14-денного дослідження, до якого залучали здорових осіб, зростає в основному розчинний бета-амілоїдний протеїн, а не його форма, схильна до агрегації. Якщо ці результати вдасться підтвердити у більш тривалих спостереженнях за хворими з HFrEF, це буде свідчити про безпечність сакубітрилу/валсартану для головного мозку [192]. Отже, треба дослідити довготривалу безпечність зазначеного засобу.
7.3.3. Інгібітор If-каналів Івабрадин уповільнює серцевий ритм, блокуючи If-канали у клітинах синусового вузла. Тому цей препарат можна призначати лише пацієнтам зі збереженим синусовим ритмом. Івабрадин зменшує частоту комбінованої кінцевої точки смертності та госпіталізацій, спричинених СН, у хворих з маніфестною HFrEF і ФВ ЛШ ≤35%, наявністю синусового ритму та ЧСС ≥70 уд/хв, якщо такі пацієнти були госпіталізовані з приводу СН упродовж попередніх 12 міс, отримують у рекомендованих (або максимальних, що можуть переноситися) дозах бета-адреноблокатори, ІАПФ (або БРА) і АМР [180]. Європейська агенція лікарських засобів (ЕМА) схвалила івабрадин для використання у країнах Європи при HFrEF з ФВ ЛШ ≤35% за наявності синусового ритму з частотою ≥75 уд/хв у спокої. Обґрунтовують таке рішення дані ретроспективного підгрупового аналізу, згідно з якими івабрадин покращує виживаність цих хворих.
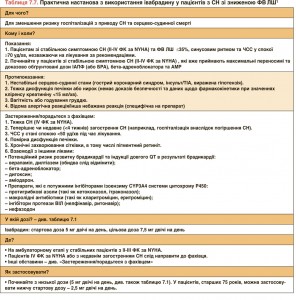
Практичні рекомендації, як саме треба призначати івабрадин, наведено в таблиці 7.7.
7.3.4. БРА
БРА рекомендовано призначати як альтернативний препарат лише тим хворим, які не переносять ІАПФ [182]. Показано, що кандесартан здатний зменшувати серцево-судинну смертність [182]. Валсартан продемонстрував вплив на частоту госпіталізацій, спричинених СН (але не на загальну частоту госпіталізацій), у хворих з HFrEF, які до того отримували ІАПФ [194].
ЕМА вивчала ефекти комбінованого застосування ІАПФ та БРА при HFrEF. Виявилося, що користь від такої терапії переважає ризики тільки у певній підгрупі хворих з HFrEF, які не можуть отримувати інше лікування.Таким чином, БРА як засіб лікування HFrEF показаний лише тим пацієнтам, які не переносять прийом ІАПФ через розвиток у них серйозних побічних ефектів. Призначення комбінації ІАПФ/БРА обмежуєтсья хворими з маніфестною HFrEF, які отримують бета-адреноблокатори, але не переносять АМР. Такі пацієнти мають перебувати під ретельним спостереженням.
7.3.5. Комбінація гідралазину та ізосорбіду динітрату
Однозначних доказів доцільності використання у всіх хворих з HFrEF цієї комбінації лікарських засобів у фіксованих дозах не існує. Позитивні результати були отримані лише в одному відносно невеликому дослідженні, яке проводилося виключно серед чоловіків ще до того, як для терапії СН стали призначати ІАПФ і бета-адреноблокатори [184]. Проте ці докази є недостатніми. Пізніше у РКВ, до якого залучили чорношкірих пацієнтів (нащадків осіб африканського походження), було встановлено, що у хворих з HFrEF III-IV ФК додавання гідралазину/ізосорбіду динітрату до звичайної терапії (ІАПФ, бета-адреноблокаторів і АМР) зменшує смертність та частоту госпіталізацій, спричинених СН. Однак ця рекомендація базується на результатах Veterans Administration Cooperative Study, до якого включали тих пацієнтів з маніфестною HFrEF, які приймали тільки дигоксин і діуретики [184].
7.4. Інші засоби з менш очевидним позитивним впливом на хворих з маніфестною СН зі зниженою ФВ ЛШ
Цей підрозділ присвячено корисним додатковим засобам, які продемонстрували здатність сприяти у пацієнтів з HFrEF симптоматичному покращенню і/або зменшувати частоту госпіталізацій, спричинених СН.
7.4.1. Дигоксин та інші серцеві глікозиди
Доцільність призначення дигоксину можна обговорювати у хворих із синусовим ритмом та маніфестною HFrEF для зниження ризику госпіталізацій (як загальних, так і спричинених СН) [185]. Водночас вплив дигоксину у разі його призначення «поверх» бета-адреноблокаторів ніколи не вивчався. Ефекти дигоксину у пацієнтів з HFrEF та ФП у РКВ ще не досліджували. У нещодавніх роботах у хворих з ФП, які отримують дигоксин, виявлено потенційно вищий ризик випадків (смерть і госпіталізація, спричинена СН) [195, 196]. Проте цей висновок вважається суперечливим, оскільки, за даними іншого нещодавнього метааналізу (залучав результати, отримані не в РКВ), дигоксин не має негативного впливу на смертність у пацієнтів з ФП та супутньою СН, більшість із яких страждають на HFrEF [197].
Для хворих із маніфестною СН і ФП користь дигоксину полягає у його здатності уповільнювати високу частоту шлуночкових скорочень (ЧШС). Проте цей засіб рекомендовано для лікування HFrEF і ФП з високою ЧШС лише в тих випадках, якщо інші терапевтичні засоби призначити неможливо [196, 198-201]. Привертає увагу, що оптимальна частота шлуночкового ритму для пацієнтів з СН і ФП ще не встановлена, хоча превалюють докази, згідно з якими жорсткий контроль ЧСС має негативний вплив. За сучасними поглядами, у спокої рекомендовано підтримувати ЧШС у межах 70-90 уд/хв, хоча в одному випробуванні було встановлено, що ЧШС із частотою до 110 уд/хв може бути ще прийнятним [202]. Ці дані потребують подальшої перевірки.
Пацієнт, який приймає дигіталіс, має перебувати під спостереженням фахівця. Враховуючи розподіл та кліренс цього препарату, слід бути обережним при його призначенні жінкам, особам похилого віку та хворим зі зниженою функцією нирок. В останніх слід віддавати перевагу дигітоксину.
7.4.2. n‑3 поліненасичені жирні кислоти
n‑3 поліненасичені жирні кислоти (n‑3 ПНЖК), за даними масштабного РВК, демонструють невеликий лікувальний ефект [186]. Препарати n‑3 ПНЖК відрізняються один від одного за своїм складом і дозами. Вплив на кумулятивну кінцеву точку серцево-судинних смертності та госпіталізації продемонстрували лише препарати, у яких вміст етилових естерів ейкозапентаєнової (ЕПК) та декозагексаєнової кислот (ДГК) становив не менше 85% (850 мг/г). Препарати, які містять <850 мг/г n‑3 ПНЖК, не мають позитивного впливу ані при HFrEF, ані у пацієнтів, які перенесли ІМ [203]. Можна обговорювати доцільність призначення препаратів n‑3 ПНЖК із вмістом етилових естерів ЕПК і ДГК 850-882 мг у середньому співвідношенні 1,0:1,2 як засобу додаткового лікування у хворих з маніфестною HFrEF, які вже отримують оптимальну рекомендовану терапію ІАПФ (або БРА), бета-адреноблокатором і АМР.
7.5. Засоби, не рекомендовані (з не доведеним позитивним впливом) для хворих із маніфестною СН та зниженою ФВ ЛШ
7.5.1. Інгібітори 3-гідрокси‑3-метилглютарил-коензим А редуктази (статини)
Хоча статини знижують смертність і захворюваність у пацієнтів з хворобами атеросклеротичного генезу, вони не здатні покращувати прогноз при HFrEF. У більшості клінічних випробувань статинів СН була критерієм виключення (оскільки залишалося не визначеним, чи мають статини позитивний вплив) [204]. У 2 масштабних РКВ, у яких вивчалася ефективність статинів при хронічній СН, не вдалося продемонструвати ніякої позитивної дії цих препаратів [205]. Отже, існуючі докази не підтримують необхідність лікування статинами більшості хворих із хронічною СН. Проте у пацієнтів, які вже отримували статини у зв’язку з ІХС і/або гіперліпідемією, має бути розглянуто питання про продовження такої
терапії.
7.5.2. Пероральні антикоагулянти та антитромбоцитарна терапія
За винятком ФП (як при HFrEF, так і при HFрEF), не існує доказів того, що пероральні антикоагулянти зменшують смертність/захворюваність порівняно з плацебо або аспірином [206, 207]. Нині тривають дослідження, у яких вивчаються нові пероральні антикоагулянти, що не є антагоністами вітаміну К, у хворих з HFrEF. Пацієнти з HFrEF, які отримують пероральні антикоагулянти для лікування супутньої ФП або корекції ризику венозної тромбоемболії, мають продовжувати цю терапію. Детальнішу інформацію наведено в підрозділі 10.1.
Також не існує доказів, які б доводили наявність позитивного впливу антитромбоцитарних засобів (у тому числі ацетилсаліцилової кислоти) у хворих з СН без супутньої ІХС. З іншого боку, ці засоби суттєво збільшують ризик шлунково-кишкових кровотеч, зокрема в осіб похилого віку.
7.5.3. Інгібітори реніну
За даними одного дослідження, аліскірен (прямий інгібітор реніну) не здатний покращувати прогноз у хворих, госпіталізованих з приводу СН, ані через 6, ані через 12 міс лікування [208]. Зараз цей препарат не рекомендований для використання замість ІАПФ або БРА.
7.6. Засоби, не рекомендовані (оскільки вважається, що можуть завдати шкоди) для хворих із маніфестною СН зі зниженою ФВ ЛШ
7.6.1. Антагоністи кальцію
Недигідропіридинові антагоністи кальцію не показані для лікування хворих з HFrEF. Було продемонстровано, що дилтіазем і верапаміл у таких хворих небезпечні [214].
Існують різні дигідропіридинові антагоністи кальцію. Відомо, що деякі з них підвищують симпатичний тонус і мають негативний профіль безпечності при HFrEF. Безпечність застосування у цих пацієнтів доведено лише для амлодипіну [215] і фелодипіну [216], які можна призначати тільки за наявності відповідних показань.
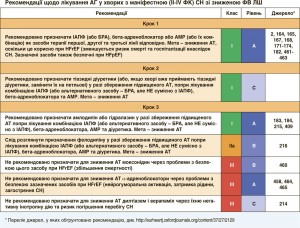
8. Нехірургічні апаратні методи лікування СН зі зниженою ФВ
У цьому розділі представлено рекомендації щодо застосування ІКД та СРТ. На сьогодні визнано недостатніми докази на підтримку інших терапевтичних технологій, таких як активація барорефлексу [217], вагусна стимуляція [218], діафрагмальна стимуляція [219, 220] та модуляція серцевої скоротливості [221, 222]; тому потрібні подальші дослідження. Імплантовані пристрої для моніторування аритмій або параметрів гемодинаміки обговорюються в інших розділах цих рекомендацій.
8.1. Імплантований кардіовертер-дефібрилятор
Значна частина смертей серед хворих на СН, особливо осіб з помірними симптомами, відбувається раптово і несподівано. Багато з них зумовлені електричними розладами, такими як шлуночкові аритмії, брадикардія та асистолія, хоча причиною в деяких випадках є коронарні, церебральні або аортальні судинні події. Методи лікування, які сповільнюють прогресування серцево-судинного захворювання, зменшують річну частоту випадків раптової смерті, але можуть мати незначний ефект на ризик протягом життя й аритмічні події, коли вони відбуваються. ІКД ефективні в попередженні брадикардії та корекції потенційно летальних шлуночкових аритмій. Деякі антиаритмічні препарати здатні зменшувати частоту розвитку тахіаритмій і випадків раптової смерті, але вони не зменшують загальної смертності та можуть її збільшувати.
8.1.1. Вторинна профілактика раптової серцевої смерті
Порівняно з терапією аміодароном ІКД зменшує смертність у хворих, які вижили після зупинки серця, та у пацієнтів, які перенесли стійкі симптомні шлуночкові аритмії. ІКД рекомендується таким хворим, якщо метою є підвищення виживання; під час прийняття рішення про імплантацію слід враховувати думку пацієнтів та якість їх життя, ФВ ЛШ (переваги щодо покращення виживання не встановлені при ФВ ЛШ >35%), а також виключити інші захворювання, які можуть спричинити смерть протягом наступного року [223-225].
8.1.2. Первинна профілактика раптової серцевої смерті
Хоча аміодарон міг зменшувати смертність у ранніх дослідженнях при СН [242, 243], сучасні дослідження, проведені після широкого впровадження терапії бета-адреноблокаторами, демонструють, що цей антиаритмічний засіб не знижує смертність у пацієнтів з HFrEF [227, 244, 245]. Дронедарон [246, 247] та антиаритмічні препарати І класу [246, 248] не слід застосовувати для профілактики аритмій у цій популяції. Деякі рекомендовані засоби терапії, включно з бета-адреноблокаторами, АМР, сакубітрилом/валсартаном та водіями ритму з функцією СРТ (СРT-В), зменшують ризик раптової смерті (див. розділ 7).
ІКД зменшує частоту випадків раптової аритмічної смерті у пацієнтів з HFrEF [249, 250]. У пацієнтів з помірною або тяжкою СН ефект запобігання раптовій смерті може бути частково чи повністю знівельований почастішанням випадків смерті внаслідок погіршення СН [227]. У пацієнтів з м’якою СН (II ФК за NYHA) ІКД здатний запобігти близько двом смертям на рік на кожні 100 імплантованих пристроїв [227]. У середньому пацієнти з ІХС мають вищий ризик раптової смерті, ніж пацієнти з ДКМП, і тому, хоча відносні переваги схожі, абсолютна користь більша в пацієнтів з ІХС [249]. Пацієнти з більшою тривалістю комплексу QRS також можуть отримати більшу користь від ІКД, але цим пацієнтам часто показана СРТ [227, 251].
Два РКВ не продемонстрували користі в пацієнтів, яким було імплантовано ІКД протягом 40 днів після ІМ [158, 228]. Хоча кількість раптових аритмічних смертей зменшилася, на противагу цьому зросла частота випадків не аритмічної смерті. Відповідно, ІКД протипоказані в цей період. Зовнішній портативний дефібрилятор може бути запропонований, якщо ризик виникнення фібриляції шлуночків у пацієнта вважається високим, однак на підтримку цього бракує доказів, отриманих у рандомізованих дослідженнях [239-241].
Імплантація ІКД рекомендується лише після адекватної спроби (щонайменше 3 міс) оптимальної медикаментозної терапії (ОМТ), якщо вона не забезпечила збільшення ФВ ЛШ до показників >35%. Однак в одному з двох визначних досліджень, на яких базуються ці рекомендації, брали участь пацієнти з ФВ ЛШ >30%. Менше ніж 400 пацієнтів з ФВ ЛШ 30-35% були залучені до цих визначних досліджень, і хоча в них не виявлено статистичної взаємодії між лікувальними ефектами та ФВ ЛШ, докази користі є менш надійними у цій групі пацієнтів.
Консервативне програмування з довгими затримками між розпізнаванням ритму та дією ІКД [252] драматично зменшує ризик як невідповідних (унаслідок артефактів або ФП), так і відповідних, але непотрібних (при шлуночковій тахікардії, що сама по собі переривається) спрацювань дефібрилятора [252-254].
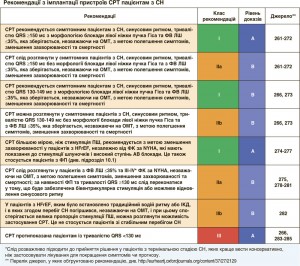
У пацієнтів з тривалістю QRS ≥130 мс доцільніше розглянути можливість встановлення дефібрилятора з функцією СРТ (СРТ-Д), ніж ІКД. За детальнішою інформацією зверніться до рекомендацій з СРТ (підрозділ 8.2).
ІКД не рекомендується пацієнтам IV ФК за NYHA з тяжкими симптомами, стійкими до фармакотерапії, які не є кандидатами на СРТ, встановлення пристроїв допомоги шлуночкам або трансплантацію серця, оскільки у таких пацієнтів очікувана тривалість життя є дуже обмеженою і вони, імовірно, помруть від насосної недостатності.
У пацієнтів із серйозними коморбідними захворюваннями, очікувана тривалість життя яких не набагато перевищує один рік, також малоймовірна користь від застосування ІКД [229-233].
Пацієнтів слід проконсультувати щодо мети встановлення ІКД, ускладнень, пов’язаних з імплантацією та активацією пристрою (особливо щодо невідповідних шоків), а також стосовно обставин, за яких пристрій може бути деактивований (термінальна стадія захворювання) чи вилучений (інфекція, відновлення функції ЛШ) [255].
Якщо перебіг СН погіршується, питання про деактивацію ІКД може розглядатися після належного обговорення з пацієнтом та опікуном (опікунами).
Якщо генератор ІКД вичерпав свій ресурс або потребує вилучення, не слід автоматично виконувати заміну [234-238]. Пацієнт має бути ретельно обстежений досвідченим кардіологом перед заміною генератора. Цілі лікування за цей час могли змінитися, ризик фатальної аритмії міг зменшитися, а ризик не аритмічної смерті – збільшитися. Дещо суперечливим є питання, чи потребують імплантації наступного пристрою пацієнти, у яких ФВ ЛШ значно покращилася, і які не потребували апаратної терапії за весь термін служби ІКД [234-238].
Підшкірні дефібрилятори можуть бути так само ефективні, як і традиційні ІКД, але асоціюватися з меншим ризиком процедури імплантації [256, 257]. Їхні переваги можуть бути корисними у пацієнтів з утрудненим доступом або в тих, що потребують вилучення ІКД через інфекцію. Пацієнти повинні бути ретельно відібрані для застосування цього типу пристроїв, оскільки вони мають обмежену здатність впливати на серйозну брадиаритмію, не спроможні до ведення ритму при тахікардії і у них відсутня функція СРТ. Очікуються результати серйозних РКВ цих пристроїв, які нададуть більше даних про їхню безпечність та ефективність [258, 259].
Портативний ІКД (зовнішній дефібрилятор з електродами, закріпленими на вдягнутому жилеті), що здатний розпізнавати і переривати шлуночкову тахікардію (ШТ)/фібриляцію шлуночків, може бути запропонований на обмежений термін деяким пацієнтам з СН та високим ризиком раптової смерті, які не підходять для імплантації ІКД (наприклад, пацієнтам з низькою ФВ ЛШ після гострого ураження міокарда доти, доки не відновиться функція ЛШ; пацієнтам, які очікують на пересадку серця) [239-241, 260]. Однак проспективних РКВ, у яких вивчався б цей пристрій, не опубліковано.
За детальними рекомендаціями щодо застосування та показань до встановлення ІКД звертайтеся до рекомендацій ЄТК/Європейської асоціації серцевого ритму (EHRA) з шлуночкових тахіаритмій та раптової серцевої смерті [260].
8.2. Серцева ресинхронізуюча терапія
СРТ покращує функцію серця у правильно відібраних пацієнтів, полегшує симптоми [286], покращує самопочуття [286] і зменшує захворюваність та смертність [266]. За покращенням показника років якісного життя (QALYs) при застосуванні СРТ у пацієнтів з помірною-тяжкою СН дві третини хворих можна віднести до категорії покращення якості життя, а одну третину – до категорії подовження тривалості життя [287].
Лише в дослідженнях COMPANION [265] та CARE-HF [262, 263] порівнювали ефекти від застосування СРТ та медикаментозної терапії, яка проводилася згідно з рекомендаціями. У більшості інших досліджень порівнювалися СРТ-Д (дефібрилятори з функцією СРТ) та ІКД, а в деяких порівнювалися СРТ-В (водії ритму з функцією СРТ) з резервною стимуляцією. Запобігання летальній брадикардії може бути важливим корисним механізмом, який є спільним для всіх стимулюючих пристроїв. На початку дослідження CARE-HF 25% пацієнтів мали серцевий ритм спокою ≤60 уд/хв [262-264]. Якщо запобігання брадикардії важливе, ефект СРТ здаватиметься більшим у дослідженнях без апаратної терапії в контрольній групі.
У більшості досліджень СРТ критерієм включення була ФВ ЛШ <35%, проте в дослідження RAFT [267] та MADIT-CRT [268, 269] включали хворих з ФВ ЛШ <30%, тоді як у дослідження REVERSE [270-272] – <40%, BLOCK-HF [274] – <50%. Було рандомізовано відносно невелику кількість пацієнтів з ФВ ЛШ 35-40%, але метааналіз індивідуальних даних учасників не виявив зменшення ефекту СРТ у цій групі [266].
Не всі пацієнти добре відповідають на СРТ [286]. За деякими характеристиками можна передбачити покращення показників захворюваності та смертності, ступінь зворотного ремоделювання є одним із таких показників, і це найважливіший механізм дії СРТ. У пацієнтів з ішемічною етіологією не слід очікувати значного покращення функції ЛШ через рубцеві зміни міокарда, сприятливе ремоделювання яких є малоймовірним [288]. Жінки можуть відповідати на терапію краще, ніж чоловіки, можливо, через менші розміри тіла та серця [273, 285, 289]. Ширина комплексу QRS є предиктором відповіді на СРТ і слугувала критерієм включення в усіх рандомізованих дослідженнях. Але морфологія QRS також була пов’язана зі сприятливим ефектом СРТ. Деякі дослідження показали, що пацієнти з морфологією блокади лівої ніжки пучка Гіса схильні краще відповідати на СРТ, тоді як у пацієнтів без морфології блокади лівої ніжки пучка Гіса результати не такі переконливі. Проте пацієнти з морфологією блокади лівої ніжки пучка Гіса часто мають більшу тривалість QRS, і нині точаться дебати навколо питання, який із показників – тривалість чи морфологія QRS – є головним предиктором сприятливої відповіді на СРТ. Докази, отримані у двох метааналізах індивідуальних даних учасників досліджень, вказують на те, що після врахування тривалості QRS недостатньо підстав вважати морфологію QRS чи етіологію захворювання надійними предикторами впливу СРТ на захворюваність та смертність [266, 273]. Крім того, в жодному з визначних досліджень пацієнтів не відбирали за морфологією QRS, статтю чи ішемічною етіологією, і жодне з досліджень не мало достатньої статистичної потужності для підгрупових аналізів.
Результати дослідження Echo-CRT [283, 284] та метааналізу індивідуальних даних учасників [266] свідчать про можливу шкоду від СРТ при тривалості QRS <130 мс, тому імплантація пристрою СРТ не рекомендується в цієї категорії хворих [266, 283, 284].
Якщо пацієнту показано встановлення ІКД і він має синусовий ритм із тривалістю QRS ≥130 мс, то можливість імплантації СРТ-Д має бути розглянута при QRS 130-149 мс і рекомендується при QRS ≥150 мс. Однак якщо головною метою імплантації СРТ є полегшення симптомів, клініцист може обирати між СРТ-В і СРТ-Д, залежно від того, який із цих пристроїв він вважатиме найбільш відповідним. Клінічна практика в різних країнах суттєво відрізняється. Єдине рандомізоване дослідження, в якому порівнювалися СРТ-В та СРТ-Д [265], не продемонструвало відмінностей показників захворюваності та смертності при застосуванні зазначених технологій [288]. Якщо первинною метою імплантації СРТ є покращення прогнозу, то більшість доказів свідчать на користь застосування СРТ-Д у пацієнтів II ФК за NYHA і СРТ-В у пацієнтів III-IV ФК. Не ясно, чи зменшує СРТ потребу в ІКД (за рахунок зменшення тягаря аритмії) та чи збільшує користь від ІКД (зменшуючи рівні смертності внаслідок погіршення СН, що призводить до збільшення періоду життя з ризиком розвитку аритмії).
В умовах зниженої ФВ ЛШ стимуляція ПШ може загострити серцеву диссинхронію. Цьому може запобігти СРТ, яка здатна покращувати прогноз пацієнта [274, 275, 277, 290]. Проте різниці між наслідками лікування не спостерігалося при застосуванні СРТ або стимуляції ПШ за даними підгрупового аналізу дослідження RAFT [267] та у пацієнтів без HFrEF у дослідженні BioPACE [291]. З урахуванням усіх доказів СРТ більшою мірою, ніж стимуляція ПШ, рекомендується до застосування у пацієнтів з HFrEF з метою зменшення захворюваності незалежно від ФК за NYHA, якщо вони мають показання до шлуночкової стимуляції, хоча чіткого впливу на смертність не спостерігалося. У пацієнтів з HFrEF, яким було встановлено традиційний водій ритму або ІКД, і в яких згодом перебіг СН погіршився з великим відсотком стимуляції ПШ, незважаючи на проведення ОМТ, слід розглянути можливість вдосконалення стимуляції із застосуванням СРТ.
Тільки у двох невеликих дослідженнях порівнювали ефекти від лише фармакотерапії та СРТ у пацієнтів з ФП, і отримали неоднозначні результати. Деякі дослідження вказують на перевагу СРТ над стимуляцією ПШ у пацієнтів, які підлягають абляції атріовентрикулярного вузла [275, 277, 290]. Однак СРТ не є показанням для здійснення абляції АВ вузла, за винятком рідкісних випадків, коли ЧШС залишається постійно високою (>110 уд/хв), незважаючи на спроби фармакологічного контролю частоти. Аналіз результатів дослідження RAFT у підгрупі пацієнтів з ФП не виявив користі від СРТ-Д порівняно з ІКД, хоча слід зазначити, що менше ніж у половини пацієнтів досягалося >90% бівентрикулярного захоплення [276]. Обсерваційні дослідження встановили, що при бівентрикулярному захопленні <98% прогноз пацієнтів з СРТ погіршується [277]. Не зовсім ясно, що відображає ця асоціація – втрату ресинхронізації (на що можна вплинути шляхом програмування пристрою), неналежне встановлення електрода в ЛШ (чого можна уникнути під час імплантації) чи більшу складність стимуляції значно зміненого хворобою міокарда (що не піддається корекції за допомогою вищезгаданих заходів). Це спостереження не було підтверджено у рандомізованому дослідженні.
Досі не підтверджено цінності візуалізаційних тестів на диссинхронію під час відбору пацієнтів на СРТ [292]. У пацієнтів з великими розмірами міокардіального рубця важче досягнути покращення функції ЛШ при застосуванні СРТ, але це справедливодля будь-якого лікування HFrEF і не обов’язково свідчить про меншу клінічну користь [293]. Пороги стимуляції є вищими у рубцево зміненому міокарді, і при встановленні електрода за можливості слід уникати цих ділянок [294, 295]. Хоча пацієнти з великим рубцем у дійсності мають гірший прогноз, бракує доказів того, що вони отримують менше користі від СРТ [266].
За рекомендаціями щодо процедури імплантації пристроїв звертайтеся до відповідних документів зі стимуляції та СРТ. Цінність спроб оптимізації АВ чи ВВ інтервалів після імплантації з використанням ехо- або електрокардіографічних критеріїв чи змін АТ не визначено, але такі спроби можна розглядати у пацієнтів з недостатнім ефектом СРТ [296, 297].
8.3. Інші імплантовані електричні пристрої
Для пацієнтів з HFrEF, які залишаються симптомними, незважаючи на ОМТ, і не мають показань до СРТ, запропоновано нові засоби апаратної терапії, які в деяких випадках затверджені для клінічного застосування у кількох країнах Європейського Союзу, але триває їх вивчення у дослідженнях.
Модуляція серцевої скоротливості (МСС) схожа за принципом на СРТ, але включає не збуджуючу електричну стимуляцію шлуночка під час абсолютного рефрактерного періоду для підвищення скоротливої продуктивності міокарда без активації екстрасистолічних скорочень. МСС вивчалася у пацієнтів з HFrEF II-III ФК за NYHA та нормальною тривалістю QRS (<120 мс) [221, 222]. Метааналіз індивідуальних даних учасників дослідження виявив підвищення толерантності до навантажень (за піковим споживанням кисню) і якості життя (за Міннесотським опитувальником життя з СН). Таким чином, МСС можна розглядати як терапевтичну опцію в окремих пацієнтів з СН. Залишається встановити вплив МСС на захворюваність та смертність при СН.
У більшості інших пристроїв, які наразі вивчаються, використовується принцип модифікації активності автономної нервової системи шляхом цілеспрямованої електричної стимуляції [298, 299]. Ці підходи включають стимуляцію блукаючого нерва, стимуляцію спинного мозку, абляцію каротидного вузла та денервацію нирок, проте жоден з пристроїв не покращував симптоми чи прогноз у РКВ.
Пристрої для дистанційного моніторування обговорюються в розділі 14.
9. Лікування СН зі збереженою ФВ
У той час як існує чітка погодженість, що діагностичним критерієм HFrEF є ФВ ЛШ <40%, немає точного визначення HFpEF. Відповідно до визначення, яке надано в цьому документі (див. розділ 3), для постановки діагнозу HFpEF необхідно, щоб ФВ ЛШ становила ≥50%, а пацієнтів із ФВ ЛШ між 40 та 49% слід відносити до категорії HFmrEF (СН із середньою (mid-range) ФВ, деталі викладено в розділі 3). Пацієнти з HFmrEF здебільшого включалися до досліджень HFpEF. Відповідно, рекомендації, викладені в цьому розділі, можна застосовувати до пацієнтів з HFmrEF та HFpEF. Оскільки з’являються нові дані та результати аналізів, зрештою, стане можливим розробити окремі рекомендації для кожного з фенотипів.
У клінічній практиці та клінічних дослідженнях дещо менша частка пацієнтів з HFpEF та HFmrEF порівняно з пацієнтами з HFrEF отримувала діуретики, бета-адреноблокатори, АМР та ІАПФ або БРА [166, 300-302]. Це може відображати лікування коморбідних серцево-судинних захворювань, таких як гіпертензія, ІХС та ФП, або екстраполяцію результатів досліджень у хворих з відповідними станами, у яких показано зменшення частоти нових випадків СН [127], або неспроможність розрізнити рекомендації для HFrEF та HFmrEF/HFpEF, або переконаність у тому, що у клінічних дослідженнях доведені переваги від застосування цих препаратів.
Патофізіологія HFpEF та HFmrEF є гетерогенною, і вони асоційовані з різними фенотипами, які включають різноманітні супутні серцево-судинні захворювання (такі як ФП, АГ, ІХС, легенева гіпертензія) та не серцево-судинні захворювання (діабет, хронічну хворобу нирок – ХХН, анемію, дефіцит заліза, ХОЗЛ та ожиріння) [303, 304]. Порівняно з пацієнтами з HFrEF госпіталізації і смерті серед пацієнтів з HFmrEF/HFpEF, імовірно, частіше зумовлені не серцево-судинними причинами [305, 306]. Тому необхідно проводити скринінг на серцево-судинні та не серцево-судинні коморбідності та в разі їх виявлення застосовувати лікувальні стратегії, які доведено покращують симптоми, самопочуття або прогноз і при цьому не загострюють перебіг СН (див. розділ 11).
До цього часу не було переконливо доведено ефективність жодного лікування щодо зменшення захворюваності або смертності серед пацієнтів з HFpEF або HFmrEF. Проте оскільки ці пацієнти здебільшого похилого віку, мають виражені симптоми та часто низьку якість життя [307], важливими цілями терапії можуть бути полегшення симптомів та покращення самопочуття [308].
9.1. Вплив лікування на симптоми СН зі збереженою ФВ
Діуретики завжди зменшують застійні явища, якщо вони присутні, і таким чином полегшують симптоми СН. Позитивний вплив діуретиків на симптоми доведено в усьому спектрі ФВ ЛШ [178, 179].
Бракує доказів позитивного впливу на симптоми для бета-адреноблокаторів та АМР в цієї категорії пацієнтів. Суперечливими є докази покращення симптомів у пацієнтів, які приймали БРА (лише для кандесартану показано покращення ФК за NYHA) [309, 310], а також ІАПФ [311].
9.2. Вплив лікування на госпіталізації з приводу СН при СН зі збереженою ФВ
У пацієнтів із синусовим ритмом отримано деякі докази того, що небіволол [173, 312, 313], дигоксин [314], спіронолактон [301] та кандесартан [310] можуть зменшувати частоту госпіталізацій з приводу СН. У пацієнтів з ФП бета-адреноблокатори не продемонстрували ефективності, а дигоксин не вивчався. Докази на підтримку БРА [315] чи ІАПФ [311] непереконливі.
9.3. Вплив лікування на смертність при СН зі збереженою ФВ
У жодному з досліджень ІАПФ, БРА, бета-адреноблокатори та АМР не зменшували смертність серед хворих з HFpEF або HFmrEF. Однак у старших пацієнтів з HFrEF, HFpEF або HFmrEF небіволол зменшував частоту настання комбінованої кінцевої точки, яка включала смерть або серцево-судинну госпіталізацію [173, 312], без достовірного взаємозв’язку між лікувальним ефектом та початковою ФВ ЛШ [313].
9.4. Інші міркування
Пацієнти з ФП мають отримувати антикоагулянт для зменшення ризику тромбоемболічних подій (детальніше див. в рекомендаціях ЄТК з ФП [316]). Антитромбоцитарні засоби з цією метою не ефективні. Ниркова дисфункція, яка є досить поширеною в цій популяції, може стати протипоказанням або підвищувати ризик кровотечі під час прийому нових пероральних антикоагулянтів (NOAC).

Оптимальна ЧШС у пацієнтів з HFmrEF/HFpEF та ФП не встановлена, і агресивний контроль частоти може бути шкідливим. Також не встановлено, яким препаратам (дигоксин, бета-адреноблокатори або антагоністи кальцію, що знижують ЧСС) чи їх комбінаціям слід надавати перевагу. Верапаміл або дилтіазем не слід поєднувати з бета-адреноблокатором. Недостатньо даних, щоб рекомендувати стратегії абляції (легеневих вен чи АВ вузла) при HFpEF чи HFmrEF.
Деякі докази свідчать про важливість лікування гіпертензії, яка здебільшого є систолічною, у хворих з HFmrEF/HFpEF [127, 317]. Прийнятними для цього засобами вважаються ІАПФ, БРА та АМР, але бета-адреноблокатори можуть менш ефективно знижувати систолічний АТ. У нещодавньому дослідженні показано, що пацієнтам з гіпертензією та HFpEF або HFmrEF не слід призначати БРА (олмесартан), якщо вони отримують ІАПФ або бета-адреноблокатор [318].
В якості орального гіпоглікемічного препарату першої лінії пацієнтам з HFpEF та HFmrEF слід призначати метформін [319] (також див. підрозділ 11.6). У нещодавньому дослідженні емпагліфлозину показано зниження АТ і зменшення маси тіла, імовірно, за рахунок індукованої глюкозурії та осмотичного діурезу. Застосування препарату асоціювалося зі зменшенням частоти госпіталізацій з приводу СН і серцево-судинної смертності [130]. Проте агресивне лікування дисглікемії може бути шкідливим [153, 320].
Ішемія міокарда може додатково зумовлювати симптоми, захворюваність та смертність, і її слід враховувати під час обстеження пацієнтів. Проте є лише окремі спостереження, які доводять, що реваскуляризація покращує симптоми чи прогноз. Пацієнтів зі стенокардією слід вести за тими самими принципами, що й пацієнтів з HFrEF [112].
Пацієнти з HFpEF та HFmrEF мають знижену толерантність до навантажень, яка зазвичай поєднується з посиленою відповіддю АТ на навантаження та хронотропною недостатністю. Комбіноване тренування на витривалість/стійкість видається безпечним для пацієнтів з HFpEF та HFmrEF і покращує фізичну продуктивність (що відображає підвищене споживання кисню), функціонування та діастолічну функцію [307, 321].
10. Аритмії та розлади провідності
Амбулаторне електрокардіографічне моніторування можна застосовувати для дослідження симптомів, які, імовірно, зумовлені аритміями [322-324], проте існує недостатньо доказів на підтримку рутинного систематичного моніторування в усіх пацієнтів з СН для діагностики тахі- та брадиаритмій. Не доведено, що клінічні рішення, прийняті на підставі даних рутинного амбулаторного електрокардіографічного моніторування, покращують результати лікування хворих на СН.
Амбулаторний запис ЕКГ виявляє передчасні шлуночкові комплекси практично в усіх пацієнтів з СН. Поширеними є епізоди асимптомних нестійких ШТ, частота яких збільшується разом з наростанням тяжкості СН і шлуночкової дисфункції, вказуючи на несприятливий прогноз, але вони майже не становлять цінності для розрізнення прогнозу раптової смерті чи смерті внаслідок прогресування СН [316, 325]. Брадикардія і паузи також часто спостерігаються, особливо вночі, коли парасимпатична активність переважає над симпатичною; апное уві сні може бути пусковим чинником [326-328]. Паузи асоціюються з несприятливим прогнозом у пацієнтів з ІХС та дисфункцією ЛШ [329]. Брадиаритмії можуть робити вагомий внесок у механізми раптової смерті при СН [330].
10.1. Фібриляція передсердь
ФП є найпоширенішою аритмією при СН, незалежно від значень ФВ ЛШ; вона підвищує ризик тромбоемболічних ускладнень (особливо інсульту) і може порушувати функцію серця, призводячи до погіршення симптомів СН [316]. Вторинна СН, викликана ФП, має набагато сприятливіший прогноз [331], але ФП, що вперше розвивається у пацієнта зі встановленим діагнозом СН, асоціюється з гіршим прогнозом, імовірно, за рахунок того, що вказує на більш тяжкий стан пацієнта і одночасно порушує серцеву функцію [332, 333].
Пацієнти з хронічною СН та постійною ФП мають гірший прогноз, ніж особи із синусовим ритмом, хоча це здебільшого пояснюється старшим віком та тяжкістю СН [332, 333]. Персистуюча ЧШС >150 уд/хв може зумовити HFrEF, яка отримує зворотний розвиток після досягнення контролю частоти або відновлення ритму («тахікардіоміопатія») [334, 335]. ФП слід класифікувати та вести відповідно до існуючих рекомендацій (уперше діагностований епізод, пароксизмальна, персистуюча, тривало персистуюча чи постійна), враховуючи те, що не завжди можна визначити дійсну тривалість епізоду, а також можливість виникнення в минулому нерозпізнаних епізодів [316].
Наступні заходи слід здійснити у пацієнтів з СН та ФП, незалежно від ФВ ЛШ, особливо при вперше діагностованому епізоді ФП або пароксизмальній ФП [316]:
– ідентифікувати причини, які можуть піддаватися корекції (такі як гіпотиреоз чи гіпертиреоз, електролітні розлади, неконтрольована гіпертензія, патологія мітрального клапана), а також провокуючих факторів (таких як недавно перенесена операція, легенева інфекція або загострення ХОЗЛ/астми, гостра ішемія міокарда, зловживання алкоголем), оскільки це може визначати стратегію ведення;
– оцінити ризик розвитку інсульту і потребу в антикоагуляції;
– оцінити частоту скорочень шлуночків і потребу в контролі частоти;
– оцінити симптоми СН та ФП.
За деталізованою інформацією звертайтеся до рекомендацій ЄТК 2016 р. з ведення ФП [316].
10.1.1. Профілактика ФП у пацієнтів з СН
Багато засобів терапії СН, включно з ІАПФ [336], БРА [337], бета-адреноблокаторами [177, 338] та АМР [339, 340] знижують частоту розвитку ФП, але івабрадин може її підвищувати [341]. СРТ мало впливає на частоту розвитку ФП [342]. Аміодарон зменшує частоту розвитку ФП, індукує фармакологічну кардіоверсію, сприяє збереженню синусового ритму після кардіоверсії та може застосовуватися для контролю симптомів у пацієнтів з пароксизмальною ФП при недостатній ефективності бета-адреноблокаторів [343-346]. Застосування аміодарону слід обмежувати короткими термінами (<6 міс) у пацієнтів з пароксизмальною чи персистуючою ФП у якості допомоги в підтримці синусового ритму і для зменшення високої імовірності рецидивів ФП одразу після кардіоверсії. Дронедарон протипоказаний у пацієнтів з СН та ФП [246, 247, 347].
10.1.2. Ведення ФП, що вперше розвинулася, у пацієнтів з СН
За відсутності у пацієнта обтяжливих симптомів СН можна починати лікування пероральними бета-адреноблокаторами з метою контролю ЧШС. У пацієнтів з вираженим застоєм, але незначним тягарем симптомів у стані спокою слід надавати перевагу початковій терапії пероральним або внутрішньовенним дигоксином. Гемодинамічно нестабільним пацієнтам слід призначити внутрішньовенно болюсно дигоксин або аміодарон [348, 349] через периферійну вену з посиленими заходами безпеки для запобігання екстравазальному проникненню препарату в тканини; у разі сумнівів щодо венозного доступу не можна застосовувати аміодарон. Більш тривале інфузійне введення аміодарону слід здійснювати лише через центральний або постійний венозний доступ для запобігання флебіту периферичних вен. Пацієнтам з різким падінням гемодинаміки рекомендується невідкладна електрична кардіоверсія (див. також розділ 12).
10.1.3. Контроль ЧШС
Оцінка контролю ЧШС за пульсом на променевій артерії не ідеальна, особливо у пацієнтів з СН, оскільки активація шлуночків не завжди генерує пульсову хвилю, яку можна виявити при пальпації. Контроль частоти має бути задокументований електрокардіографічно. Портативний пристрій дає змогу оцінювати частоту скорочень шлуночків у стані спокою, під час навантажень та уві сні, але цінність рутинного моніторування не встановлено. Імплантовані пристрої, такі як водії ритму, СРТ або ІКД, також можуть надавати інформацію про частоту скорочень шлуночків.
Оптимальна ЧШС у стані спокою для пацієнтів з ФП та СН не встановлена, але може перебувати в межах 60-100 уд/хв [350, 352-354]. Результати одного дослідження вказують на те, що частота у стані спокою до 110 уд/хв також може бути прийнятною [198, 202], і в рекомендаціях ЄТК з ФП (2016) саме це порогове значення пропонується як цільове при терапії, спрямованій на контроль частоти [316]. Однак наша робоча група вважає, що для пацієнтів з СН нижча частота (60-100 уд/хв) може бути більш прийнятною. Частота <70 уд/хв асоціюється з гіршим прогнозом [351]. Це може пояснювати, чому бета-адреноблокатори, титровані до цільових доз, не спроможні зменшити захворюваність або смертність у пацієнтів з HFrEF та ФП [177], а також може пояснювати зв’язок між прийомом дигоксину та несприятливими наслідками за даними деяких обсерваційних досліджень при ФП [355-357]. Оптимальна ЧШС при навантаженні також не з’ясована, але може становити <110 уд/хв під час легкого навантаження [354]. Бета-адреноблокатори, дигоксин або їх комбінація можуть застосовуватися для контролю ЧШС [358]. Не визначено, який із підходів є оптимальним, але бета-адреноблокатори видаються безпечними у якості препаратів першої лінії, навіть якщо не з’ясовано, чи зменшують вони захворюваність та смертність у пацієнтів с ФП. Бета-адреноблокатори знижують ЧШС в періоди активності, а дигоксин чинить більший ефект уночі [358]. Постійно висока частота може вказувати на тиреотоксикоз або надмірну симпатичну активність унаслідок застою, що можна коригувати діурезом. Хоча аміодарон та недигідропіридинові антагоністи кальцію можуть знижувати ЧШС, вони мають більшу кількість побічних ефектів, тому загалом слід уникати їх призначення у пацієнтів з HFrEF, і з меншою впевненістю – у пацієнтів з HFpEF та HFmrEF. У рідкісних випадках не вдається досягнути ЧШС <100-110 уд/хв за допомогою лише фармакотерапії; у такому разі можна розглянути можливість виконання абляції АВ вузла та встановлення водія ритму шлуночків. У цій ситуації у пацієнтів з HFrEF слід розглядати можливість імплантації СРТ замість традиційного водія ритму. Наразі існує недостатньо доказів, окрім тих, що отримані з реєстрів, на підтримку стратегії абляції АВ вузла і СРТ порівняно з лише фармакотерапією у пацієнтів з ФП і ЧШСу спокої <100-110 уд/хв (див. розділ 8.2) [281]. Однак у пацієнтів з високою ЧШС та стійкими до терапії симптомами можна розглядати можливість АВ абляції. Також у разі наявності показань до імплантації ІКД абляція АВ вузла зі встановленням СРТ-Д може бути переважною опцією, особливо якщо пацієнт має симптоми від помірних до тяжких.
10.1.4. Контроль ритму
У пацієнтів із хронічною СН стратегія контролю ритму (включаючи фармакологічну чи електричну кардіоверсію) не продемонструвала переваги над стратегією контролю частоти щодо зменшення смертності чи захворюваності [359]. Невідкладна кардіоверсія показана лише в тому разі, якщо ФП загрожує життю, за інших обставин слід прагнути досягти контролю і над СН, і над ЧШС перед тим, як виконувати кардіоверсію. Стратегію контролю ритму, імовірно, слід краще залишити в резерві для пацієнтів зі зворотними вторинними причинами ФП (наприклад, з гіпертиреозом) або з очевидними провокуючими факторами (наприклад, з недавно перенесеною пневмонією) та для пацієнтів з обтяжливими симптомами, зумовленими ФП, після оптимізації контролю частоти й терапії СН. Застосування антиаритмічних препаратів I класу та дронедарону підвищує захворюваність і смертність серед пацієнтів з СН та ФП, тому їх призначення слід уникати [246, 247, 347]. Аміодарон дає змогу в деяких пацієнтів із хронічною ФП відновити синусовий ритм, може пригнічувати симптомні пароксизми ФП та допомагає утримувати синусовий ритм після спонтанної чи електричної кардіоверсії [343-346]. Під час лікування аміодароном слід регулярно переглядати й підтверджувати потребу у продовженні терапії.
Безпечність та ефективність катетерної абляції передсердь і легеневих вен у якості стратегії контролю ритму при СН наразі не встановлені, за винятком випадків кардіоміопатії, індукованої тахікардією [316]. В одному невеликому дослідженні продемонстровано перевагу абляції ФП над абляцією АВ вузла та СРТ [360]. Інше дослідження, у якому брали участь 203 пацієнти з персистуючою ФП, СН та встановленими ІКД чи СРТ, показало, що абляція ФП була ефективнішою порівняно з аміодароном щодо корекції ФП, і це асоціювалося з меншою частотою госпіталізацій з приводу СН та нижчою смертністю. У двох невеликих дослідженнях абляції ФП порівняно з контролем частоти отримано суперечливі результати щодо ускладнень від процедур та успіху у покращенні симптомів [278, 279]. В останньому метааналізі на основі даних 914 пацієнтів продемонстровано обнадійливу успішність абляції легеневих вен при ФП у пацієнтів з дисфункцією ЛШ, що супроводжувалося покращенням ФВ ЛШ та функціональної спроможності [361]. Ці результати потребують підтвердження у РКВ, які наразі тривають, таких як CASTLE AF [362], AMICA та CABANA.
10.1.5. Профілактика тромбоемболізму
Пацієнти з СН та ФП здебільшого повинні отримувати антикоагулянтну терапію, і у них слід оцінити співвідношення користі і ризику кровотеч (користуючись шкалами CHA2DS2-VASc та HAS-BLED, детальніше див. таблиці 10.1 і 10.2) відповідно до рекомендацій ЄТК з ФП [316]. У значної частини пацієнтів з СН обидві оцінки – користі і ризику – становитимуть ≥3 балів, тому слід розважливо ухвалювати рішення про призначення їм орального антикоагулянта та регулярно переглядати потребу в продовженні терапії (а також здійснювати вплив на фактори ризику, які піддаються корекції), якщо оральний антикоагулянт був призначений.
Нові пероральні антикоагулянти (NOAC) мають перевагу у пацієнтів з СН та неклапанною ФП, оскільки NOAC порівняно з антагоністами вітаміну К забезпечують принаймні подібну ефективність і навіть є безпечнішими (викликають меншу кількість внутрішньочерепних крововиливів) у хворих з СН, ніж у пацієнтів без СН [316, 366, 367], хоча існують сумніви щодо їх безпечності в осіб старшого віку з СН та зниженою функцією нирок [368, 369] (детальніший опис взаємодій між NOAC і нирковою функцією надано у відповідних рекомендаціях [370]). У пацієнтів з СН та ФП, які мають механічні клапани серця або принаймні помірний мітральний стеноз, для профілактики тромбоемболічного інсульту слід застосовувати лише антагоністи вітаміну К [370].
Дозу дабігатрану слід знизити до 110 мг двічі на добу, якщо кліренс креатиніну становить 30-49 мл/хв, ривароксабану – до 15 мг/добу, едоксабану – до 30 мг/добу при значеннях кліренсу креатиніну 30-50 мл/хв, апіксабану – до 2,5 мг двічі на добу, якщо пацієнт має дві або більше з таких ознак: вік ≥80 років, рівень сироваткового креатиніну ≥1,5 мг/дл або масу тіла ≤60 кг [370-375]. Резюме рекомендацій з профілактики тромбоемболізму у пацієнтів із симптомною СН і пароксизмальною або персистуючою/постійною формами ФП представлено в таблиці. За детальнішою інформацією звертайтеся до рекомендацій ЄТК з ФП [316].
Можливість встановлення пристрою для оклюзії вушка лівого передсердя слід розглянути в якості альтернативи оральному антикоагулянту у пацієнтів з ФП, які мають високий ризик розвитку як тромбоемболізму, так і кровотеч, з метою уникнення геморагічних ускладнень антикоагуляції [381, 382].
10.2. Шлуночкові аритмії
Початкові заходи при асимптомних шлуночкових аритміях – це корекція електролітних розладів, особливо низького рівня калію та магнію в сироватці, відміна препаратів, які можуть провокувати аритмії, і у пацієнтів з HFrEF – оптимізація фармакотерапії із застосуванням ІАПФ, бета-адреноблокаторів, АМР та сакубітрилу/валсартану, кожен з яких знижує ризик раптової смерті [174, 177, 383, 384].
Клінічне значення ішемії міокарда як провокуючого фактора шлуночкових аритмій не встановлено, хоча описано окремі випадки аритмій, індукованих ішемією. У рандомізованих дослідженнях реваскуляризація у пацієнтів з HFrEF не знижувала загальну смертність [107, 385], навіть у підгрупах пацієнтів зі стенокардією чи міокардіальною ішемією [115, 386], проте подальший аналіз виявив зниження частоти випадків раптової смерті [387].
Для пригнічення симптомних шлуночкових аритмій можна застосовувати аміодарон (частіше в комбінації з бета-адреноблокатором), але це може негативно впливати на прогноз, особливо у пацієнтів з більш тяжкою СН [227, 244]. Застосування інших антиаритмічних препаратів слід уникати [247]. Транскатетерна радіочастотна модифікація аритмогенного субстрату може зменшувати кількість відповідних розрядів ІКД і застосовуватися для переривання аритмічного шторму у пацієнтів з СН та частими повторними шлуночковими тахіаритміями, тому цю опцію слід розглядати у таких пацієнтів. При наданні допомоги пацієнтам зі стійкими до лікування шлуночковими аритміями необхідно радитися з фахівцями у сфері електрофізіології. Детальнішу інформацію можна знайти в рекомендаціях ЄТК/Європейської асоціації ритму серця з шлуночкових аритмій та раптової серцевої смерті [260].
10.3. Симптомна брадикардія, паузи та атріовентрикулярна блокада
Згідно з рекомендаціями ЄТК з електростимуляції та СРТ втручання рекомендується, якщо паузи перевищують 6 с, навіть коли вони не супроводжуються симптомами [389]. Однак ці рекомендації були розроблені здебільшого для пацієнтів без очевидної дисфункції міокарда, а у пацієнтів з СН навіть коротші паузи можуть потребувати втручання [329]. Якщо під час електрокардіографічного моніторування виявлені паузи тривалістю >3 с, слід переглянути медикаментозну терапію і відмінити або зменшити дозу таких препаратів: антагоністів кальцію, які знижують частоту серцевих скорочень, аміодарону, дигоксину, івабрадину. У пацієнтів з ФП можна розглянути можливість зниження дози бета-адреноблокатора, що дозволить досягти зростання частоти скорочень шлуночків у стані спокою до 70-90 уд/хв, оскільки недостатньо доказів на користь того, що бета-адреноблокатори покращують прогноз у пацієнтів з ФП [177]. У пацієнтів з паузами, але на фоні синусового ритму, слід уникати зниження дози бета-адреноблокаторів, окрім випадків, коли паузи викликають симптоми, мають подовжену тривалість або виникають часто; в кожному випадку можна розглядати відносну користь від зниження дози, відміни бета-адреноблокатора або застосування водія ритму (з бівентрикулярною стимуляцією). Однак бракує доказів на підтримку стратегії встановлення водія ритму з єдиною метою – забезпечити можливість початку терапії бета-адреноблокатором або титрування дози за відсутності стандартних показань до електростимуляції; отже, ця стратегія не рекомендується. У пацієнтів з HFrEF та АВ блокадою високого ступеня слід надавати перевагу СРТ перед стимуляцією ПШ (підрозділ 8.2). Якщо причиною брадикардії або пауз є патологія синусового вузла при збереженій АВ провідності, слід надавати перевагу терапевтичним стратегіям, які не викликають шлуночкову диссинхронію, хоча на підтримку цієї експертної думки у пацієнтів з СН практично немає доказів з клінічних досліджень. Стосовно інших показань до електростимуляції звертайтеся до рекомендацій ЄТК з електростимуляції та СРТ [389].
11. Супутні захворювання
11.1. СН і супутні захворювання
Супутні захворювання мають значний вплив на перебіг СН (табл. 11.1). Іноді вони визначають тактику лікування у таких пацієнтів. Так, наприклад, деяким хворим з вираженою дисфункцією нирок призначення інгібіторів РАС є неможливим (див. розділ 7). Терапія супутніх захворювань є ключовою умовою індивідуалізованого ведення пацієнтів з СН. Більшість супутніх захворювань активно лікують відповідні спеціалісти, і ці лікарі мають дотримуватися своїх власних Рекомендацій. У цих Рекомендаціях зазначатиметься, у яких випадках СН модифікує звичайне лікування супутніх захворювань внаслідок змін/невизначеності його безпеки чи ефективності або через наявність доказів того, що така терапія має певну (позитивну чи негативну) дію на хворих з СН. Порівняно з HFrEF при HFрEF поширеність супутніх захворювань є вищою, причому ці хвороби можуть призводити до загострення СН [398].
11.2. Стенокардія та ІХС
11.2.1. Медикаментозне лікування
Бета-адреноблокатори, а в окремих групах хворих – й івабрадин [180] є ефективними засобами контролю стенокардії, так само, як і обов’язковими компонентами терапії HFrEF. У хворих з HFpEF ці препарати також можуть призначати для полегшення перебігу стенокардії, хоча доцільність такого підходу в дослідженнях формально не перевірялася.
Продемонстровано, що у пацієнтів з СН і стенокардією триметазидин, якщо його додають до бета-адреноблокаторів, певною мірою посилює позитивні ефекти терапії [400-406], зокрема при HFrEF зменшує ФК СН, збільшує тривалість фізичного навантаження, поліпшує функцію ЛШ [402-406]. Деякі з інших ефективних антиангінальних засобів вивчали на співставній кількості хворих з HFrEF/дисфункцією ЛШ, і було показано, що вони (амлодипін [215, 407], нікорандил [408], нітрати [183, 184, 409]) є безпечними. Профіль безпеки при HFrEF інших антиангінальних засобів (зокрема, ранолазину) не визначено, тоді як дилтіазем і верапаміл для пацієнтів з HFrEF вважають небезпечними (хоча при HFрEF їх можна призначати) [214]. Дигідропіридинові антагоністи кальцію можуть стимулювати симпатичний тонус, і тому їхня безпека при HFrEF (за винятком амлодипіну [215] та фелодипіну [216]) та HFрEF не визначена.
11.2.2. Реваскуляризація міокарда
Показання до інвазивної реваскуляризації міокарда, будь ласка, див. у підрозділі 5.8.
Черезшкірна та хірургічна реваскуляризація – додаткові підходи до симптоматичного полегшення стенокардії у хворих з HFpEF, хоча до сьогодні остаточно не зрозуміло, чи можуть зазначені втручання поліпшувати наслідки хвороби. Згідно з останніми Рекомендаціями ESC з реваскуляризації міокарда у хворих зі значущим стенозом лівої вінцевої артерії або його еквівалентом (проксимальний стеноз лівої передньої низхідної та лівої огинаючої артерій) аортокоронарне шунтування (АКШ) поліпшує прогноз [112, 113]. Водночас необхідно мати на увазі, що досліджень, до яких залучали хворих з чітко визначеними критеріями СН, не проводили. Отже, ці рекомендації базуються лише на думці експертів. Критеріями виключення у РКВ STICH були ураження лівої вінцевої артерії та III-IV ФК стенокардії напруження. За даними цього дослідження, АКШ рекомендовано проводити хворим з HFrEF, значущою ІХС (ураження лівої передньої низхідної артерії або мультисудинне ураження) і ФВ ЛШ ≤35%. Це зменшує частоту летальних випадків і госпіталізацій внаслідок серцево-судинних причин [385]. До хворих, які з найбільшою вірогідністю отримають користь від реваскуляризації міокарда, відносять осіб з площею неповноцінного за функцією, але життєздатного міокарда ЛШ >10%. Вірогідність такої користі у пацієнтів з площею <10% нижча. Проте зазначений підхід до відбору пацієнтів, яким показана реваскуляризація, є недоведеним. У випробуванні STICH у тих пацієнтів, які отримали від АКШ користь у вигляді зниження смертності, не досліджували ані життєздатність міокарда, ані ступінь ремоделювання ЛШ [118]. Щодо методик оцінки життєздатності міокарда, будь ласка, див. розділ 5. Згідно з висновками post hoc аналізу даних, отриманих у РКВ STICH, наявність індуцибельної ішемії міокарда (яку встановлювали у радіонуклідному або добутаміновому ехокардіографічному стрес-тестах) або стенокардії не вказує на гірший прогноз та на більшу користь від АКШ або оптимальної медикаментозної терапії [115, 386]. Проте порівняно з останньою АКШ не має переваг щодо впливу на перебіг стенокардії.
Вибір між АКШ і черезшкірним втручанням на вінцевих артеріях мають здійснювати відповідні спеціалісти після ретельної оцінки клінічного стану пацієнта та анатомії його коронарних судин, очікуваної повноти реваскуляризації, співіснуючих клапанних вад серця та супутніх захворювань.
11.3. Кахексія та саркопенія
Кахексія – це процес генералізованої втрати маси тіла, який уражає всі компартменти, тобто «сухі» (скелетні м’язи), жирові (енергетичні резерви) та кісткові (остеопороз) тканини. Кахексія може розвиватися у 5-15% пацієнтів з СН, зокрема при HFrEF, особливо при тяжкому перебігу хвороби [414-416]. Таке серйозне ускладнення супроводжується іншою тяжкою симптоматикою та обмеженою здатністю до виконання фізичного навантаження, частішими госпіталізаціями та зниженою виживаністю. Кахексію при СН можна діагностувати/визначити як мимовільну та не пов’язану з динамікою набряків втрату маси тіла ≥6% від загальної упродовж попередніх 6-12 міс [414-417].
Кахексія має поліетіологічне походження, яке тяжко визначити у кожного окремого пацієнта. Факторами, які призводять до її розвитку, є прозапальна активація імунної системи, нейрогуморальний дисбаланс, незбалансоване харчування й мальабсорбція, порушення енергетичного та білкового обмінів, розвиток резистентності до дії анаболічних гормонів, пригнічення анаболізму, тривала іммобілізація та фізичне виснаження. Зазначені фактори об’єднують у поняття «дисбаланс катаболізму/анаболізму» [418]. Втрату маси скелетної мускулатури, яка супроводжується обмеженою мобільністю та суб’єктивною симптоматикою (так звана саркопенія, або міопенія), діагностують у 30-50% хворих з HFrEF [419]. У найбільш тяжких випадках саркопенія зумовлює ослаблення хворого та спричиняє виникнення ускладнень і летальних випадків [420].
До можливих лікувальних заходів належать стимулятори апетиту, фізичні вправи [120] та анаболічні засоби, у тому числі тестостерон, які можна поєднувати із прийомом харчових добавок та антикатаболічною терапією. Щоправда, ефективність жодного з цих методів не доведена, а профіль їхньої безпеки не відомий [421].
11.4. Злоякісні новоутворення
Деякі з хіміотерапевтичних засобів можуть спричиняти (або провокувати) розвиток систолічної дисфункції ЛШ і СН. Серед таких препаратів найвідомішими є антрацикліни (наприклад, доксорубіцин), трастузумаб та інгібітори тирозинкінази [397, 422]. У нещодавньому Кокранівському огляді було встановлено, що у пацієнтів, які приймають антрацикліни, дексразоксан може чинити певну кардіопротекторну дію [423]. Для хворих, які отримують кардіотоксичну хіміотерапію, до та після лікування вкрай важливою є оцінка ФВ ЛШ (якщо можливо, за допомогою візуалізації міокардіального напруження) [397, 422]. Для жінок з раком грудної залози розроблено шкалу ризику розвитку СН на тлі лікування трастузумабом. Ця, потенційно корисна, шкала враховує вік, особливості хіміотерапії, вихідний стан серцево-судинної системи та наявність інших супутніх захворювань [424]. У тих пацієнтів, у яких виникла помірна або тяжка систолічна дисфункція ЛШ, треба припинити хіміотерапію і почати лікування HFrEF. Після покращення функції ЛШ необхідно оцінити ризики та користь від продовження хіміотерапії [397, 425, 426]. Медіастинальна променева терапія також зумовлює різні відтерміновані кардіальні ускладнення. Щоб встановити пацієнтів, які належать до групи підвищеного ризику розвитку кардіотоксичних реакцій, можна застосовувати визначення серцевих біомаркерів (НУП і тропоніни), ефективне також для моніторування дії та адекватності доз кардіотоксичних цитостатиків [397, 425, 426].
11.5. Центральна нервова система (у тому числі депресія, інсульт та автономна дисфункція)
Інсульт і СН часто співіснують, оскільки для них характерні спільні фактори ризику. Обидва захворювання погіршують прогноз хворого. Інсульт утруднює самообслуговування пацієнта з СН. При веденні хворих із групи високого ризику розвитку інсульту необхідно враховувати ризик, асоційований з антикоагулянтною та антитромбоцитарною терапією.
Автономна дисфункція при HFrEF, особливо тяжкій, зустрічається часто [427]. Поєднання автономної дисфункції з низьким АТ підвищує ризик непритомності та травмування, утруднюючи призначення оптимальних доз бета-адреноблокаторів, ІАПФ, БРА та АМР. У таких пацієнтів може бути необхідним зниження доз сечогінних препаратів, що зменшує тяжкість постуральної гіпотензії.
Депресія є частим розладом, який погіршує клінічний статус хворого і прогноз СН [428-430]. Окрім того, депресія може знижувати комплайєнс до лікування та спричиняти соціальну ізоляцію. Обґрунтована підозра щодо наявності у пацієнта депресії потребує її діагностики, особливо в осіб похилого віку. Належною практикою є рутинний скринінг за допомогою валідованих опитувальників. Для встановлення депресивного настрою у хворих з СН до сьогодні використовують такі формально валідовані інструменти, як шкали BDI (Beck Depression Inventory) та Cardiac Depression Scale [431, 432]. Водночас іноді з цією метою застосовують також інші опитувальники (наприклад, Geriatric Depression Scale, Hamilton Depression Scale, Hospital Anxiety and Depression Scale).
У пацієнтів з HFrEF і депресією корисними є психосоціальні методи, медикаментозне лікування, фізичні вправи [433]. Застосування когнітивно-поведінкової терапії в комбінації зі стандартним лікуванням хворих з СН і вираженою депресією, а також структуровані освітні програми можуть зменшити тяжкість депресії, тривожного розладу та синдрому втоми, поліпшити соціальне функціонування і якість життя, асоційовану з СН і ментальним статусом [434].
Вважається, що інгібітори зворотного захоплення серотоніну є безпечними засобами. Водночас РКВ Sertraline Antidepressant Heart Attack не підтвердило переваг сертраліну перед плацебо щодо зменшення симптомів депресії та поліпшення стану серцево-судинної системи у хворих з HFrEF. Щоправда, це випробування не мало достатньої потужності для надання відповідних доказів [435]. Аналогічно й есциталопрам порівняно з плацебо упродовж 24 міс спостереження за хворими з HFrEF та депресією не впливав ані на останню, ані на її клінічні наслідки. Важливо наголосити, що призначення трициклічних антидепресантів слід уникати, оскільки вони спричиняють гіпотензію, погіршують перебіг СН і провокують виникнення серцевих аритмій [429, 435].
11.6. Цукровий діабет
Гіперглікемія та ЦД при СН зустрічаються дуже часто, причому ЦД асоціюється з гіршим функціональним статусом і прогнозом. У пацієнтів з HFrEF ті лікарські засоби, які зменшують захворюваність і смертність, однаково ефективні незалежно від наявності/відсутності ЦД [320]. Так, бета-адреноблокатори поліпшують наслідки СН як за наявності, так і за відсутності супутнього ЦД, хоча різні препарати мають різну дію на показники глікемії [436].
Невідомо, чи впливає у хворих з СН жорсткий контроль глікемії на ризик серцево-судинних подій [437]. Серед пацієнтів з СН, у яких ЦД не лікували, більший рівень HbA1c асоціювався з вищим ризиком серцево-судинних подій [438, 439].
У хворих з ЦД і СН контроль глікемії необхідно впроваджувати поступово і помірно, надаючи перевагу таким лікарським засобам, як метформін, що продемонстрував свою безпеку і ефективність. На відміну від попередніх уявлень тепер вважають, що метформін є безпечним препаратом для пацієнтів з HFrEF. Він має бути препаратом вибору при СН [440, 441]. Водночас метформін, підвищуючи ризик розвитку лактатацидозу, протипоказаний хворим з тяжкою нирковою або печінковою недостатністю.
Інсулін необхідно призначати хворим з ЦД 1 типу, а також пацієнтам з ЦД 2 типу та маніфестною гіперглікемією на тлі виснаження β-клітин острівців Лангерганса. Проте інсулін – потужний гормон, який затримує натрій. Отже, паралельно зі зниженням глюкозурії може посилюватися затримка рідини, що спричиняє погіршення перебігу СН. Похідні сульфонілсечовини також збільшують ризик загострення СН, тому їх треба призначати з обережністю.
Тіазолідиндіони (глітазони) зумовлюють затримку рідини, збільшуючи ризик погіршення перебігу СН і госпіталізації. Отже, ці засоби не рекомендовано призначати хворим з СН [209, 210]. Інгібітори дипептидилпетидази‑4 (ІДПП‑4), або гліптини, стимулюють секрецію інкретину, внаслідок чого збільшують вивільнення інсуліну. Агоністи рецепторів глюкогоноподібного пептиду 1 (ГПП‑1) тривалої дії імітують ефекти інкретину. Ці засоби, як і гліптини, поліпшують показники глікемії, але не зменшують, і навіть можуть збільшувати ризик виникнення серцево-судинних подій та загострення СН [320, 442, 443]. Важливо, що дані щодо безпеки гліптинів та аналогів ГПП‑1 у хворих з СН відсутні.
Нещодавно було встановлено, що емпагліфлозин, інгібітор котранспортера натрію/глюкози 2 типу, знижує у пацієнтів з ЦД і високим серцево-судинним ризиком (частина – з СН) частоту госпіталізацій внаслідок СН та смертність, не впливаючи на частоту ІМ або інсульту [130]. За відсутності інших досліджень з препаратами цієї групи результати, отримані для емпагліфлозину, не є доказами наявності зазначеного ефекту у всього класу.
При прогресуванні розладів глікемії корекцію останньої треба проводити з урахуванням стану серцево-судинної системи. Якщо пацієнту призначено новий протидіабетичний засіб, кардіолог має ретельно за ним спостерігати.
11.7. Еректильна дисфункція
Еректильна дисфункція – поширена та важлива проблема, що впливає на якість життя чоловіків з СН [444, 445]. Її лікування складається з оптимальної терапії основного серцево-судинного захворювання та іншої супутньої патології (наприклад, ЦД), боротьби з тривожними й депресивними розладами. Деякі засоби, що призначають з приводу СН (наприклад, тіазидні діуретики, спіронолактон, бета-адреноблокатори) можуть посилювати еректильну дисфункцію [444, 445]. Показано, що інгібітори фосфодіестерази 5 типу мають сприятливий вплив на гемодинаміку та ремоделювання міокарда. Це підвищує толерантність до фізичних навантажень і якість життя пацієнтів з HFrEF [446, 447]. Водночас ці препарати протипоказані хворим, які приймають нітрати.
11.8. Подагра та артрит
Гіперурикемія та подагра при СН зустрічаються часто і можуть спричинятися або провокуватися діуретиками. Гіперурикемія погіршує прогноз HFrEF [448]. Згідно з останніми Рекомендаціями з лікування подагри Європейської протиревматичної ліги (EULAR) гіпоурикемічна терапія показана хворим із повторним загостренням, артропатією, тофусами або рентгенологічними ознаками подагри. Мета терапії – підтримання рівня сечової кислоти нижче точки кристалізації урату натрію – <357 мкмоль/л (<6 мг/дл) [449].
Для профілактики подагри можна призначати інгібітори ксантиноксидази (алопуринол, оксипуринол), хоча їх безпека при HFrEF не визначена [450].
Для лікування нападу подагри найкраще застосовувати колхіцин, аніж НПЗП, хоча колхіцин, по-перше, може провокувати діарею, а, по-друге, він протипоказаний при вкрай тяжкій дисфункції нирок. У хворих з моноартикулярною подагрою альтернативним методом лікуванням є внутрішньосуглобове введення кортикостероїдів. Водночас кортикостероїди системної дії спричиняють затримку натрію та води.
Артрит – поширена супутня патологія і часта причина прийому безрецептурних і рецептурних препаратів (зокрема, НПЗП), які можуть погіршувати функцію нирок і перебіг СН. Ревматоїдний артрит підвищує ризик виникнення HFрEF. Безпечність засобів, що модифікують перебіг ревматоїдного артриту та нерідко застосовуються при цьому захворюванні, у пацієнтів з СН не визначена.
11.9. Гіпо- та гіперкаліємія
Як гіпо-, так і гіперкаліємія асоціюються з СН та можуть спричинятися значною кількістю засобів, які приймають для лікування зазначених синдромів [451]. Обидва електролітні розлади здатні провокувати виникнення шлуночкових аритмій.
Петльові та тіазидні діуретики знижують сироватковий рівень калію, тоді як ІАПФ, БРА та АМР підвищують його. Амілорид і тріамтерен іноді застосовують як засоби допоміжної діуретичної терапії при резистентних набряках. Окрім того, вони допомагають попередити гіпокаліємію. Для корекції останньої необхідним є призначення рекомендованих продуктів з високим вмістом калію або рецептурних калієвих добавок.
Терапія гострої гіперкаліємії (>6,0 ммоль/л) потребує короткотривалої відміни засобів, які затримують калій, та інгібіторів РААС. Проте тривалість такої відміни треба мінімізувати, а інгібітори РААС якнайшвидше призначити повторно, моніторуючи рівень калію. У Кокранівському огляді не встановлено жодних доказів того, що існує такий режим корекції гіперкаліємії, який може вплинути на «великі» наслідки [452]. На сьогодні два нові препарати, які зв’язують іони калію (патиромер і циклосилікат натрію/цирконію), проходять процес ухвалення регуляторними органами [453, 454]. Є перші результати, отримані у пацієнтів з СН. Вони підтверджують ефективність такої терапії щодо зниження сироваткового рівня калію [455] та попередження рецидивуючої гіперкаліємії у хворих з СН і ХХН на тлі терапії інгібіторами РААС [456].
11.10. Гіперліпідемія
Підвищення рівня холестерину ліпопротеїнів низької густини є рідкісним при HFrEF. Хворі з тяжкою HFrEF часто мають низьку концентрацію цих ліпопротеїнів, що асоціюється з гіршим прогнозом. За даними 2 масштабних РКВ, у хворих з СН (незалежно від наявності ІХС) розувастатин не зменшує частоту первинної комбінованої кінцевої точки (смертність/захворюваність), але й не збільшує ризик, а може навіть знижувати частоту госпіталізацій [205, 457]. Отже, докази, які дають змогу рекомендувати початок терапії статинами у більшості пацієнтів з СН, відсутні. Водночас у тих хворих, які вже приймають статини для лікування ІХС, можна обговорити доцільність їх подальшого призначення.
11.11. Артеріальна гіпертензія
АГ збільшує ризик розвитку СН, тоді як лікування АГ суттєво зменшує частоту її виникнення (за винятком α-адреноблокаторів, які порівняно з іншими антигіпертензивними засобами менш ефективно попереджують СН) [458]. У нещодавньому проспективному когортному дослідженні було встановлено, що серед осіб, в яких виникла СН, вищі рівні систолічного, діастолічного та пульсового АТ асоціюються з більшою частотою несприятливих подій [459]. Це ще один доказ важливості оптимального контролю АТ, який є елементом комплексного лікування хворих з СН.
Антагоністи кальцію, яким притаманний негативний інотропний ефект (наприклад, дилтіазем і верапаміл), не мають призначати хворим з HFrEF для лікування АГ (хоча вважають, що вони безпечні для пацієнтів з HFрEF). Окрім того, хворим з HFrEF необхідно уникати прийому моксонідину, оскільки, за даними одного РКВ [460], цей препарат підвищує смертність. Якщо рівень АТ не вдається контролювати за допомогою ІАПФ (або БРА), бета-адреноблокатора, АМР і діуретика, можна призначати гідралазин і амлодипін [215] (або фелодипін [216]) – додаткові антигіпертензивні препарати, які безпечні при систолічній СН.
Цільові рівні АТ, зазначені в Рекомендаціях з лікування АГ [317], є адекватними й для пацієнтів з СН. Неконтрольована АГ у хворих з HFrEF зустрічається дуже рідко, що свідчить про оптимальну терапію СН. На противагу цьому для пацієнтів з HFрEF антигіпертензивна терапія є вкрай важливою. Хворим з гострою СН для зниження АТ рекомендується вводити внутрішньовенно нітрати (або нітропрусид натрію).
11.12. Дефіцит заліза та анемія
Дефіцит заліза при СН, як і при інших хронічних захворюваннях, зустрічається часто і може спричиняти розвиток анемії і/або дисфункції скелетних м’язів без анемії [466]. У хворих з СН дефіцит заліза погіршує прогноз [467, 468]. Ефекти внутрішньовенного введення заліза хворим з СН і дефіцитом заліза (сироватковий рівень феритину <100 мкг/л або у межах 100-299 мкг/л на тлі сатурації трансферином <20%) окремо вивчали у 2 РКВ [469, 470], у які залучали пацієнтів як з анемією, так і без. У РКВ FAIR-HF [469] було продемонстровано, що внутрішньовенне введення упродовж 6 міс заліза карбоксимальтози поліпшує стандартизований узагальнюючий показник самопочуття хворого, якість життя та ФК незалежно від наявності у хворого з СН анемії [471]. За даними РКВ CONFIRM-HF [470] здатність виконувати фізичні навантаження поліпшується через 24 тиж. Згідно з результатами аналізу вторинних кінцевих точок РКВ CONFIRM-HF [470] внутрішньовенне введення заліза знижує ризик госпіталізацій внаслідок СН у хворих з HFrEF і дефіцитом заліза. Метааналіз ефектів внутрішньовенного лікування (упродовж 52 тиж) таких пацієнтів продемонстрував зменшення частоти госпіталізацій, полегшення суб’єктивної симптоматики СН, підвищення толерантності до фізичних навантажень і якості життя [472]. Лікування заліза карбоксимальтозою може, таким чином, суттєво поліпшити функціональний та клінічний статус і якість життя. Окрім того, ця терапія асоціювалася зі значущим зменшенням частоти госпіталізацій внаслідок загострення СН. Проте кількість летальних випадків і несприятливих реакцій не змінювалась. Жодне з досліджень внутрішньовенного введення заліза не мало достатньої потужності, щоб оцінити його дію залежно від наявності/відсутності анемії або вплив лікування на «великі» наслідки. Не досліджено ефекти корекції дефіциту заліза у хворих з HFpEF/HFmrEF, а також віддалену безпеку зазначеної терапії при HFrEF, HFmrEF та HFрEF. Невідомий профіль безпеки внутрішньовенного введення заліза хворим з СН і рівнем гемоглобіну >150 г/л [469, 470]. Пацієнтів з дефіцитом заліза необхідно обстежувати, щоб встановити його потенційно зворотні причини (наприклад, шлунково-кишкові джерела кровотечі).
Анемія (встановлюється при рівні гемоглобіну <130 г/л у чоловіків і <120 г/л у жінок) є поширеним станом при СН, зокрема у госпіталізованих хворих. Вона частіше виникає у жінок, осіб літнього віку, пацієнтів з дисфункцією нирок та асоціюється з вираженим ремоделюванням міокарда, запаленням та об’ємним перевантаженням [474]. Анемія супроводжується вираженими скаргами, гіршим функціональним статусом, вищим ризиком госпіталізації внаслідок СН, нижчою виживаністю. Показаний діагностичний пошук причини анемії (окультна втрата крові, дефіцит заліза, дефіцит вітаміну В12/фолієвої кислоти, дискразії), хоча у багатьох випадках специфічної причини виявити не вдається. У хворих з HFrEF та легкою/помірної тяжкості анемією стимулятор еритропоетину дарбепоетин альфа, не покращуючи клінічних наслідків, збільшує частоту тромбоемболічних епізодів, і отже, не рекомендований для призначення [475].
11.13. Дисфункція нирок (у тому числі ХХН, гостре ураження нирок, кардіоренальний синдром та обструкція, зумовлена патологією передміхурової залози)
ХХН і СН часто співіснують, мають чимало спільних факторів ризику (ЦД, АГ, гіперліпідемія) та погіршують прогноз [476, 477]. Як правило, ХХН встановлюють, якщо розрахункова ШКФ становить <60 мл/хв/1,73 м2 і/або хворий має високу (30-300 мг альбуміну/1 г креатиніну сечі) або дуже високу (>300 мг альбуміну/1 г креатиніну сечі) альбумінурію. Пацієнтів з тяжкою дисфункцією нирок (розрахункова ШКФ (рШКФ) <30 мл/хв/1,73 м2) завжди виключали з РКВ. Тому доказовий підхід до їх лікування не розроблено.
Для позначення подальшого прогресування процесу, у вигляді підвищення сироваткового рівня креатиніну, зазвичай до >26,5 мкмоль/л (>0,3 мг/дл), або його збільшення на 25%, або зменшення ШКФ на 20%, застосовують термін «погіршення функції нирок» (ПФН). Важливість таких, на перший погляд, незначних змін полягає в тому, що вони часто зустрічаються, вказують на розвиток і прогресування ХХН [478] та погіршують прогноз СН. Підвищення рівня креатиніну упродовж перебування в стаціонарі після госпіталізації внаслідок гострої СН не завжди має клінічну значущість, особливо якщо це супроводжується зворотним розвитком набряків, збільшенням діурезу й гемоконцентрацією [479].
Суттєве підвищення сироваткової концентрації креатиніну (позначається як гостре ураження нирок) при СН зустрічається відносно рідко і, ймовірно, асоціюється з прийомом діуретиків на тлі інших потенційно нефротоксичних засобів, зокрема антибіотиків (гентаміцин і триметоприм), контрастних препаратів, ІАПФ, БРА, НПЗП та ін. Якщо деякі з цих ліків екскретуються нирками, вони можуть акумулюватися в організмі. ПФН при СН є поширеним станом, зокрема на початку терапії інгібіторами РААС або при підвищенні їх дози. Попри відомий факт, що у хворих з СН інгібітори РААС часто спричиняють зниження ШКФ, ці зміни, як правило, незначні й не мають бути причиною припинення лікування (за винятком суттєвого зниження ШКФ), оскільки користь від такої терапії, ймовірно, зберігається [480]. Якщо спостерігається значне підвищення сироваткового рівня креатиніну, необхідно ретельно обстежити хворого, у тому числі для виключення стенозу ниркової артерії, суттєвої гіпо- або гіперволемії, прийому інших медикаментів, а також гіперкаліємії, яка часто поєднується з ПФН.
Діуретики, особливо тіазидні (але й петльові), у хворих з дуже низькою ШКФ можуть бути менш ефективними. Тому для досягнення відповідного ефекту необхідно застосовувати вищі дози цих засобів. У пацієнтів з ураженням нирок препарати, які екскретуються із сечею (наприклад, дигоксин, інсулін і низькомолекулярні гепарини), можуть акумулюватися, що за умов погіршення ниркової функції потребує корекції їх доз. Хворі з СН та атеросклеротичним ураженням коронарних або периферійних артерій належать до групи ризику розвитку гострої дисфункції нирок на тлі введення контрастних засобів для ангіографії (контраст-індуковане гостре ураження нирок).
Обструкція, зумовлена патологією передміхурової залози, часто зустрічається серед літніх чоловіків і може погіршувати функцію нирок. Отже, цю патологію треба виключати у чоловіків з СН і погіршенням ниркової функції. α-Адреноблокатори спричиняють артеріальну гіпотензію та затримку натрію і води, тому при HFrEF вони небезпечні [458, 464, 465]. Це пояснює, чому у пацієнтів з СН як препарат вибору при медикаментозному лікуванні обструкції, зумовленої патологією передміхурової залози, зазвичай обирають інгібітор 5-α-редуктази.
11.14. Захворювання легенів (у тому числі бронхіальна астма та ХОЗЛ)
У пацієнтів з СН діагностика ХОЗЛ та бронхіальної астми може бути утруднена через спільність скарг та об’єктивної симптоматики. З іншого боку, у таких випадках, особливо у пацієнтів з HFrEF, виникають проблеми з інтерпретацією результатів спірометрії [48, 49, 391]. При СН спостерігається гіпердіагностика ХОЗЛ (і бронхіальної астми) [481]. Спірометрію треба виконувати, якщо у пацієнта стабільний стан та еуволемія спостерігаються упродовж щонайменше 3 міс. Це дає змогу уникнути впливу легеневого застою, що спричиняє зовнішню обструкцію альвеол і бронхіол [482]. ХОЗЛ (діагностований як коректно, так і неправильно) погіршує функціональний статус та прогноз при HFrEF.
Бета-адреноблокатори лише відносно протипоказані при бронхіальній астмі, але не хворим з ХОЗЛ. Перевагу надають селективним бета-адреноблокаторам (тобто бісопрололу, метопрололу сукцинату або небівололу) [48, 49, 391]. В аркушах-вкладишах до лікарських засобів наведено інформацію щодо бронхіальної астми як протипоказання до призначення бета-адреноблокаторів. Ця інформація базується на невеликих спостереженнях окремих випадків, опублікованих у 1980-х та наприкінці 1990-х рр. Досліджувані пацієнти – молоді особи з тяжким перебігом бронхіальної астми. Їм призначали високі стартові дози бета-адреноблокаторів. У клінічній практиці починають з невеликих доз кардіоселективних бета-адреноблокаторів, ретельно спостерігаючи за появою ознак бронхіальної обструкції (свистячих хрипів, задишки з подовженням видиху). Це дає змогу застосовувати ефективні бета-адреноблокатори у хворих з HFrEF, зокрема в осіб похилого віку, в яких істинна бронхіальна астма зустрічається рідко. Отже, відповідно до доповіді «Глобальна стратегія GINA» (2015) [395, 396], бронхіальна астма не є абсолютним протипоказанням, проте призначати бета-адреноблокатори можливо тільки за умови ретельного професійного спостереження за хворим, після обговорення усіх «за» та «проти» такої терапії. Дані про безпеку при тривалому прийомі інгаляційних «легеневих» препаратів, які впливають на серцево-судинну систему, відсутні. Потребу їх призначення хворим з HFrEF щоразу необхідно обговорювати окремо, оскільки дія цих препаратів при бронхіальній астмі та ХОЗЛ може бути тільки симптоматичною, без чіткого впливу на смертність. Пероральні кортикостероїди спричиняють затримку натрію та води, що призводить до загострення СН. Проте для інгаляційних кортикостероїдів зазначений побічний ефект невластивий. Тривале ХОЗЛ тяжкого перебігу може ускладнюватися легеневою гіпертензією, яка, у свою чергу, підвищує ризик формування правошлуночкової СН і застою у великому колі кровообігу. Неінвазивна вентиляція легенів, яку додають до рутинної терапії, поліпшує прогноз у хворих з гострою дихальною недостатністю, спричиненою гіперкапнічним загостренням ХОЗЛ або СН з гострим набряком легенів.
11.15. Ожиріння
Ожиріння, ускладнюючи діагностику СН, є водночас фактором ризику СН [141]. Дійсно, ожиріння зумовлює виникнення задишки, зниження толерантності до фізичного навантаження, набряк кісточок. Окрім того, ожиріння погіршує якість ехокардіографічної візуалізації. В осіб з ожирінням знижений рівень НУП [62]. Ожиріння частіше зустрічається при HFрEF, ніж у хворих з HFrEF. Проте можливо, що ці відмінності частково зумовлені діагностичними помилками. Хоча ожиріння є незалежним фактором ризику СН, при виникненні останньої прогноз пацієнта тим гірший, чим менший його індекс маси тіла (ІМТ) – так званий парадокс ожиріння, який властивий також іншим хронічним захворюванням [414, 416]. Якщо метою лікування ожиріння є попередження розвитку СН, його слід проводити згідно з Рекомендаціями ESC з профілактики серцево-судинних захворювань [483]. Проте ці Рекомендації не призначені для тих хворих з СН, які не мають підвищеного ІМТ. Хоча зниження маси тіла часто рекомендують для полегшення симптоматики та контро-
лю факторів ризику, ефективність/безпека такої рекомендації при СН у проспективних дослідженнях не тестувалася. Якщо маса тіла знижується на тлі СН, це підвищує смертність і захворюваність, погіршує клінічний статус та якість життя. Хворим з СН та помірним ступенем ожиріння (ІМТ <35 кг/м2) зменшувати масу тіла не рекомендовано. За більших значень ІМТ (35-45 кг/м2) доцільність зниження маси тіла (для полегшення симптоматики та підвищення толерантності до фізичних навантажень) можна обговорити.
11.16. Порушення сну та порушення дихання уві сні
Порушення дихання уві сні (ПДС) реєструють у понад третини хворих з СН [484], причому у пацієнтів з гострою СН поширеність цього стану є навіть вищою [485]. До найчастіших видів ПДС належать центральне апное уві сні (ЦАС), яке подібне до дихання Чейна-Стокса, обструктивне апное уві сні (ОАС), а також комбінація цих двох розладів. Іншими причинами порушення сну є тривожність, депресія, пароксизмальний легеневий застій (ортопное/пароксизмальна нічна задишка) та діуретична терапія, яка спричиняє нічний діурез. Розпитування щодо особливостей сну (у тому числі у партнера хворого) є частиною цілісного підходу до лікування пацієнта з СН. Встановлено, що ЦАС і ОАС погіршують прогноз СН [485, 486]. ОАС асоціюється з підвищеним ризиком виникнення СН у чоловіків [487]. Серед інших ПДС при HFrEF найчастіше зустрічається ЦАС, а HFrEF, у свою чергу, є найпоширенішою причиною ЦАС. Отже, ці стани тісно пов’язані між собою. Скринінг, діагностику та лікування апное уві сні детальніше розглянуто в інших джерелах [484, 488]. Діагностика потребує проведення нічної полісомнографії. Водночас уже розроблено пристрій для сучасного дослідження в домашніх умовах, що дозволяє встановлювати окремий вид апное уві сні.
Можна обговорити доцільність застосування нічної додаткової оксигенотерапії, тривалого позитивного тиску в дихальних шляхах (CPAP), дворівневого позитивного тиску в дихальних шляхах (BiPAP) та адаптивної сервовентиляції (ASV). Згідно з існуючими Рекомендаціями [489, 490] ці методики застосовують для корекції нічної гіпоксемії при ОАС. Індекс апное/гіпопное, який перевищує 30 на годину, коригується за допомогою CPAP, BiPAP, ASV або нічної додаткової оксигенотерапії. Встановлено, що всі наведені методики є ефективними. Проте треба наголосити, що для жодної з них не вдалося продемонструвати у проспективному дослідженні наявності позитивного впливу на «великі» наслідки HFrEF.
У хворих з СН, які страждають на ЦАС, СРАР зменшує частоту епізодів апное/гіпопное, збільшує ФВ ЛШ та дистанцію в тесті з 6-хвилинною ходьбою, але не покращує прогноз і не знижує частоту госпіталізацій, спричинених СН [491].
Нещодавно в РКВ SERVE-HF було встановлено, що ASV, яку застосовували у пацієнтів з HFrEF та ПДС (переважно у вигляді ЦАС), має нейтральну дію на композитну первинну кінцеву точку (смерть від усіх причин; незапланована госпіталізація, спричинена погіршенням перебігу СН; життєзберігаюче втручання на серцево-судинній системі, тобто трансплантація серця, імплантація шлуночково-допоміжних пристроїв, реанімаційні заходи після раптової зупинки серця, життєзберігаючий шоковий розряд), збільшуючи (а це головне) загальну та серцево-судинну смертність. Отже, ASV не рекомендується призначати хворим з HFrEF і ПДС (переважно у вигляді ЦАС).
Безпечність та ефективність у хворих з HFrEF альтернативних підходів до лікування ЦАС (тобто імплантованого стимулятора діафрагмального нерва [219, 220, 492]) зараз вивчаються у клінічному дослідженні. Можливо, для цього буде необхідним додаткове проведення довготривалого випробування.
11.17. Клапанні вади серця
Клапанні вади серця можуть спричиняти або провокувати виникнення СН. Цей підрозділ коротко висвітлює питання, специфічно пов’язані з СН.
Для отримання більш детальної інформації читач має звернутися до нещодавніх Рекомендацій із ведення пацієнтів з клапанними вадами серця [493, 494].
Хворі з СН і супутніми клапанними вадами серця формують групу високого ризику. Отже, вибір тактики ведення пацієнта має базуватися на ретельній оцінці ризику/користі різних лікувальних заходів. Таку оцінку здійснює багатопрофільна команда спеціалістів з відповідним досвідом у питаннях клапанних вад серця. До складу цієї команди входять кардіолог, який має досвід роботи з хворими на СН, кардіохірург, спеціаліст з інтервенційної корекції (якщо обговорюється доцільність катетерної корекції структури клапана), променевий діагност, анестезіолог, а також – за потребою – лікар загальної практики, геронтолог і реаніматолог. Створення такої команди доцільно для пацієнтів з СН, яким планується виконати хірургічну корекцію, транскатетерну імплантацію аортального клапана або транскатетерне втручання на мітральному клапані.
Усі хворі мають отримувати оптимальну медикаментозну терапію. Пацієнтам з HFrEF фармакологічне лікування планують відповідно до алгоритму, наведеного в розділі 7. Хворим з тяжким аортальним стенозом слід призначати вазодилататори (ІАПФ, БРА, антагоністи кальцію, гідралазин, нітрати), але так, щоб уникнути розвитку артеріальної гіпотензії.
11.17.1. Аортальний стеноз
Головною проблемою, яка виникає у хворих з тяжким аортальним стенозом і зниженою ФВ ЛШ, є формування «низькошвидкісного/низькоградієнтного» стенозу (площа клапанного отвору <1 см2, ФВ ЛШ <40%, градієнт середнього тиску <40 мм рт. ст.).
У таких осіб необхідно обговорити доцільність призначення стрес-ехокардіографії з низькими дозами добутаміну. Мета цього дослідження полягає, по-перше, в диференціації між помірним і тяжким аортальним стенозом з низькошвидкісним плином крові крізь клапанний отвір (унаслідок низького ударного об’єму), а, по-друге, в оцінці скоротливості міокарда та резерву кровотоку.
Якщо у хворих з маніфестним тяжким аортальним стенозом середній градієнт становить >40 мм рт. ст., для протезування аортального клапана нижньої межі ФВ ЛШ теоретично не існує.
Трансаортальну імплантацію клапана (ТАІК) рекомендують здійснювати хворим з тяжким аортальним стенозом, яким, за оцінкою команди спеціалістів, не можна проводити хірургічну корекцію і в яких очікувана виживаність після втручання перевищує 1 рік. Доцільність ТАІК необхідно також обговорити у хворих високого ризику з тяжким аортальним стенозом, яким ще можна виконати хірургічне втручання, але ТАІК, за висновком команди спеціалістів, має переваги через індивідуальні особливості профілю ризику та анатомії [495, 496]. За результатами нещодавнього РКВ, біопротезна ТАІК значуще збільшувала частоту 1-річної виживаності, причому цей ефект зберігався і через 2 роки [497, 498].
11.17.2. Аортальна недостатність
При тяжкій аортальній недостатності рекомендовано здійснювати, за відсутності протипоказань, пластику або протезування аортального клапана всім хворим зі скаргами, а також тим безсимптомним пацієнтам, у яких ФВ ЛШ становить ≤50% [499, 500].
11.17.3. Мітральна недостатність
Первинна (органічна) мітральна недостатність
Хірургічна корекція рекомендована хворим зі скаргами, які мають тяжку органічну мітральну недостатність і в яких відсутні протипоказання до такого втручання. Вибір методу хірургічної корекції (протезування клапана або його пластика) залежить головним чином від анатомічних особливостей, досвіду хірурга та стану пацієнта.
У хворих з ФВ ЛШ <30% хірургічна пластика зменшує ступінь вираження скарг, хоча її дія на виживаність невідома. У таких пацієнтів рішення щодо доцільності проведення оперативного втручання залежить від ефективності медикаментозної терапії, супутніх захворювань, а також імовірності того, що клапан потребуватиме саме пластики (а не протезування).
Вторинна мітральна недостатність
Зазначений стан формується через збільшення та ремоделювання ЛШ, які обмежують здатність його стулок до змикання. Ефективна медикаментозна терапія (у тому числі СРТ у хворих з відповідними показаннями) сприяє зворотному розвитку ремоделювання ЛШ та може зменшувати функціональну мітральну регургітацію. Отже, у таких хворих необхідно докласти максимальних зусиль, щоб оптимізувати медикаментозну терапію.
Варто обговорити доцільність проведення комбінованого хірургічного втручання на клапані та коронарних артеріях у маніфестних хворих із систолічною дисфункцією ЛШ (ФВ ЛШ <30%), вінцевими артеріями, які потребують реваскуляризації, та доведеною життєздатністю міокарда. Хірургічне втручання також рекомендовано пацієнтам з тяжкою мітральною недостатністю і ФВ ЛШ >30%, яким здійснюється АКШ.
З іншого боку, в недавньому дослідженні не вдалося підтвердити, що у хворих з помірною вторинною мітральною недостатністю ішемічного генезу додавання пластики мітрального клапана до АКШ збільшує ступінь зворотного розвитку ремоделювання ЛШ [501]. Також відсутні дані на користь того, що пластика мітрального клапана має будь-які переваги перед протезуванням відносно впливу на наслідки хвороби або ступінь вираження ремоделювання ЛШ [502]. За наявності ФП під час хірургічного втручання на мітральному клапані можна обговорити доцільність проведення абляції передсердь або закриття вушка лівого передсердя.
У хворих із тяжкою функціональною мітральною регургітацією та тяжкою систолічною дисфункцією ЛШ (ФВ ЛШ <30%), яким не показана реваскуляризація або які мають кардіоміопатію неішемічного генезу, роль ізольованого хірургічного втручання на мітральному клапані є сумнівною. У більшості таких пацієнтів перевагу слід надавати звичайній медикаментозній терапії або використанню відповідних пристроїв. В окремих випадках можна обговорити доцільність пластики, щоб уникнути або відтермінувати трансплантацію серця. Відповідне рішення має базуватися на ретельній клінічній оцінці (у тому числі результатах ехокардіографії і магнітно-резонансної візуалізації [499, 503]) та обговорюватися серед спеціалістів, які ведуть хворого.
У пацієнтів з СН та помірної тяжкості/тяжкою вторинною мітральною недостатністю, які визнані неоперабельними або такими, що мають високий ризик хірургічного втручання, можна обговорити доцільність черезшкірного втручання на мітральному клапані (черезшкірної пластики край-у-край), щоб зменшити ступінь вираження скарг і покращити якість життя. Водночас докази на користь такої рекомендації отримано лише в регістрах [504-506], але не РКВ.
11.17.4. Трикуспідальна недостатність
Вторинна (функціональна) трикуспідальна недостатність часто ускладнює перебіг СН. Її причинами є дилатація клапанного кільця й розходження стулок на тлі підвищеного тиску в ПШ та його об’ємного перевантаження. Тяжка трикуспідальна недостатність спричиняє появу симптомів правошлуночкової СН або погіршує її перебіг, що потребує призначення сечогінних засобів для боротьби з периферійними набряками. Оскільки у таких пацієнтів часто виникає печінковий застій (який додатково стимулює формування гіперальдостеронізму), боротьбі з набряками сприяє призначення АМР (у вищих, діуретичних, дозах) [507]. Необхідно оптимізувати лікування СН, що спричиняє вторинну трикуспідальну недостатність, оскільки така терапія полегшує перебіг цього стану. Чіткі показання до хірургічної корекції вторинної трикуспідальної недостатності, яка ускладнює СН, ще не встановлені [493, 494]. Необхідність у такій корекції зазвичай обговорюється під час хірургічного втручання на клапанах лівого серця [493, 494]. За нещодавнім першим повідомленням, при трикуспідальній недостатності можливим є проведення катетерного втручання [508].
13. Механічна підтримка кровообігу та трансплантація серця
13.1. Механічна підтримка кровообігу
У пацієнтів з гострою чи хронічною СН, які не можуть бути стабілізовані за допомогою медикаментозної терапії, можна застосовувати системи механічної підтримки кровообігу для розвантаження неспроможного шлуночка та підтримки достатньої перфузії периферичних органів. Пацієнти в стані кардіогенного шоку, як правило, потребують підключення до екстракорпоральних систем життєзабезпечення, але їх використовують короткочасно, і в цей період слід планувати подальшу стратегію. Пацієнтам з хронічною, рефрактерною СН можуть бути імплантовані постійні пристрої допомоги ЛШ (LVAD).
13.1.2. Механічна підтримка кровообігу на кінцевій стадії ХСН
Трансплантація серця завжди була обмеженою опцією для пацієнтів на кінцевій стадії ХСН. Зростання кількості пацієнтів з рефрактерною ХСН та неготовність суспільства до донорства органів зумовлюють тривале перебування в списку очікування на трансплантацію (медіана 16 міс у регіонах, покритих мережею Eurotransplant) [598]. Понад 60% трансплантацій виконують у пацієнтів за високоургентними показаннями, залишаючи мало шансів дочекатися пацієнтам з менш ургентними станами. Утричі більше пацієнтів потрапляють у лист очікування, ніж реально виконується трансплантацій; рівень смертності, за даними листа очікування, Eurotransplant становив у 2013 р. 21,7% [598]. Більш сучасні дані свідчать про те, що пацієнти, які перебувають на підтримці LVAD, мають кращі показники виживання в очікуванні трансплантації [599]. Відповідно, пристрої МПК, особливо LVAD, дедалі частіше розглядаються як альтернатива трансплантації серця. Спочатку LVAD розроблялися як короткочасний міст до трансплантації (табл. 13.1) [600], а тепер вони застосовуються протягом місяців і навіть років у хворих, яким доводиться довго чекати (на сьогодні лише 10% пацієнтів з пристроями МПК у якості мосту до трансплантації отримують донорський орган протягом 1 року) або в якості пожиттєвої терапії у хворих, які не підходять для трансплантації. Чудові показники 2-3 річної виживаності ретельно відібраних пацієнтів, яким імплантуються сучасні моделі пристроїв постійного потоку, співставні з ранньою виживаністю після трансплантації серця [595].
14. Організація допомоги пацієнтам з СН.
Рекомендації зі зміни способу життя
Рекомендації друкуються в скороченому вигляді.
Повний варіант та перелік джерел дивись http://eurheartj.oxfordjournals.org/content/37/27/2129