24 серпня, 2024
Анестезіологічне забезпечення та інтенсивна терапія в акушерстві, гінекології та перинатології
За матеріалами конференції
Створення й впровадження в клінічну практику новітніх антибактеріальних препаратів і методів профілактики гнійно-септичних ускладнень в акушерстві та гінекології не призвели до повного зникнення запальних ускладнень у пацієнтів даного профілю. Інфекційні ускладнення, найважчими з яких є сепсис і септичний шок, продовжують займати одне з провідних місць у структурі як акушерсько-гінекологічної захворюваності, так і материнської смертності.
Ключові слова: сепсис, септичний шок, вагітність, післяпологовий період, прокальцитонін, лактат, інфузійна терапія, антибіотикотерапія.
Наприкінці минулого року відбулася знакова подія – міждисциплінарний науковий VI конгрес із міжнародною участю «Анестезіологічне забезпечення та інтенсивна терапія в акушерстві, гінекології та перинатології», присвячений останнім досягненням у лікуванні сепсису в акушерській практиці. У рамках заходу доповідь «Сепсис в навколопологовому періоді: особливості діагностики та лікування» представив професор кафедри анестезіології та інтенсивної терапії Львівського національного медичного університету ім. Данила Галицького, доктор медичних наук Ярослав Михайлович Підгірний.
 У 2000 році була створена міжнародна організація з менеджменту сепсису та септичного шоку – Surviving Sepsis Campaign (SSC) for management of severe sepsis and septic shock, яка кожні 4 роки переглядає та вдосконалює протокол, що дозволяє практикуючому лікарю ознайомитися із сучасними підходами до лікування однієї з найбільш тяжких патологій – сепсису. Останні оновлення були створені в 2021 році (Guidelines for management of severe sepsis and septic shock, 2021), проте протягом багатьох років (1992-2016) клініцисти активно застосовували наступну класифікацію сепсису:
У 2000 році була створена міжнародна організація з менеджменту сепсису та септичного шоку – Surviving Sepsis Campaign (SSC) for management of severe sepsis and septic shock, яка кожні 4 роки переглядає та вдосконалює протокол, що дозволяє практикуючому лікарю ознайомитися із сучасними підходами до лікування однієї з найбільш тяжких патологій – сепсису. Останні оновлення були створені в 2021 році (Guidelines for management of severe sepsis and septic shock, 2021), проте протягом багатьох років (1992-2016) клініцисти активно застосовували наступну класифікацію сепсису:
1) колонізація: мікробіологічна подія;
2) інфекція: мікробіологічна подія + місцева запальна реакція;
3) сепсис: мікробіологічна подія + загальна відповідь організму на запалення;
4) тяжкий сепсис: мікробіологічна подія + загальна відповідь організму на запалення + синдром поліорганної дисфункції;
5) септичний шок: мікробіологічна подія + загальна відповідь організму на запалення + синдром поліорганної дисфункції + падіння артеріального тиску (АТ).
Синдром системної запальної відповіді (SIRS) характеризується ≥2 клінічними ознаками:
- температура тіла >38 °C або <36 °C;
- тахіпное (частота дихання >20 дихальних рухів/хв, РаСО2 <32 мм рт. ст.);
- лейкоцитоз >12Ч109/л, або лейкопенія <4Ч109/л, або наявність незрілих форм >10%;
- частота серцевих скорочень (ЧСС) >90/хв.
Кардинально змінилися підходи до ведення сепсису в протоколі 2016 року, за якими провідну роль у встановленні діагнозу відіграє шкала SOFA (Sequential (Sepsis-related) Organ Failure Assessmen).
Сепсис – це загрозлива для життя органна дисфункція, яка викликана порушеною відповіддю людського організму на інфекцію. Септичний шок встановлюють за наявності сепсису та гіпотонії, яка вимагає вазопресорної терапії для досягнення середнього АТ (СрАТ) >65 мм рт. ст. і рівня лактату в плазмі крові <2 ммоль/л.
Алгоритм діагностики сепсису можна розглядати в наступних етапах клінічних обстежень пацієнта з підозрою на генералізацію вогнища інфекції (The third International consensus definitions for sepsis and septic shock, Sepsis‑3):
- оцінка за шкалою qSOFA (quick SOFA) >2 балів;
- оцінка респіраторної дисфункції;
- оцінка ментального статусу пацієнта;
- інструментальна оцінка систолічної дисфункції лівого шлуночка.
Якщо за шкалою SOFA пацієнт має оцінку >2 балів, слід запідозрити сепсис або токсикосептичний шок. Є певні відмінності між шкалами qSOFA та SOFA. Перша найчастіше застосовується в приймальному відділенні для швидкої оцінки стану пацієнта і включає наступні показники:
- частота дихання;
- стан свідомості;
- рівень систолічного АТ (САТ).
Натомість шкала SOFA більш поглиблена і використовується безпосередньо у відділенні як для встановлення/підтвердження діагнозу сепсису, так і для прогнозу клінічного стану пацієнта. Розширена шкала SOFA передбачає визначення наступних параметрів:
- індекс оксигенації РаО2/FiO2;
- шкала коми Глазго;
- показник СpАТ;
- необхідність призначення вазопресорів, їх тип і доза інфузії;
- рівень креатиніну або сечовини сироватки крові;
- рівень білірубіну;
- кількість тромбоцитів.
Для раннього виявлення сепсису в акушерстві використовуються наступні шкали:
- Модифікована акушерська рання система попередження (Modified early obstetrics warning system – MEOWS);
- Шкала сепсису в акушерстві (Sepsis in obstetrics score – SOS).
Сприятливими факторами перебігу інфекційного процесу у вагітних/породіль є молодий вік, відсутність преморбідного фону, локалізація вогнища інфекції та встановлена чутливість мікрофлори.
Спікер звернув увагу на фактори, які зумовлюють прогресування септичного процесу, що варто враховувати практикуючому клініцисту:
- зниження активності клітинного імунітету;
- лейкоцитоз вагітних;
- збільшення рівня D-димеру;
- дисфункція ендотелію;
- зниження рівня протеїну S;
- зниження активності фібринолізу;
- високий рівень прозапальних цитокінів (MSIR – maternal systemic inflammatory response).
Системні прояви, включаючи розвиток поліорганної недостатності, можуть випереджати локальні симптоми джерела інфекції, тому питання своєчасної санації останнього є вкрай важливим.
Однією з найважчих клінічних ситуацій в акушерстві та гінекології, яка потребує мультидисциплінарного рішення щодо тактики ведення пацієнтки, є загроза проведення гістеректомії. Основними показаннями до гістеректомії слід вважати наступні клінічні стани:
- крім матки лабораторно та інструментально не визначаються інші джерела інфекції;
- невідповідність між погіршенням клінічної картини та симптомами основної патології (наростання жовтяниці, олігурії, задишки);
- наростання симптомів SIRS;
- зростання рівня прокальцитоніну та С-реактивного білка;
- антенатальна загибель плода на фоні інфекційного процесу будь-якої етіології;
- ознаки синдрому поліорганної дисфункції або його поглиблення.
Органозберігаюча тактика стосовно матки у пацієнток із сепсисом може розглядатися в наступних випадках:
- верифіковане й сановане джерело інфекції іншої локалізації, яке визначає тяжкість стану;
- не прогресує SIRS;
- не прогресує синдром поліорганної недостатності;
- невисокий рівень прокальцитоніну;
- живий плід;
- відсутня клініка септичного шоку.
Спікер детально зупинився на діагностичних особливостях перебігу сепсису у вагітних. Температура тіла >38,3 °С або <36,0 °С є одним із визначених показників підозри на сепсис. Враховуючи, що у вагітних жінок температура тіла відповідає нормі, даний критерій є абсолютно інформативним на початкових етапах верифікації діагнозу. Натомість ЧСС, яка характеризується у вагітних фізіологічною тахікардією, може помилково сприйматися за збільшення ритму при сепсисі, тому варто більш детально звертати увагу на додаткові симптоми. Такі ж судження є справедливими стосовно частоти дихання: фізіологічне тахіпное супроводжує всі триместри вагітності, посилюючись на останніх термінах, що зумовлено підвищенням внутрішньочеревного та внутрішньогрудного тиску, а також зменшенням ефективної екскурсії діафрагми. При оцінці рівня свідомості пацієнтки варто враховувати, що фізіологічна дія прогестерону може призводити до надмірної сонливості, слабкості, зниження концентрації та уваги. Також при сепсисі можуть спостерігатися значні набряки або позитивний баланс рідини (>20 мл/кг/24 год), що має бути віддиференційовано від пастозності вагітних. Ще один важливий лабораторний показник – рівень глюкози – у вагітних перебуває в нормоглікемії, тоді як при сепсисі часто визначається гіперглікемія. Таким чином, лише два з клінічних критеріїв (температура тіла та рівень глюкози) є точно визначеними й можуть піддаватися оцінці при підозрі на сепсис у вагітних.
Автор доповіді зазначив, що лейкоцитоз >12Ч109 та лейкопенія <4Ч109 є важливими діагностичними маркерами сепсису, проте у вагітних починаючи з ІІІ триместру рівень лейкоцитів підвищується до 5-12Ч109, досягаючи максимальних значень до 30-го тижня вагітності. Інколи цей показник може сягати 16Ч109, а на початку перейм – 25-30Ч109.
Певні зміни також спостерігаються в лейкоцитарній формулі: у крові вагітних до 3% можуть визначатися мієлоцити та метамієлоцити, але кількість лімфоцитів та моноцитів є сталим показником, тому зсув формули вліво може бути більш достовірним показником запалення, ніж загальна кількість лейкоцитів. С-реактивний білок плазми крові при сепсисі зазвичай вищий, ніж два стандартних відхилення від норми. За таким же принципом оцінюють рівень прокальцитоніну.
Є певні особливості проведення інтенсивної терапії у зазначеної категорії пацієнтів, оскільки досягнення задовільного показника центрального венозного тиску у вагітної із сепсисом має бути вкрай виваженим. Значне волемічне навантаження є небезпечним в акушерській практиці. Характерними для вагітності є певні зміни роботи ендотелію, внаслідок чого може спостерігатися ендотеліальна дисфункція, яка призводить до збільшення проникності мембран, розширення судин мікроциркуляторного русла. У результаті рідка частина плазми може дифундувати в інтерстиційний простір, спричиняючи наступні порушення функції органів (Wiedermann C.J., 2012):
- порушення перфузії внутрішніх органів і абдомінальний компартмент-синдром;
- печінкова дисфункція;
- гіпоксична енцефалопатія;
- зміна системної гемодинаміки і гіпотензія;
- зміни ниркового кровотоку і гостре пошкодження нирок;
- дефіцит перфузії легень із гіпоксичною травмою ендотелію і, як наслідок, розвиток гострого респіраторного дистрес-синдрому.
Запорукою успішної терапії сепсису у вагітних є досягнення еуволемічного статусу. Первинним методом оцінки еуволемії є тривалість «білої плями нігтьового ложа»: показник >2 секунд дозволяє запідозрити порушення в роботі мікроциркуляторного русла. У стаціонарі важливим показником водного обміну є темп діурезу, який має становити не менше 1 мл/кг/год для адекватного забезпечення кровообігу всіх систем, оскільки кровообіг в нирках є опосередкованим показником кровопостачання всього організму.
Інструментальні методи також дозволяють оцінити волемічний статус пацієнта. При ультразвуковому дослідженні в нормі нижня порожниста вена у фазі видоху має розміри 1,5-2,5 см. Якщо вона <1,5 см і на вдиху спадається більш ніж на 50%, це свідчить про гіповолемію. Якщо ж нижня порожниста вена в діапазоні 1,5-2,5 см зі змінами <20% – пацієнт не може толерувати інфузійне навантаження. У такому випадку варто розглянути призначення вазопресорів і не зловживати інфузійними розчинами.
Етапи відновлення водного статусу при сепсисі включають ресусцитацію, оптимізацію, стабілізацію та деескалацію (Patient’s volume status at different phases: modified from Hoste et al.). Перші два заходи передбачають застосування принципів ліберальної стратегії відновлення водного балансу, наступні два – рестриктивної стратегії. Маркером останньої є темп сечовиділення: який об’єм сечі за годину виділяється пацієнтом, такий об’єм інфузійної терапії йому має бути застосований (Ogbu O.C. et al., 2015).
Також важливим маркером волемічного статусу є лактат, що характеризує баланс між постачанням кисню та його споживанням. Рівень лактату >2 ммоль/л відображає недостатню перфузію органів і систем, призводить до накопичення молочної кислоти, що потребує проведення інфузійної терапії відповідно до статусу пацієнта, оскільки перевантажене інтерстиційне русло є також небезпечним ускладненням сепсису.
Згідно з протоколом SSC (2021), при рефрактерному септичному шоку необхідно протягом однієї години забезпечити наступні кроки:
- визначити концентрацію лактату;
- здійснити забір культури крові до призначення антибактеріальної терапії;
- призначити антибіотики широкого спектра дії;
- ввести 30 мл/кг кристалоїдного розчину при гіпотензії або підвищеній концентрації лактату.
Останній пункт стосується початкового болюсного введення інфузійних розчинів, яке розраховане на перші два етапи відновлення водного балансу і загалом складає близько 1 л кристалоїдів, що в подальшому потребує оцінки стану пацієнта. Пізніше можуть бути додатково призначені інфузійні розчини разом із вазопресорними препаратами. Також, згідно з протоколом, варто використовувати альбумін (20-25% концентрації) на додаток до кристалоїдів для початкової реанімації та подальшого відновлення об’єму циркулюючої крові (ОЦК) у пацієнтів із сепсисом і септичним шоком у випадках, коли вони потребують значних об’ємів кристалоїдів. Не слід призначати для відновлення ОЦК гідроксиетилкрохмаль; також кристалоїди є більш ефективним і релевантними, ніж розчини желатину, при реанімації пацієнтів із сепсисом і септичним шоком.
Рефрактерний септичний шок виникає за відсутності відповіді на терапію вазопресорами, коли зберігається гіпотензія, симптоми поліорганної недостатності та потреба в інфузії норадреналіну зі швидкістю введення >0,2-0,5-1,0 мкг/кг/хв. Проте застосування норадреналіну в дозі >0,5 мкг/кг/хв є несприятливим фактором ведення сепсису і викликає підвищення ризику летальності до 60%, а доза >1,0 мкг/кг/хв – до 80-90% летальності (Management of refractory vasodilatory shock, 2018). За необхідності використання високих доз вазопресорів варто розглянути їх комбінації. Дані щодо вазопресорів та їх «норадреналінового еквіваленту» наведено в табл. 1.
|
Таблиця 1. Вазопресори та «норадреналіновий еквівалент» |
||
|
Препарат |
Доза |
«Норадреналіновий еквівалент», мкг/кг/хв |
|
Адреналін |
0,1 мкг/кг/хв |
0,1 |
|
Допамін |
15 мкг/кг/хв |
0,1 |
|
Норадреналін |
0,1 мкг/кг/хв |
0,1 |
|
Фенілефрин (мезатон) |
1 мкг/кг/хв |
0,1 |
|
Вазопресин |
0,04 Од/хв |
0,1 |
Стосовно кортикостероїдів спікер зазначив, що не слід використовувати гідрокортизон для лікування хворих на токсико-септичний шок, якщо гемодинамічна стабільність у них може бути досягнута волемічною та інотропною/вазопресорною підтримкою. Як альтернатива може бути проведена внутрішньовенна інфузія гідрокортизону 200 мг/24 год. У якості основного клінічного показання до застосування кортикостероїдів слід розглядати наявну необхідність введення норадреналіну в дозі вище 0,1 мкг/кг/хв.
Не менш важливою є респіраторна підтримка пацієнта. При різних рівнях насиченості киснем крові призначають різні схеми респіраторної терапії. Стратегічні напрямки респіраторної підтримки (step by step) відображені наступними етапами та схемами вентиляції легень:
- при SpO2 <90% – інсуфляція зволоженого кисню від 4-6 до 10-12 л/хв;
- за неефективності та подальшого збереження SpO2 <90% – неінвазивна штучна вентиляція легень (ШВЛ) за допомогою систем створення постійного позитивного тиску в дихальних шляхах (Continuous Positive Airway Pressure – СРАР) або систем із визначенням верхньої та нижньої межі тиску в легенях (Biphasic Positive Airway Pressure – ВіРАР);
- при SpO2 <80%, участі в акті дихання допоміжної мускулатури та/або появі ознак церебральної дисфункції – інвазивна ШВЛ;
- при SpO2 <90% та неефективності попередньої схеми – інвазивна ШВЛ із помірним позитивним тиском наприкінці видиху (РЕЕР) + вентиляція зі зворотним співвідношенням вдих/видих (IVR);
- при SpO2 <90% – ШВЛ + РЕЕР + IVR + FiO2 0,6;
- при SpO2 <90% – ШВЛ + РЕЕР + IVR + FiO2 0,6 + фуросемід 0,5-1 мг/кг;
- при SpO2 <90% – ШВЛ + РЕЕР + IVR + FiO2 1,0 (не більше 24 год).
Сепсис передбачає наявність та виділення збудника безпосередньо з крові або джерела інфекції. Першою стадією антибіотикотерапії є призначення препарату широкого спектра дії, здійснення забору матеріалу для бактеріологічного дослідження та вибір препарату з урахуванням наступних показників:
- клініка захворювання;
- місцева антибіотикограма;
- попередня антибіотикотерапія;
- діючі протоколи;
- тяжкість стану за шкалою CRIS і/або APACHE.
Після отримання результатів обстеження необхідно оцінити стан пацієнта, розглянути можливість антимікробної монотерапії та визначити адекватний термін призначення антибактеріальних засобів. Згідно з даними Управління із санітарного нагляду за якістю харчових продуктів і медикаментів США (FDA), на сьогодні не існує безпечних антибіотиків для вагітних жінок. Безпечність антибактеріальних засобів представлена у табл. 2.
|
Таблиця 2. Розподіл антибіотиків за критеріями FDA |
|
|
Критерії FDA |
Препарати |
|
А (безпечні) |
– |
|
В (умовно безпечні) |
Пеніциліни, цефалоспорини, монобактами, макроліди/азаліди (крім кларитроміцину), фосфоміцин, ніфуроксазид, меропенем |
|
С (потенційно безпечні) |
Рифампіцин, іміпенем, гентаміцин, кларитроміцин, нітрофурани, сульфоніламіди, нітроксолін, метронідазол, ізоніазид, піразинамід, етамбутол |
|
D (небезпечні) |
Аміноглікозиди, тетрацикліни, фторхінолони, хлорамфенікол |
|
Х (шкідливі) |
– |
|
Остаточно не встановлено |
Спектиноміцин (В?), ванкоміцин (В?), меропенем (В?), поліміксин (В?), лінкозаміди (С?), хінолони (С?), тейкоплакін, тіамфенікол, тинідазол, орнідазол, фузидова кислота, протіонамід, етіонамід |
При діагностиці сепсису у вагітних та породіль необхідно враховувати анатомо-фізіологічні особливості жінки, що також впливає на інтенсивність проведення волемічної ресусцитації та антибактеріальної терапії. Синдром гіпо-/реперфузії до цього часу залишається невирішеною проблемою інтенсивної терапії.
Основні положення щодо менеджменту сепсису представила керівник Вінницького обласного перинатального центру КНП «Вінницька обласна клінічна лікарня ім. М.І. Пирогова ВОР», кандидат медичних наук Інна Леонідівна Кукуруза в доповіді «Доказовий менеджмент сепсису. PRO».
 Загалом, науковий підхід до менеджменту сепсису базується на трьох документах:
Загалом, науковий підхід до менеджменту сепсису базується на трьох документах:
- Кампанія виживання при сепсисі: міжнародні рекомендації щодо лікування сепсису та септичного шоку (Surviving sepsis campaign: international guidelines for management of sepsis and septic shock, 2021);
- ІІІ Міжнародний консенсус щодо сепсису та септичного шоку (The third international consensus definitions for sepsis and septic shock (Sepsis‑3));
- Комплект (комплекс заходів. – Ред.) кампанії виживання при сепсисі: оновлення 2018 року (The surviving sepsis campaign bundle: 2018 Update).
Утім в акушерській практиці варто також керуватися документом «Consult Series № 67: Maternal sepsis» (2023), який оприлюднило Товариство медицини матері та плода (Society of maternal-fetal medicine, SMFM).
За визначенням Всесвітньої організації охорони здоров’я 2017 року, материнський сепсис є загрозливим для життя станом, який визначається як органна дисфункція, що є наслідком інфекції під час вагітності, пологів, після аборту/пологів. Інфекції, які можуть призводити до материнського сепсису, загалом поділяються на акушерські та неакушерські й, залежно від часу виникнення, на анте- та постнатальні. До неакушерських інфекцій відносять інфекції сечових шляхів, пневмонії, апендицит, розлади шлунково-кишкового тракту.
Акушерські інфекції включають наступні підгрупи:
- антенатальні: септичний аборт, хоріоамніоніт;
- постнатальні: ендометрит, ранова інфекція.
Вагоме значення має клінічне дослідження щодо вивчення біомаркерів сепсису, яке показало, що значну роль у перебігу цього патологічного стану відіграє прокальцитонін, меншою мірою – інтерлейкіни 6, 8 і С-реактивний білок (Teggert A. et al., 2020).
Встановлення діагнозу сепсису базується на розпізнаванні його симптомів й ознак згідно з основними шкалами:
- модифікована шкала omqSOFA у вагітних;
- модифікована шкала omSOFA у вагітних;
- модифікована акушерська рання система попередження (Modified obstetrics early warning system – MOEWS);
- шкала акушерського сепсису (Sepsis in obstetrics score – SOS).
Згідно з ІІІ Міжнародним консенсусом щодо сепсису та септичного шоку (Sepsis‑3), у пацієнтів з ознаками поліорганної недостатності варто продовжувати діагностику явної або підозрюваної інфекції. Рекомендації Товариства медицини матері та плода 2023 року вказують, що сепсис і септичний шок під час вагітності слід вважати невідкладними станами і в екстреному порядку розпочинати лікувальні та невідкладні заходи.
Враховуючи невідкладність надання допомоги пацієнтам із сепсисом, для практикуючих лікарів постійно розробляються «септичні комплекти», щоб забезпечити швидку діагностику та ескалацію лікування. Проте необхідні додаткові дослідження для оцінки ефективності «септичних комплектів» і засобів для швидкої діагностики та лікування материнського сепсису (The California Pregnancy-Associated Mortality Review, 2011). Утім, за відсутності доступних досліджень, використання «септичних комплектів» є рекомендованим для поліпшення стандартизації медичної допомоги (Rhodes A. et al., 2015).
Одним із основоположних комплектів діагностики сепсису є BLAST, який був представлений у 2018 році та включає дослідження наступних показників: В – культура крові, L – рівень лактату, А – антибіотикотерапія, S –інфузійна терапія, Т – артеріальний тиск. Перший етап передбачає взяття крові для мікробіологічного дослідження, проте даний крок не має сприяти затримці антибактеріальної терапії. У вагітних або у жінок у післяпологовому періоді з підтвердженим сепсисом або підозрою на нього виявлення інфекційних агентів здійснюється за допомогою відповідних культуральних досліджень зразків крові до початку антибактеріальної терапії, за умови що це не призводить до суттєвих затримок у своєчасному призначенні антибіотиків. Спікер зауважила, що проведення культуральних досліджень після призначення антибіотиків також допускається в клінічній практиці. У вагітних або жінок у післяпологовому періоді з підтвердженим сепсисом або підозрою на нього рекомендовано визначення рівня лактату в сироватці крові (SMFM, рівень доказовості 1В). За результатами клінічного дослідження за участю понад 500 пацієнтів у відділенні інтенсивної терапії з підозрою на сепсис вихідний лактат був найкращим біомаркером для прогнозування тяжкого сепсису або септичного шоку зі співвідношенням шансів 2,7 (95% довірчий інтервал) (Karon B.S. et al., 2017).
Антибіотикотерапія є однією з провідних ланок менеджменту сепсису, оскільки вогнище інфекції є першоджерелом поліорганної недостатності. Вагітним або жінкам у післяпологовому періоді з підтвердженим сепсисом або підозрою на нього рекомендовано призначення емпіричної антибактеріальної терапії з використанням препаратів широкого спектра дії. Найкраще розпочинати її впродовж однієї години після встановлення діагнозу або появи обґрунтованої підозри на сепсис (SMFM, рівень доказовості 1C).
Багатоцентрове дослідження «випадок – контроль», у якому взяли участь 410 жінок, показало, що смертність серед тих, хто отримував антибіотики протягом однієї години після встановлення діагнозу, становила 8,3%. Смертність у пацієнтів, які отримували антибіотики більш ніж через годину, становила 20% (Bauer M.E. et al., 2019).
Рекомендовані антибактеріальні препарати при акушерському сепсисі представлені у табл. 3.
|
Таблиця 3. Антибіотики, рекомендовані SMFM (2019) при акушерському сепсисі |
|
|
Джерело інфекції |
Антибіотики |
|
Цефотаксим, цефтріаксон, ертапенем або ампіцилін + азитроміцин, кларитроміцин або еритроміцин |
|
|
Госпітальна пневмонія |
Пацієнти з низьким ризиком смерті: піперацилін/тазобактам, меропенем, іміпенем або цефепім Пацієнти з високим ризиком смерті: подвійне прикриття від Pseudomonas (β-лактам + аміноглікозид або хінолон) та ванкоміцин або лізенолід проти метицилін-резистентного Staphylococcus aureus |
|
Хоріоамніоніт |
Ампіцилін + гентаміцин Антианаеробну активність можна забезпечити кліндаміцином або метронідазолом за показання до кесаревого розтину |
|
Ендометрит |
Ампіцилін, гентаміцин та метронідазол (або кліндаміцин) |
|
Інфекції сечових шляхів |
Гентаміцин та ампіцилін |
|
Інфекції черевної порожнини |
Цефтріаксон, цефотаксим, цефтазидим або цефепім + метронідазол |
|
Інфекції шкіри |
Ванкоміцин + піперацилін/тазобактам |
Четвертий крок «септичного комплекту» першої години передбачає проведення інфузійної терапії. При сепсисі, ускладненому гіпотензією, або при підозрі на гіпоперфузію органів рекомендовано раннє (протягом перших 3 год) введення від 1 до 2 л збалансованих кристалоїдних розчинів. Професор І.Л. Кукуруза зауважила, що не доцільно призначати з цією метою гідроксиетилкрохмаль, желатини, 5% розчин глюкози та фізіологічний розчин, а слід застосовувати збалансовані кристалоїди та розчин альбуміну. Якщо цільове значення СрАТ >65 мм рт. ст. не досягнуто, варто розглянути призначення вазопресорів. У вагітних або у жінок у післяпологовому періоді із септичним шоком рекомендовано використовувати норадреналін як вазопресор першої лінії. За відсутності ефекту або за недостатніх показників тиску можна використовувати комбінації вазоактивних препаратів (рисунок).
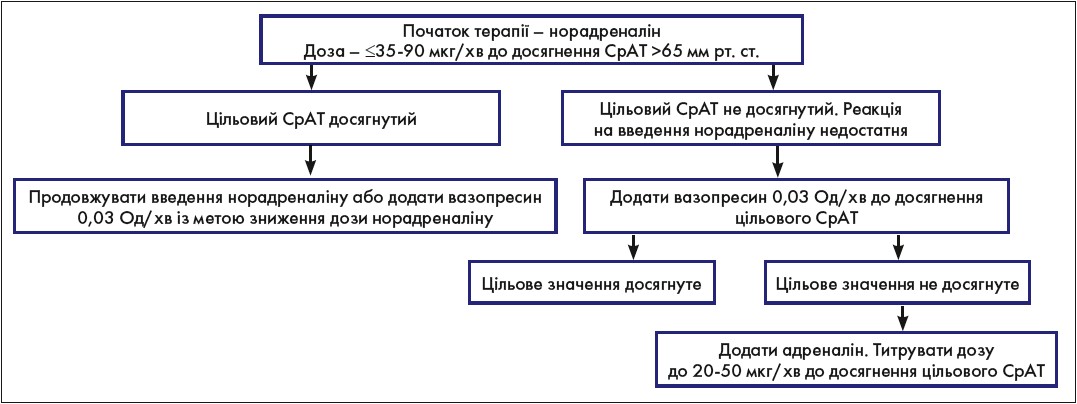
Рис. Алгоритм застосування вазоактивних препаратів при сепсисі в акушерстві
Додатково регламентовано введення гормонів. У вагітних або жінок у післяпологовому періоді із септичним шоком, які продовжують отримувати вазопресори, рекомендовано внутрішньовенне застосування кортикостероїдів. При підтвердженні того, що джерелом сепсису є матка, рекомендовано здійснення розродження в терміновому порядку та евакуації маткового вмісту незалежно від гестаційного терміну для досягнення контролю над вогнищем інфекції.
Відомо, що будь-яка клінічна настанова містить рекомендації різної сили та рівня доказовості. Гайдлайни з ведення сепсису та септичного шоку не є винятком. Контраверсійні питання щодо лікування цього небезпечного для життя стану у вагітних представила доцент кафедри анестезіології, інтенсивної терапії та медицини невідкладних станів Вінницького національного медичного університету ім. М.І. Пирогова, лікар-анестезіолог Вінницького обласного перинатального центру КНП «Вінницька обласна клінічна лікарня ім. М.І. Пирогова ВОР», кандидат медичних наук Наталія Василівна Титаренко у доповіді «Доказовий менеджмент сепсису. CONTRA».
 Незважаючи на сучасні вдосконалення клінічних настанов щодо менеджменту сепсису, ця патологія відіграє провідну роль у структурі материнської смертності. Сепсис діагностується за наявності вогнища інфекції (встановленого чи невстановленого) і поліорганної дисфункції. Існують певні відмінності у референтних значеннях критеріїв діагностики синдрому системної запальної відповіді у вагітних, оскільки порогові значення частоти дихання, ЧСС та кількості лейкоцитів при сепсисі перетинаються з діапазоном нормальних значень під час вагітності, пологів і/або у ранньому післяпологовому періоді (Bauer M.E. et al., 2014).
Незважаючи на сучасні вдосконалення клінічних настанов щодо менеджменту сепсису, ця патологія відіграє провідну роль у структурі материнської смертності. Сепсис діагностується за наявності вогнища інфекції (встановленого чи невстановленого) і поліорганної дисфункції. Існують певні відмінності у референтних значеннях критеріїв діагностики синдрому системної запальної відповіді у вагітних, оскільки порогові значення частоти дихання, ЧСС та кількості лейкоцитів при сепсисі перетинаються з діапазоном нормальних значень під час вагітності, пологів і/або у ранньому післяпологовому періоді (Bauer M.E. et al., 2014).
Також для діагностування органної дисфункції в акушерській популяції має бути модифікована й шкала SOFA, адже:
- у неакушерських пацієнтів бали за шкалою SOFA нараховуються, коли рівень креатиніну в сироватці крові сягає >110 мкмоль/л, проте цей рівень значно перевищує верхню межу (70 мкмоль/л) за нормального перебігу вагітності;
- у невагітних пацієнтів значення САТ <70 мм рт. ст. згідно із SOFA вважається аномальним, тоді як цей рівень може бути фізіологічним у ІІ триместрі вагітності.
Перекриття діапазонів нормальних та аномальних показників під час вагітності може бути причиною хибнопозитивних діагнозів, і навпаки, клініцист може недостатньо реагувати на ознаки сепсису, особливо в післяпологовому періоді, вважаючи тахікардію або лейкоцитоз за норму.
Другим обов’язковим критерієм сепсису є встановлення наявності інфекції. Обстеження на виявлення джерела інфекції входить до складу «септичного комплекту першої години». Рекомендовано з цією метою використовувати бактеріологічне дослідження крові та інших біологічних середовищ. Проспективне дослідження «випадок – контроль», яке охопило 365 підтверджених випадків тяжкого материнського сепсису, показало, що гемокультуральним методом можливо провести ідентифікацію збудника лише у 64% (Acosta C.D. et al., 2014). Відповідно у 36% випадків збудника встановити не вдається, натомість у 16% не вдається визначити ані збудника, ані джерело інфекції. Тому в клінічній практиці виникає потреба додатково застосовувати біомаркери для діагностування сепсису. Одним із найпоширеніших із них є прокальцитонін.
Незважаючи на високу чутливість і специфічність є певні обмеження щодо трактування рівня прокальцитоніну. Хибнонегативні результати визначення прокальцитоніну можуть виникати у наступних випадках:
- нейтропенія, тяжка імуносупресія;
- локалізовані інфекції, які не викликають системного запалення;
- прокальцитонін може залишатися низьким на ранній стадії інфекції (зазвичай підвищується протягом 4-6 год, досягаючи піку близько 12-48 год);
- атипові бактерії часто не викликають зростання рівня прокальцитоніну (наприклад, Mycoplasma pneumoniae).
Хибнопозитивні результати визначення рівня прокальцитоніну спостерігаються при таких станах:
- ниркова недостатність;
- панкреатит, ішемія кишечника, операція, травма, опіки, зупинка серця;
- певне підвищення – при грибкових, вірусних інфекціях;
- деякі ревматологічні захворювання;
- деякі види раку (наприклад, дрібноклітинний рак легень, медулярна карцинома щитоподібної залози).
Багатоцентрове дослідження за участю понад 1700 пацієнтів, госпіталізованих із підозрою на пневмонію та подальшим підтвердженням діагнозу за допомогою бактеріального посіву, методу полімеразної ланцюгової реакції (ПЛР) та/або аналізу сечі на антигени, показало, що зв’язок між концентрацією прокальцитоніну при госпіталізації та виділеними патогенними мікроорганізмами має тісну кореляцію лише за наявності типової бактеріальної флори (третина пацієнтів); натомість атипова грибкова, вірусна етіологія пневмонії спричиняла як хибнопозитивні, так і хибнонегативні результати дослідження прокальцитоніну (Self W.H. et al., 2017). Тому, відповідно до нових настанов, у дорослих із підозрою на сепсис або септичний шок не рекомендовано використовувати прокальцитонін у якості маркера призначення антибіотикотерапії (SSC, 2021). На сьогодні не доведена роль протоколів на основі визначення рівня прокальцитоніну для окреслення тактики антибіотикотерапії у вагітних або жінок у післяпологовому періоді (SMFM, 2023). Згідно з рекомендаціями SSC 2021 року, рівні прокальцитоніну мають використовуватися лише як критерій припинення антибіотикотерапії.
Клінічні випробування останнього десятиліття підтвердили високу ефективність і доцільність використання нових мікробіологічних технік дослідження для достовірного й, найголовніше, швидкого виявлення збудника інфекційного процесу (Peri A.M. et al., 2022), зокрема флуоресцентної гібридизації in situ, матрично-активованої лазерної десорбції /іонізації/мас-спектроскопії, ПЛР. За результатами дослідження, молекулярні технології покращують здатність ідентифікувати збудника й скорочують час детекції (можливість повністю встановити мікроорганізм протягом першої доби).
Наступним важливим етапом дослідження у пацієнтів із сепсисом є вимірювання рівня лактату. Проте вагітність вносить корективи щодо концентрації й цього маркера: лактат може підвищуватися в породілей через анаеробний метаболізм під час нормального перебігу пологів. Систематичний огляд і метааналіз 22 клінічних досліджень за участю 1193 здорових вагітних жінок показав, що типовим є інтранатальне підвищення лактату до рівня >2 ммоль/л. Нормальні значення в деяких здорових пацієнток, особливо наприкінці пологів, перевищують 4 ммоль/л (Bauer M.E. et al., 2019). Сучасні дані показують, що збільшення лактату при сепсисі відбувається не через гіпоперфузію, а є наслідком β-адренергічної стимуляції. Також утворення лактату відбувається в печінці у процесі анаеробного гліколізу, і в подальшому лактат може використовуватися як енергетичний субстрат мозком і клітинами серця в умовах фізіологічного стресу. Початкова фаза сепсису характеризується розвитком гіперкінетичного кровообігу, тому оксигенація клітин відбувається адекватно. Цей факт також спростовує твердження, що рівень лактату є прямим відображенням рівня кисневого забезпечення. Отже, ресусцитація ймовірно не повинна бути орієнтованою на рівень лактату, оскільки це не не призводить до покращення виживаності. Правомірність твердження стосовно зв’язку між лактатом і ацидозом також підлягає сумніву, оскільки лактат є акцептором іонів водню, через що його включають до складу збалансованих кристалоїдних розчинів у якості резервної лужності.
Спікер підсумувала, що для пацієнтів із сепсисом у більшості випадків характерні зміни концентрації лактату, проте немає переконливих доказів того, що спроба нормалізувати даний показник має позитивні наслідки в менеджменті сепсису. Утім є дані, що клінічні дослідження з екстракорпоральним вилученням лактату з організму в критичних пацієнтів були припинені достроково у зв’язку з надзвичайно високою летальністю.
До комплексу заходів, які проводять протягом першої години у пацієнтів із сепсисом, відносять призначення антибіотиків. Дослідження різних років неодноразово показували, що з кожною годиною затримки початку антибактеріальної терапії при септичному шоці виживаність знижується на 7,7% (Kumar A. et al., 2006). Ретроспективне дослідження R. Ferrer et al. (2014) продемонструвало лінійне збільшення смертності при сепсисі та септичному шоці на 1% за кожну годину затримки антибіотикотерапії. Схожі результати були отримані V.X. Liu et al. (2017), згідно з якими затримка початку антибактеріальної терапії на кожну годину була пов’язана зі збільшенням ризику лікарняної летальності на 1,09%.
Дані клінічні дослідження є ретроспективними й показують лише кореляційний зв’язок, без висвітлення етіологічних причин і наслідків збільшення летальності. У зазначених випробуваннях найбільш тісний зв’язок простежувався лише у групах із септичним шоком, натомість у категоріях пацієнтів із сепсисом без шоку летальність була істотно нижчою. Для вирішення суперечок щодо часу призначення антибіотиків при сепсисі був проведений систематичний огляд і метааналіз 11 досліджень за участю понад 16 тис. пацієнтів (Sterling S.A. et al., 2015). Як наслідок, не було встановлено значної користі від введення антибіотиків протягом 3 год після оцінки ступеня тяжкості стану пацієнта у відділенні невідкладної допомоги або протягом 1 год після розпізнавання тяжкого сепсису та септичного шоку. У зв’язку із цим в оновлених настановах SSC (2021) рекомендовано: у разі верифікованого чи вірогідного сепсису або септичного шоку слід увести антибактеріальні препарати негайно, бажано протягом 1 год після розпізнавання стану. При підозрі на можливий сепсис і за відсутності шоку необхідно провести швидку оцінку ймовірності інфекційних або неінфекційних причин гострого захворювання та ввести антибіотики протягом 3 год, якщо підозра на інфекцію зберігається.
Призначення інфузійної терапії у пацієнтів із сепсисом та артеріальною гіпотензією призводить до покращення гемодинамічних параметрів лише у 50% випадків (Biais M. et al., 2014). Тому твердження про необхідність інфузії об’ємом 1-3 л (у неакушерській популяції – 30 мг/кг) є сумнівним, а у деяких ситуаціях – небезпечним. Розвиток ендотеліальної дисфункції, особливо в пацієнтів, які не є респондерами, призведе до переходу рідини в інтерстицій і перевантаження рідиною. Останнє може мати наступні негативні наслідки:
- дихальна система: набряк легень, гідроторакс, зміна еластичності грудної клітки, труднощі з проведенням ШВЛ;
- печінка: перевантаження внаслідок збільшення ОЦК, порушення синтетичної функції, холестаз, зниження активності цитохрому Р450;
- шлунково-кишковий тракт: асцит, набряк кишечника, синдром мальабсорбції, кишкова непрохідність, абдомінальний компартмент-синдром, збільшення проникності стінки кишечника, що призводить до транслокації бактеріальної флори та інфекційного процесу;
- центральна нервова система: набряк мозку, порушення свідомості, делірій, збільшення внутрішньочерепного тиску;
- серце та судини: порушення діастолічної функції серця, гідроперикард, кардіо-абдомінальний (абдомінальний ішемічний) синдром, кардіо-ренальний синдром;
- нирки: набряк інтерстицію, збільшення ниркового венозного тиску та зменшення кровообігу в нирках.
Окрім цього слід пам’ятати, що септичний шок не є гіповолемічним. Низький центральний венозний тиск і УЗ-ознаки колапсу нижньої порожнистої вени в пацієнтів із сепсисом найчастіше є показниками не гіповолемії, а вазоплегії, тому дані клінічні параметри не можуть слугувати орієнтирами для призначення інфузії.
Вибір норадреналіну як вазопресора першої лінії при сепсисі також є неоднозначним питанням. Так, наприклад, A.C. Gordon et al. (2016) показали, що у групі призначення вазопресину нирковозамісну терапію застосовували рідше, ніж у групі норадреналіну (25,4% проти 35,3%). Є й інші дослідження, у яких було показано, що стартова підтримка гемодинаміки вазопресином може бути більш корисною при септичному шоці. Також існують докази відсутності суттєвої різниці у часі досягнення цільового СрАТ протягом 28- та 90-денного періоду між групами вазопресорної терапії адреналіном і норадреналіном (Myburgh J.A. et al., 2008). Як наслідок, не тільки норадреналін, а й адреналін і вазопресин можуть призначатися як вазопресори першої лінії. На сьогодні відсутні докази того, що будь-який із них перевершує дію іншого. Цілком можливо, що вибір препаратів даної групи є індивідуальним, що дозволить на практиці визначити мультипресорне титрування.
Материнський сепсис є одним із найтяжчих ускладнень інфекційного процесу у вагітних і жінок у післяпологовому періоді. Основні кроки менеджменту сепсису й септичного шоку в акушерстві передбачають швидке виявлення та санацію вогнища інфекції, ранній початок антибіотикотерапії та раціональне застосування вазоактивних препаратів.
Підготувала Катерина Пашинська



 Кукуруза І.Л.
Кукуруза І.Л.
